文章信息
- 秦瑞坪, 李玲霞, 马晓玲, 席欧彦, 赵婷, 邱玲玲, 李江伟.
- QIN Rui-ping, LI Ling-xia, MA Xiao-ling, XI Ou-yan, ZHAO Ting, QIU Ling-ling, LI Jiang-wei.
- 抗人卵泡刺激素受体多克隆抗体的制备及其对实验大鼠骨质疏松的抑制作用
- Inhibition of Osteoporosis in Ovariectomized Rats Using Follicle-stimulating Hormone Receptor Specific Polyclonal Antibody
- 中国生物工程杂志, 2017, 37(6): 9-16
- China Biotechnology, 2017, 37(6): 9-16
- http://dx.doi.org/DOI:10.13523/j.cb.20170602
-
文章历史
- 收稿日期: 2016-12-27
- 修回日期: 2017-01-17
随着老龄化社会的到来,骨质疏松症已成为威胁人类健康的重要疾病之一。成骨细胞与破骨细胞组成骨重建单位,在健康的成人中破骨与成骨过程保持相对平衡,这有赖于两种细胞彼此之间有良好的互相调节。当免疫功能紊乱时通过各种途径加速骨吸收,延缓骨生长,导致骨质疏松[1]。绝经后骨质疏松已成为当前全球关注的健康问题之一,妇女进入更年期由于雌激素缺乏会导致骨吸收速度快于骨生成,促使骨的大量流失而形成骨质疏松[2]。
卵泡刺激素(follicle stimulating hormone,FSH)是垂体分泌的一种糖蛋白激素,具有促进和维持性腺正常发育,在生殖中发挥重要功能。近期,文献报道破骨细胞的形成受到FSH的刺激而影响其骨转换,FSH刺激破骨细胞的形成通过激活Gi2a-偶联的FSHR来实现[3]。绝经期妇女的血清FSH水平变化与骨密度(BMD)或骨吸收标志物相关,甚至在围绝经期雌二醇下降[4]。Wang等[5]调查了248例骨代谢正常的绝经后女性,发现随着年龄的增长,血清FSH与LH水平逐渐增加,在60岁左右达到最高值,60岁以后慢慢下降,血清E2水平和前臂骨密度逐渐降低,实验研究表明FSH通过刺激破骨细胞的分化是导致绝经后骨质疏松的主要原因。已在动物体内证实,FSH具有刺激破骨细胞的形成,促进骨的重吸收功能和促进破骨细胞存活的功能[6]。且Sun等[7]发现FSH可以直接作用于破骨细胞和破骨细胞前体上的FSHR,从而增强破骨细胞的形成和功能。因此,阻断FSH或其与受体FSHR的结合有可能起到保护性腺机能减退的骨丢失[8]。
最近,Zhu等[3]报道了抗FSH的抗体可以抑制实验动物的骨质疏松,实验发现FSH抗体使骨形成和骨吸收解偶联,有效地刺激成骨细胞的形成。另外,Liu等[6]采用FSH抑制剂亮丙瑞林也能达到抑制实验动物的骨质疏松的作用。这些实验表明阻断FSH通路可以起到对骨质疏松的治疗作用。FSH的作用是通过结合其受体FSHR实现的。FSHR表达于人间叶干细胞(mesenchymal stem cells),也表达于成骨细胞和单核细胞表面,其表达水平与骨质疏松之间的关系还不清楚,但在牙骨质中,FSHR的表达数量与骨质流失成正相关。目前还没有报道阻断FSHR对骨质疏松的影响。
本研究通过建立SD大鼠骨质疏松症模型,利用制备的抗FSHR多克隆抗体进行治疗,分析主要雌激素FSH、LH及E2的变化,对大鼠股骨颈骨密度值(BMD)测定,以及组织病理学观察等以验证抗FSHR多克隆抗体对骨质疏松实验动物的治疗效果。
1 材料与方法 1.1 材料 1.1.1 材料新西兰兔,两只,雌性,2 kg /只,购于新疆医科大学实验动物中心; 30只10周龄左右雌性SPF级Sprague-Dawley(SD)大鼠,体重(200~250g),购于新疆医科大学实验动物中心。实验动物许可证号:SCXK(新)2016-0003。实验随机分为2组,去卵巢骨质疏松模型组21只和假手术对照组9只。每笼5只,于室温条件在24℃左右的清洁环境下饲养,自由进食水,饲料及饮用水相同;Protein A/G-Plus Beads抗体纯化柱购于北京全式金生物技术公司;Protein A亲和介质购于GE公司。
1.1.2 试剂蛋白marker及蛋白预染marker购自Thermo公司;Ni SepharoseTM6 Fast Flow购于GE Healthcare公司;Bradford法蛋白定量试剂盒购自北京百泰克生物技术有限公司;完全弗式佐剂及不完全弗式佐剂购于Sigma公司;Goat Anti-rabbit-IgG H & L(HRP)购于康为世纪公司;IPTG购于Genview公司,SD大鼠实验所用试剂均购自新疆医科大学实验动物中心;其它常用试剂均为国产分析纯。
1.1.3 仪器化学发光仪(美国,DXi800型号);双能X线骨密度测量仪(美国,LE XX09);生理生化检测仪(美国,DXi800型号);台式高速离心机(力康发展有限公司),Lynx 6000 centrifuge(Thermo Fisher)公司,洁净工作台(BoXun)公司。
1.2 方法 1.2.1 抗FSHR多克隆抗体的制备及鉴定表达纯化实验室前期构建的FSHR234蛋白[9],Bradford法测定蛋白浓度为0.5 mg/ml,利用纯化的FSHR234蛋白免疫新西兰兔,初次免疫抗原为200 μg,每隔两周加强免疫,共免疫七次。在第七次加强免疫两周后,静脉采血并分离得到上层血清。采用Protein A纯化血清。间接ELISA法检测抗FSHR多克隆抗体的最低结合浓度,一抗为纯化的未免血清和纯化的免疫后血清,二抗为Goat Anti-rabbit-IgG H & L(HRP)。TMB显色,Prism 5.0作图,并计算与抗原反应的最适多抗浓度。Western blot检测抗FSHR多克隆抗体结合特异性,FSHR234按上样量为16 μg,一抗为抗FSHR多克隆抗体IgG稀释至4μg/ml,4 ℃孵育12 h。二抗为Goat Anti-rabbit-IgG H & L(HRP)1:5 000,37 ℃孵育1.5 h,DAB显色。
1.2.2 SD大鼠骨质疏松模型的建立大鼠腹腔注射戊巴比妥钠3%,按40 mg/Kg麻醉,大鼠仰卧固定板,腹部术部剃毛消毒。正中部位切开腹部皮肤,分离腹肌腹膜打开腹腔。寻找卵巢并分离结扎输卵管并将卵巢完全切除(这一过程称为"去势"),缝合切口内皮及外皮层,术后肌肉注射青霉素,80万U/kg。假手术对照组麻醉方法、手术操作同手术组,只是开腹后不摘除卵巢,只在卵巢附近触摸并按以上相同路径操作。两组大鼠饲养条件一致。
1.2.3 抗FSHR多克隆抗体对实验大鼠骨质疏松症的治疗SD大鼠随机分为4组,按以下剂量尾静脉注射治疗。(1) 假手术(SHAM)组:6只,不加任何药物;(2) OVX+pAbFSHR:5只,2 mg/kg;(3) OVX+LE:5只,1.6 mg/kg;(4) OVX:5只,PBS按200 μl/只。每周治疗2次,共治疗12次即6周。
1.2.4 大鼠血清生化检测及E2、FSH、LH水平测定分离得到血清样品,-20℃冷藏并于48h内送至新疆维吾尔自治区区医院质检科,利用全自动化学发光仪测定血生化指标血钙(S-Ca)、血磷(S-P)含量检测以及雌激素水平雌二醇(E2)、促黄体生成素(LH)和促卵泡刺激素(FSH)。
1.2.5 大鼠骨密度(BMD)测定乙醚麻醉处死大鼠,割取后腿,剔除毛皮层,送新疆医科大学附属中医医院,利用双能X线骨密度测量仪测量股骨颈骨密度(BMD)(g/cm2)[10-12]。
1.2.6 免疫组化检测SD大鼠骨组织病理学取右腿股骨,剔除骨组织周围的软组织,用4 %多聚甲醛固定液室温固定48 h。将已固定的骨组织按1:30的比例加入EDTA脱钙液,每隔48 h更换一次,并控制温度在25 ℃,至完全脱钙大约两周可以发现骨组织变软,用大头针轻轻刺入而感觉不到阻力为宜。脱钙后骨组织用蒸馏水冲洗,进行石蜡包埋,切片,脱蜡后,苏木精-伊红(HE)染色观察骨组织病理学变化。
1.2.7 数据处理及分析采用prism5.0作图,数据经过统计学处理,采用方差分析和t检验方法进行显著性检验。
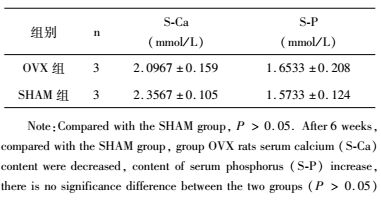
2 结果 2.1 抗FSHR多克隆抗体的制备及鉴定原核表达获得FSHR234抗原[9],SDS-PAGE检测结果如图 1a所示,将纯化得到的FSHR234蛋白免疫新西兰兔,第七次加强免疫两周后分离得到上层血清用于纯化。采用Protein A纯化血清总IgG(图 1b、图 1c)。抗原FSHR234在确定最适结合浓度后固定其为1μg/ml,包被96孔ELISA板,将免疫血清和未免血清稀释固定至相同浓度1mg/ml,再将稀释后蛋白按倍比稀释为不同浓度即1:250、1:500、1:1 000、1:2 000、1:4 000、1:8 000、1:16 000、1:24 000等8个比例作为一抗,对应浓度分别为4 μg/ml、2 μg/ml、1 μg/ml、0.5 μg/ml、0.25 μg/ml、0.125 μg/ml、0.0625 μg/ml、0.0938μg/ml,二抗为Goat Anti-rabbit-IgG H & L(HRP),从ELISA结果(图 1e)可以得出,在稀释比例为1:16 000,浓度为0.0625 μg/ml的时候,免疫后血清纯蛋白OD值/免疫前血清纯蛋白OD值大于2.1,即为多抗最低反应浓度。
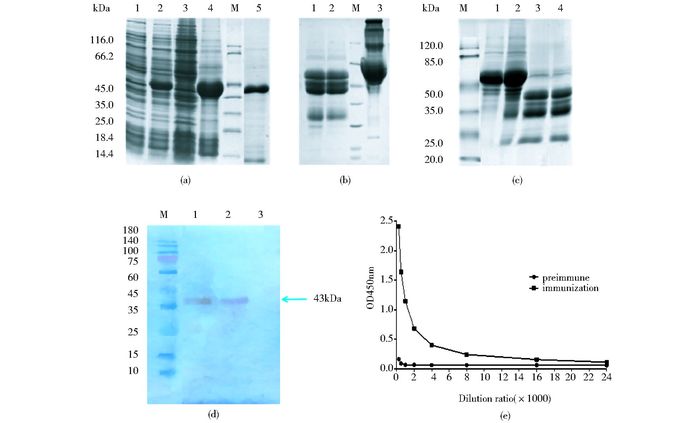
|
| 图 1 抗FSHR多克隆抗体的制备及纯化 Figure 1 Preparation and identification of anti-FSHR polyclonal antibody (a), (b), (c) are expression and purification of FSHR234 antigen. (a) 1:Uninduced BL21-pET-30a-fshr234; 2: Induced BL21-pET-30a-fshr234; 3: Supernatant protein of induced bacterial lysate; 4: Precipitation of induced bacterial lysate; 5: Purified protein of His-FSHR234 (b) Purification of rabbit preimmune serum. 1~2: Purified protein of under reduced; 3: Purified protein of under non-reduced (c) Purification of rabbit immune serum. 1~2: Elution using binding buffer; 3~4: Purified protein of under reduced (d) Detecting the binding of FSHR polyclonal antibody with recombinant FSHR by Western blot. Samples in lanes 1~2 contained FSHR234 protein 16 μg while lane 3 contained irrelevant protein CD133 (e) The titer of anti-FSHR polyclonal binding with FSHR assayed by ELISA(>1:40 000). The optimal binding concentration of anti-FSHR polyclonal antibody is 0.062 5 μg/ml |
Western blot检测抗FSHR多克隆抗体(图 1d),结果显示在多克隆抗体浓度为4 μg/ml时,可以与抗原FSHR特异性结合,而与无关蛋白没有结合。
2.2 OVX大鼠血清E2、FSH、LH水平的测定SD大鼠分组情况及去势实验如实验部分所示,每周大鼠称体重。可以看出OVX组及SHAM组大鼠体重逐渐增加,但两组增长并无统计学意义(P>0.05)(图 2a)。对E2、FSH、LH、水平进行测定,可以看出,OVX组E2水平在去势2周后急速下降(图 2b),在第2周~5周时内,与SHAM组相比,OVX组E2水平降低具有极显著差异(P<0.01),在SHAM组中E2水平保持不变。同时在OVX组中FSH和LH在2到5周内有逐渐增加的趋势,但增加不显著(P>0.05)(图 2c、2d)。以上实验结果基本符合大鼠骨质疏松模型的激素变化特征。
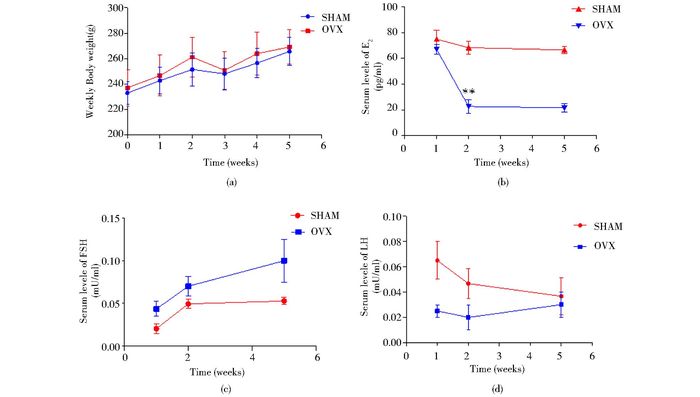
|
| 图 2 去势大鼠血清激素水平变化 Figure 2 The serum hormone levels change in ovariectomized rats (a) The body weight of rats in OVX group and SHAM group increased gradually, but had no statistical significance (P > 0.05) (b)~(d): The E2, LH and FSH levels were determined by automatic chemiluminescence analyzer. E2 levels in OVX group fell sharply after 2 weeks (** P < 0.01) (b) and FSH levels increased no significant compared with the SHAM group(P > 0.05) (c) LH levels changed no significantly(P>0.05) (d) |
对大鼠血钙(S-Ca)、血磷(S-P)含量进行测定,实验结果见表 1,可以看出,大鼠建模6周后,与SHAM组相比,OVX组大鼠血清钙(S-Ca)含量均有下降,血清磷(S-P)含量显示升高。在临床中机体部分骨流失时血清钙含量会有降低,测定结果符合骨质疏松临床现象。但是相比之下,两组差异并不显著(P>0.05)。
2.4 大鼠骨密度(BMD)测定
在去势第8周,进行大鼠左股骨颈BMD测定,两组相比较,OVX组明显低于SHAM组P<0.05(表 2)。
2.5 抗FSHR多克隆抗体治疗对OVX大鼠血清E2、FSH、LH水平的影响
大鼠体重在抗FSHR多克隆抗体和LE治疗后,有逐渐增加的趋势,但每组间体重增加的差异不明显(P>0.05)(图 3a)。
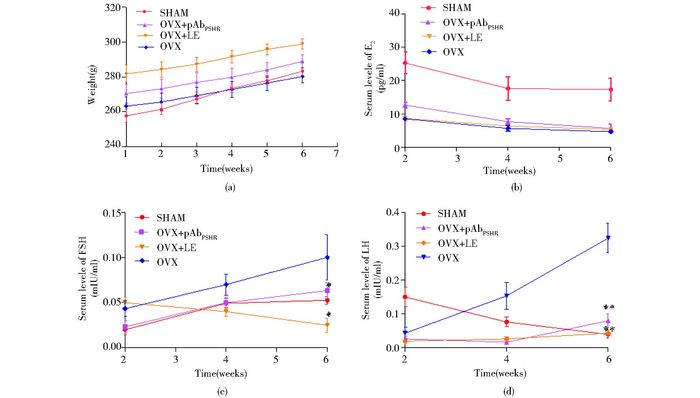
|
| 图 3 去势大鼠治疗前后血清激素水平的变化 Figure 3 The serum hormone level in ovariectomized rats before and after treament (a) The body weight of rats (b) The E2 levels in pAbFSHR and LE treated OVX groups increased but not reached significant compared with PBS injected OVX (P >0.05) (c) The FSH levels decreased significantly (* P < 0.05) after pAbFSHR and LE treatment from the fourth to sixth weeks in OVX group compared with PBS injected OVX rats (d) The LH levels decreased significantly (** P < 0.01) after pAbFSHR and LE treatment at the sixth weeks in OVX group compared with PBS injected OVX rats |
抗FSHR多抗或LE注射OVX大鼠治疗六周时,E2水平明显降低达到10pg/ml左右,显著低于SHAM组(P<0.05),但各处理组间E2水平没有显著差异(P>0.05)(图 3b)。同时,各处理组FSH水平与PBS对照组相比显著降低(P<0.05)。另外,在治疗第6天时,处理组LH水平与PBS对照组相比也显著降低(P<0.05)(图 3d)。表明FSHR多抗和LE对去卵巢大鼠FSH和LH水平的增高有明显抑制作用。
2.6 免疫组化分析OVX组右股骨病理组织学检查显示骨小梁变得细小,而且数量减少,存在断裂现象,髓腔间隙较宽(图 4c);施加LE组,显著抑制了FSH水平的增加(图 4b),由于FSH水平升高会导致骨质疏松,组织学观察到抑制FSH水平后骨髓腔间隙变小,骨小梁相对较多,与OVX组是拮抗关系,针对疾病E组骨质疏松具有好转趋势。利用多克隆抗体治疗组,与OVX组比较发现,多克隆抗体治疗组骨小梁数量增加较多,断裂现象较少,说明治疗有一定效果(图 4a)。
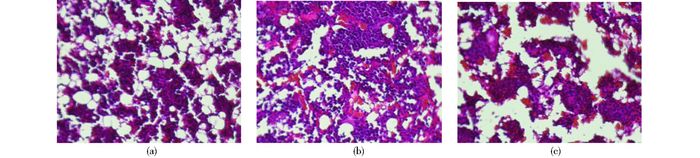
|
| 图 4 抗体治疗过程中大鼠各项指标变化 Figure 4 Changes of various indexes in the process of antibody treatment (a) OVX+ pAbFSHR (b) OVX+LE (c) OVX (HE×20) |
骨质疏松的危害已引起公众关注,不管是临床还是研究领域,力求寻找针对骨质疏松药效更好、靶点更佳的治疗药物势在必得,抗体疗法也给医学领域癌症的治疗等提供新的思路与方法。对于绝经后骨质疏松的治疗,骨合成代谢中骨的重建和防止骨的流失在治疗骨质疏松症方面具有潜在的利用价值,并成为长期的治疗目标[13]。最近研究表明FSH可以直接导致骨质疏松,并且利用尾静脉注射抗FSH抗体的治疗方法,可以改善和防止骨的流失,并达到治疗绝经后骨质疏松的目的[7-8, 14-16]。这些研究提示FSH-FSHR可以作为骨质疏松治疗的潜在的靶点。
本研究中,我们探讨靶向FSH受体的抗体对骨质疏松的治疗效果。采用大鼠卵巢切除建立骨质疏松动物模型。建模6周后,与SHAM组相比OVX组大鼠血清钙(S-Ca)含量下降,血清磷(S-P)含量升高,但是相比之下,两组间差异并不显著P>0.05。但是存在变化趋势说明大鼠去势后Ca含量是降低的,说明骨质在流失。BMD能反映OVX组骨量的丢失,去卵巢2周后大鼠E2水平显著下降,左侧股骨颈BMD明显降低,与临床已有文献报道FSH可以直接导致骨质疏松症特征相符,以上说明建立大鼠骨质疏松症动物模型成立[12, 17-18]。通过注射给药治疗发现,随着治疗时间的延长,大鼠生长体重增加,OVX组增长较慢,OVX+pAbFSHR组有一定的增长。OVX+LE对体重的增加影响较大,可能原因是,LE抑制了FSH激素的增加,而随着注射LE的时间加长,FSH水平会降低,会影响脂肪组织增加,从而使得体重增加较快[19]。而在研究者利用女贞子灌胃给药治疗大鼠骨质疏松过程中,每周给药6天,在治疗26周后才显示体重的差异较显著。而本实验中可能原因是治疗时间不够长才使大鼠体重增加不够明显。大鼠机体内LH与FSH是相互协同作用,当去势后E2水平显著降低时,LH与FSH相应地增加以维持雌激素的平衡。实验中,多克隆抗体治疗后抑制了FSH水平的增加,对骨质疏松症具有治疗作用。可能的原因是本实验中制备的多克隆抗体与FSHR特异结合,从而阻断了FSH与其受体FSHR的结合,体内环境周围产生大量FSH,由于负反馈调节作用会反过来刺激垂体减少FSH的释放,从而抑制FSH水平的增加。阳性对照采用LE,而LE本身具有抑制垂体生成和释放促性腺激素的作用,施加LE后限制了垂体释放FSH使得FSH水平显著降低(P<0.05)。组织病理学观察结果表明,去卵巢后,由于雌激素的减少,对破骨细胞抑制减弱,骨吸收大于骨形成,骨骼呈高度转换状态,骨量处于不平衡状态,OVX组大鼠骨丢失明显增加,而抗FSHR抗体治疗后可以抑制骨量的流失。
总之,本研究成功建立大鼠骨质疏松症动物模型,利用制备的高滴度的兔抗人FSHR多克隆抗体进行治疗,并证实其可以显著降低血清FSH和LH的水平,同时增加大鼠骨小梁数目,减少断裂现象,说明兔抗人FSHR多克隆抗体对SD大鼠骨质疏松症具有一定的治疗作用。研究结果为今后进一步开发基于该靶点的临床应用提供了有价值的实验参考。
| [1] | Kim J H, Kim E Y, Lee B, et al. The effects of Lycii Radicis Cortex on RANKL-induced osteoclast differentiation and activation in RAW 264.7 cells. International Journal of Molecular Medicine, 2016, 37(3) : 649–658. |
| [2] |
潘德, 郝秋芳, 王玮, 等.
绝经老年妇女骨质疏松调查及影响因素分析. 中国老年学杂志, 1994, 14(6) : 352–354.
Pan D, Hao Q F, Wang W, et al. Older women menopause osteoporosis research and influence factors analysis. Chinese Journal of Gerontology, 1994, 14(6) : 352–354. |
| [3] | Zhu L L, Blair H, Cao J, et al. Blocking antibody to the β-subunit of FSH prevents bone loss by inhibiting bone resorption and stimulating bone synthesis. Proceedings of the National Academy of Sciences, 2012, 109(36) : 14574–14579. DOI:10.1073/pnas.1212806109 |
| [4] | Cannon J G, Cortez-Cooper M, Meaders E, et al. Follicle-stimulating hormone, interleukin-1, and bone density in adult women. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2010, 298(3) : R790–R798. DOI:10.1152/ajpregu.00728.2009 |
| [5] | Wang J, Zhang W, Yu C, et al. Follicle-stimulating hormone increases the risk of postmenopausal osteoporosis by stimulating osteoclast differentiation. PloS One, 2015, 10(8) : e0134986. DOI:10.1371/journal.pone.0134986 |
| [6] | Liu S, Cheng Y, Xu W, et al. Protective effects of follicle-stimulating hormone inhibitor on alveolar bone loss resulting from experimental periapical lesions in ovariectomized rats. Journal of endodontics, 2010, 36(4) : 658–663. DOI:10.1016/j.joen.2010.01.011 |
| [7] | Sun L, Peng Y, Sharrow A C, et al. FSH directly regulates bone mass. Cell, 2006, 125(2) : 247–260. DOI:10.1016/j.cell.2006.01.051 |
| [8] | Sun L, Zhang Z, Zhu L L, et al. Further evidence for direct pro-resorptive actions of FSH. Biochemical and Biophysical Research Communications, 2010, 394(1) : 6–11. DOI:10.1016/j.bbrc.2010.02.113 |
| [9] |
夏雪琴, 木亚沙尔·买买提拉洪, 翟田甜, 等.
抗卵泡刺激素受体纳米抗体的制备及鉴定. 细胞与分子免疫学杂志, 2013, 29(8) : 829–833.
Xia X Q, Mu Y S, Zhai T T, et al. Preparation and identification of anti-follicle-stimulating hormone receptor nanobodies. Chin J Cell Mol Immunol, 2013, 29(8) : 829–833. |
| [10] |
卢勇, 孟庆才, 方锐, 等.
SD大鼠骨性关节炎合并骨质疏松症模型的建立. 中国组织工程研究与临床康复, 2009, 13(46) : 9092–9096.
Lu Y, Meng Q C, Fang R, et al. Establishment of SD rat models of osteoarthritis and osteoporosis. Journal of Clinical Rehabilitative Tissue Engineering Research, 2009, 13(46) : 9092–9096. DOI:10.3969/j.issn.1673-8225.2009.46.019 |
| [11] |
田茂友, 李洪洋.
去卵巢大鼠骨质疏松模型研究. 现代预防医学, 2007, 34(12) : 2239–2241.
Tian M Y, Li H Y. Experimental study on the model of osteoporosis in ovariectomized rats. Modern Preventive Medicine, 2007, 34(12) : 2239–2241. DOI:10.3969/j.issn.1003-8507.2007.12.016 |
| [12] |
李旭鸿, 侯曼, 仰红慧.
骨密度的测定方法及影响因素. 天津体育学院学报, 2005, 20(3) : 62–65.
Li H X, Hou M, Yang H H. The measurement methods and influence factors of bone density. Journal of TjIPE, 2005, 20(3) : 62–65. |
| [13] | Xiaodong L, Ominsky M S, Warmington K S, et al. Sclerostin antibody treatment increases bone formation, bone mass, and bone strength in a rat model of postmenopausal osteoporosis. Journal of Bone & Mineral Research the Official Journal of the American Society for Bone & Mineral Research, 2009, 24(4) : 578–588. |
| [14] | Durlej M, Knapczyk-Stwora K, Duda M, et al. The expression of FSH receptor (FSHR) in the neonatal porcine ovary and its regulation by flutamide. Reproduction in Domestic Animals, 2011, 46(3) : 377–384. DOI:10.1111/rda.2011.46.issue-3 |
| [15] | Haberman S, Race G J. Application of immunofluorescence to study of human tumors by rabbit antibody production to nucleoprotein of human malignant tissues. Texas Medicine, 1968, 64(5) : 45. |
| [16] | Heukers R, Henegouwen P M, Oliveira S. Nanobody-photosensitizer conjugates for targeted photodynamic therapy. Nanomedicine:Nanotechnology, Biology and Medicine, 2014, 10(7) : 1441–1451. DOI:10.1016/j.nano.2013.12.007 |
| [17] | Kalu D N. The ovariectomized rat model of postmenopausal bone loss. Bone & Mineral, 1992, 15(3) : 175–191. |
| [18] | Liu S P, Liao E Y, Hanwen W U, et al. Comprehensive assessment of the ovariectomized rat model of postmenopausal osteoporosis. Bulletin of Hunan Medical University, 2001, 26(2) : 111–114. |
| [19] | Pujol J P, Chadjichristos C, Legendre F, et al. Interleukin-1 and transforming growth factor-β1 as crucial factors in osteoarthritic cartilage metabolism. Connective Tissue Research, 2008, 49(3-4) : 293–297. DOI:10.1080/03008200802148355 |
 2017, Vol. 37
2017, Vol. 37