文章信息
- 李艳伟, 马义, 韩磊, 肖兴, 党诗莹, 文涛, 王得华, 范志勇.
- LI Yan-wei, MA Yi, HAN Lei, XIAO Xing, DANG Shi-ying, WEN Tao, WANG De-hua, FAN Zhi-yong.
- Fas凋亡抑制分子FAIM 1表达缺失诱发单纯性肥胖的初步研究
- A Preliminary Study on Fas Apoptosis Inhibitory Molecule FAIM 1 Inducing and Simple Obesity
- 中国生物工程杂志, 2017, 37(6): 37-42
- China Biotechnology, 2017, 37(6): 37-42
- http://dx.doi.org/DOI:10.13523/j.cb.20170606
-
文章历史
- 收稿日期: 2017-01-03
- 修回日期: 2017-02-16
2. 广州中医药大学第二附属医院<广东省中医院>广州 510405
2. The Second Affiliated Hospital of Guangzhou University of Chinese Medicine Guangdong Provincial Hospital of Traditional Chinese Medicine, Guangzhou 510632, China
细胞凋亡是一种细胞程序性死亡,其与维持内环境稳定、免疫稳态及代谢平衡等密切相关。Fas(CD95/APO-1) 是肿瘤坏死因子受体(TNFR)超家族的一员,与其配体(FasL)结合,可诱导细胞凋亡[1]。Fas凋亡抑制分子FAIM(Fas apoptosis inhibitory molecule)是一种广泛表达的细胞抗凋亡蛋白,在生物进化上高度保守,在细胞的诸多生理过程中起着关键作用。1999年,FAIM从诱导的Fas抵抗B淋巴细胞中被首次克隆,并证实其具有保护细胞免受Fas诱导的细胞凋亡的生物学作用[2]。研究发现,FAIM有三种类型:FAIM1、FAIM2和FAIM3。虽然FAIM1、FAIM2、FAIM3都抑制Fas诱导的细胞死亡,但它们在结构和表达模式上都无相关性,而且通过完全不同的作用机制抑制细胞凋亡[3]。通过选择性剪接,FAIM可产生FAIM-S和FAIM-L两种亚型,FAIM-L主要在神经组织中表达[3-5],而FAIM-S在生物体大部分组织器官中广泛表达[6-7]。
肥胖是一种慢性代谢性疾病,分为单纯性肥胖和继发性肥胖,单纯性肥胖约占肥胖患者的95%。世界卫生组织调查显示,全球成人中10%以上为肥胖人口,而中国是全球肥胖人数最多的国家,中国的男性肥胖人数约为4 320万人,女性肥胖人数达4 640万人,肥胖现已成为公共卫生面临的又一重大课题。肥胖的判定标准是身体质量指数(Body Mass Index,BMI),BMI=体重(kg)/身高(m)2,BMI≥30(BMI≥28为中国人口判定标准)即判定为肥胖。近年来,随着FAIM 1的结构及功能研究的开展,FAIM 1与肥胖发生、发展的关系逐渐被国内外研究者所认识,2016年,本课题组与国外合作者首次报道了基因敲除FAIM 1的诱导实验小鼠发生单纯性肥胖和脂肪肝,初步揭示了FAIM 1在胰岛素信号转导通路和能量代谢中的重要作用[8]。为进一步研究FAIM 1的表达与单纯性肥胖的发生、发展的关系,本研究利用临床单纯性肥胖患者的外周血白细胞及人工饲养的肥胖动物模型深入研究FAIM 1及相关信号通路关键蛋白的表达差异[9-11],从而为揭示肥胖发生的分子机制以及其诊断、治疗提供新的实验基础。
1 材料与方法 1.1 材料单纯性肥胖患者及正常人的血液样本(暨南大学附属第一医院);雄性SD大鼠(上海斯莱克实验动物有限公司);饲料(南通特洛菲饲料技术有限公司);总RNA提取试剂盒(美国Omega公司);逆转录试剂盒(TaKaRa公司);β-actin抗体(美国Cell Signaling Technology公司);FAIM1抗体(美国Abcam公司);胰岛素受体β(Insulin Receptor β,IR β)抗体(美国Abcam公司);PVDF膜(德国Merck Millipore公司);BCA蛋白定量试剂盒(美国Thermo公司);免疫印迹化学发光试剂盒(美国Thermo公司);SYBR(TaKaRa公司);蛋白裂解液RIPA(上海碧云天生物技术有限公司);其他均为国产分析纯。引物合成由华大基因生物公司完成。
1.2 仪器高速冷冻离心机(美国Thermo Fisher Scientific公司);微量移液器(日本Toyo公司);酶标仪(美国Bio-Rad公司);RCP仪(德国Eppendorf公司);电泳系统(美国Bio-Rad公司);电转系统(美国Bio-Rad公司);凝胶成像系统(美国Bio-Rad公司)。
1.3 方法 1.3.1 临床血液样本的分析从临床上收集40例单纯性肥胖患者(男性23例,女性17例,年龄18~40岁,BMI 28~48.1,无疾病史)及17例正常者(男性8例,女性9例,年龄18~35岁,BMI 19~23.8,无疾病史)的血液样本。将血液中的红细胞裂解离心除去,加适量的DEPC水溶解白细胞沉淀,加入适量的裂解液、蛋白酶抑制剂(PMSF)提取蛋白,以正常者的血样为对照,利用Western blot方法检测肥胖患者和正常者血液白细胞中FAIM 1蛋白表达水平的差异:采取BCA法进行蛋白定量后,样本加入5× Loading Buffer和β-巯基乙醇进行制样,先用SDS-PAGE分离总蛋白,然后用电转法转移至PVDF膜,室温下以5%脱脂奶粉封闭2 h,分别加入FAIM1抗体并室温孵育2 h,TBST洗涤3次,每次5 min,加入辣根过氧化物酶标记的IgG,室温孵育1 h,TBST洗涤3次,每次5 min,利用ECL试剂盒曝光蛋白条带;并利用统计学分析FAIM 1蛋白表达与肥胖的相关性。
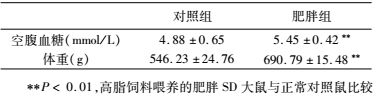
1.3.2 肥胖模型鼠的构建24只6周龄雄性SD大鼠随机分为两组:正常对照组(以下简称对照组)和肥胖模型组(以下简称肥胖组),每组12只。肥胖组用高脂饲料喂养,对照组则用相应的对照饲料喂养。饲料的具体组成及热量提供见表 1所示。10周后,检测对照组和肥胖组的空腹血糖和体重,以构建高脂饲料喂养的肥胖SD大鼠模型[12]。
1.3.3 肥胖SD大鼠模型与正常对照鼠的血脂、附睾脂肪垫和肾周脂肪及FAIM 1与IR β表达水平的测定与分析
造模成功的肥胖鼠和对照鼠,禁食12h,注射3%戊巴比妥钠麻醉。老鼠被彻底麻醉后,心脏采血法取血,静置20min,3 000r/min离心5min分离血清,检测总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白-胆固醇(HDL-C)和低密度脂蛋白-胆固醇(LDL-C)。迅速分离出附睾脂肪垫、肾周脂肪和肝脏,生理盐水清洗,滤纸擦干,附睾脂肪垫、肾周脂肪称重,肝脏置于液氮中保存。从液氮中取出肝脏,迅速称取20mg,研磨器磨碎,加入150~200μl裂解液(PMSF浓度为1mmol/L),匀浆仪充分匀浆,冰浴30 min。4 ℃,10 000 g离心15min,取上清。采取BCA法进行蛋白定量。加入5× Loading Buffer和β-巯基乙醇进行制样。先用SDS-PAGE, 将不同大小的蛋白进行分离。然后用电转法转移至PVDF膜,室温下以5%脱脂奶粉封闭2 h,分别加入FAIM 1抗体和IR β抗体、室温孵育2 h,TBST洗涤3次,每次8 min,加入辣根过氧化物酶标记的IgG,室温孵育1 h,TBST洗涤3次,每次5 min,利用ECL试剂盒曝光蛋白条带,检测在肥胖SD大鼠模型与正常对照鼠肝组织中FAIM 1与IR β表达的差异。
1.4 统计学处理应用SPSS 19.0软件进行统计学分析,实验数据均以均数±标准差(M±S.E.M)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果与分析 2.1 临床血液样本的分析以正常者作为对照,肥胖患者血液白细胞的FAIM 1表达量显著下降(图 1a)。对17例正常者和40例肥胖者血液白细胞的FAIM 1表达量进行统计分析发现,以正常者作为对照,肥胖患者血液白细胞的FAIM 1表达量平均减少36.4%(图 1b)。FAIM 1表达量与肥胖程度(BMI)的相关性分析显示,FAIM 1表达量与肥胖程度(BMI)呈显著性负相关(R= -0.833)(图 1c)。
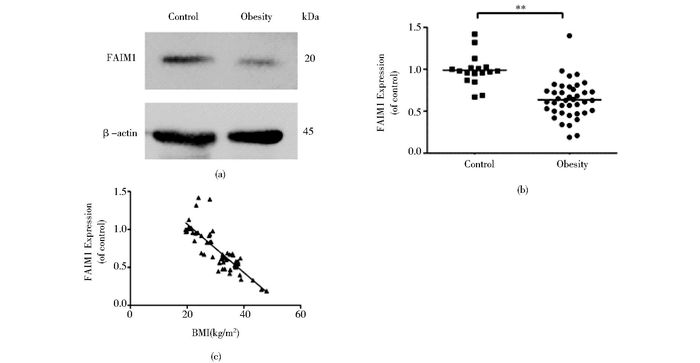
|
| 图 1 正常者与肥胖患者血液白细胞的FAIM 1表达量比较及与BMI的相关性 Figure 1 Comparison of FAIM1 expression levels in leukocytes between the normal individuals and obese patients and the relation of FAIM 1 and BMI (a) Assay of FAIM 1 protein expression in white blood cells of the normal individuals and obese patients by Western blot (b) Statistical analysis of FAIM 1 protein expression in white blood cells for 17 cases of normal individuals and 40 cases of obese patients (c) Correlation analysis of FAIM 1 protein expression and BMI ** P < 0.01, normal individuals versus obese patients |
6周龄雄性SD大鼠利用高脂饲料喂养,正常对照组则用相应的对照饲料连续喂养10周后,与正常对照组相比,肥胖组的大鼠空腹血糖和体重分别增加11.7%和26.5% (表 2),表明高脂饲料喂养的SD大鼠肥胖模型构建成功。
 |
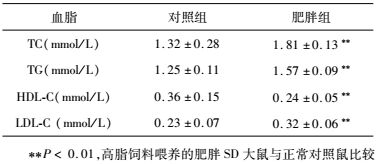
2.3 正常组和肥胖组的大鼠血脂差异分析
如表 3所示,与正常对照SD大鼠组相比,高脂饲料喂养肥胖SD大鼠组的血清TC、TG和LDL-C分别升高37.1%、25.6%和39.1%,而HDL-C则显著降低33.3%。实验结果显示,高脂饲料喂养肥胖SD大鼠的血脂常数明显异常,TC、TG和LDL-C异常升高,而HDL-C则异常显著性降低。
 |
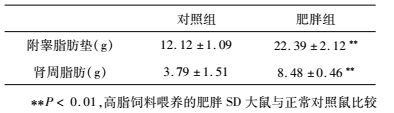
2.4 高脂饲料喂养的肥胖SD大鼠与正常鼠的附睾脂肪垫和肾周脂肪的重量差异分析
与正常组相比,肥胖组的大鼠附睾脂肪垫重量和肾周脂肪重量明显增加,附睾脂肪垫重量约为正常对照鼠的1.85倍,肾周脂肪重量为正常对照鼠的2.24倍(表 4)。实验结果表明:与正常对照鼠相比,高脂饲料喂养肥胖SD大鼠的主要内脏脂肪量显著增加,肥胖特征显著。
 |
2.5 高脂饲料喂养肥胖SD大鼠与正常鼠的FAIM 1与IR β的表达检测
与正常组相比,肥胖组的大鼠肝脏中FAIM 1和IR β表达量分别下降45.9%和32.6 %(图 2a、图 2b)。实验结果表明,肥胖组的大鼠肝脏中不仅FAIM 1的表达显著减少,而且胰岛素通路和能量代谢相关的IR β的表达也明显减少,这些与能量代谢相关的关键蛋白的表达异常降低可能诱导了肥胖的发生与发展。
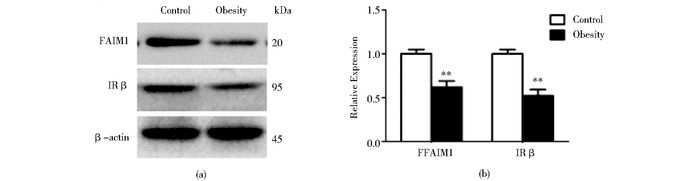
|
| 图 2 高脂饲料喂养肥胖SD大鼠与正常鼠肝组织中FAIM 1和IR β蛋白表达量比较 Figure 2 Comparison of FAIM 1 and IR β expression in liver tissue between the normal and high-fat diet-fed obese SD rats (a) Assay of FAIM 1 and IR β protein expression in liver tissue of the normal and high-fat diet-fed obese SD rats by Western blot (b) Relative expression assay for FAIM 1 and IR β protein expression in (a) ** P < 0.01, normal SD rats versus high-fat diet-fed obese SD rats |
FAIM 1蛋白通过与Fas受体的直接相互作用以及通过稳定XIAP(一种有效抑制半胱天冬蛋白酶的抗凋亡蛋白)水平来抑制细胞因子FasL和TNFα诱导的细胞凋亡。FAIM 1作为一种新发现的功能调节蛋白,近年来不断发现它的表达异常与某些疾病关系密切[8, 13-14]。目前关于FAIM 1蛋白与肥胖关系的研究罕有报道。近期本课题组及国外合作者的研究已发现FAIM 1的表达异常与肥胖的发生、发展密切相关,在小鼠实验中FAIM 1基因敲除导致肥胖症状,进而导致脂肪肝,FAIM 1的正常表达水平对于胰岛素的正常信号传导是不可或缺的,这都提示,FAIM 1是能量代谢平衡的一个重要调节因子。本研究以单纯性肥胖患者和正常者的外周血白细胞及人工饲养的肥胖动物模型为实验材料,进一步检测和确证单纯性肥胖与FAIM 1蛋白表达的关系,实验结果显示,FAIM 1蛋白的表达缺失与肥胖的发生具有显著的正相关性,在肥胖患者白细胞中FAIM 1蛋白的表达水平显著降低;在高脂饲料喂养的肥胖SD大鼠模型实验中,也证实其肝组织中FAIM 1的表达水平显著降低,同时,胰岛素信号通路中的关键信号传导分子胰岛素受体β的蛋白表达也显著降低,动物或人体葡萄糖正常代谢的关键是正常的肝胰岛素信号转导,作为下游的丝氨酸/苏氨酸激酶,AKT是维持胰岛素信号转导、血糖和血脂代谢平衡的重要调节因子,AKT激活后可通过磷酸化抑制糖原合成激酶3β(GSK3β),阻止了GSK3β对β-catenin的磷酸化和泛素化降解作用,可进一步促进胰岛β细胞的增殖,同时可促进葡萄糖转运蛋白(GLUT)的表达和膜转位,从而促进和维持糖脂代谢平衡,而FAIM 1可介导AKT的活化[15],这提示FAIM 1不仅在保护逐渐成熟的肝细胞免受Fas介导的凋亡中起关键作用[16],更重要的是FAIM 1蛋白的正常表达水平对于胰岛素信号转导通路的完整性是必需的,FAIM 1蛋白的表达缺失可能是胰岛素信号传导阻碍及胰岛素抵抗的重要原因,FAIM 1蛋白表达缺失造成的调节功能失常进而导致能量代谢紊乱。当然,关于FAIM 1参与调节胰岛素信号转导的分子机理及其在能量代谢平衡中的生物学作用仍需深入地研究。本研究通过人体样本和喂养动物模型初步确证了FAIM 1表达与单纯性肥胖发生的相关性,揭示了FAIM 1蛋白的表达缺失可能是诱发单纯性肥胖的关键因素,这也可成为单纯性肥胖的诊断和治疗提供新靶点。
| [1] | Krammer P H. CD95's deadly mission in the immune system. Nature, 2000, 407(6805) : 789–795. DOI:10.1038/35037728 |
| [2] | Schneider T J, Fischer G M, Donohoe T J, et al. A novel gene coding for a Fas apoptosis inhibitory molecule (FAIM) isolated from inducibly Fas-resistant B lymphocytes. Journal of Experimental Medicine, 1999, 189(6) : 949–956. DOI:10.1084/jem.189.6.949 |
| [3] | Planells-Ferrer L, Urresti J, Coccia E, et al. Fas apoptosis inhibitory molecules:more than death-receptor antagonists in the nervous system. Journal of Neurochemistry, 2016, 139(1) : 11–21. DOI:10.1111/jnc.2016.139.issue-1 |
| [4] | Sole C, Dolcet X, Segura M F, et al. The death receptor antagonist FAIM promotes neurite outgrowth by a mechanism that depends on ERK and NF-κB signaling. Journal of Cell Biology, 2004, 167(3) : 479–492. DOI:10.1083/jcb.200403093 |
| [5] | Zhong X, Schneider T J, Cabral D S, et al. An alternatively spliced long form of Fas apoptosis inhibitory molecule (FAIM) with tissue-specific expression in the brain. Molecular Immunology, 2001, 38(1) : 65–72. DOI:10.1016/S0161-5890(01)00035-9 |
| [6] | Huo J, Xu S, Lam K P. Fas apoptosis inhibitory molecule regulates T cell receptor-mediated apoptosis of thymocytes by modulating Akt activation and Nur77 expression. Journal of Biological Chemistry, 2010, 285(16) : 11827–11835. DOI:10.1074/jbc.M109.072744 |
| [7] | Huo J, Xu S, Guo K, et al. Genetic deletion of faim reveals its role in modulating c-FLIP expression during CD95-mediated apoptosis of lymphocytes and hepatocytes. Cell Death & Differentiation, 2009, 16(7) : 1062–1070. |
| [8] | Huo J, Ma Y, Liu J J, et al. Loss of Fas apoptosis inhibitory molecule leads to spontaneous obesity and hepatosteatosis. Cell Death and Disease, 2016, 7(2) : e2091. DOI:10.1038/cddis.2016.12 |
| [9] | Wigand J P, Blackard W G. Downregulation of insulin receptors in obese man. Diabetes, 1979, 28(4) : 287–291. DOI:10.2337/diab.28.4.287 |
| [10] | Arner P, Einarsson K, Backman L, et al. Studies of liver insulin receptors in non-obese and obese human subjects. J Clin Invest, 1983, 72(5) : 1729–1736. DOI:10.1172/JCI111132 |
| [11] | McElduff A, Hedo J A, Taylor S I, et al. Insulin receptor degradation is accelerated in cultured lymphocytes from patients with genetic syndromes of extreme insulin resistance. J Clin Invest, 1984, 74(4) : 1366–1374. DOI:10.1172/JCI111547 |
| [12] | Qian B C, Shi H, Lu Y P. Progress in studies of preparation of obesity animal models. Chinese Journal of New Drugs, 2007, 16(15) : 1159–1162. |
| [13] | Carriba P, Jimenez S, Navarro V, et al. Amyloid-beta reduces the expression of neuronal FAIM-L, thereby shifting the inflammatory response mediated by TNFalpha from neuronal protection to death. Cell Death & Disease, 2015, 6(2) : e1639. |
| [14] | Huo J, Xu S, Lin B, et al. Fas apoptosis inhibitory molecule is upregulated by IGF-1 signaling and modulates Akt activation and IRF4 expression in multiple myeloma. Leukemia Official Journal of the Leukemia Society of America Leukemia Research Fund U K, 2012, 27(5) : 1165–1171. |
| [15] | Huo J, Xu S, Lin B, et al. Fas apoptosis inhibitory molecule is upregulated by IGF-1 signaling and modulates Akt activation and IRF4 expression in multiple myeloma. Leukemia Official Journal of the Leukemia Society of America Leukemia Research Fund U K, 2012, 27(5) : 1165–1171. |
| [16] | Huo J, Xu S, Guo K, et al. Genetic deletion of faim reveals its role in modulating c-FLIP expression during CD95-mediated apoptosis of lymphocytes and hepatocytes. Cell Death & Differentiation, 2009, 16(7) : 1062–1070. |
 2017, Vol. 37
2017, Vol. 37





