文章信息
- 秦瑶, 赵鸿彦, 张文航, 王冬梅.
- QIN Yao, ZHAO Hong-yan, ZHANG Wen-hang, WANG Dong-mei.
- miR146a通过Smad4参与多柔比星的心肌细胞毒性作用
- miR146a Participates in Doxorubicin Cardiotoxicity Through Smad4
- 中国生物工程杂志, 2017, 37(6): 31-36
- China Biotechnology, 2017, 37(6): 31-36
- http://dx.doi.org/DOI:10.13523/j.cb.20170605
-
文章历史
- 收稿日期: 2016-11-26
- 修回日期: 2017-02-19
多柔比星(Doxorubicin,DOX)临床使用时的心脏毒性一直是限制其使用的一个因素,其机制尚未完全解释清楚[1]。有研究表明miR146a可以通过调节幼红细胞白血病病毒癌基因同源体4(ErbB4) 的表达部分地参与了多柔比星的心脏毒性效应[2]。miRNA通常可以调节多个基因的表达发挥其生理功能[3],因此很可能有其他通路也参与了多柔比星的毒性效应。
常间回文重复序列丛集(Clustered regularly interspaced short palindromic repeats,CRISPR)是近几年发展迅速的一种基因编辑技术,可以简单有效地敲除基因的表达[4]。本研究中我们使用CRISPR技术敲除大鼠心肌细胞中miR146a的表达,获得了显著优于现有抑制miRNA功能方法的效果。在此基础上,我们证实了敲除miR146a可以抑制多柔比星导致的心肌细胞毒性,Smad家族成员4(Smad4) 是miR146a的一个靶基因,并且参与了这一过程。本研究为探索多柔比星的毒性机制提供了一些新的证据。
1 材料与方法 1.1 试剂和仪器大鼠心肌细胞系H9c2购于中国科学院细胞库;293FT细胞购于Life Technologies公司。多柔比星购于Sigma-aldrich公司;DMEM培养基,胰酶,双抗购于Life Technologies公司;蛋白提取液,BCA蛋白浓度测定试剂盒购于碧云天生物技术研究所;ECL化学发光检测试剂盒购于Bio-rad公司;Smad4,Caspase3抗体购于Cell Signaling公司;CCK-8试剂盒购于碧云天生物技术研究所;Blasticidin和Puromycin购于Life Technologies公司;荧光素酶检测试剂购于Promega公司;miR-146a检测试剂盒购于Applied Biosystems公司。普通PCR仪(Thermo Scientific,USA),Nanodrop2000分光光度计(Thermo Scientific,USA),Stratagene MX3000p荧光定量PCR仪(Agilent,USA)等。
1.2 CCK-8细胞活力检测检测过程按照试剂盒说明进行。按104/孔将细胞铺入到96孔板中,每组5个孔,4h后加入DOX处理,24h后,加入10μl CCK-8检测试剂,混匀,孵育1h后,测定450nm吸光度值。
1.3 Western blot用胰酶消化收集培养的细胞,加入蛋白提取液裂解,离心后收集上清,用BCA试剂盒测定蛋白浓度,取适量蛋白提取液进行SDS-PAGE电泳,按照常规操作流程进行Western blot检测目的蛋白表达。
1.4 miR146a表达检测弃去培养细胞的上清,用PBS洗一次,然后加入Trizol裂解,按说明书流程提取RNA,然后按miR-146a检测试剂盒说明书步骤进行荧光定量PCR检测,通过U6作为内参校正miR-146a表达量。
1.5 4miR146a靶点预测通过TargetScan(http://www.targetscan.org/vert_71/)进行miR146a的靶点信息学分析[5]。
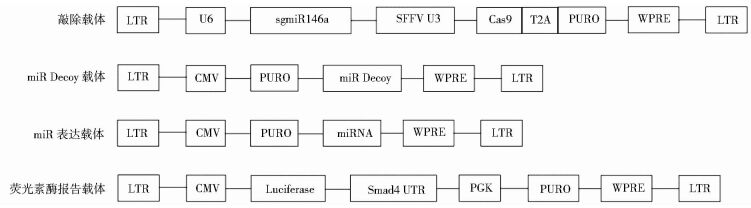
1.6 载体构建在网站http://crispr.genome-engineering.org/设计针对大鼠miR146a基因序列的sgRNA靶点,共设计两个,靶点1:ctctgagaactgaattccat,靶点2:gctaaagaactgaacttcac。按序列合成寡聚核苷酸,用BbsI酶切敲除载体pLentis-U6-sgRNA-SFFV-Cas9-T2A-PURO,将合成的寡聚核苷酸退火以后连入酶切的载体中,得到针对miR146a的敲除载体pLentis-U6-sgmiR146a-SFFV-Cas9-T2A-PURO,通过测序验证载体构建正确,针对两个不同靶点的干扰载体分别用sgmiR146a-1和sgmiR146a-2表示。
合成连续的5个miR146a的部分互补序列[2],然后用BbsI连入载体pLentis-CMV-PURO的puromycin基因后,得到针对miR146a的Decoy病毒载体。
合成250bp包含miR146a发卡区的基因组序列,然后用BbsI连入载体pLentis-CMV-PURO的puromycin基因后,得到miR146a的表达病毒载体,此载体中puromycin和miR146a的表达均由CMV启动子启动,以表达miR30的载体作为对照。
合成Smad4基因100bp包含miR146a结合靶点的UTR序列,然后用BbsI连入载体pLentis-CMV-Luc-PGK-Bsd的Luciferase基因后,得到针对miR146a的荧光素酶报告载体。
所用载体示意如下。
 |
病毒制备按照文献[6]报道方法进行。通过磷酸钙转染法将病毒载体和包装质粒共转染到293FT细胞中,培养48h后收集上清,用0.45μmol/L滤器过滤后置于-20度保存。
1.8 细胞转染用胰酶消化培养的H9c2细胞,按2×104/孔铺入24孔板中,24h后加入病毒液(转染复数20),培养20h后换为新鲜的DMEM培养基,待细胞长满后传代,带有PURO基因的病毒用Puromycin筛选,带有Bsd基因的病毒用Blasticidin筛选,获得稳定转染的细胞。
1.9 统计学分析实验结果用GraphPad Prism 5进行处理,组间差异使用非配对t检验,P<0.05认为有统计学差异。
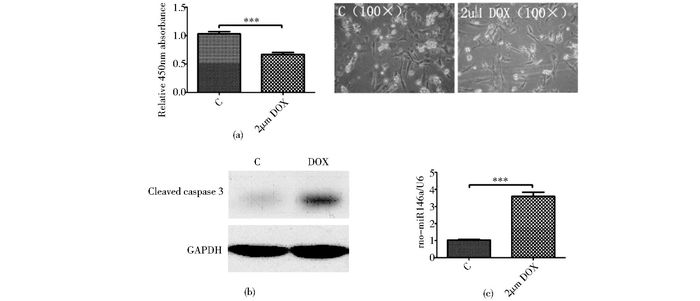
2 结果 2.1 多柔比星毒性作用伴随miR146a表达增加多柔比星处理大鼠心肌细胞后,细胞活力为对照组的67.1±3.1%(图 1a),Western blot检测发现DOX处理后胞内有较明显的Caspase3表达(图 1b),而处理细胞的miR146a表达增加3.60±0.24倍(图 1c)。
|
| 图 1 多柔比星处理对大鼠心肌细胞活力,Caspase 3水平以及miR146a表达的影响 Figure 1 Effects of DOX on the cell viability, Caspase 3 level and miR146a expression of rat cardiomyocytes x±s, n=5, *** P < 0.001 |
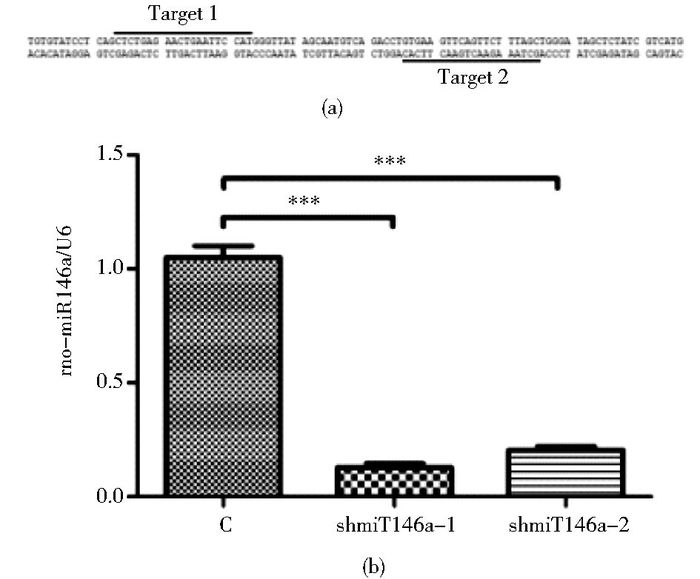
设计针对miR146a的两个sgRNA靶点并构建病毒载体(图 2a),用构建的敲除病毒转染细胞并筛选后,检测miR146a的表达。两条序列均可以有效地敲除miR146a,1#靶点miR146a表达是对照细胞的12.8±1.7%,2#靶点是正常细胞的20.4±1.5%,选用sgmiR146a-1进行后续的实验(图 2b)。
|
| 图 2 使用CRISPR敲除miR146a的表达 Figure 2 Downregulating miR146a expression using CRISPR x±s, n=5, *** P < 0.001 |
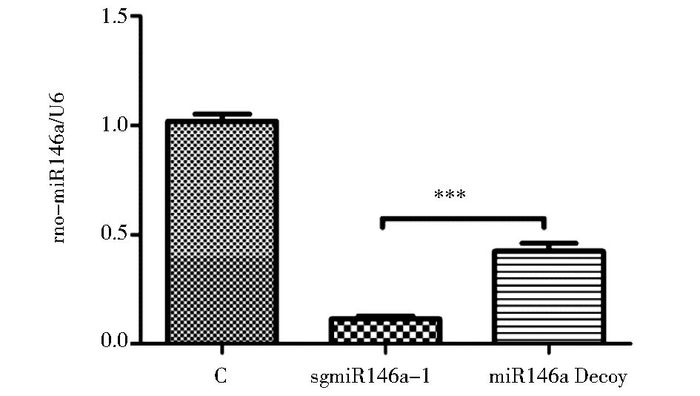
Decoy是常用的抑制miRNA研究其功能的方法[7],使用miR146a Decoy的病毒转染细胞并筛选后,检测到miR146a的表达是对照细胞的42.4±3.7%,CRISPR介导的miR146a敲除效果显著优于Decoy(图 3)。
|
| 图 3 使用CRISPR和miR Decoy对miR146a抑制效率的比较 Figure 3 Comparison of miR146a knockdown efficiency between CRISPR and miR Decoy x±s, n=5, *** P < 0.001 |
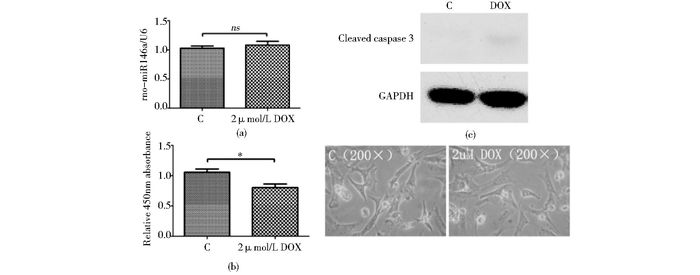
敲除miR146a的细胞用DOX处理后,miR146a的增加不明显(1.08±0.06倍,ns)(图 4a),处理细胞活力为对照组的80.4±5.7%(图 4b),Western blot显示Caspase3表达也不明显(图 4c),证明敲除miR146a抑制了多柔比星对心肌细胞的毒性作用。
|
| 图 4 敲除miR146a对多柔比星处理导致的miR146a表达,细胞活力以及Caspase 3水平变化的影响 Figure 4 Effects of miR146a downregulation on the cell viability, Caspase 3 level and miR146a expression of rat cardiomyocytes x±s, n=5, ns P>0.05, * P < 0.05 |
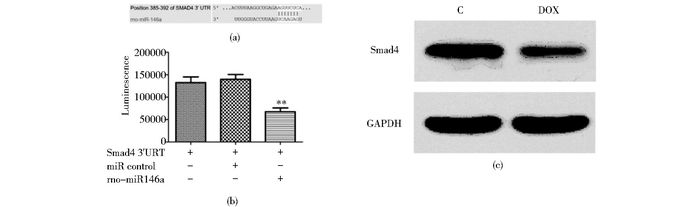
靶点预测显示Smad4是miR146a的潜在靶基因(图 5a),用Smad4 UTR的荧光素酶报告病毒转染细胞建立稳定表达细胞后,再用表达miR146a的病毒转染此细胞,相对于对照,miR146a表达显著抑制了荧光素酶的表达(139 900±10 650 vs 67 630±8 419,P<0.01)(图 5b)。而在DOX处理的心肌细胞内,Western blot检测发现Smad4表达下降(图 5c)。
|
| 图 5 验证Smad4作为miR146a靶基因的荧光素酶实验以及多柔比星处理对Smad4表达的影响 Figure 5 Identification of Smad4 as a target of miR146a and the influence of DOX treatment on Smad4 expression x±s, n=5, ** P < 0.01 |
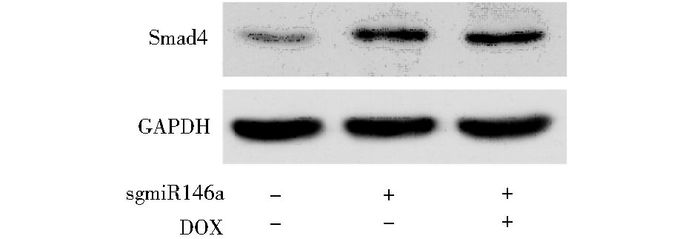
进一步检测发现在敲除miR146a的细胞中,Smad4表达升高,而DOX处理此细胞,Smad4变化不明显(图 6)。
|
| 图 6 敲除miR146a对多柔比星导致的Smad4表达变化的影响 Figure 6 Effect of miR146a downregulation on DOX induced Smad4 expression |
揭示多柔比星的毒性作用机制,对于减小副作用,改良药物临床应用有着重要的意义。miRNA是一类重要的胞内小RNA,参与了细胞内各种基因的表达调控[3]。由于一个miRNA可以通过结合不同的UTR区同时调控多个基因的表达,因此它常会参与多种细胞生理行为。本文中描述的miR146a,一些免疫细胞中能够通过调节TRAF6影响细胞的凋亡[8],而在心肌细胞中,却通过调控另一个基因ErbB4影响细胞凋亡[2]。在我们的研究中,发现Smad4也是miR146a的一个靶基因,在多柔比星处理的细胞中,miR146a通过抑制Smad4促进细胞凋亡。这意味着miR146a在此过程中是一个重要的效应分子,可以通过多条通路介导多柔比星的细胞毒性效应。敲除miR146a可以显著抑制多柔比星的毒性,提示miR146a抑制剂有可能作为一种选择来缓解临床上多柔比星导致的心脏毒性。
Smad4是转化生长因子受体β(TGFβ)通路中的一个重要的信号分子,介导了TGFβ的胞内信号传递,对于细胞的增殖或凋亡有重要的影响[9]。在不同的细胞中,miR146a对Smad4的调控可能会产生不同的结果。通常在肿瘤细胞中,TGFβ通路是细胞生长的负向调节因素,miR146a上调表达抑制Smad4,从而抑制TGFβ通路,促进了细胞的生长[10]。而在另一些细胞,如软骨细胞,肝脏星形细胞中,TGFβ通路作为细胞增殖的正向调节因素,miR146a上调表达会抑制Smad4,从而导致细胞凋亡[11-12]。由于细胞行为是多种信号共同控制的结果,因此对于特定的细胞由于内源性基因表达的差异,需要进行特定的分析,因此本研究证明在心肌细胞上,miR146a表达的增加通过抑制Smad4表达最终产生促进凋亡的效果(见以下图示)。
CRISPR作为现在最热门的基因编辑技术,广泛地应用于基因功能研究中。使用CRISPR可以非常简单地进行基因组的精确修饰。但在其应用中,对于miRNA的编辑研究并不多见[13],有研究使用CRISPR或CRISPRi抑制miRNA的表达[14],由于其采用的瞬时转染技术,对miRNA的表达抑制率并不高。在本研究中,我们结合了慢病毒载体技术,从而获得高转染效率,有效地敲除了细胞中内源性的miRNA表达。并且与传统的使用Decoy或者Sponge的miRNA抑制方法相比[7],具有更高的抑制效率。本研究中使用的这一方法,对于miRNA的功能研究,具有积极的意义。
| [1] | Jensen B V, Skovsgaard T, Nielsen S L. Functional monitoring of anthracycline cardiotoxicity:a prospective, blinded, long-term observational study of outcome in 120 patients. Ann Onco, 2002, 13(5) : 699–709. DOI:10.1093/annonc/mdf132 |
| [2] | Horie T, Ono K, Nishi H, et al. Acute doxorubicin cardiotoxicity is associated with miR-146a-induced inhibition of the neuregulin-ErbB pathway. Cardiovasc Res, 2010, 87(4) : 656–664. DOI:10.1093/cvr/cvq148 |
| [3] | He Lin, Hannon G J. MicroRNAs:small RNAs with a big role in gene regulation. Nat Rew Genet, 2004, 5(7) : 522–531. DOI:10.1038/nrg1379 |
| [4] | Cong L, Ran F A, Cox D, et al. Multiplex genome engineering using CRISPR/Cas systems. Science, 2013, 339(6121) : 819–823. DOI:10.1126/science.1231143 |
| [5] | Agarwal V, Bell G W, Nam J W, et al. Predicting effective microRNA target sites in mammalian mRNAs. eLife, 2015, 4 : e05005. |
| [6] | Kutner R H, Zhang X Y, Reiser J. Production, concentration and titration of pseudotyped HIV-1-based lentiviral vectors. Nat Protoc, 2009, 4(4) : 495–505. DOI:10.1038/nprot.2009.22 |
| [7] | Margaret S E, Joel R N, Phillip A S. MicroRNA sponges:competitive inhibitors of small RNAs in mammalian cells. Nat Methods, 2007, 4(9) : 721–726. DOI:10.1038/nmeth1079 |
| [8] | Guo Q, Zhang J, Li J, et al. Forced miR-146a expression causes autoimmune lymphoproliferative syndrome in mice via downregulation of Fas in germinal center B cells. Blood, 2013, 131(24) : 4875–4883. |
| [9] | Derynck R, Zhang Y E. Smad-dependent and Smad-independent pathways in TGF-beta family signalling. Nature, 2003, 425(6958) : 577–584. DOI:10.1038/nature02006 |
| [10] | Geraldo M V, Yamashita A S, Kimura E T. MicroRNA miR-146b-5p regulates signal transduction of TGF-β by repressing SMAD4 in thyroid cancer. Oncogene, 2012, 31(15) : 1910–1922. DOI:10.1038/onc.2011.381 |
| [11] | He Y, Huang C, Sun X, et al. MicroRNA-146a modulates TGF-beta1-induced hepatic stellate cell proliferation by targeting SMAD4. Cell Signal, 2012, 24(10) : 1923–1930. DOI:10.1016/j.cellsig.2012.06.003 |
| [12] | Jin L, Zhao J, Jing W, et al. Role of miR-146a in human chondrocyte apoptosis in response to mechanical pressure injury in vitro. Int J Mol Med, 2014, 34(2) : 451–463. |
| [13] | Xiao A, Wang Z, Hu Y, et al. Chromosomal deletions and inversions mediated by TALENs and CRISPR/Cas in zebrafish. Nucleic Acids Res, 2013, 41(14) : e141. DOI:10.1093/nar/gkt464 |
| [14] | Zhao Y, Dai Z, Liang Y, et al. Sequence-specific inhibition of microRNA via CRISPR/CRISPRi system. Sci Rep, 2014, 4 : 3943. |
 2017, Vol. 37
2017, Vol. 37




