文章信息
- 孙丹, 徐国霞, 王自强, 王云山, 张利平, 苏志国.
- SUN Dan, XU Guo-xia, WANG Zi-qiang, WANG Yun-shan, ZHANG Li-ping, SU Zhi-guo.
- 产酸丙酸杆菌耐酸菌株的选育及其应用
- Screening and Application of Acid-resistant Strains of Propionibacterium acidipropionici
- 中国生物工程杂志, 2017, 37(11): 83-88
- China Biotechnology, 2017, 37(11): 83-88
- http://dx.doi.org/DOI:10.13523/j.cb.20171111
-
文章历史
- 收稿日期: 2017-04-24
- 修回日期: 2017-06-27
2. 中国科学院过程工程研究所生化工程国家重点实验室 北京 100190
2. The State Key Lab of Biochemical Engineering, The Institute of Process Engineering of the Chinese Academy of Sciences, Beijing 100190, China
丙酸(propionic acid, PA)是一种用途广泛的天然有机弱酸,同时也是非常普遍的化工材料和饲料抗真菌剂[1-2]。丙酸主要的生产方法有化学合成和微生物发酵法[3],化学合成要求的条件比较苛刻且成本较高,同时会带来一定的环境问题,因此微生物发酵法生产丙酸这一比较环保的生产方式,得到了越来越多的关注[4]。
微生物发酵法生产丙酸,会产生丙酸、乙酸和丁二酸[5],有机酸的积累会抑制菌体的生长,从而影响其发酵水平,因此筛选丙酸杆菌优良耐酸菌株对工业化生产和后续发酵分离耦合具有重要意义[6-7]。Zhu等[8]通过逐级传代,逐渐提高选择压力(丙酸浓度)的方法来提高丙酸杆菌的耐酸性能,以甘油作为碳源,发酵周期220h,产酸44.62g/L。陈焕蛟等[9]通过压力筛选方法得到一株菌株,菌株发酵240h时的产酸浓度为49.35g/L。但这两种发酵周期长且产酸浓度不够高。另外,也可通过改变发酵模式提高产量。例如,Coronado等[10]设计了固定化丙酸杆菌细胞在搅拌式发酵罐中发酵过程的动力学模型;梁泽鑫和王菊芳[11]采用FBB固定化补料流加发酵工艺,经过400h的驯化,丙酸产量达到80.86g/L;Feng等[12]发明了一种多点式纤维床反应器作为丙酸的固定化发酵,发酵496h,获得丙酸最高的浓度是67.05g/L。但这些法发酵周期较长,产酸速率很低,不适宜工业化生产和应用。
文献报道表明,通过压力筛选的方法进行菌种选育是可行的[6-7]。为了进一步提高丙酸的发酵水平以及菌株的产酸耐酸能力,本研究以实验室保藏的产酸丙酸杆菌(耐30g/L丙酸)为出发菌株,采用逐级传代的方式,逐渐提高选择压力(丙酸浓度)的方法来提高丙酸杆菌的耐酸性能,选育出一株耐受丙酸的产酸丙酸耐酸菌株,降低了发酵过程中丙酸的反馈抑制作用。一方面有利于有机酸的积累,提高菌株的发酵水平,另一方面也降低了微生物发酵生产丙酸的成本,有利于菌种的工业化生产和应用,同时对后续的发酵分离耦合具有重要意义。
1 材料与方法 1.1 实验材料 1.1.1 菌株产酸丙酸杆菌(Propionibacterium acidipropionici)。
1.1.2 培养基种子培养基(g/L):葡萄糖35,玉米浆21(干物),(NH4)2SO4 5,K2HPO4 4,pH 7.0,121℃灭菌20min。
发酵培养基(g/L):葡萄糖80,玉米浆50(干物),酵母浸膏5,K2HPO4 4.6,pH 7.0,121℃灭菌20min;葡萄糖单独灭菌。
固体培养基(g/L):葡萄糖20,玉米浆10(干物),(NH4)2SO4 2,调节pH 7.0后添加CaCO3 2,琼脂20;121℃灭菌20min。
1.1.3 实验设备与分析仪器LA-20A型高效液相色谱仪(日本岛津公司),PL203型电子天平(瑞士梅特勒-托利多公司),Delta 320型pH计(瑞士梅特勒-托利多公司),i7紫外分光光度计(济南海能仪器股份有限公司),SBA-40A型生物传感分析仪(山东省科学院生物研究所),ZXDP-B2160全自动新型电热培养箱(上海智城分析仪器制造有限公司),LDZM-80KCS型立式蒸汽压力灭菌器(上海申安医疗器械厂),TGL-20M台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司),7L全自动搅拌式发酵罐(上海百仑生物科技有限公司)。
1.2 实验方法 1.2.1 菌种筛选将实验室保藏的产酸丙酸杆菌(耐30g/L丙酸)接种于种子培养基中,30℃厌氧培养48h时,涂布固体培养皿,将培养皿置于厌氧盒,30℃厌氧培养4天时,挑取培养皿上长势较大的单菌落接种于斜面培养基,30℃厌氧培养4天,保藏备用。
将斜面保存的产酸丙酸杆菌菌株用种子液体培养基洗下,接入种子培养基中,30℃厌氧培养48h。以10%的接种量接入到含5g/L丙酸的种子培养基中,30℃厌氧培养48h。再以10%的接种量接入含更高浓度丙酸的种子培养基中30℃厌氧培养48h,通过不断提高丙酸浓度依次以10%的接种量进行传代培养,筛选出具有优良耐酸性能的产酸丙酸杆菌菌株,如图 1所示。
|
| 图 1 丙酸杆菌耐酸菌株的筛选 Figure 1 Screening of the acid-resistant stains of Propionibacterium |
将出发菌株和筛选的耐酸菌株分别接至种子培养基中,30℃厌氧培养48h,以10%的接种量转接到二级种子中30℃厌氧培养48h,再以10%的接种量转接到发酵培养基中,采用生物传感分析仪测发酵中葡萄糖的浓度,当葡萄糖浓度低于10g/L时补加葡萄糖,以维持菌体的正常生长和产物的合成,同时,用氨水调节pH为6.8~7.2,发酵过程中定期取样检测发酵液中的丙酸产量,比较出发菌株和耐酸菌株的产酸能力和耐酸能力。
1.2.3 7L发酵罐实验7L发酵罐放大培养,以出发菌株P-0为对照组,耐酸菌株P-10为实验组,控制搅拌速率为50r/min,30℃厌氧发酵,采用生物传感分析仪测发酵中葡萄糖的浓度,当葡萄糖浓度低于10g/L时补加葡萄糖,以维持菌体的正常生长和产物的合成,同时,用氨水调节pH为6.8~7.2,定时取样测菌体的生长和产酸浓度,比较出发菌株和耐酸菌株的产酸能力。
1.2.4 耐酸菌株产酸稳定性试验将上述耐酸筛选的菌株在发酵过程中传代培养,分两种:发酵培养基添加10g/L丙酸和发酵培养基不添加丙酸,在培养到48h时以10%的接种量转接到下一代,依次传代。采用生物传感分析仪测发酵中葡萄糖的浓度,当葡萄糖浓度低于10g/L时补加葡萄糖,以维持菌体的正常生长和产物的合成,同时,用氨水调节pH为6.8~7.2,定时取样测产酸浓度。
1.2.5 二次接种实验出发菌株和耐酸菌株在摇瓶发酵分别到84h和156h时,以10%的接种量进行二次接种,发酵过程中用氨水调节pH为6.8~7.2,定时取样测产酸浓度,比较出发菌株和耐酸菌株的产酸耐酸能力。
1.3 分析方法 1.3.1 生物量的测定采用光密度法测定菌体的生物量:用i7型紫外分光光度计在600nm的波长条件下,用去离子水稀释一定的倍数,使OD600 0.3~0.8,用分光光度计测定。菌液生物量OD600=n×A600,n表示菌液的稀释倍数。
1.3.2 葡萄糖浓度的测定采用SBA-40A型生物传感分析仪测定葡萄糖的浓度:将发酵液进行离心,取1ml上清液用去离子水稀释100倍,进样测葡萄糖含量,进样量25μl。
1.3.3 丙酸浓度的测定使用高效液相色谱法(HPLC):流动相为0.005mol/L H2SO4,流速0.4ml/min,柱温55℃,进样量10μl。
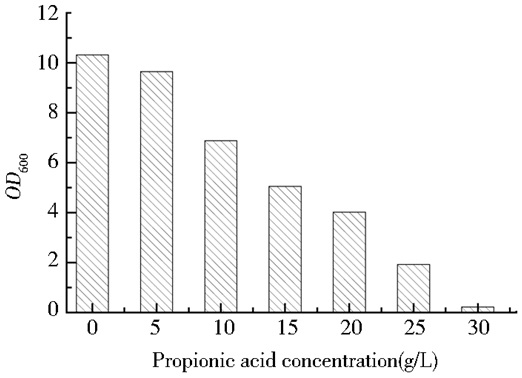
2 结果与讨论 2.1 耐酸菌株筛选出发菌株经过在液体种子培养基活化后,以10%的接种量依次转接,随着培养基中添加丙酸浓度的增加菌体的生长受到了抑制,其菌体生长的结果如图 2所示。
|
| 图 2 丙酸压力筛选过程菌体的生长状况 Figure 2 The growth status of bacteria in the process of propionic acid pressure screening |
由图 2可以看出,当培养基添加30g/L丙酸时几乎无菌体生长,培养基添加25g/L丙酸时菌体的OD值小于4,添加10g/L、15g/L和20g/L丙酸的菌体OD值都大于4,且由于添加15g/L和20g/L丙酸的菌株在丙酸压力条件下菌体生长较为缓慢,添加5g/L丙酸时,添加浓度过小,达不到耐酸效果,因此,选择培养基添加10g/L丙酸的菌株进行后续的发酵培养及应用,命名为P-10。
2.2 摇瓶发酵耐酸菌株P-10做摇瓶发酵,发酵周期为168h,同时与出发菌株P-0做比较,检测其产酸浓度和产酸速率,如表 1所示,发酵终点168h时,耐酸菌株P-10的丙酸浓度为49.66g/L,产酸速率为0.30g/(L·h),比出发菌株P-0丙酸浓度高53.04%。
| Strains | P-0 | P-10 |
| Propionic acid concentration(g/L) | 32.45 | 49.66 |
| Acid production rate[g/(L·h)] | 0.19 | 0.30 |
2.3 7L发酵罐发酵
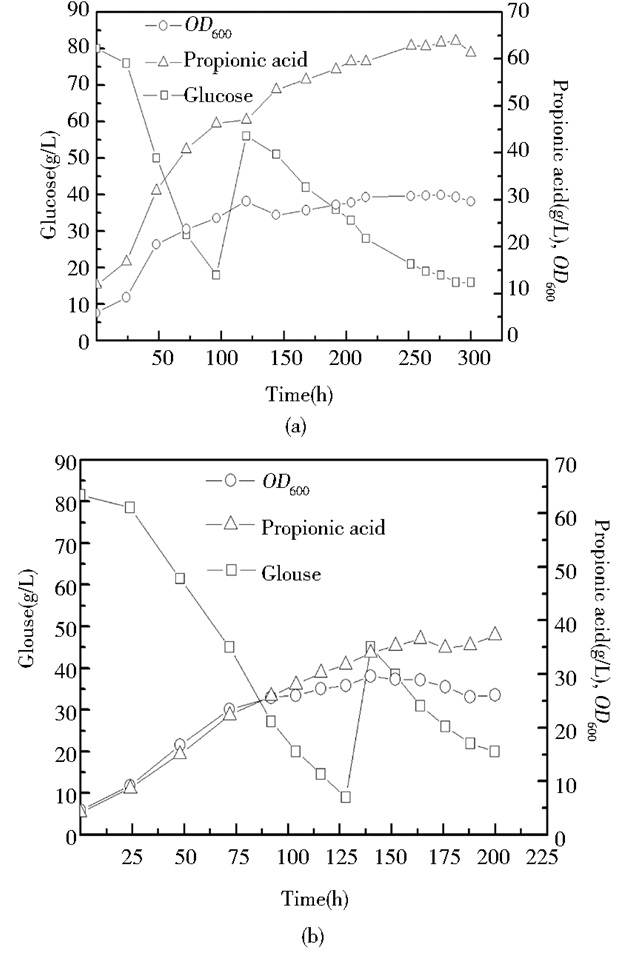
7L发酵罐搅拌速率为50r/min,温度为30℃,pH为6.8~7.0,耐酸菌株P-10和出发菌株P-0在发酵过程中的相关参数变化如图 3(a)、(b)所示,出发菌株P-0发酵到168h丙酸浓度为36.53g/L,产酸速率为0.22g/(L·h),而耐酸菌株P-10培养到96h葡萄糖消耗速率较快且产酸浓度为46.23g/L,产酸速率为0.48g/(L·h)。发酵到168h时菌体生长到稳定期葡萄糖消耗速率缓慢,菌体生长稳定且产酸没有明显的增加,丙酸浓度为55.63g/L,产酸速率为0.33g/(L·h),较出发菌株P-0提高了52.33%。
|
| 图 3 P-10和P-0分批补料发酵过程中相关参数的变化 Figure 3 Changes of related parameters in P-0 and P-0 batching filling material fermentation process (a) Changes of related parameters in P-10 batching filling material fermentation process (b) Changes of related parameters in P-0 batching filling material fermentation process |
将耐酸菌株P-10在发酵过程中进行传代培养,同时测定P-10在培养基添加10g/L丙酸与培养基未添加丙酸两种情况下的产酸情况,实验结果表明菌株P-10在培养基添加10g/L丙酸和未添加丙酸两种环境中都能够连续传代8次,且每代产酸并没有显著的变化,表 2所示结果证明菌株P-10具有优良的产酸稳定性。
| Propionic acid concentration (g/L) | Generations of propagation | |||||||
| F1 | F2 | F3 | F4 | F5 | F6 | F7 | F8 | |
| A | 52.27 | 54.43 | 55.21 | 51.50 | 51.83 | 55.21 | 50.53 | 52.91 |
| B | 49.66 | 55.88 | 52.76 | 53.79 | 51.91 | 52.42 | 54.04 | 49.37 |
| Note: F represents the number of passages; A represents that the medium is added with propionic acid; B represents that the medium is not added with propionic acid | ||||||||
2.5 二次接种实验
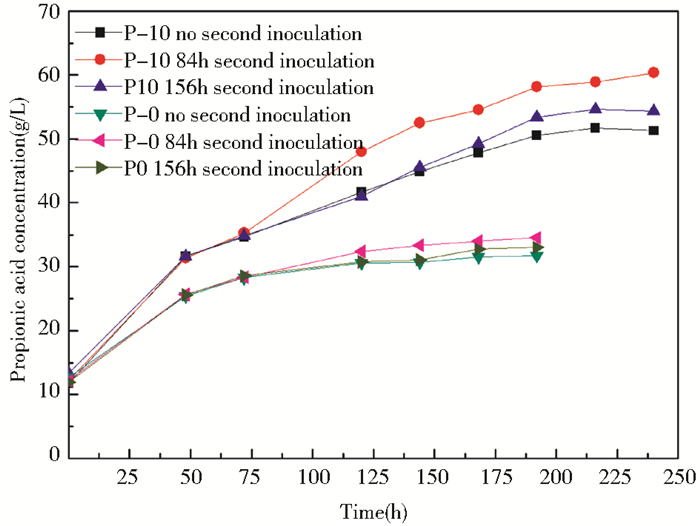
将耐酸菌株P-10摇瓶发酵分别到84h和156h时以10%的接种量进行二次接种,同时以出发菌株P-0作为对照组,发酵过程中用氨水调节pH为6.8~7.2,定时取样测产酸浓度,并持续发酵,发酵终点产酸结果如表 3所示。
| Strains | ||||||
| P-0 | P-10 | |||||
| Secondary inoculation time | No second inoculation | 84h second inoculation | 156h second inoculation | No second inoculation | 84h second inoculation | 156h second inoculation |
| Propionic acid concentration (g/L) | 31.74 | 34.51 | 32.71 | 51.29 | 60.39 | 54.35 |
由表 3可以看出,P-10在84h二次接种的终点产酸浓度为60.39g/L,产酸最高,证明了84h为二次接种最适时间段,同时对照组P-0的产酸也证明了84h为二次接种最适时间段。
由图 4可以显著看出,84h二次接种时,耐酸菌株P-10比出发菌株P-0发酵终点产酸浓度高74.99%,进一步验证了耐酸菌株P-10的应用前景。二次接种实验对菌株产酸浓度有一定的影响,能够延长菌株的产酸周期,提高菌株的产酸能力和耐酸能力,更有利于有机酸的积累,另外也可降低生产成本,有利于菌种的工业化生产和应用,同时对后续的发酵分离耦合具有重要意义。
|
| 图 4 P-0和P-10二次接种实验 Figure 4 P-0 and P-10 secondary inoculation experiment |
以实验室保藏的产酸丙酸杆菌(耐30g/L丙酸)为出发菌株P-0,通过压力筛选的方法,筛选出一株具有优良产酸耐酸性能的菌株P-10,同时,得到以下结论。
(1) 筛选出了一株耐受10g/L丙酸的产酸丙酸杆菌菌株P-10,其产酸浓度为49.66g/L,较出发菌株P-0提高了53.04%。
(2) 7L发酵罐实验结果表明,菌株P-10的发酵周期为168h时,丙酸浓度可达到55.63g/L,丙酸产率为0.33g/(L·h),较出发菌株P-0提高了52.33%。
(3) 产酸丙酸杆菌耐酸菌株P-10具有优良的产酸稳定性,摇瓶传代8次后,其产酸没有明显变化。
(4) 产酸丙酸杆菌耐酸菌株P-10具有良好的应用前景。当发酵进行至84h时,进行二次接种,发酵结束时丙酸浓度可达到60.39g/L,较批次发酵时提高了17.77%。此外,84h二次接种时,耐酸菌株P-10比出发菌株P-0发酵终点产酸浓度高74.99%,进一步验证了耐酸菌株P-10的应用前景。
产酸丙酸杆菌在发酵过程中有机酸的积累会抑制菌体的生长,从而影响其发酵水平。筛选出的耐酸菌株P-10具有优良的产酸稳定性,且耐酸菌株P-10在二次接种实验中能够延长菌株的产酸周期,提高菌株的产酸能力和耐酸能力,更有利于有机酸的积累,提高了菌株的发酵水平,同时也降低了生产成本,有利于菌种的工业化生产和应用,并对后续的发酵分离耦合具有重要意义。
| [1] |
叶文彬. 产酸丙酸杆菌FS1026丙酸发酵的研究. 福建: 福建师范大学, 2015. Ye W B. Studies on the Propionic Acid Fermentation from Propionibacterium acidipropionici FS1026. Fujian:Fujian Normal University, 2015. |
| [2] |
Suwannakham S, Huang Y, Yang S T. Construction and characterization of ack knock-out mutants of Propionibacterium acidipropionici for enhanced propionic acid fermentation. Biotechnology and Bioengineering, 2006, 94(2): 383-395. DOI:10.1002/(ISSN)1097-0290 |
| [3] |
孙帅, 常忠义, 唐学明, 等. 丙酸杆菌代谢物摇瓶补料分批发酵条件研究. 西北农林科技大学学报(自然科学版), 2011, 39(7): 135-140. Sun S, Chang Z Y, Tang X M, et al. Study of Propionibacterium metabolites flask fed-batch fermentation. Journal of Northwest A & F University (Natural Science Edition), 2011, 39(7): 135-140. |
| [4] |
Jiang L, Wang J F, Liang S Z, et al. Enhanced butyric acid tolerance and bioproduction by Clostridium tyrobutyricum immobilized in a fibrous bed bioreactor. Biotechnology and Bioengineering, 2011, 108(1): 31-40. DOI:10.1002/bit.22927 |
| [5] |
梁泽鑫, 王菊芳. 产酸丙酸杆菌生长特性及5L罐发酵动力学研究. 激光生物学报, 2014, 23(3): 251-256. Liang Z X, Wang J F. The growth and 5L fermentor kinetics characteristics of Propionibacterium acidipropionici. Journal of Laser Biology, 2014, 23(3): 251-256. |
| [6] |
Goswami V, Srivastava A K. Fed-batch propionic acid production by Propionibacterium acidipropionici. Biochemical Engineering Journal, 2000, 4(2): 121-128. DOI:10.1016/S1369-703X(99)00042-X |
| [7] |
Karadag D, Puhakka J A. Direction of glucose fermentation towards hydrogen or ethanol production through online pH control. International Journal of Hydrogen Energy, 2010, 35: 10245-10251. DOI:10.1016/j.ijhydene.2010.07.139 |
| [8] |
Zhu Y F, Liu L, Li J H, et al. Optimization and scale-up of propionic acid production by propionic acid-tolerant Propionibacterium acidipropionici with glycerol as the carbon source. Bioresource Technology, 2010, 101(22): 8902-8906. DOI:10.1016/j.biortech.2010.06.070 |
| [9] |
陈唤蛟, 李小连, 李彦良, 等. 丙酸高产菌株的选育及发酵培养基优化. 过程工程学报, 2014, 14(3): 482-486. Chen H J, Li X L, Li Y L, et al. Screening of high yield propionic acid producing strain and optimization of its fermentation medium. Journal of Process Engineering, 2014, 14(3): 482-486. |
| [10] |
Coronado C, Botello J E, Herrera F. Study and mathematical modeling of the production of propionic acid by Propionibacterium acidipropionici immobilized in a stirred tank fermentor. Biotechnology Progress, 2001, 17(4): 669-675. DOI:10.1021/bp010059p |
| [11] |
梁泽鑫. 利用纤维床生物反应器发酵廉价生物质生产丙酸的研究. 广州: 华南理工大学, 2012. Liang Z X. Study on the Production of Propionic Acid by Fermentation of Cheap Biomass Using Fiber Bed Bioreactor. Guangzhou:South China University of Technology, 2012. |
| [12] |
Feng X, Chen F, Xu H, et al. Propionic acid fermentation by Propionibacterium freudenreichii CCTCC M207015 in a multi-point fibrous-bed bioreactor. Bioprocess and Biosystems Engineering, 2010, 33(9): 1077-1085. DOI:10.1007/s00449-010-0433-7 |
 2017, Vol. 37
2017, Vol. 37




