文章信息
- 王路路, 权春善, 许永斌, 陈金利, 吴懿, 王冠天, 董悦生.
- WANG Lu-lu, QUAN Chun-shan, XU Yong-bin, CHEN Jin-li, WU Yi, WANG Guan-tian, DONG Yue-sheng.
- 金黄色葡萄球菌arl双组分信号转导系统受体蛋白ArlSCA的表达、纯化及活性研究
- Expression, Purification and Functional Assay of ArlSCA from Staphylococcus aureus
- 中国生物工程杂志, 2017, 37(11): 52-58
- China Biotechnology, 2017, 37(11): 52-58
- http://dx.doi.org/DOI:10.13523/j.cb.20171108
-
文章历史
- 收稿日期: 2017-04-19
- 修回日期: 2017-07-12
2. 大连民族大学生物技术与资源利用教育部重点实验室 大连 116600;
3. 大连民族大学生命科学学院 大连 116600
2. Key Laboratory of Biotechnology and Bioresources Utilization, State Ethnic Affairs Commission and Ministry of Education, Dalian 116000, China;
3. College of Life Science, Dalian Minzu University, Dalian 116600, China
金黄色葡萄球菌是极具危害的人类病原菌,具有较高的致死率[1],约有30%的正常人群也长期携带着该菌[2]。金黄色葡萄球菌可引起伤口的化脓感染,亦可诱发内脏器官感染,导致肺炎、心内膜炎及脓毒血症等疾病[3-4],致使病人免疫能力降低甚至死亡。目前,医院主要通过抗生素来治疗由金黄色葡萄球菌引起的疾病感染。近几十年,先后出现了耐青霉素菌株、耐甲氧西林菌株和耐万古霉素菌株等耐药性菌株,这些超级细菌的出现为相关疾病的治疗带来了巨大的困难,因此发现抗菌靶点和开发新的抗菌药物迫在眉睫[5-10]。
金黄色葡萄球菌的致病机制与其能分泌多种细胞外毒素及胞外酶密切相关[2, 11],而这些毒力因子的表达受多个基因组成的网络调控,过程十分复杂。研究表明,agr、srr、arl、sae、lyt、wal等多个双组分信号转导系统均参与这些毒力因子的调控过程[12],其中arl系统是最重要的双组分信号转导系统之一。arl系统由组氨酸激酶蛋白ArlS和反应调控蛋白ArlR构成[2-3],ArlRS可作为全面调控因子,直接或间接调节多种基因的表达[13],与金黄色葡萄球菌的致病性密切相关。我们利用在线软件预测ArlS蛋白含有两个跨膜片段和一个较大的胞内域结构(图 1a),蛋白质胞内域部分含有两个结构域分别是组氨酸自身磷酸化位点和ATP结合的激酶功能区;ArlR包含两个结构域,N端含有接受自组氨酸蛋白激酶转移的磷酸基团位点,C端有含DNA结合位点的效应区[2, 14-15]。

|
| 图 1 AgrC蛋白和ArlS蛋白二级机构预测及同源性分析图 Figure 1 The homogeneity analysis result and the putative periplasmic region of ArlS and AgrC proteins (a) The putative periplasmic region of ArlS and AgrC proteins. The transmembrane segments, dimerization and histidine phosphotransfer regions (DHP) subdomain, and catalytic and ATP-binging (CA) subdomain are indicated by purple, blue and red boxes, respectively (b)The homogeneity analysis result of AgrC and ArlS |
ArlRS双组分系统的信号传递通过组氨酸激酶ArlS磷酸化实现,组氨酸的磷酸基团转移到反应调节蛋白接受域的天冬氨酸残基上,从而调控目的基因的表达或目的蛋白的功能发生适应性变化。ArlS蛋白可以捕捉胞外信号并且能够发生磷酸化,启动信号转导过程[16-17],因而ArlS的胞内域被认为是调控毒力因子表达的重要功能域。
ArlS蛋白属于组氨酸激酶蛋白,文献报道[18]该蛋白质与双组分信号转导系统中的其他组氨酸蛋白具有同源性。经过序列的同源性分析,结果显示ArlS蛋白与AgrC蛋白具有较高的同源性。目前对于AgrC蛋白的研究较为透彻,已经成功解析了AgrC蛋白CA域(结合ATP并磷酸化组氨酸残基的C端催化域)的晶体结构[19]。有文献介绍[19-20]AgrC蛋白的394位和396位氨基酸残基在其自磷酸化过程中起着关键作用,根据同源性比对分析结果推测ArlS蛋白的418位和420位氨基酸残基可能是ArlS蛋白自磷酸化过程中的具有重要功能的氨基酸。由于ArlS蛋白控制磷酸化的功能域位于蛋白质胞内域部分,因此本文首先以ArlS蛋白的胞内域部分即ArlSCA(残基数294~451)为目标蛋白,进行相关的活性研究。同时,本文利用定点突变的研究方法,构建了418位和420位氨基酸残基突变的ArlS蛋白即ArlSCAG418A和ArlSCAG420A,并利用Kinase-Glo Luminescent Kinase Assay方法测定激酶活性,以检测418位和420位氨基酸残基在ArlSCA蛋白自磷酸化过程中的作用。
1 材料与方法 1.1 材料本研究所用引物均由Invitrogen(上海)贸易有限公司合成,限制性内切核酸酶NcoⅠ和XhoⅠ酶、Ex Taq DNA聚合酶、T4 Ligase均购自大连宝生物工程公司。
1.2 ArlSCA、ArlR、ArlSCA-G418A及ArlSCA-G420A表达载体的构建根据NCBI登记的ArlS和ArlR蛋白的碱基序列,以及载体pProEX-HTa的多克隆酶切位点,利用clone manager软件设计上下游引物,分别引入NcoⅠ和XhoⅠ酶切位点。ArlR的引物信息如下:上游引物F-ArlR:5′-GGGCCATGGATATATGACGCAAATTTTA-3′(划线部分为NcoⅠ酶切位点);下游引物R-ArlR:5′-GGGCTCGAGTCATCGTATCACATACCC-3′(划线部分为XhoⅠ酶切位点)。ArlS的引物信息如下:上游引物F-ArlSCA:5′-GGGCCATGGATAAAGGAGATGTAAATGAC-3′(划线部分为NcoⅠ酶切位点);下游引物R-ArlSCA:5′-GGGCTCGAGTTAAAATATGATTTTAAA-3′(划线部分为XhoⅠ酶切位点)。ArlS蛋白的第418位、420位氨基酸G突变为A,构建418位突变菌株ArlSCA-G418A和420位突变菌株ArlSCA-G420A。ArlSCA-G418A的引物信息如下:上游引物F-ArlSCA-G418A:5′-CAAGGCGGTAATGCGCTCGGATTATCT-3′;下游引物R-ArlSCA-G418A:5′-AGATAATCCGAGCGCATTACCGCCTTG-3′。ArlSCA-G420A的引物信息如下:上游引物F-ArlSCA-G420A:5′-GGTAATGGTCTC GCGTTATCTATTGCG-3′;下游引物R-ArlSCA-G420A:5′-CGGAATAGATAACGCGAGTCCATTACC-3′。
以金黄色葡萄球菌基因组为模板,体系中加入上下游引物、Taq DNA聚合酶及缓冲液,进行PCR反应,切胶回收PCR扩增产物。将目的基因和pProEX-HTa质粒用NcoⅠ和XhoⅠ进行双酶切,用T4 DNA连接酶将载体与目的基因连接得到重组质粒,用化学转化法将重组质粒转入大肠杆菌DH5α感受态细胞中。对转化成功的菌株提质粒,送至生物公司测序。
1.3 ArlSCA、ArlR、ArlSCA-G418A及ArlSCA-G420A蛋白的表达将测序成功的表达载体1μl用化学转化法转入E.coli BL21(RIL)感受态细胞中,涂布于含有100μg/ml氨苄霉素的LB固体培养基上过夜培养。挑取单菌落接种于20ml含有100mg/L氨苄霉素的液体LB培养基中,37℃恒温震荡过夜培养后按1%的接种量接种到200ml液体LB培养基中,37℃震荡培养至OD600在0.6时,取出20ml样品作为诱导前样品,其余加入终浓度为0.5mmol/L的IPTG,30℃培养8h后收集菌体。
将收集的菌体用缓冲液(20mmol/L Tris-HCl, 150mmol/L NaCl, pH8.0)悬浮后进行超声破碎,13 000r/min离心50min,保存上清液作为粗提液备用。分取诱导前后的上清液用15%的SDS-PAGE检测蛋白质的诱导表达情况。
1.4 ArlSCA、ArlR、ArlSCA-G418A及ArlSCA-G420A蛋白的纯化将诱导后的ArlSCA、ArlR、ArlSCA-G418A及ArlSCA-G420A的上清液依次进行金属离子螯合层析(Ni2+-NTA柱),离子交换层析和凝胶过滤层析。
用金属离子螯合层析对ArlSCA、ArlR、ArlSCA-G418A及ArlSCA-G420A蛋白进行初步分离纯化,纯化后的蛋白质用15%的SDS-PAGE检测蛋白质纯化效果。
用离子交换层析对ArlR蛋白进行进一步的分离纯化。先用Buffer B(20mmol/L Tris-HCl,1mol/L NaCl,2mmol/L β-Me,pH8.0,0.22μm滤膜过滤)洗阴离子交换柱(Hi Trap Q,5ml)中可能残留的蛋白质,再用Buffer A(20mmol/L Tris-HCl,2mmol/L β-Me,pH8.0)洗去柱子中的盐离子,然后将待纯化的蛋白质与离子交换柱结合,用Buffer B、Buffer A的混合液对目的蛋白进行梯度洗脱,在280nm波长下监测洗脱结果并收集目标样品。根据洗脱峰谱图,选择样品用15%的SDS-PAGE进行检测分析,回收目的蛋白,浓缩至5ml备用。
用凝胶过滤层析再次纯化ArlR蛋白。在AKTA层析系统上利用凝胶过滤柱(HiLoadTM 16/600,SuperdexTM 200pg)纯化蛋白质,缓冲液(20mmol/L Tris-HCl,150mmol/L NaCl,2mmol/L β-Me)流速0.5ml/min,在280nm波长下监测结果并收集目标样品。根据洗脱峰谱图,选择样品用15%的SDS-PAGE进行检测分析,回收目的蛋白,浓缩后保存备用。
1.5 圆二色谱检测ArlR蛋白的二级结构待测的ArlR蛋白溶于缓冲液(20mmol/L HEPES, 150mmol/L NaCl,pH 8.0)中,浓度为0.2mg/ml,圆二色谱(circular dichroism, CD, JASCO-J1500 spectropolarimeter)的分析条件如下:带宽3nm,响应时间1s,测量范围190~300nm,重复测量次数为5次。
1.6 ArlSCA、ArlSCA-G418A及ArlSCA-G420A蛋白激酶活性的测定ArlSCA、ArlSCA-G418A及ArlSCA-G420A蛋白激酶活性测定采用Kinase-Glo Luminescent Kinase Assay方法,具体实验步骤参见试剂盒说明。实验在96孔板中进行,反应体系50μl,含有终浓度为10mmol/L的MgCl2和5μmol/L的ATP,0~20μmol/L的目的蛋白,反应缓冲液为凝胶过滤层析缓冲液。37℃孵育10min,加入50μl发光试剂,37℃反应10min,用多功能酶标仪检测体系的发光强度。
1.7 ArlSCA蛋白的体外磷酸化实验ArlSCA蛋白磷酸化ArlR蛋白的实验通过体外磷酸化的方法进行测定,反应体系为50μl,含有100μmol/L ATP、400μmol/L氯化镁、10mmol/L β-巯基乙醇、50μg ArlR蛋白、20μg ArlSCA蛋白,反应体系分别在37℃孵育1h、2h、4h后,用12%的SDS-PAGE和Western blot检测磷酸化效果。
2 结果 2.1 ArlSCA和ArlR蛋白的诱导表达表达载体构建成功后对菌种进行扩培,用15%的SDS-PAGE检测添加诱导剂后目的蛋白的表达量是否增加,ArlSCA蛋白的理论分子质量约为25kDa,ArlR蛋白的理论分子质量约为30kDa。图 2中实验组条带2、4与对照组条带1、3对比可知,条带2、4在分子质量接近25kDa和30kDa的位置蛋白质表达量明显增多,可判断经过IPTG诱导后ArlSCA和ArlR蛋白表达成功。

|
| 图 2 ArlSCA和ArlR蛋白诱导表达结果图 Figure 2 The induced expression of ArlSCA and ArlR M: Marker; 1: ArlSCA without IPTG; 2: ArlSCA induced by IPTG; 3: ArlR without IPTG; 4: ArlR induced by IPTG |
由于pProEX-HTa表达载体中有组氨酸标签,利用组氨酸的咪唑基与镍金属离子的亲和力的差异可以实现对目的蛋白的分离纯化,因此实验中首先利用镍金属离子螯合层析对ArlSCA、ArlR、ArlSCA-G418A及ArlSCA-G420A蛋白进行分离纯化,再用离子交换层析及凝胶过滤层析对ArlR蛋白进行进一步纯化。纯化后的蛋白质用15%的SDS-PAGE检测结果,由图 3可知,经镍柱分离纯化后ArlSCA蛋白的纯度可达90%以上,经测定产量约为15mg/L,ArlR蛋白经三种层析技术分离纯化后纯度可达98%,产量约为25mg/L,将纯化后的目的蛋白收集浓缩后保存备用。

|
| 图 3 ArlSCA和ArlR蛋白纯化结果图 Figure 3 The result of the purification of ArlSCA and ArlR protein (a) The result of the purification of ArlSCA protein M: Marker; 1: ArlSCA protein (b) The result of the purification of ArlR protein M: Marker; 1: ArlR protein |
ArlR蛋白是arl双组分信号转导系统的转录因子,文献报道转录因子通常含有一定数量的螺旋结构且不稳定[21],因此实验中用圆二色谱检测纯化后的ArlR蛋白的二级结构,结果如图 4所示。从图中可知ArlR蛋白在208nm处有一个负峰,这是α螺旋结构的特征峰,可以判断纯化后的ArlR蛋白具有稳定的二级结构,可以作为有效底物验证ArlSCA蛋白的激酶活性。

|
| 图 4 ArlR蛋白的圆二色谱检测图 Figure 4 Circular dichroism spectra of ArlR and bovine serum albumin (BSA) |
本文对ArlSCA蛋白激酶活性的测定是通过检测反应体系中剩余的ATP含量间接得到的。底物在磷酸激酶的作用下与ATP发生反应,反应结束后,在反应体系中加入甲壳荧光素,使其与反应体系中剩余的ATP作用,形成氧化荧光素,进而发出荧光。为了检测目的蛋白是否具有激酶活性,在反应体系中分别添加了0μg、5μg、10μg、20μg、40μg的目的蛋白,并进行激酶活性的检测,检测结果如图 5所示,从图中可以看出随着蛋白质含量的增加,荧光值呈下降的趋势,这表明反应体系中剩余的ATP含量逐渐降低,即随着蛋白质含量的增加蛋白质的激酶活性逐渐增大,因此可以证明纯化后的ArlSCA蛋白具有激酶活性。
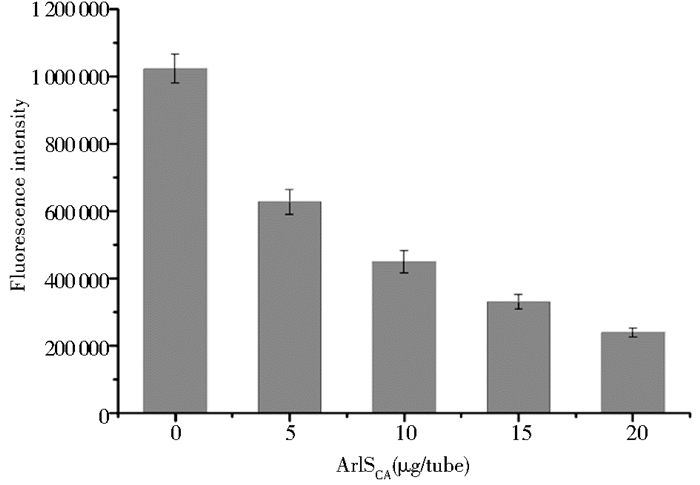
|
| 图 5 ArlSCA蛋白激酶活性的测定结果 Figure 5 The kinase activity of ArlSCA protein |
利用体外磷酸化实验来验证ArlSCA蛋白是否可以磷酸化ArlR蛋白,实验结果分别用Western blot和12%的SDS-PAGE检测。图 6中条带1与2均为对照组,反应体系经不同时间孵育后检测结果见条带3~5,与对照组相比ArlSCA蛋白无明显变化,而部分ArlR蛋白分子质量出现上移现象,是磷酸化的表现,据此判断ArlSCA蛋白可以磷酸化ArlR蛋白。
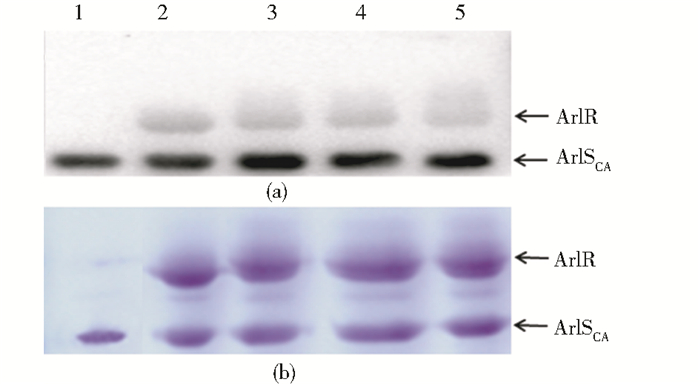
|
| 图 6 ArlSCA蛋白与ArlR蛋白作用结果图 Figure 6 Cooperative activity of ArlSCA with ArlR (a) Cooperative activity of ArlSCA with ArlR measured by Western blot (b) Cooperative activity of ArlSCA with ArlR measured by 12% SDS-PAGE M: Marker; 1: 20μg ArlSCA; 2: 20μg ArlSCA and 50μg ArlR, and then detect immediately; 3: 20μg ArlSCA and 50μg ArlR incubated in 37℃ for 1h; 4: 20μg ArlSCA and 50μg ArlR incubated in 37℃ for 2h; 5: 20μg ArlSCA and 50μg ArlR incubated in 37℃ for 4h |
利用酶切酶连的方法构建418位和420位氨基酸突变的重组菌株BL21(RIL)-ArlSCA-G418A和BL21(RIL)-ArlSCA-G420A,用金属离子螯合层析技术纯化ArlSCA-G418A和ArlSCA-G420A蛋白,纯化结果用15%的SDS-聚丙烯酰胺凝胶电泳检测,由图 7可知纯化后的ArlSCA-G418A(条带2)和ArlSCA-G420A(条带3)分子质量约为25kDa,与ArlSCA(条带1)分子质量一致,ArlSCA-G418A和ArlSCA-G420A蛋白的纯度均可达90%。

|
| 图 7 ArlSCA-G418A和ArlSCA-G420A蛋白纯化结果图 Figure 7 The result of the purification of ArlSCA-G418A and ArlSCA-G420A M: Marker; 1: ArlSCA; 2: ArlSCA-G418A; 3: ArlSCA-G420A |
反应体系中添加0~30μg的目的蛋白,检测激酶活性,由图 8可见随着ArlSCA-G418A和ArlSCA-G420A蛋白含量的增加,反应体系的荧光值基本持平,无明显变化趋势,这表明反应体系中剩余的ATP含量没有发生明显变化,即纯化后的ArlSCA-G418A和ArlSCA-G420A蛋白没有激酶活性,并未发生自磷酸化作用,因此可以证明418位和420位氨基酸残基与ArlS蛋白自磷酸化密切相关,在ArlS蛋白的自磷酸化过程中起着十分重要的作用。
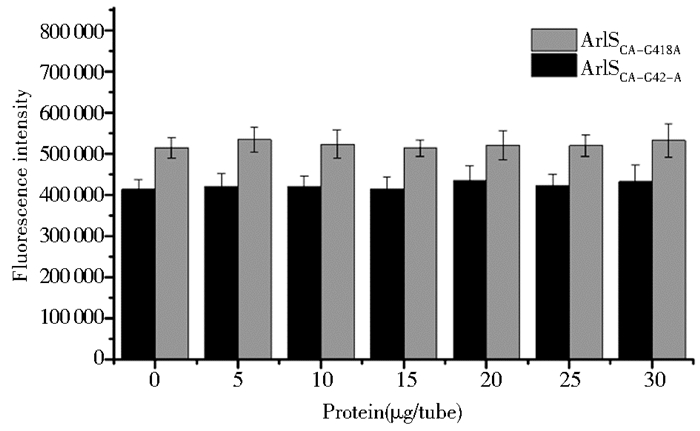
|
| 图 8 ArlSCA-G418A和ArlSCA-G420A蛋白激酶活性的测定结果 Figure 8 The kinase activity of ArlSCA-G418A and ArlSCA-G420A protein |
金黄色葡萄球菌arl系统与其致病性密切相关,有文献报道,ArlSR双组分信号转导系统可调节上百种基因的转录,参与细菌的生长和分裂,与细菌的聚集作用有关,可以下调表面蛋白A、α-溶血素、β-溶血素、凝固酶等多种毒力因子[2-3, 22]。已有研究表明双组分信号转导系统中的组氨酸蛋白激酶可捕捉胞外信号,发生自磷酸化并磷酸化下游的反应调控蛋白,进而调控相关基因的表达[16-17, 23-25]。本研究证实在arl系统中,组氨酸蛋白激酶ArlS可以在其胞质域的磷酸化位点处发生自磷酸化作用,随后将磷酸基团转移给下游的反应调控蛋白ArlR,启动整个arl双组分信号转导过程。
众多的研究表明,膜蛋白的结构和功能较为复杂[23],本实验在对膜蛋白进行相关研究之前,利用多种在线软件对其拓扑结构进行预测,选定膜蛋白胞内域部分作为研究对象展开实验,一方面ArlS蛋白的磷酸化位点在其胞内域部分,并不影响对其自磷酸化等相关功能研究;另一方面避开了膜蛋白表达量极低且分离纯化较为困难的问题。
为了阐明组氨酸蛋白激酶ArlS自磷酸化过程中起关键作用的氨基酸,实验中采用定点突变的研究技术,该技术可通过改变特定氨基酸获得突变蛋白质,然后对突变蛋白质进行功能研究,进而从微观水平上阐明正常状态下基因的调控机制[26-27]。金葡菌双组分信号转导系统中的组氨酸蛋白具有同源性,通过同源性分析结果得知ArlS蛋白与AgrC蛋白具有较高的同源性,二者在功能上也较为相近,均为膜蛋白,可以感知外界环境的刺激因素,发生自磷酸化并将磷酸基团转移至反应调控蛋白,开启整个信号转导通路。有研究报道[19-20],AgrC蛋白的394位和396位氨基酸残基与其自磷酸化有关,根据同源性比对分析结果推测ArlS蛋白的418位和420位氨基酸残基可能是ArlS蛋白自磷酸化过程中的具有重要功能的氨基酸。因此本研究将ArlSCA蛋白的418位、420位氨基酸残基进行定点突变,对其自磷酸化作用进行检测,结果证实ArlSCA蛋白的418位和420位氨基酸残基是ArlSCA蛋白自磷酸化过程中的关键氨基酸,起着十分重要的作用。
本研究为进一步阐明arl双组分信号转导系统的作用机制以及新的药物靶点的开发奠定了基础,为后续对ArlS蛋白、ArlR蛋白三级结构的研究,晶体结构的解析提供了一定帮助。
| [1] |
Thompson K A, Copley V R, Parks S, et al. Staphylococcus aureus dispersal from healthy volunteers. Am Jinfect Control, 2014, 42(3): 260-264. DOI:10.1016/j.ajic.2013.09.029 |
| [2] |
宋娟, 楚雍烈. 金黄色葡萄球菌基因调节系统研究进展. 生命科学, 2012, 24(5): 463-469. Song J, Chu Y L. Advances in research of gene regulation sustems in Staphylococcus aureus. Chinese Bulletin of Life Sciences, 2012, 24(5): 463-469. |
| [3] |
Junecko J M, Zielinska A K, Mrak L N, et al. Transcribing virulence in Staphylococcus aureus. WJCID, 2012, 2(4): 63-76. DOI:10.5495/wjcid.v2.i4.63 |
| [4] |
路荣, 韩文瑜. 金黄色葡萄球菌调控基因agr及sae对其耐热核酸酶分泌的影响. 河北科技师范学院学报, 2010, 24(4): 28-31. Lu R, Han W Y. Isolation and analysis of non-tuberculous Mycobacteria from bovine. Journal of Hebei Normal University of Sci and Tech, 2010, 24(4): 28-31. |
| [5] |
Rasko D A, Sperandio V. Anti-virulence strategies to combat bacteria-mediated disease. Nat Rev Drug Discov, 2010, 9(2): 117-128. DOI:10.1038/nrd3013 |
| [6] |
Barczak A K, Hung D T. Productive steps toward an antimicrobial targeting virulence. Curr Opin Microbiol, 2009, 12(5): 490-496. DOI:10.1016/j.mib.2009.06.012 |
| [7] |
Cegelski L, Marshall G R, Eldridge G R, et al. The biology and future prospects of antivirulence therapies. Nat Rev Microbiol, 2008, 6(1): 17-27. DOI:10.1038/nrmicro1818 |
| [8] |
Dancer S J, Kirkpatrick P, Corcoran D S, et al. Approaching zero:temporal effects of a restrictive antibiotic policy on hospital-acquired Clostridium difficile, extended-spectrum -lactamase-producing coliforms and meticillin-resistant Staphylococcus aureus. Int J Antimicrob Agents, 2013, 41(2): 137-142. DOI:10.1016/j.ijantimicag.2012.10.013 |
| [9] |
Hiramatsu K, Aritaka N, Hanaki H, et al. Dissemination in Japanese hospitals of strains of Staphylococcus aureus heterogeneously resistant to vancomycin. Lancet, 1997, 350(9092): 1670-1673. DOI:10.1016/S0140-6736(97)07324-8 |
| [10] |
Weigel L M, Clewell D B, Gill S R, et al. Genetic analysis of a high-level vancomycin-resistant isolate of Staphylococcus aureus. Science, 2003, 302(5650): 1569-1571. DOI:10.1126/science.1090956 |
| [11] |
Fournier B, Hooper D C. A new two-component regulatory system involved in adhesion, autolysis, and extra cellular proteolytic activity of Staphylococcus aureus. J Bacteriol, 2000, 182(14): 3955-3964. DOI:10.1128/JB.182.14.3955-3964.2000 |
| [12] |
Lindsay J A, Foster S J. Interactive regulatory pathways control virulence determinant production and stability in response to environmental conditions in Staphylococcus aureus. Mol Gen Genet, 1999, 262(20): 323-331. |
| [13] |
于冰, 杨光, 邵宁生. 金黄色葡萄球菌中二元调控系统agr及与其他二元系统相互作用的研究进展. 军事医学科学院院刊, 2007, 31(2): 187-190. Yu B, Yang G, Shao N S. Advances in the research on two-component regulatory system, agr, and its in teraction with other two-component systems in Staphylococcus aureus. Acad Mil Med Sci, 2007, 31(2): 187-190. |
| [14] |
Walker J N, Crosby H A, Spaulding A R, et al. The Staphylococcus aureus ArlRS two-component system is a novel regulator of agglutination and pathogenesis. PLoS Pathog, 2013, 9(12): 1-17. |
| [15] |
李明, 胡福泉, 唐家琪. 二元信号转导系统与细菌的致病性. 微生物学杂志, 2007, 27(1): 58-62. Li M, Hu F Q, Tang J Q. Dual signal transduction system and bacterial pathogenicity. J Microbiol, 2007, 27(1): 58-62. |
| [16] |
Mascher T, Helmann J D, Unden G. Stimulus perception in bacterial signal-transducing histidine kinases. Microbiol Mol Biol Rev, 2006, 70(4): 910-938. DOI:10.1128/MMBR.00020-06 |
| [17] |
Gao R, Stock A M. Biological insights from structures of two-component proteins. Annu Rev Microbiol, 2009, 1(63): 133-154. |
| [18] |
Galperin M Y. A census of membrane-bound and intracellular signal transduction proteins in bacteria:bacterial IQ, extroverts and introverts. BMC Microbiol, 2005, 5(35): 1-19. |
| [19] |
Sandeep K S, Kalagiri R, Aneesa F, et al. Influence of the AgrC-AgrA complex in the response time of Staphylococcus aureus quorum sensing. J Bacteriol, 2014, 196(15): 2876-2888. DOI:10.1128/JB.01530-14 |
| [20] |
Wang B Y, Zhao A, Novick R P, et al. Activation and inhibition of the receptor histidine kinase AgrC occurs through opposite helical transduction motions. Mol Cell, 2014, 53(6): 929-940. DOI:10.1016/j.molcel.2014.02.029 |
| [21] |
张艳馥, 沙伟. 转录因子概述. 生物学教学, 2009, 34(10): 7-8. Zhang Y F, Sha W. The summary of transcription factors. Biol Teach, 2009, 34(10): 7-8. DOI:10.3969/j.issn.1004-7549.2009.10.003 |
| [22] |
Liang X, Zheng L, Landwehr C, et al. Global regulation of gene expression by ArlRS, a two component signal transduction regulatory system of Staphylococcus aureus. J Bacteriol, 2005, 187(15): 5486-92. DOI:10.1128/JB.187.15.5486-5492.2005 |
| [23] |
Wang L N, Quan C S, Xiong W, et al. New insight into transmembrane toplogy of Staphylococcus aureus histidine kinase AgrC. Biochim Biophys Acta, 2014, 1838(3): 988-993. DOI:10.1016/j.bbamem.2013.12.006 |
| [24] |
Wu Y, Liu J G, Jiang J, et al. Role of the two-component regulatory system arlRS in ica operon and aap positive but non-biofilm-forming Staphylococcus epidermidis isolates from hospitalized patients. Microb Pathogenesis, 2014, 76(2014): 89-98. |
| [25] |
王路路, 权春善, 许永斌, 等. 跨膜蛋白AgrCTM6-7C分离纯化方法的优化. 生物技术通报, 2016, 32(7): 59-65. Wang L L, Quan C S, Xu Y B, et al. Optimization of the purification method for transmembrane protein AgrCTM6-7C. Biotechnol Bull, 2016, 32(7): 59-65. |
| [26] |
张浩, 毛秉智. 定点突变技术的研究进展. 免疫学杂志, 2000, 16(4): 108-110. Zhang H, Mao B Z. Advance in technology of site-directed mutagenesis. Immunol J, 2000, 16(4): 108-110. |
| [27] |
Zhang B, Wan F, Qiu Y L, et al. Increased L-arginine production by site-directed mutagenesis of N-acetyl-L-glutamate kinase and proB gene deletion in Corynebacterium crenatum. Biomed Environ Sci, 2015, 28(12): 864-874. |
 2017, Vol. 37
2017, Vol. 37




