文章信息
- 翟兵兵, 董秀涛, 丁明珠, 元英进.
- ZHAI Bing-bing, DONG Xiu-tao, DING Ming-zhu, YUAN Ying-jin.
- VC三菌种一步发酵方法的构建与研究
- Analysis on and Construction of the VC One Step Fermentation of Three Strains
- 中国生物工程杂志, 2016, 36(12): 72-78
- China Biotechnology, 2016, 36(12): 72-78
- http://dx.doi.org/DOI:10.13523/j.cb.20161211
-
文章历史
- 收稿日期: 2016-05-03
- 修回日期: 2016-05-23
维生素C作为一种高效的抗氧化剂对生物细胞有着异乎寻常的作用[1-2]。现今为止,维生素C在我国国内主要通过尹光琳等[3]的“微生物二步发酵”法用于工业生产,其效率已达到了很高的水平[4],由此引发了进一步提高产量的困难。所以通过缩减生产步骤,降低能耗等方法就成为提高经济效益、降低成本的重要途径,一步发酵法成为具有良好前景的方法。
在山梨醇脱氢过程中,辅酶PQQ起到了重要的作用。1981年,辅酶PQQ在醋酸菌中首次被发现[5],Du等[6]也发现,维生素C产酸菌株酮古龙酸杆菌(Ketogulonicigenium vulgare)中的山梨糖/山梨酮脱氢酶的表达都需要在辅酶PQQ的辅助下才能高效工作,同样,氧化葡萄糖酸杆菌(Gluconobacter oxydans)中山梨醇脱氢酶也需要PQQ的辅助[7-8],Miyazaki等[9]通过向大肠杆菌中导入山梨醇脱氢酶发现,只有PQQ辅酶存在的情况下,sldA和sldB才能实现第一步脱氢反应。所以辅酶PQQ在维生素C发酵菌株表达过程中起着重要的作用,构建K. vulgare和G. oxydans菌种一步发酵的重要物质。加之近年来,Zou等[10]构建了Ketogulonicigenium vulgare WSH001基因代谢模型,Jia等[11]也解密了K. vulgare hbe602的全基因组信息,为两菌一步发酵构建提供了基础。Gao等[12]将K. vulgare WSH001中的5种山梨糖脱氢酶和2种山梨酮脱氢酶组合导入G. oxydans WSH003,实现了D-山梨醇到2-酮-L-古龙酸(2-KGA)在G. oxydans中的转化,其中的最佳组合得到了4.9g/L的2-KGA。Wang等[13]通过敲除G. oxydans中的山梨糖脱氢酶,减少了对K. vulgare转化山梨糖的竞争,并且利用K. vulgare和改造后的G. oxydans共生配合,以山梨醇为底物,使醇酸转化率在36h达到了89.6%。但是,K. vulgare菌种生长很弱[14],单独培养或者与G. oxydans混菌培养放大到工业规模所需时间较长且生物量不高,两菌一步发酵过程困难,所以芽孢杆菌等辅助菌株的加入很有必要。在工艺优化方面,Yang等[15]通过RSM和ANN的方法,构建了K. vulgare和Bacillus subtilis的发酵优化模型,通过改变发酵工艺参数,提高混菌的产酸效率。Wang等[16]也通过建模的方法,在生物反应器上试图通过微生物生长动力学揭示K. vulgare和Bacillus megaterium间的关系。而且Zhang等[17]通过研究发现产酸菌和Bacillus megaterium之间的关系偏向捕食关系。Zhu等[18]构建了Bacillus megaterium spo0A和spoVFA缺失菌株,使得K.vulgare醇酸转化率分别降低了33%和70%,说明了孢子稳定性和产孢能增强K.vulgare的作用,而Liu等[19]向K.vulgare中添加Bacillus megaterium胞外发酵液及细胞裂解液,发现K. vulgare的生长得到了提高,进一步揭示了芽孢杆菌在维生素C生产过程中重要的作用。
目前在K. vulgare和G. oxydans菌种所实现的维生素C一步发酵有诸多问题,许多研究人员希望通过D-葡萄糖转化为2, 5-KDG,然后再转化为2-KGA这两个步骤实现高效转化[20]。但是,存在的难点在于发酵过程中,2, 5-KDG是不稳定的,消毒灭菌等都可破坏这种化学物质,产率不高且不容易实现工业规模的生产,所以通过山梨醇脱氢转化为2-KGA的方式依然是高效的方法。
在维生素C生产过程中K. vulgare菌株必须借助辅助菌促进生长,而G. oxydans可以促进其生长,但是其作用主要是参与第一步脱氢反应,Bacillus sp主要用来在第二步脱氢反应过程中辅助K. vulgare的生长[21],若在此基础上,使得K. vulgare、G. oxydans和Bacillus sp能以混菌的形式,以D-山梨醇为底物直接三种菌株混合发酵,可能会有更好的醇酸转化率。
1 材料与方法 1.1 菌株产酸菌为产酮古龙酸杆菌(K. vulgare HB602),一步菌为氧化葡萄糖酸杆菌(G. oxydans),由河北科技大学生物与工程院仪宏教授惠赠;植物内生芽孢杆菌(Bacillus endophyticus)由华北制药集团提供。
1.2 试剂与培养基D-山梨醇和L-山梨糖来自华北制药华盈有限公司。
种子培养基(以D-山梨醇为底物):每100ml含2g D-山梨醇,0.3g酵母膏,0.3g牛肉膏,0.6g玉米浆粉,1g蛋白胨,0.1g尿素,0.1g碳酸钙,0.1g磷酸二氢钾,0.02g硫酸镁。
种子培养基(以L-山梨糖为底物):每100ml含2g L-山梨醇,0.3g酵母膏,0.3g牛肉膏,0.6g玉米浆粉,1g蛋白胨,0.1g尿素,0.1g碳酸钙,0.1g磷酸二氢钾,0.02g硫酸镁。
发酵培养基:每100ml含8g D-山梨醇,1g玉米浆粉,1g尿素,0.1g碳酸钙,0.1g磷酸二氢钾,0.05g硫酸镁。
发酵罐(5L)培养基(分批发酵):培养基3L中含240g D-山梨醇,30g玉米浆,3g磷酸二氢钾,1.5g硫酸镁,36g尿素。
发酵罐(5L)培养基(补料发酵):基础料2.5L中含120g D-山梨醇,30g玉米浆,3g磷酸二氢钾,1.5g硫酸镁,36g尿素;补料500ml中含120g D-山梨醇。
1.3 细胞培养与生长条件接种250ml锥形瓶时,分别吸取500μl K. vulgare和G. oxydans的甘油菌,注入50ml (种子培养基)/250ml (容积)摇瓶中,培养24h,然后按照接种量为10%的接入量,再次接入50ml (种子培养基)/250ml (容积)摇瓶中,作为二级种子。按10%接种量将一定量种子液接入摇瓶发酵液中,30℃,250r/min摇床振荡培养,发酵72h左右。可在发酵过程中,取样进行各种参数的检测,如OD,胞外2-KGA及残余L-山梨糖浓度测定,胞内代谢物提取及分析。
在发酵罐中,按接种量为10%确定所接入的菌的总量为300ml,然后按K. vulgare与B. endophyticus接种量为2%,G. oxydans接种量为8%的比例将二代种子接入到5L的发酵罐中。可在发酵过程中,取样进行各种参数的检测,如OD,胞外2-KGA及残余L-山梨糖浓度测定,胞内代谢物提取及分析。
1.4 发酵条件与菌种比例发酵罐总体积为5L,装液量3L,接种量采用10%,接入的K. vulgare、B. endophyticus和G. oxydans总体积为300 ml,500r/min,pH控制7.0,用2.5mol硫酸和5mol氢氧化钠调节pH,通气1.5vvm。补料流加发酵时,采用流加山梨醇培养基的方式进行三菌的一步发酵。初始山梨醇浓度为4%,补料于发酵开始后4h连续恒速流加,流加时间为4h。分批发酵时,控制山梨醇初始浓度为8%,然后其它条件恒定。
1.5 2-KGA、L-山梨糖和D-山梨醇的测定采用高效液相色谱法(HPLC),利用标品做标准曲线,根据标准曲线以及HPLC测定的2-KGA、L-山梨糖和D-山梨醇峰面积,计算出三者实际浓度。
2 结果与讨论 2.1 G. oxydans单菌生长特性维生素C二步发酵过程中,第一步就是G. oxydans将D-山梨醇高效转化为L-山梨糖,单菌在5L的发酵罐中生长特性如图 1所示。从图 1可知,在5L发酵罐中,在恒定的30℃温度,600r/min搅拌速度和1.5vvm通气条件下,80g/L的D-山梨醇在12h以内可以高效地转化为L-山梨糖,且转化率可以达到90%以上。而在消耗完D-山梨醇后,G. oxydans又开始以L-山梨糖作为碳源,在发酵的30h过程中,会损失一部分中间产物从而导致最终产物2-KGA的损失。所以,在构建三种菌种混菌发酵体系过程中,我们会选用G. oxydans催化D-山梨醇向L-山梨糖的转化,同时通过合适的条件优化减少G. oxydans对L-山梨糖的消耗,增大醇酸转化率。
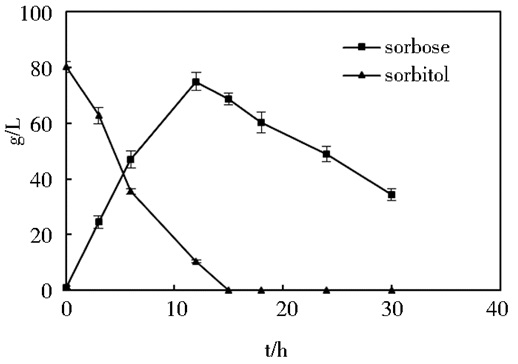
|
| 图 1 G. oxydans在5L的发酵罐中生长特性曲线图 Figure 1 The growth map of G. oxydans in 5L fermenter |
维生素C二步发酵过程中,K. vulgare作为产酸菌起到催化L-山梨糖到2-KGA的转化过程,在2%山梨糖为底物的50ml/250ml的摇瓶中,其生长特性如图 2所示。从图中可知,K. vulgare作为产酸菌能促进2-KGA的产生,但其生长很弱,转化能力有限,摇瓶中,K. vulgare在18h时就已停止产酸,最终转化率只达到约32%。
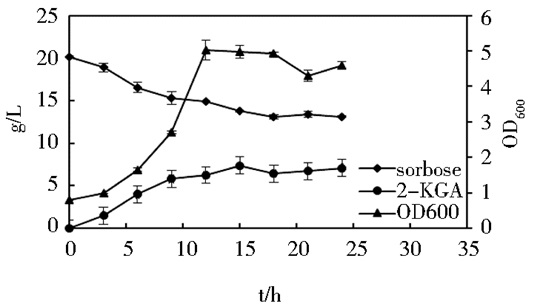
|
| 图 2 K. vulgare在锥形瓶中生长特性曲线图 Figure 2 The growth map of K. vulgare in conical flask |
在5L的发酵罐中,为了探察其在D-山梨醇为底物的特性,为混菌发酵提供基础依据,通过接种10%的接种量,并且为了防止底物D-山梨醇等浓度过高带来的负面影响,将D-山梨醇以流加的方式补进5L罐内,初始罐山梨醇浓度为2%,补料于发酵开始后9h连续恒速流加,流加时间为8h。如图 3所示,流加发酵过程中,K. vulgare对D-山梨醇的消耗很低,对D-山梨醇的转化也微乎其微,L-山梨糖的生成很少,醇酸转化率很低,所以,以D-山梨醇为底物所进行的一步发酵体系,必然要通过K. vulgare菌种和其他菌种间的配合才可以。而且K. vulgare单菌的转化能力有限,可以通过优化三种菌种混菌生长的环境条件,进一步增强其生长能力,促进其产酸。
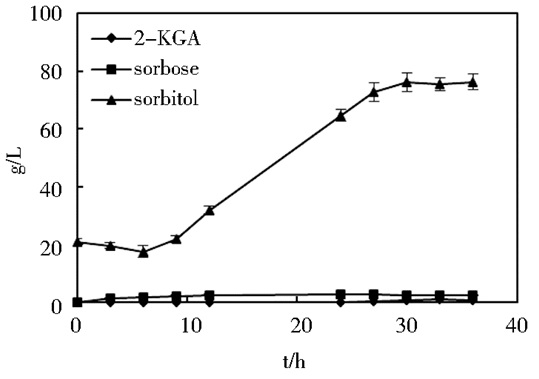
|
| 图 3 K. vulgare在5L发酵罐中生长特性曲线图 Figure 3 The growth map of K. vulgare in 5L fermenter |
K. vulgare单独生长很弱,发酵过程持续时间不长,醇酸转化率不高,工业上一般用芽孢杆菌作为K. vulgare的伴生菌,以促进其生长和产酸。本实验室保存有植物内生芽孢杆菌B. endophyticus,为了甄别芽孢杆菌是否可用于混菌一步发酵体系,以2%的L-山梨糖为底物,用芽孢杆菌B. endophyticus配合K. vulgare产酸,结果如图 4所示。由图 4可知,在2% L-山梨糖为底物的250ml锥形瓶中,芽孢杆菌B. endophyticus可以配合K. vulgare生长和产酸;菌种生物量要比K. vulgare单菌高很多,20g/L山梨糖转化率约50%,较K. vulgare单菌在2%的L-山梨糖为底物条件下转化率32%要高得多。因为山梨糖在发酵过程中除了作为生成2-KGA的底物,也作为K. vulgare的碳源。所以我们在混菌体系中加入芽孢杆菌B. endophyticus作为K. vulgare的伴生菌,以促进其生长和产酸,提高混菌体系的效率。
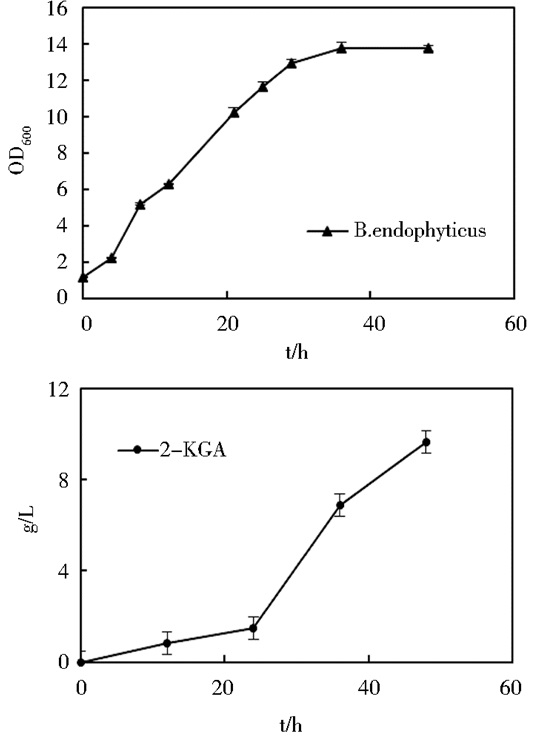
|
| 图 4 芽孢杆菌B. endophyticus生长及发酵特性 Figure 4 The growth and fermentation properties of B. endophyticus |
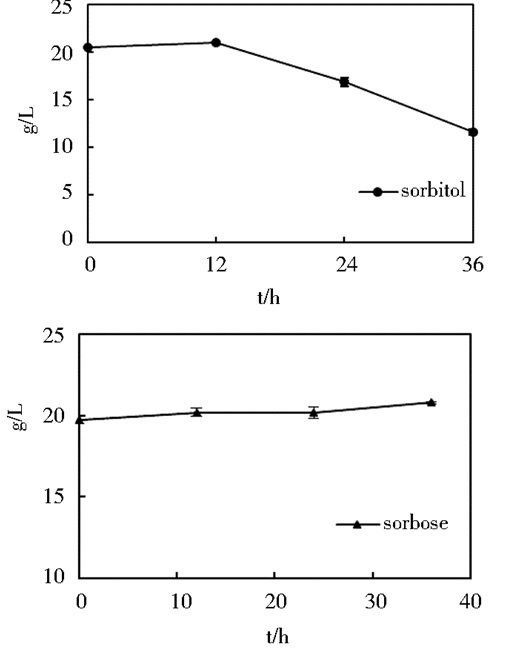
构建K. vulgare、G. oxydans和B. endophyticus三种菌种的混菌一步发酵体系,要以D-山梨醇为初始底物,K. vulgare菌对D-山梨醇几乎不消耗,从D-山梨醇到L-山梨糖的转化主要由G. oxydans进行,从L-山梨糖到2-KGA的转化主要由K. vulgare进行,而芽孢杆菌B. endophyticus对初始底物D-山梨醇和中间物L-山梨糖的代谢情况也有必要研究以优化最终的发酵条件。分别以D-山梨醇和L-山梨糖为底物培养芽孢杆菌B. endophyticus单菌,接种量为10%,对D-山梨醇和L-山梨糖的消耗结果如图 5所示。芽孢杆菌B. endophyticus不代谢L-山梨糖,即不会对山梨糖的再次脱氢产酸产生影响,而本实验室对B. endophyticus进行了初步的全基因组测序,没有发现山梨糖代谢基因,这和实验结果相一致;而在以D-山梨醇为底物的发酵过程中,B. endophyticus会消耗一定量的D-山梨醇,这也与全基因组测序结果相一致。由图中可知,B. endophyticus芽孢杆菌在大约10h后开始急剧代谢山梨醇,鉴于芽孢杆菌生长强势的生长特性,其在混菌发酵过程中有可能会消耗部分底物,使得最终的醇酸转化率降低,2-KGA的产量减少,所以三菌种混菌发酵要尽可能地保证三个菌种可以在短时间内发挥应有的作用,减少损失。
|
| 图 5 芽孢杆菌B. endophyticus对山梨醇和山梨糖的代谢 Figure 5 The consumption map of sorbitol and sorbose by B. endophyticus |
K. vulgare菌单独生长能力弱,对山梨糖的转化率又低,单独的菌种培养困难,所需要的条件比较苛刻。所以,在其种子培养阶段就将其和伴生菌B. endophyticus混合培养,一方面可以在短时间内促进K. vulgare的生长,另一方面又可以将其与伴生菌B. endophyticus当作一个整体,方便接种和活化。本实验所用的K. vulgare纯培养前的伴生菌B. endophyticus,其在工业规模中有着良好的使用基础,所以混菌体系选用B. endophyticus来研究。
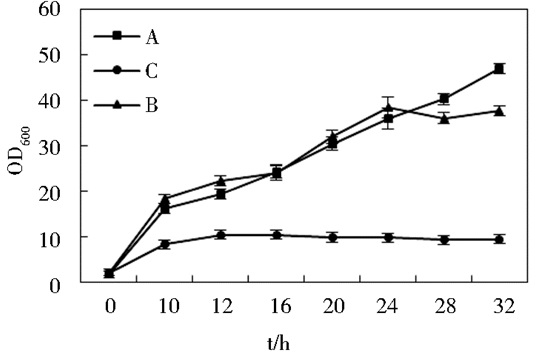
K. vulgare和B. endophyticus的全基因组分析结果显示,两菌都有山梨醇代谢基因,能够消耗掉一部分底物,验证结果如图 6所示。三种情况初始底物分别为A (40g/L山梨醇),B (20g/L山梨醇和20g/L山梨糖)和C (40g/L山梨糖),由图 6可知,A和B条件下的芽孢杆菌和K. vulgare菌混菌菌体浓度远远高于C,说明山梨醇有利于K. vulgare及其伴生菌的生长,在有山梨醇存在的条件下K. vulgare及其伴生菌B. endophyticus能够快速地生长增殖,并且短时间内就可以达到很大的菌体密度,这有利于后期对山梨糖的转化和产酸的进行,从侧面印证了三菌混合一步发酵培养的可能性。
|
| 图 6 K. vulgare及其伴生菌生长曲线图 Figure 6 The growth map of K. vulgare and B. endophyticus |
综合各株菌的特点,我们构建了三菌一步发酵体系来实现D-山梨醇到2-KGA的一步发酵。混菌发酵前,G. oxydans单独培养种子,K. vulgare及其伴生菌B. endophyticus混合培养种子,然后发酵阶段一起接种进行发酵,混菌发酵的特点如下:(1) G. oxydans可以快速且高效地将D-山梨醇转化为L-山梨糖,还能通过一系列的相互作用,以促进K. vulgare的生长和产酸,同时发酵后期会消耗部分中间产物L-山梨糖造成浪费;(2) K. vulgare催化L-山梨糖向2-KGA的转化,是主要产酸菌;(3) 伴生菌B. endophyticus辅助K. vulgare的生长产酸,且在发酵过程中不消耗中间代谢物L-山梨糖;(4) 三种菌均可以代谢D-山梨醇,G. oxydans和K. vulgare及其伴生菌B. endophyticus代谢部分山梨醇用于增长生物量。所以我们设计三菌体系要旨是,前期(约12h内)尽可能地促进山梨醇转化为山梨糖,并且尽量减少山梨醇的消耗浪费;后期以产酸为主,同时减少山梨糖的过度损失。
三个菌种都需要培养二级种子,其中G. oxydans一级种子培养24h,二级种子培养24h,K. vulgare及其伴生菌混合培养,一级种子培养24h,二级种子培养20h,伴生菌B. endophyticus作为模式菌研究构建三菌一步发酵方法。
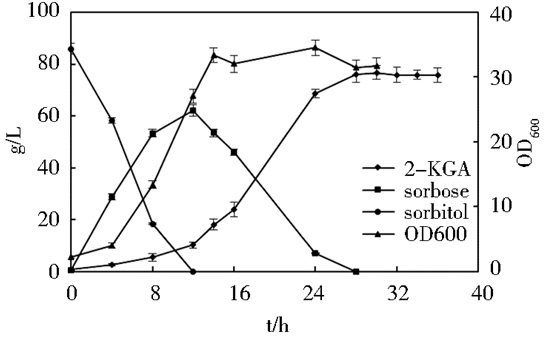
在分批发酵过程中,发酵结果如图 7所示。K. vulgare及其伴生菌B. endophyticus、G. oxydans三菌混菌在发酵罐中能够很好地发挥各自的作用,有效地混合生长。G. oxydans菌将D-山梨醇转化为L-山梨糖,K. vulgare菌在伴生菌的辅助下快速生长并有效产酸,发酵过程在28h结束,发酵液中古龙酸终浓度为75.72g/L,发酵终体积2.88L。2-KGA产量较高,按总物料折算,D-山梨醇到2-KGA质量转化率87.90%。
|
| 图 7 分批发酵结果 Figure 7 The result map of batch fermentation |
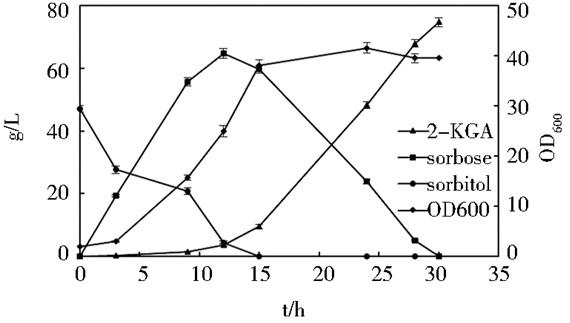
而在补料发酵过程中,D-山梨醇采用流加的方式,补料为24g/L D-山梨醇500ml。发酵结果如图 8所示。三菌种在发酵罐内也能有效混合生长,并有效发挥自己的作用。发酵最终也在约28h结束,发酵液中2-KGA终浓度为71.95g/L,发酵终体积2.80L。2-KGA产量较高,按总物料折算,D-山梨醇到2-KGA质量转化率为81.89%。
|
| 图 8 补料发酵结果 Figure 8 The result map of fed batch fermentation |
本研究首次在维生素C发酵方法中,构建了以G. oxydans、K. vulgare及其伴生菌B. endophyticus三种菌混菌一步发酵体系。此方法以D-山梨醇为底物,研究发现,G. oxydans、K. vulgare及其伴生菌B. endophyticus均可以代谢底物D-山梨醇,发酵过程中G. oxydans可以代谢中间产物L-山梨糖,B. endophyticus不以L-山梨糖为碳源,三种菌种可以很好地在相同条件下配合生产2-KGA。
发酵参数控制在初始3L装液量,G. oxydans为8%,K. vulgare及B. endophyticus为2%,30℃,500 r/min,pH控制7.0,通气1.5vvm时,醇酸转化率较高。三菌分批发酵和补料发酵醇酸转化率都达到了80%以上,分批发酵发酵液浪费挥发较少,醇酸转化率最高,达到了87.90%,证明了三菌种混菌一步发酵可以实现,较高醇酸转化率证实可以进一步应用于工业化。
3 展望以G. oxydans、K. vulgare及其伴生菌B. endophyticus三种菌混菌一步发酵体系还需进一步的研究,在以D-山梨醇为底物的一步发酵过程中,B. endophyticus会消耗一部分山梨醇,并且未转化为中间产物L-山梨糖,造成醇酸转化率的降低,有待进一步改进。在发酵过程中,G. oxydans在后期对L-山梨糖的消耗,导致最终2-KGA的转化损耗,也需要进一步的改进。三菌种可以很好地配合完成2-KGA的生产,其三菌种在发酵过程中的菌种间关系及作用机制还需研究完善,同时,还可通过本研究获得的G. oxydans和B. endophyticus一步发酵过程中缺点,对菌株进行改造,进而进一步提高三菌一步发酵体系的发酵水平。
| [1] | Chen S, Roffey D M, Dion C A, et al. Effect of perioperative vitamin C supplementation on postoperative pain and the incidence of chronic regional pain syndrome:a systematic review and meta-analysis. The Clinical Journal of Pain , 2016, 32 (2) : 179–185. DOI:10.1097/AJP.0000000000000218 |
| [2] | Pappenberger G, Hohmann H P. Direct Microbial Routes to Vitamin C Production. Industrial Biotechnology of Vitamins, Biopigments, and Antioxidants, Wiley-VCH Vevlag GmbH & Co.kGaA, 2016. |
| [3] | 尹光琳, 魏东芝, 袁渭康. 维生素C二步发酵过程动力学模型的研究. 生物工程学 , 1992, 8 (3) : 277–279. Yin G L, Wei D Z, Yuan W K. Study on the kinetic model of vitamin C two step fermentation. Chinese Journal of Biotechnology , 1992, 8 (3) : 277–279. |
| [4] | Jia N, Du J, Ding M Z, et al. Genome sequence of Bacillus endophyticus and analysis of its companion mechanism in the Ketogulonigenium vulgare-Bacillus Strain consortium. PloS One , 2015, 10 (8) : e0135104. DOI:10.1371/journal.pone.0135104 |
| [5] | Ameyama M, Matsushita K, Ohno Y, et al. Existence of a novel prosthetic group, PQQ, in mebrane-bound, electron transport chain-linked, primary dehydrogenases of oxidative bacteria. FEBS Letters , 1981, 130 (2) : 179–183. DOI:10.1016/0014-5793(81)81114-3 |
| [6] | Du J, Bai W, Song H, et al. Combinational expression of sorbose/sorbosone dehydrogenases and cofactor pyrroloquinoline quinone increases 2-keto-l-gulonic acid production in Ketogulonigenium vulgare-Bacillus cereus consortium. Metabolic Engineering , 2013, 19 : 50–56. DOI:10.1016/j.ymben.2013.05.006 |
| [7] | Wang P, Xia Y, Li J, et al. Overexpression of pyrroloquinoline quinone biosynthetic genes affects l-sorbose production in Gluconobacter oxydans WSH-003. Biochemical Engineering Journal , 2016, 112 : 70–77. DOI:10.1016/j.bej.2016.04.011 |
| [8] | Hoshino T, Shinjoh M, Toepfer C, et al. Vitamin C production in a microorganism, gluconobacter:U.S. Patent 9, 279, 138. 2016-3-8. |
| [9] | Miyazaki T, Tomiyama N, Shinjoh M, et al. Molecular cloning and functional expression of d-sorbitol dehydrogenase from Gluconobacter suboxydans IFO3255, which requires pyrroloquinoline quinone and hydrophobic…. Bioscience, Biotechnology, and Biochemistry , 2002, 66 (2) : 262–270. DOI:10.1271/bbb.66.262 |
| [10] | Zou W, Liu L, Zhang J, et al. Reconstruction and analysis of a genome-scale metabolic model of the vitamin C producing industrial strain Ketogulonicigenium vulgare WSH-001. Journal of Biotechnology , 2012, 161 (1) : 42–48. DOI:10.1016/j.jbiotec.2012.05.015 |
| [11] | Jia N, Ding M Z, Du J, et al. Insights into mutualism mechanism and versatile metabolism of Ketogulonicigenium vulgare Hbe602 based on comparative genomics and metabolomics studies. Scientific Reports , 2016, 6 : 23068. DOI:10.1038/srep23068 |
| [12] | Gao L, Hu Y, Liu J, et al. Stepwise metabolic engineering of Gluconobacter oxydans WSH-003 for the direct production of 2-keto-l-gulonic acid from d-sorbitol. Metabolic Engineering , 2014, 24 : 30–37. DOI:10.1016/j.ymben.2014.04.003 |
| [13] | Wang E X, Ding M Z, Ma Q, et al. Reorganization of a synthetic microbial consortium for one-step vitamin C fermentation. Microbial Cell Factories , 2016, 15 (1) : 1. DOI:10.1186/s12934-015-0402-6 |
| [14] | Zhu Y, Liu J, Liu J, et al. A high throughput method to screen companion bacterium for 2-keto-L-gulonic acid biosynthesis by co-culturing Ketogulonicigenium vulgare. Process Biochemistry , 2012, 47 (9) : 1428–1432. DOI:10.1016/j.procbio.2012.05.010 |
| [15] | Yang Y, Gao M, Yu X, et al. Optimization of medium composition for two-step fermentation of vitamin C based on artificial neural network-genetic algorithm techniques. Biotechnology & Biotechnological Equipment , 2015, 29 (6) : 1128–1134. |
| [16] | Wang T, Sun J, Yuan J. Modeling and parameters identification of 2-keto-l-gulonic acid fed-batch fermentation. Bioprocess and Biosystems Engineering , 2015, 38 (4) : 605–614. DOI:10.1007/s00449-014-1300-8 |
| [17] | Zhang Z, Sun J, Yuan J. Investigating the interaction between Gluconobacter oxydans and Bacillus megaterium for 2-keto-L-gulonic acid biosynthesis in the two-step vitamin C fermentation. Journal of Shanghai Jiaotong University (Science) , 2015, 20 : 281–285. DOI:10.1007/s12204-015-1622-y |
| [18] | Zhu Y, Liu J, Du G, et al. Sporulation and spore stability of Bacillus megaterium enhance Ketogulonigenium vulgare propagation and 2-keto-L-gulonic acid biosynthesis. Bioresource Technology , 2012, 107 : 399–404. DOI:10.1016/j.biortech.2011.12.080 |
| [19] | Liu J, Hu S, Chang F, et al. Effects of the accompany strain on the fermentation performance of Ketogulonigenium vulgare. Journal of Taizhou Polytechnic College , 2013, 2 : 027. |
| [20] | Anderson S, Marks C B, Lazarus R, et al. Production of 2-keto-L-gulonate, an intermediate in L-ascorbate synthesis, by a genetically modffied Erwinia herbicola. Science , 1985, 230 (4722) : 144–149. DOI:10.1126/science.230.4722.144 |
| [21] | Han X, Xiong X, Jiang D, et al. Crystal structure of L-sorbose dehydrogenase, a pyrroloquinoline quinone-dependent enzyme with homodimeric assembly, from Ketogulonicigenium vulgare. Biotechnology Letters , 2014, 36 (5) : 1001–1008. DOI:10.1007/s10529-013-1446-5 |
 2016, Vol. 36
2016, Vol. 36




