文章信息
- 武雪龙, 杨晓慧, 汪俊卿, 王瑞明.
- WU Xue-long, YANG Xiao-hui, WANG Jun-qing, WANG Rui-ming.
- 蜜蜂NADPH-细胞色素P450还原酶基因在大肠杆菌中的表达及酶学特性分析
- Expression and Characteristics of Apis mellifera NADPH-cytochrome P450 Reductase Gene in Escherichia coli
- 中国生物工程杂志, 2016, 36(12): 28-35
- China Biotechnology, 2016, 36(12): 28-35
- http://dx.doi.org/DOI:10.13523/j.cb.20161205
-
文章历史
- 收稿日期: 2016-05-25
- 修回日期: 2016-06-22
NADPH (烟酰胺腺嘌呤二核苷酸)-细胞色素P450还原酶是一类以FMN (黄素单核苷酸)和FAD (黄素腺嘌呤二核苷酸)为辅基的氧化还原酶,是细胞色素P450酶系(Cytochrome P450 enzymes system, P450s)的重要组成部分[1],普遍存在于动物、微生物、昆虫及植物等生物体中。研究表明,动物、昆虫和酵母中仅有一种CPR基因,而植物中存在1~4种[2-3]。CPR作为P450s电子循环系统的重要组成部分[4-5],在P450s催化内外源物质过程中起限速作用[6],包括药物、类固醇、脂肪酸等。Horike等[7]发现CPR参与细胞色素P450所介导的解毒代谢反应,且CPR能够通过电子还原反应活化抗癌药物前体[8];Shackleton等[9]突变人CPR基因,导致胆固醇合成缺陷,使人体生理代谢紊乱。同时,研究报道表明CPR蛋白与细胞色素P450的协同作用可催化脂肪酸ω端发生羟基化反应[10-12]。
10-羟基-2-癸烯酸(10-HDA)是蜂王浆中的主要脂肪酸成分,不仅是蜂王浆质量的重要指标,而且具有抗菌、抗癌、抗衰老等生理功能[13],广泛应用于医药与保健品。而蜂王浆中10-HDA含量仅为1.4%~2.0%[14],无法满足市场需求。羟基作为10-HDA中的特殊官能团,其形成对探究生物法合成10-HDA新途径具有极其重要的作用。据研究推测10-HDA的羟基是由细胞色素P450酶系的参与下直接氧化ω端形成[15]。作为P450s反应的电子供体[16],CPR参与P450s对脂肪酸的羟基化反应。Kim等[17]利用CPR建立CYP52A21体外生物特性检测体系,研究结果表明月桂酸发生ω端羟基化生成12-羟基月桂酸; CYP147F1可催化月桂酸、十四酸以及软脂酸发生羟基化反应[18]。由于10-HDA是由前体硬脂酸经过羟基化修饰而来,因此,CPR及细胞色素P450可能对10-HDA的羟基形成起着重要作用。
本研究通过将蜜蜂CPR基因在E.coli中异源表达,对目的蛋白进行纯化,并对其酶学特性进行分析,为进一步构建细胞色素P450体外生物特性反应酶系,验证CPR在10-HDA生物合成途径中的功能奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌种和质粒宿主菌大肠杆菌(Escherichia coli) BL21(DE3)和质粒均为本实验室保藏。
1.1.2 试剂及仪器DNA marker AL5000、Tap DNA聚合酶、DNA连接酶、限制内切酶均为TaKaRa产品;UNIQ-10柱式Trizol总RNA抽提试剂盒、柱纯化试剂盒和Ni-NTA为生工生物工程(上海)有限公司产品;PC18-TUREscript 1st Strand cDNA Synthesis Kit、质粒提取试剂盒以及胶回收试剂盒购于北京艾德莱生物科技有限公司;其他试剂为国产和进口分析纯试剂。所用仪器:2720 Thermal Cycler PCR仪;DYY-12电泳仪、水平式电泳槽以及垂直电泳槽;xMak型酶标仪。
1.1.3 引物据蜜蜂工蜂上颚腺细胞色素NADPH-P450还原酶基因(GenBank Accession No.AK724870)设计上游、下游引物并分别命名为N1、N2,将酶切位点(下划线)BamH Ⅰ、Xho Ⅰ分别引入,引物由生工生物工程(上海)有限公司合成(表 1)。
| Primer name | Primer sequence (5′-3′) | Size (bp) |
| Forward (N1) | CGCGGATCCATGATGTTTTATATGTACATATGTT | 31 |
| Reverse (N2) | CCGCTCGAGCTCCATACGTCACTTGAAT | 26 |
| The underlined sequences correspond to the BamH Ⅰ restriction site in N1 and the Xho Ⅰ site in N2 | ||
1.2 方法 1.2.1 获取目的片段
用剪刀剪下成年意大利工蜂的头部,按照UNIQ-10柱式Trizol总RNA抽提试剂盒要求进行操作以获取总RNA。以意蜂工蜂总RNA为模板,反转录合成意蜂工蜂cDNA。以意蜂工蜂的cDNA为模板,进行PCR扩增。反应条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 4 min 30 s,30个循环;最后72 ℃延伸10 min。反应完成后以1%的琼脂糖凝胶电泳检测PCR产物,并对目的产物进行柱纯化回收,并送至上海生工公司测序。
1.2.2 意蜂CPR氨基酸序列分析利用DNAman软件对已获的细胞色素P450还原酶氨基酸序列与GenBanK已登录的中华蜜蜂(Apis cerana),苜蓿切叶蜂(Megachile rotundata),家蝇(Musca domestica),按蚊(Anopheles funestus),棉铃虫(Helicoverpa armigera),原鸡(Gallus gallus),Capsicum annuum CPR基因的氨基酸序列进行多序列对比分析。
1.2.3 构建重组表达载体pET-NADPH-p450将含有质粒pET-28a的E.cloi摇瓶过夜培养并提取质粒。将所得质粒pET-28a及上述PCR所得CPR基因分别进行BamH Ⅰ和Xho Ⅰ双酶切,胶回收相应基因片段和同时双酶切的pET-28a质粒,按照比例连接获得重组表达载体pET-NADPH-p450。
1.2.4 重组质粒pET-NADPH-p450的转化和鉴定将上述获得的重组表达载体pET-NADPH-p450转化至新鲜制备的表达宿主BL-21(DE3)感受态细胞中,并将其涂布于含有100 μg/ml Kan的抗性平板,37 ℃恒温隔夜培养,用已灭菌牙签挑取抗性单克隆菌落,并分别以N1、N2作为上、下游引物,进行菌落PCR初步验证。按对应序号在同浓度的Kan抗性LB低盐培养基中进行扩培,提取重组质粒,双酶切进行二次鉴定,然后将通过验证的重组表达载体送至上海生工公司测序以最终验证。
1.2.5 外源蛋白的诱导表达取经验证无误并由甘油保藏的重组E.coli BL21(pET-NADPH-p450)菌种500 μl接入含有50 μg/ml Kan的50ml LB液体培养基中,37 ℃过夜培养。转接到另一装有50 μg/ml Kan的50 ml LB液体培养基的100 ml三角瓶中,37 ℃、210 r/min培养7 h (菌株达到生长周期的对数中后期),添加终浓度为1.0 mmol/L的诱导剂IPTG (异丙基-β-D-硫代吡喃半乳糖苷),25 ℃ 180 r/min培养12 h,离心收集菌体,用15 ml pH 7.4的1/15 mol/L磷酸盐缓冲液重悬菌体并超声破碎,超声功率为300 W,间歇时间6 s,破碎时间5 s,总共需要时间12 min。破碎后再次离心收集菌体,对上清液进行浓缩并进行SDS-PAGE分析。
1.2.6 Ni-NTA亲和层析纯化取出保存在4 ℃冰箱的镍柱,用酒精重悬填料并在填料完全下沉后将柱内酒精全部放出。用5~10倍体积的Ni-Native-0缓冲液平衡填料,流速控制为1 ml/min;加入1.2.5所得大肠杆菌裂解液,保持流速1 ml/min 30 min, 收集流出液;用Ni-Native-100缓冲液溶解目的蛋白,控制流速为1 ml/min,并收集流出液;用Ni-Native-250缓冲液溶解目的蛋白,流速为1 ml/min,收集流出液;加入5~10倍体积的Ni-Native-0缓冲液平衡柱子,并用30%的乙醇溶液保存填料,收集到的酶液样品进行SDS-PAGE分析。
1.2.7 CPR酶活测定CPR活性测定参照Brogdon等[19]和Tiwari等[20]的方法,通过测定血红素过氧化酶的活力间接反映CPR的酶活力。具体操作为:在酶标板上每孔反应总体系为325 μl,包括20 μl酶液,25 μl H2O2溶液(体积比为3%),80 μl 0.625 mol/L,pH 7.2的磷酸钾缓冲液,200 μl 3,3’,5,5’-四甲基联苯胺(TMBZ)溶液(0.01 g TMBZ溶解于5 ml甲醇和15 ml 0.25 moL/L,pH 5.0的醋酸钠缓冲液),对照孔酶液用磷酸钾缓冲液代替。将总体系放置于25~27 ℃下2 h后,在25 ℃、450 nm处进行终读数,计算酶液同对照组OD值之差。根据细胞色素C标准曲线,取到酶活力单位(即产物量),其与酶液蛋白量的比值,即为CPR比活力(equivalent units of cytochrome CPR/μg of protein, EU of CPR/μg)。
细胞色素C标准曲线制作见表 2。将细胞色素C稀释成不同浓度,取20 μl同TMBZ在H2O2还原条件下进行反应,室温下2 h后,在25℃ 450 nm处测定吸光值,重复3次,最终以细胞色素C的含量为X轴,处理孔同对照孔的OD差值为Y轴做回归直线。
| Reagents (μl) | Reference | Treated | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | ||
| Content of Cytochrome C (μg) | 0 | 2 | 4 | 6 | 10 | 12 | 16 |
| Volumn of CytochromeC (μl) | 20 | ||||||
| H2O2(μl) | 25 | ||||||
| 0.625mol/L,pH7.2 PBS | 80 | ||||||
| TMBZ (μl) | 200 | ||||||
| Abosorbance was read at 450nm at 25℃ after 2 h | |||||||
1.2.8 CPR酶学特性分析
最适作用pH:分别在不同pH缓冲液(4.0、5.0、6.0、7.0、8.0、9.0、10.0)下测定蛋白酶活性,pH3.0~5.0(乙酸钠缓冲液)、pH6.0~7.0(磷酸钾缓冲液)、pH8.0~9.0(Tris缓冲液)、pH10~11(Glycine-NaOH),确定最适pH。其它条件按2.2.6节方法,计算相对酶活。将pH梯度中对应的最高酶活性定义为100%。
最适作用温度:分别在不同的温度(20、25、30、35、40、45、50、55℃)下测定蛋白酶活性,确定最适温度。其他条件如方法2.2.6,计算相对酶活。将温度梯度中对应的最高酶活性定义为100%。
添加剂(金属离子、添加物)对酶活的影响:在标准反应体系中分别加入金属离子:Na+、K+、Ni2+、Ca2+、Zn2+、Mg2+、Co2+、Cu2+、Fe2+和EDTA终浓度10 mmol/L,甲醇、乙醇、异丙醇和丙酮的终浓度体积为10%(体积比)。对照组不添加任何物质,其他条件如方法2.2.6,测定相对酶活。
动力学常数的表征:细胞色素C还原测定实验参照Brogdon等[19]的方法。在100 mmol/L磷酸钾缓冲液中加入10 nmol/L CPR和不同浓度的细胞色素C (0.5~200 μmol/L),添加100 μmol/L的NADPH启动反应。测定并记录开始与在30 ℃条件反应1 min后的A520,细胞色素C的减少速率为细胞色素C由氧化型向还原型的转变速率。以上数据均重复测定3次。利用Origin Pro 8.5.1和公式(1)对测定的数据进行拟合,由公式(2)计算的kcat值。
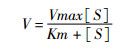 |
(1) |
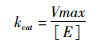 |
(2) |
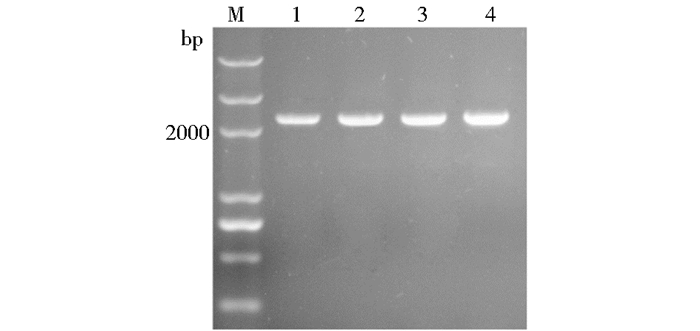
以意蜂工蜂的头部作为原始材料,通过抽提其RNA,反转录获得cDNA。利用所设计的引物,以意蜂工蜂的cDNA为模板,凝胶电泳结果(图 1)显示PCR扩增获得约2 300 bp的基因片段,大小与细胞色素NADPH-p450还原酶基因预测值相符,测序结果与GenBank (Accession No.AK724870)序列进行比对分析,表明PCR扩增获得的基因片段序列与Apis mellifera NADPH-cytochrome P450 reductase序列相似度为100%,说明目的基因克隆成功。
|
| 图 1 细胞色素NADPH-p450还原酶基因的扩增 Figure 1 Amplification of cytochrome NADPH-p450 recombinat reductase M:DNA marker; 1~4: Result of amplification |
意蜂CPR氨基酸序列与其他物种多序列比对分析结果如图 2所示,Apis mellifera与Apis cerana和Megachile rotundata的氨基酸序列同源性较高,分别为99%和93%;与Musca domestica、Anopheles funestus和Helicoverpa armigera同源性分别为71%、68%和67%;与Gallus gallus和Capsicum annuumCPR氨基酸序列同源性较低,分别为58%和40%。

|
| 图 2 意蜂CPR基因氨基酸序列比对 Figure 2 Amino acid sequence alignments of CPR gene Ame: Apis mellifera; Ace:Apis cerana; Afu:Anopheles funestus; Mdo:Musca domestica; Mro:Megachile rotundata; Har:Helicoverpa armigera; Gga:Gallus gallus; Can:Capsicum annuum |
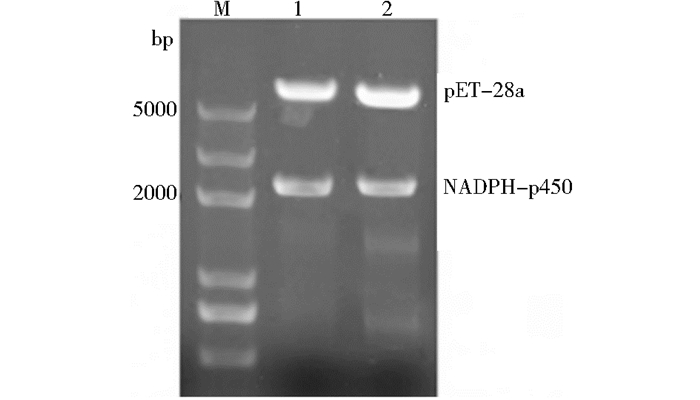
将意蜂工蜂CPR基因扩增片段插入到表达载体。经菌落PCR及对重组质粒双酶切验证(图 3),测序结果显示成功构建重组质粒pET-NADPH-p450,同时证明重组质粒pET-NADPH-p450成功导入表达宿主大肠杆菌中。
|
| 图 3 重组质粒pET-NADPH-p450的双酶切 Figure 3 Restriction enzymes analysis of the cytochrome NADPH-p450 recombinat plasmid M:DNA marker; 1~2: Double digestion of recombinant plasmid pET-NADPH-p450 |
SDS-PAGE检测分析结果(图 4)显示,E.coli BL21(pET-NADPH-p450)与对照菌株相比,确有蛋白在80~100 kDa之间形成积累,说明重组菌株成功表达外源蛋白。由于在目的蛋白附近有杂带出现,因此对粗酶液进行纯化处理。本研究构建的细胞色素NADPH-p450还原酶的N端含有一个6×His标签,利用组氨酸的咪唑基团和镍离子的高度亲和作用原理,分离纯化目的蛋白。纯化后再次进行SDS-聚丙烯酰胺凝胶电泳检测分析,分离得纯蛋白酶液。
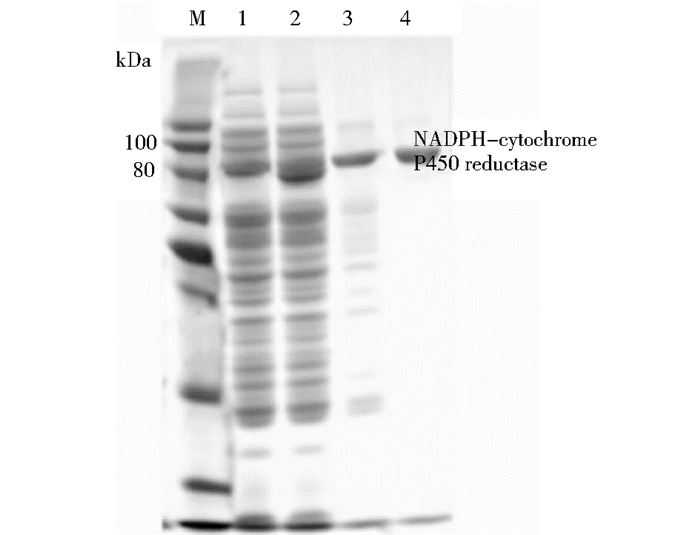
|
| 图 4 大肠杆菌(pET-NADPH-p450)胞内蛋白纯化SDS-聚丙烯胺凝胶电泳分析 Figure 4 SDS-PAGE analysis of intracellular protein of E.coli (pET-NADPH-p450) recombinant strain M: Protein marker; 1: Fraction eluted from Ni-Native-0; 2: Crude enzyme liquid; 3: Fraction eluted from Ni-Native-100; 4:Fraction eluted from Ni-Native-250 |
在25 ℃条件下反应2 h,测得不同细胞色素C含量下,处理孔与对照孔OD差值(ΔOD),以细胞色素C的含量为X轴,处理孔同对照孔的OD差值为Y轴做回归直线,即为细胞色素C的标准曲线(图 5)。
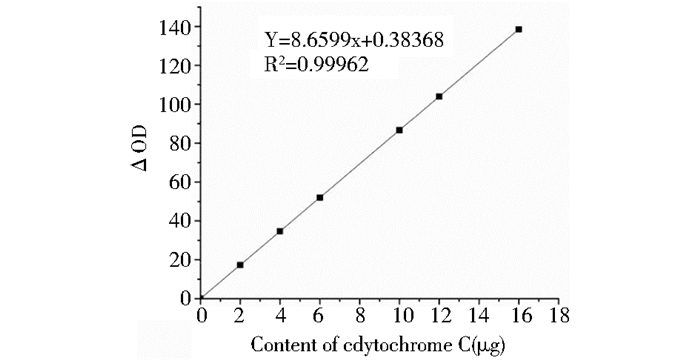
|
| 图 5 细胞色素C的标准曲线 Figure 5 The standard curve of cytochrome C |
经计算得以CPR酶液与磷酸钾缓冲液代替酶液测定OD值之差为169.730,利用细胞色素C标准曲线可得酶蛋白量为980 μg/ml,CPR (血红素过氧化酶)比活性为77.33 (EU of CPR)/μg。
2.5.2 最适pH及最适温度经测定蜜蜂CPR酶的最适温度为40 ℃,由图 6分析得出温度在20~40℃之间,酶活性逐渐升高,当温度大于45℃酶活性明显降低,表明该酶不适合在温度较高条件下使用。最适pH为8.0(图 6),当pH低于7.0高于9.0后酶活性均低于60%。
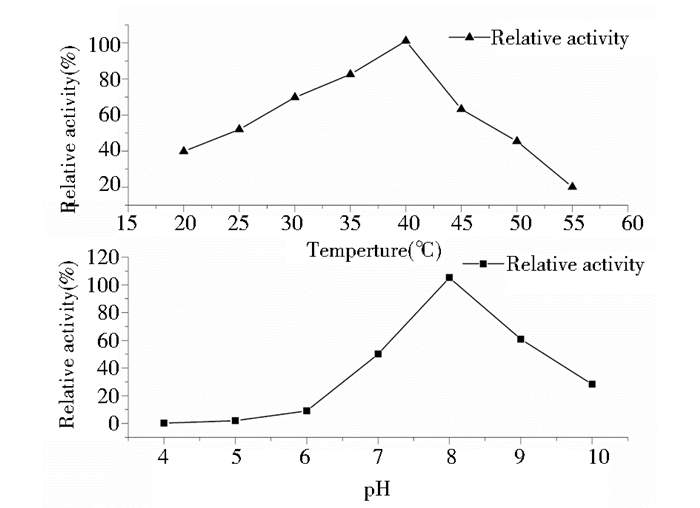
|
| 图 6 不同温度及pH对蜜蜂CPR酶力的影响 Figure 6 Effects of temperature and pH on activity of the purified CPR The enzyme activity was measured at various temperature (20~55℃) at pH7.2. And the enzyme activity was measured at various pH (4.0~10.0) at 25~27℃ |
测定后(图 7),没有发现对蜜蜂CPR酶具有明显促进作用的金属离子,Ni2+、Zn2+、Co2+对酶活影响较大,相对酶活均在10%以下,Co2+使酶失活,添加Mg2+时相对酶活为110.2%,Na+、K+、Ca+对酶活影响较小。EDTA的加入没有对酶活产生明显影响,乙醇和丙酮使酶活降低40%左右,甲醇和丙醇存在时相对酶活性保持在75%以上。
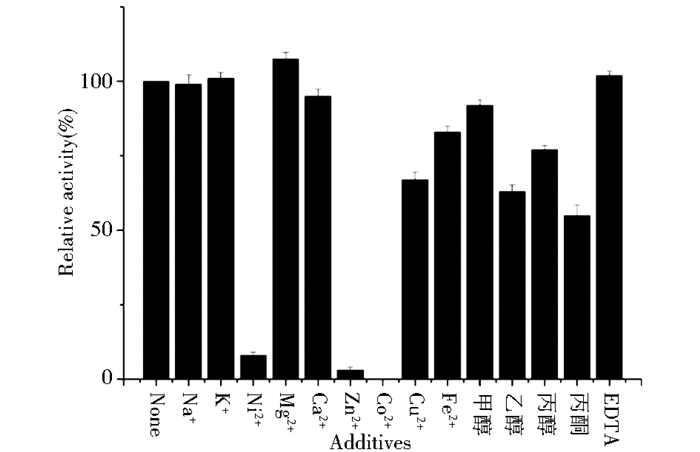
|
| 图 7 添加剂对蜜蜂CPR酶活性的影响 Figure 7 Effects of additives on activity of the purified CPR The additives include mental ions :Na+、K+、Ni2+、Ca2+、Zn2+、Mg2+、Co2+、Cu2+、Fe2+, and methanol, ethanol, propanol, acetone, EDTA |
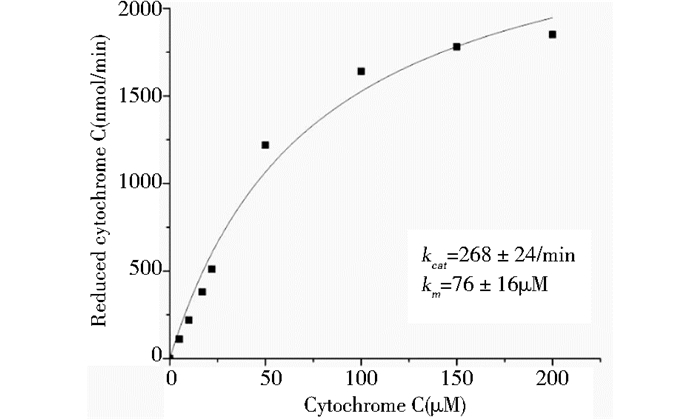
根据公式(1)拟合得蜜蜂CPR酶对底物细胞色素C反应的Km为76 μM,Vmax为2.317μmol/min/mg (图 8),根据公式(2)进一步计算得kcat为268/min。
|
| 图 8 意蜂CPR酶对细胞色素C的动力学参数 Figure 8 The enzyme kinetic of Apis mellifera CPR parameters of cytochrome C |
实验成功构建表达载体pET-NADPH-p450,并实现其在E.coli (BL21)中的异源表达,利用Ni-NTA亲和层析纯化后测得CPR (血红素过氧化酶)比活性为77.33 (EU of CPR)/μg, 最适温度和pH分别为40 ℃和8.0;金属离子Ni2+、Zn2+明显使酶活性降低,Co2+使酶失活,Mg2+可适当提高酶活,Na+、K+、Ca+的影响较小;外源添加剂EDTA对酶活没有显著影响,乙醇、丙酮、甲醇和丙醇均可降低酶活性。其对底物细胞色素C的动力学参数Km和kcat分别为76 μM和268/min。
据报道,自首个昆虫家蝇(Musca domestica Linnaeus)CPR基因由Koener等[21]完成序列分析后,已有20多种昆虫CPR基因得到鉴定[22],而关于昆虫CPR酶动力学的研究较少[23]。我们实现蜜蜂CPR基因的异源表达,酶学特性研究结果表明蜜蜂CPR最适温度40 ℃低于Capsicum annuum CaCPR的56.1±0.4 ℃[24]; 对底物细胞色素C的动力学参数Km=76±16 μM明显高于Km=19.35±1.54 μM (Helicoverpa armigera)[25]及Km=21.9±2.3 μM (Gallus gallus)[25],低于Km=81±13 μM (Capsicum annuum)[24],说明不同物种CPR酶学特性存在一定差异。本研究为进一步揭示CPR与P450s在10-HDA合成过程中的功能以及探究生物法合成10-HDA新途径奠定基础。
| [1] | 易胜.烟粉虱NADPH-细胞色素P450还原酶与NADPH-细胞色素b5还原酶基因的克隆机表达量分析.湖南:湖南农业大学, 2014. Yi S. Molecular cloning and relative expression analysis of NADPH-cytochrome P450 reductase and NADPH-cytochrome b5 reductase gene in whitefly (Bemisia tabaci). Hunan:Hunan Agricultural University, 2014. |
| [2] | Rana S, Lattoo S K, Dhar N, et al. NADPH-cytochrome P450 reductase:molecular cloning and function characterization of two paralogs from Withania somnifera(L.). Dunal.PLoS One , 2013, 8 (2) : e57068. DOI:10.1371/journal.pone.0057068 |
| [3] | Jensen K, Møller B L, Birger L. Plant NADPH-cytochrome P450 oxidoreductases. Phytochemistry , 2010, 71 (2-3) : 132–141. DOI:10.1016/j.phytochem.2009.10.017 |
| [4] | Riddick D S, Ding X, Wolf C R, et al. NADPH-cytochrome P450 oxidoreductase:roles in physiology, pharmacology, and toxicology. Drug Metabolism and Disposition , 2013, 41 (1) : 12–23. DOI:10.1124/dmd.112.048991 |
| [5] | Mizutani M. Impacts of diversification of cytochrome P450 on plant metabolism. Biol Pharm Bull , 2012, 35 (6) : 824–832. DOI:10.1248/bpb.35.824 |
| [6] | Cheng J, Wan D F, Gu J R, et al. Establishment of a yeast system that stably expresses human cytochrome P450 reductase:application for the study of drug metabolism of cytochrome P450s in vitro. Protein Expression and Purification , 2006, 47 (2) : 467–476. DOI:10.1016/j.pep.2005.11.022 |
| [7] | Nonaka Y, Horike N, Takemori H, et al. Molecular cloning of NADPH-cytochrome P450 oxidoreductase from silkworm egg. European Journal of Biochemistry , 2000, 267 (23) : 6914–6920. DOI:10.1046/j.1432-1033.2000.01796.x |
| [8] | Hart S N, Wang S, Nakamoto K, et al. Genetic polymorphisms in cytochrome P450 oxidoreductase influence microsomal P450-catalyzed drug metabolism. Pharmacogenet Genomics , 2008, 18 (1) : 11–24. DOI:10.1097/FPC.0b013e3282f2f121 |
| [9] | Shackleton C, Marcos J, Arlt W, et al. Prenatal diagnosis of P450 oxidoreductase deficinecy (ORD):a discorder causing low pegnancy estriol, maternal and fetal virilization, and the Antley-Bixler syndrome phenotype. Am J Med Genet A , 2004, 129A (2) : 105–112. DOI:10.1002/(ISSN)1096-8628 |
| [10] | Koo A J, Howe G A. Catabolism and deactivation of the lipid-derived hormone jasmonoyl-isoleucine. Frontiers in Plant Science , 2012, 3 : 19. |
| [11] | Heitz T, Widemann E, Lugan R, et al. Cytochromes P450 CYP94C1 and CYP94B3 catalyze two successive oxidation steps of plant hormone jasmonoyl-isoleucine for catabolic turnover. Journal of Biological Chemistry , 2012, 287 (9) : 6296–6306. DOI:10.1074/jbc.M111.316364 |
| [12] | Saurabh B, Kwangkyoung L, Tae-Jin O. Hydroxylation of long chain fatty acids by CYP147F1, a new cytochrome P450 subfamily protein from Streptomyces peucetius. Archives of Biochemistry and Biophysics , 2013, 539 (1) : 63–69. DOI:10.1016/j.abb.2013.09.008 |
| [13] | Isoda Y. Antitumor activity of lipids antitumor activity of free fatty acid in mice with transplant stumors. Yukagaku , 1993, 42 (11) : 923–928. |
| [14] | 党亚丽, 张中健, 闫小伟. 蜂王浆产品中10-羟基-2-癸烯酸的稳定性比较. 食品研究与开发 , 2012, 7 (33) : 5–8. Dang Y L, Zhang Z J, Yan X W. Comparison on the stability of 10-hydroxy-2-decenoic acid in royal jelly product. Food Research and Development , 2012, 7 (33) : 5–8. |
| [15] | Plettner E, Slessor K N, Winston M L. Biosynthesis of mandibular acids in honeybees (Apis mellifera):De novo synthesis, route of fatty acid hydroxylation and caste selective β-oxidation. Insect Biochem Mol Biol , 1997, 1 : 31–42. |
| [16] | Paine M J, Scrutton N S, Munro A W, et al. Electron transfer partners of cytochrome P450. In:Ortiz de Montellano. Cytochrome P450. Springer, 2005.115-148. |
| [17] | Kim D, Cryle M J, De Voss J J, et al. Functional expression and characterization of cytochrome P45052A21 from Candida albicans. Arch Biochem Biophys , 2007, 464 (2) : 213–220. DOI:10.1016/j.abb.2007.02.032 |
| [18] | Saurabh B, Kwangkyoung L, Tae-Jin O. Hydroxylation of long chain fatty acids by CYP147F1, a new cytochrome P450 subfamily protein from Streptomyces peucetius. Archives of Biochemistry and Biophysics , 2013, 539 (1) : 63–69. DOI:10.1016/j.abb.2013.09.008 |
| [19] | Brogdon W G, McAllister J C, Vulule J. Vulule J. Heme peroxidase activity measured in single mosquitoes identifies individuals expressing an elevated oxidase for insecticide resistance. J Am Mosq Control Assoc , 1997, 13 (3) : 233–237. |
| [20] | Tiwari S, Pelz-Stelinski K, Mann R S, et al. Glutathione transferase and cytochrome P450(general oxidase) activity levels in Candidatus Liberibacter asiatcus-infected and uninfected Asian citrus psyllid (Hemiptera:Psyllidae). Ann Entomol Soc Am , 2011, 104 (2) : 297–305. DOI:10.1603/AN10128 |
| [21] | Koener J E, Cario F A, Feyereisen R. The cDNA and deduced protein sequence of house fly NADPH-cytochrome P450 reductase. Insect Biochem Mol Biol , 1993, 23 (4) : 439–447. DOI:10.1016/0965-1748(93)90051-S |
| [22] | Zhu F, Sams S, Moural T, et al. RNA interference of NADPH-cytochrome P450 reductase results in reduced insecticide resistance in the bed bug, Cimex lectularius. PLoS One , 2012, 7 (2) : e31037. DOI:10.1371/journal.pone.0031037 |
| [23] | Dong L B, Xiaojie Zhoua B C, Mei L, et al. Characterization of NADPH-cytochrome P450reductase gene from the cotton bollworm, Helicoverpa armigera. Gene , 2014, 545 (2) : 262–270. DOI:10.1016/j.gene.2014.04.054 |
| [24] | Ga-Young L, Hyun M K, Sang H M, et al. Heterologous expression and functional characterization of the NADPH-cytochrome P450 reductase from Capsicum annuum. Plant Physiology and Biochemistry , 2014, 82 : 116–122. DOI:10.1016/j.plaphy.2014.05.010 |
| [25] | Zhou X, Li M, Sheng C, et al. NADPH-cytochrome P450 oxidoreductase from the chicken (Gallus gallus):Sequence characterization, functional expression and kinetic study. Comparative Biochemistry and Physiology Part C:Toxicology and Pharmacology , 2011, 153 (1) : 53–39. DOI:10.1016/j.cbpc.2010.08.005 |
 2016, Vol. 36
2016, Vol. 36




