文章信息
- 韩海红, 汪俊卿, 王腾飞, 肖静, 韩登兰, 王瑞明.
- HAN Hai hong, WANG Jun qing, WANG Teng fei, XIAO Jing, HAN Deng lan, WANG Rui ming.
- 一种基于单交换原理的地衣芽孢杆菌基因敲除方法及应用
- Method and Application of Gene Knockout Based Single Cross in Bacillus licheniformis 20085
- 中国生物工程杂志, 2016, 36(11): 63-69
- China Biotechnology, 2016, 36(11): 63-69
- http://dx.doi.org/DOI:10.13523/j.cb.20161109
-
文章历史
- 收稿日期: 2016-05-04
- 修回日期: 2016-06-23
地衣芽孢杆菌(Bacillus licheniformis)是一类在自然界广泛存在且能抵抗恶劣环境的革兰氏阳性嗜热菌,在包括医药、饲料、纳米技术等领域[1-3]在内的生物技术领域具有重要的应用价值,同时研究还发现地衣芽孢杆菌具有高效的纤维素、半纤维素和木质素降解酶系[4-6],在生物质材料降解方面也崭露头角[7]。目前对地衣芽孢杆菌的研究主要集中在功能基因的克隆及表达上[8],而关于地衣芽孢杆菌分子改造技术则鲜有报道。
基因敲除(gene knockout),又称为基因打靶,即利用DNA转化技术,将构建的打靶载体导入靶细胞后,通过同源重组技术失活目的基因的方法,是微生物分子改造的重要手段之一。目前芽孢杆菌的基因敲除多采用以质粒为载体的同源双交换法,即获取目的基因上下游两段基因序列作为同源臂,构建穿梭载体或自杀载体并转化到目的菌株中,转化后通过同源双交换实现目标基因的敲除,如田李等[9]对构建含有Vdku80上下游同源臂、潮霉素抗性标记、遗传霉素抗性标记和pGKO2-Gateway复制起始位点的敲除载体pKO2-Vdku80,电转化至大丽轮枝菌中,最终实现Vdku80基因的敲除。虽然基于上述原理进行基因敲除的方法目前已被广泛应用,但整体构建流程复杂、操作周期相对较长[10-11],而通常以基因功能验证为目的基因敲除则需要更为简便快速的基因敲除技术。
本研究利用PCR技术两步构建敲除片段,酶切后转化至目标地衣芽孢杆菌中,通过一次同源单交换,在目的基因内部插入一段含有筛选标记基因的序列,实现地衣芽孢杆菌的内切纤维素酶celb基因的快速敲除。本研究建立了一种快速高效的地衣芽孢杆菌基因敲除体系,也为其它微生物基因的快速敲除提供了一定的借鉴。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒与引物地衣芽孢杆菌CICC20085(以下简称为B. licheniformis 20085)购自中国工业微生物菌种保藏管理中心,含有氯霉素抗性基因的质粒pHT01购自杭州宝赛生物科技有限公司;实验所涉及引物见表 1。
| Primer name | Sequence(5′→3′) | Size (bp) | Restriction site |
| celb F1 | CGGGATCCCGCTTCTAAAACACCCGTTG | 28 | BamH I |
| celb R1 | AAGGCCAGCAAAAGTACATGACATTGCCGTCT | 32 | |
| celb F2 | ATGTCATGTACTTTTGCTGGCCTTTTGCTCA | 31 | |
| celb R2 | CATAATCGGCTGGATCCTAGTGACTGGCGATGCT | 34 | BamH I |
1.1.2 培养基
LB培养基:蛋白胨1%、酵母浸粉0.5%、氯化钠1%,pH7.0~7.4;发酵培养基:蛋白胨0.3%、(NH4)2SO4 0.3%、MgSO4·7H2O 0.02%、KH2PO4 0.1%、氯化钠0.5%,pH7.0~7.4。菌体增殖培养基:蛋白胨1%、酵母浸粉0.5%、氯化钠1%、山梨醇9.1%。电转缓冲液:山梨醇9.1%、甘露醇9.1%、甘油10%。菌体复苏培养基:蛋白胨1%、酵母浸粉0.5%、氯化钠1%、山梨醇9.1%、甘露醇6.9%。以上培养基均需在高压蒸汽灭菌锅中121℃灭菌20min。
1.1.3 试剂限制性内切核酸酶购自TaKaRa公司,氯霉素、Ezup柱式基因组DNA抽提试剂盒、SanPrep柱式DNA胶回收试剂盒均购自上海生工生物工程有限公司,高纯度质粒小量快速提取试剂盒由艾德莱生物公司提供;Whatman纤维素滤纸购自沃特曼公司;其它试剂均属于国产分析纯。
1.2 实验方法 1.2.1 重组同源性片段celb1-Cmr的制备使用上海生工Ezup柱式基因组DNA抽提试剂盒提取B. licheniformis 20085菌体的DNA,并以此为模板,使用引物celb F1和celb R1进行PCR扩增。PCR扩增条件为:95℃预变性5min;94℃变性30s,57℃退火30s,72℃延伸1.5min,30个循环;72℃延伸10min,4℃保存,扩增获得长度为589bp用于celb基因敲除的同源臂celb1;使用高纯度质粒小量快速提取试剂盒提取质粒pHT01,以质粒pHT01为模板,使用引物celb F2和celb R2进行PCR扩增,PCR扩增条件为:95℃预变性5min;94℃变性30s,57℃退火30s,72℃延伸3min,30个循环;72℃延伸10min,4℃保存,30个循环扩增获得长度为1 245bp的氯霉素抗性基因片段Cmr;使用SanPrep柱式DNA胶回收试剂盒(上海生工)胶回收制得的celb1片段与Cmr片段为模板,celb F1和celb R2为引物进行PCR扩增进行重叠延伸PCR[12-14],PCR扩增条件为:①95℃预变性5min;94℃变性30s,57℃退火30s,72℃延伸1.5min,5个循环;72℃延伸2min;②95℃预变性5min,94℃变性30s,55℃退火30s,72℃延伸5min,30个循环;72℃延伸10min,4℃保存,扩增制得长度为长度1 834bp的同源重组片段celb1-Cmr(图 1),使用SanPrep柱式DNA胶回收试剂盒(上海生工)进行胶回收,保存于-20℃备用。
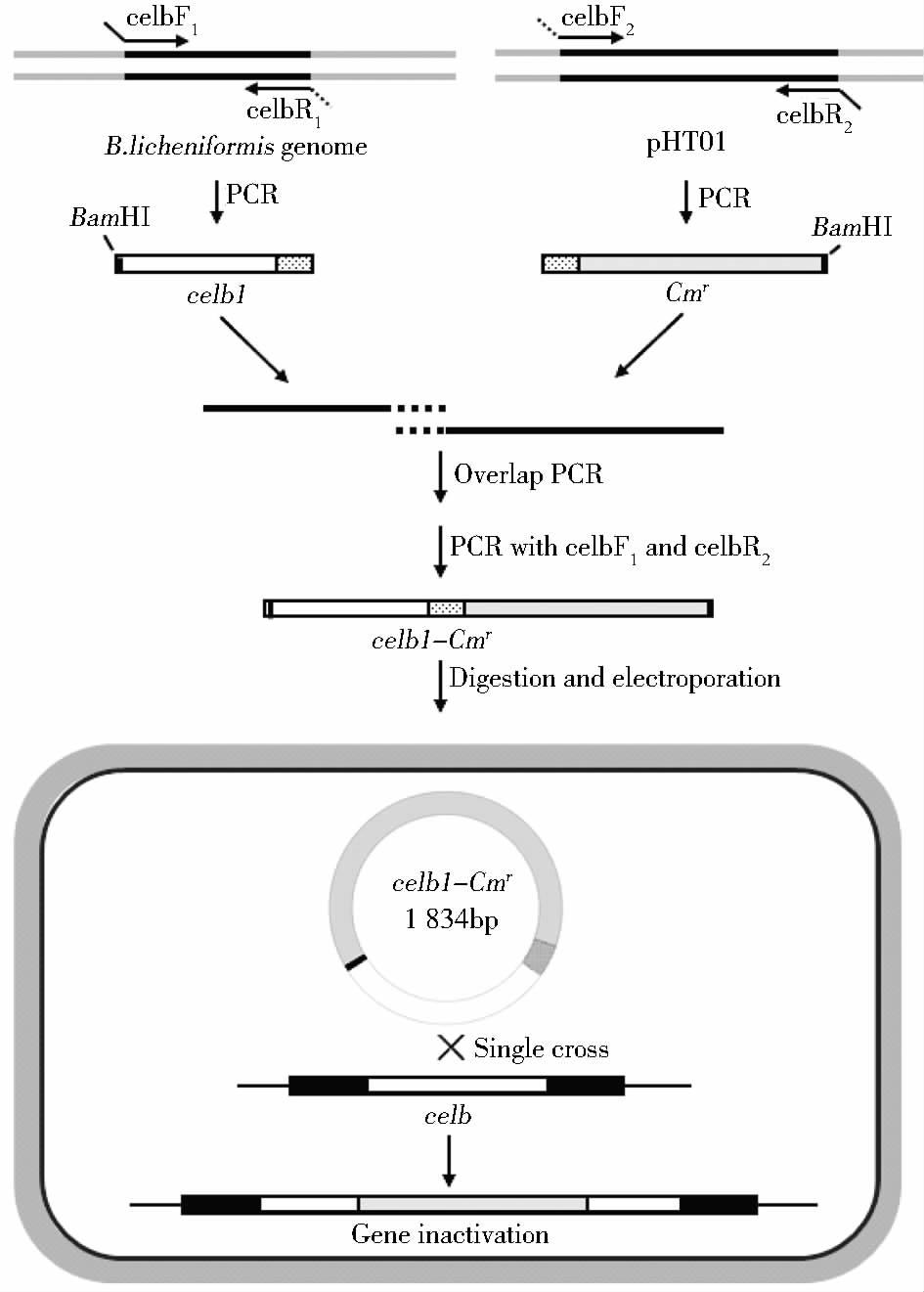
|
| 图 1 Bacillus licheniformisΔcelb构建流程图 Figure 1 Flowchart of construction of Bacillus licheniformisΔcelb |
celb1-Cmr基因片段胶回收产物经限制性内切酶BamHI酶切处理,并向酶切产物中加入1/10体积3mol/L乙酸钠和2.5倍体积无水乙醇,并置于-20℃冰箱冷却20min,后经12 000r/min离心5min得沉淀;加入300μl 75%乙醇重悬沉淀,12 000r/min离心5min除去乙醇,37℃风干30min,最后加入15~18μl ddH2O重悬DNA。使用核酸超微量分光光度计(BioFuture MD2000)测定回收DNA浓度,并最终获得浓度为200~1 000ng/μl的DNA溶液。
1.2.3 电转感受态细胞制备挑取新鲜LB固体培养基表面的B. licheniformis 20085单菌落,接种于10ml菌体增殖培养基中,37℃、220r/min培养12h;取1ml上述菌液转接到100ml菌体增殖培养基中,37℃、220r/min培养至OD600=0.9;将菌液转移至100ml离心管,冰浴15~20min后,8 000r/min、4℃离心5min,收集菌体;离心后的菌体用预冷的电转缓冲液洗涤2次或3次,并使用1ml电转缓冲液重悬菌体,即制成地衣芽孢杆菌电转化感受态[15-16];将制备好的感受态细胞分装100μl每管,-80℃保存备用。
1.2.4 电转化将回收片段与B. licheniformis 20085感受态混合均匀后加入2min电转杯预冷5min,并使用Eppendorf电转仪在2 100V、5ms条件下进行电转化。电转后立即加入500μl菌体复苏培养基,37℃、180r/min复苏培养4h,离心重悬后涂布含氯霉素(30μg/ml)固体LB培养基,37℃恒温培养箱中培养1~2天,筛选抗氯霉素的菌株。
1.2.5 阳性重组菌株的鉴定挑取上述菌落接种到含氯霉素抗性的液体LB培养基中,37℃培养过夜后8 000r/min离心收集菌体,使用上海生物工程有限公司提供的试剂盒提取重组菌DNA,并以获得的基因组为模板、celb F1和celb R2为引物进行PCR扩增,扩增产物利用1%琼脂糖凝胶电泳进行验证,最终获得阳性重组菌株。
1.3 Whatman滤纸崩解试验挑取保藏的B. licheniformis 20085单菌落,转接于50ml液体LB培养基中,37℃、220r/min摇床培养12h,其后按照2%的接种量接种至添加Whatman纤维素滤纸条(1cm×6cm)的100ml发酵培养基中,37℃、200r/min发酵培养120h,每隔24h检查记录滤纸崩解情况[17]。
1.4 纤维素酶活性测定以1.0%羧甲基纤维素钠(CMC-Na)为底物利用发酵培养基对celb基因缺失菌株及原始菌株进行发酵测试。并在发酵12h、24h、36h、48h、72h、96h、120h时取样,14 000r/min、4℃离心10min弃去沉淀即得发酵粗酶液。采用DNS法以CMC-Na为底物测定内切纤维素酶(CMC酶)活性,具体方法参照罗紫臣[18]研究并稍作改进:取0.5%(m/V)CMC底物溶液(pH6.0磷酸氢二钠-柠檬酸缓冲液配制)2.4ml,置(50±0.2)℃恒温水浴中预热5min,加入0.1ml粗酶液,50℃准确反应45min;加入2.5ml DNS试剂,煮沸7min终止酶反应,迅速冷却后加5ml水混匀,并测量其在OD540下的吸光度值。
2 结果讨论 2.1 基因敲除片段celb1-Cmr的构建以B. licheniformis 20085菌体的基因组DNA为模板,使用引物celb F1和celb R1进行PCR扩增,1%琼脂糖凝胶电泳检测发现在600bp左右出现特异性电泳条带[图 2(a)],与理论长度589bp相符,表明已成功获得用于celb基因敲除的同源臂celb1;以质粒pHT01为模板,使用引物celbF2和celb R2进行PCR扩增,1%琼脂糖凝胶电泳检测发现在1 200bp左右出现特异性电泳条带[图 2(b)],与理论长度1 245bp相符,表明以成功获得氯霉素抗性基因片段Cmr;以胶回收制得的celb1片段与制得的Cmr片段为模板,celb F1和celb R2为引物进行PCR扩增进行重叠延伸PCR,制得基因敲除片段celb1-Cmr,琼脂糖凝胶电泳检验PCR产物,发现在1 800bp左右出现特异性电泳条带[图 2(c)],与理论长度1 834bp相符,表明基因敲除片段celb1-Cmr构建成功。
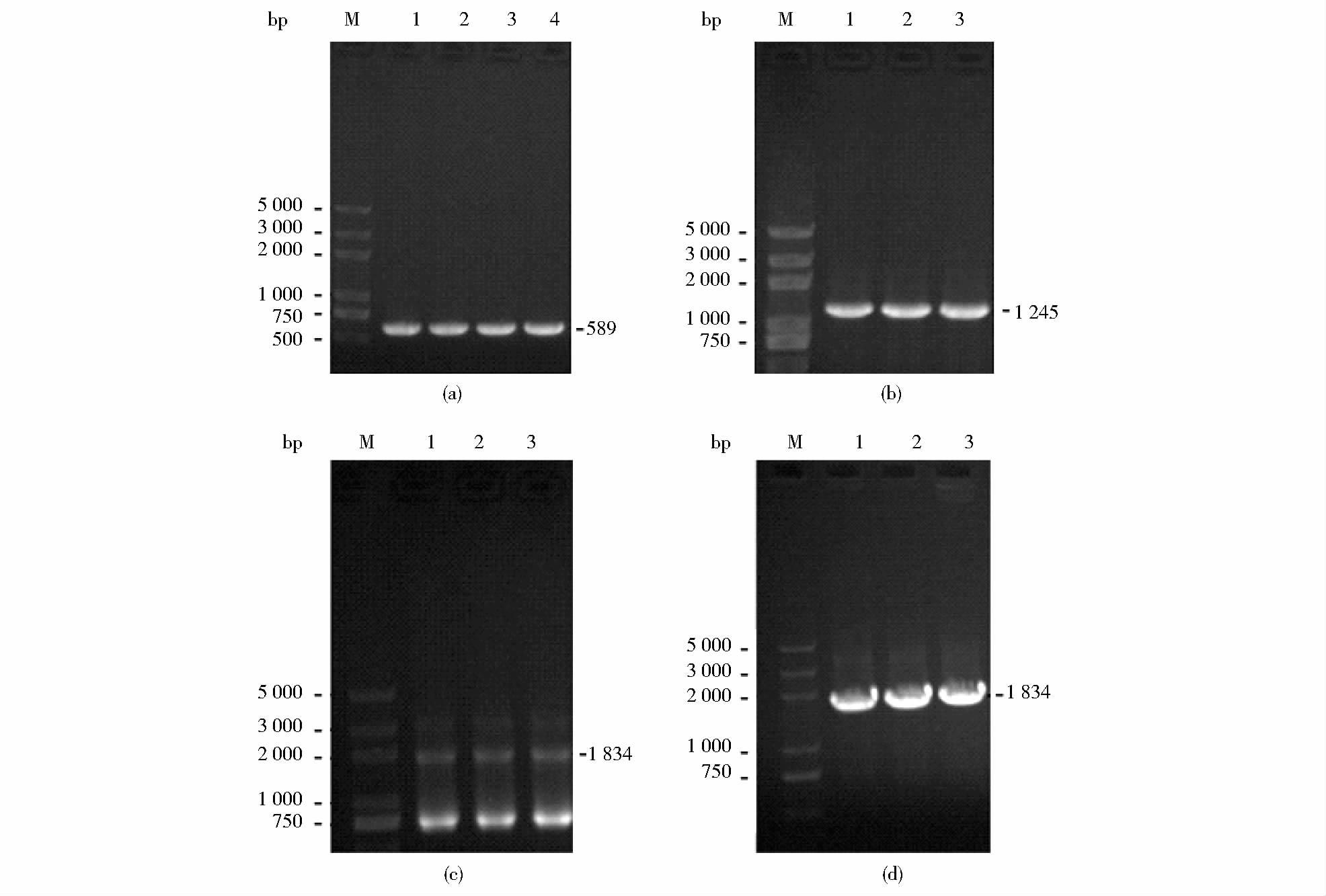
|
| 图 2 PCR产物电泳图 Figure 2 Electrophoresis of amplified products of PCR (a) PCR product of homology arms celb1 gene. M:Marker DL5000;1-4:589bp DNA fragment of celb1 gene from B.licheniformis 20085 (b)PCR product of chloromycetin gene M: Marker DL5000;1-3:1 245bp DNA fragment of chloromycetin gene from plasmid pHT01 (c) Product of overlap PCR M: Marker DL5000; 1-3:1 834bp DNA fragment by oerlap PCR (d)Verification of mutant M: Mrker DL5000; 1-3:1 834bp PCR product of mutant |
使用BamH I对500μl融合PCR产物进行单酶切,并使用乙醇沉淀法浓缩获得酶切片段,使用核酸超微量分光光度计(BioFuture MD2000)测定回收DNA浓度,结果显示DNA浓度为363.76ng/μl。将10μl回收片段与100μl B. licheniformis 20085感受态细胞混合并电转化,并使用引物celb F1和celb R2对含氯霉素平板上生长菌落的基因组进行验证,结果如图 2(d)所示,表明celb1-Cmr与celb发生同源重组,完成celb基因的敲除。
2.3 celb基因的敲除对内切纤维素酶活性的影响以1.0% CMC-Na为底物对celb1基因缺失菌株及原始菌株进行发酵测试。结果显示,改造前后原始菌株与突变菌株内切纤维素酶酶活力相差较大。如图 3所示,B. licheniformis 20085在发酵72h后CMC酶的活性达到1.86U/ml,而B. licheniformisΔcelb发酵过程中CMC酶的活性最大值为0.50U/ml,这与滤纸崩解实验的结果一致。由此得出B. licheniformisΔcelb菌株发酵后的CMC酶的活性较B.licheniformis 20085降低了1.36U/ml,从而证实B.licheniformis 20085中的celb基因已被成功敲除。

|
| 图 3 内切纤维素酶活力 Figure 3 CMCase activity |
Whatman纤维素滤纸纤维素含量达98%以上,因此适用于作为纤维素降解的参照标准,验证原始菌株和突变菌株的纤维素降解能力。以Whatman纤维素滤纸(1cm×6cm)为底物发酵结果见表 2,原始菌株在发酵72h后滤纸崩解能力达到最大,滤纸完全崩解,而突变菌株的滤纸崩解能力则明显低于原始菌株,整个发酵过程滤纸仅发生极微小变化。Whatman纤维素滤纸崩解试验表明,突变菌株滤纸崩解能力被显著减弱,纤维素降解能力显著降低,该结果同时也表明celb 基因在B. licheniformis 20085降解纤维素的过程中发挥着重要的作用。
| Strain name | 24h | 48h | 72h | 96h | 120h |
| B. licheniformis20085 | + | ++ | +++++ | +++++ | +++++ |
| B. licheniformisΔcelb | + | + | + | ||
| Note:"+" Means the strength of filter disintegrating. "+" shows the filter paper does not fracture but hairy edge; "++" shows the filter paper was fractured; "+++"shows the filter paper was collapsed; "++++" shows the filter paper was collapsed,and was rolled into a paste-like;"+++++"shows paper was violently collapsed,and was rolled into uniform paste | |||||
3 结论
目前,对地衣芽孢杆菌进行基因敲除时多采用以质粒为载体的同源双交换法,即获取目的基因上下游两段基因序列作为同源臂,构建穿梭载体或自杀载体并转化到目的菌株中,转化后需先后发生两次单交换,实现目标基因的敲除[19-20]。以上述原理进行基因敲除的方法虽然目前已被广泛应用,但此类方法仅构建载体就需要数次酶切连接及测序操作,完成整个操作周期耗时相对较长,同时由于载体结构复杂,序列较长,转化效率一般较低。虽然上述方法能够实现基因的无痕敲除等特殊需求,但在以基因功能验证为目的的基因敲除操作中该类方法往往成为整个实验流程的限速环节。本实验针对现有技术的不足,提供一种快速实现地衣芽孢杆菌基因敲除的方法,首先利用PCR扩增技术获取地衣芽孢杆菌celb基因同源臂celb1、抗性标签氯霉素基因Cmr,借助重叠延伸PCR技术构建地衣芽孢杆菌celb基因敲除载体(celb1-Cmr),通过一次同源重组(单交换)即可实现目的基因的敲除;构建的敲除片段仅包含两段序列celb1-Cmr(同源臂和抗生素抗性标签基因),构建流程简单,基因敲除周期短,并有效降低敲除成本,提高工作效率。
本研究获得的celb基因敲除菌株经过初步发酵研究,发现突变菌株滤纸崩解能力显著降低,内切纤维素酶酶活力降低了73.1%,表明地衣芽孢杆菌中的celb基因已被成功敲除,在后续实验中需要进一步对突变菌株进行发酵实验,针对性地对其木质素、纤维素、半纤维素降解能力做出系统地研究,同时研究不同酶系之间存在的协同降解作用,从而明确突变菌株在生物制浆方面的应用[21-22]。综上所述,本研究成功构建了地衣芽孢杆菌内切纤维素酶缺失菌株,为后续实验提供了工作基础。
| [1] | Meng X, Wu Q, Wang L. Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making. Journal of Industrial Microbiology & Biotechnology , 2015, 42 (12) : 1601–1608. |
| [2] | Muhammad J, Salma Z, Muhammad A, et al. Role of Bacillus licheniformis in phytoremediation of nickel contaminated soil cultivated with rice. International Journal of Phytoremediation , 2014, 16 (6) : 554–571. DOI:10.1080/15226514.2013.798621 |
| [3] | Bora L. Purification and characterization of highly alkaline lipase from Bacillus licheniformis MTCC 2465:and study of its detergent compatibility and applicability. Journal of Surfactants and Detergents , 2014, 17 (5) : 889–898. DOI:10.1007/s11743-013-1517-6 |
| [4] | 陈丽燕, 张光祥, 黄春萍, 等. 两株高产纤维素酶细菌的筛选、鉴定及酶学特性. 微生物学通报 , 2011, 38 (4) : 531–538. Chen L Y, Zhang G X, Huang C P, et al. Isolation, identification and enzymatic characteristics of cellulose-producing strains with high cellulase activity. Microbiology China , 2011, 38 (4) : 531–538. |
| [5] | 李红亚, 李术娜, 王树香, 等. 产芽孢木质素降解菌MN-8的筛选及其对木质素的降解. 中国农业科学 , 2014, 47 (2) : 324–333. LI H Y, LI S N, Wang S X, et al. Screening, identification of lignin-degradating Bacillus MN-8 and its characteristics in degradation of maize straw lignin. China Agriculture Science , 2014, 47 (2) : 324–333. |
| [6] | 高云航, 王巍, 勾长龙, 等. 响应面优化Bacillus licheniformis MX5产木质素过氧化物酶的发酵条件. 中国农业大学学报 , 2015, 20 (5) : 209–215. Gao Y H, Wang W, Gou C L, et al. Response surface optimization of fermentation conditions for lignin peroxidase by Bacillus licheniformis MX5. Journal of China Agricultural University , 2015, 20 (5) : 209–215. |
| [7] | Cho S, Moon H I, Hong G E. Biodegradation of capsaicin by Bacillus licheniformis SK1230. Journal of the Korean Society for Applied Biological Chemistry , 2014, 57 (3) : 335–339. DOI:10.1007/s13765-013-4277-0 |
| [8] | 山其木格, 包慧芳, 王炜, 等. 地衣芽孢杆菌WS-6β-葡聚糖酶的基因克隆及表达. 生物技术通报 , 2008 (6) : 135–138. Shan Q M G, Bao H F, Wang W, et al. Cloning of β-glucanase gene from Bacillus licheniformis WS-6 and expression. Biotechnology Bulletin , 2008 (6) : 135–138. |
| [9] | 田李, 刘娜, 徐荣旗, 等. 通过缺失大丽轮枝菌Vdku80构建其高效基因敲除受体菌株. 中国农业科学 , 2014, 47 (11) : 2142–2150. Tian L, Liu N, Xu R Q, et al. Construction of enhanced gene knockout frequency recipient strain by deletion of Vdku80 in Verticillium dahliae. China Agriculture Science , 2014, 47 (11) : 2142–2150. |
| [10] | 陈利飞, 李猛, 马春玲, 等. 克雷伯氏菌产1,3-丙二醇ldhA基因缺失菌株的构建. 生物技术通报 , 2015, 31 (3) : 121–126. Chen L F, Li M, Ma C L, et al. Construction a metabolic engineering strain to produce 1, 3-propanediol from Klebsiella pneumoniae by ldhA gene deletion mutation. Biotechnology Bulletin , 2015, 31 (3) : 121–126. |
| [11] | Yamamoto S, Izumiya H, Morita M, et al. Application of λRed recombination system to Vibrio choleraegenetics:simple methods for inactivation and modification of chromosomal genes. Gene , 2009, 438 (1-2) : 57–64. DOI:10.1016/j.gene.2009.02.015 |
| [12] | 王远, 高秋强, 辛秀娟, 等. β-葡萄糖苷酶基因和内切葡聚糖酶基因在枯草芽孢杆菌中的表达. 应用与环境生物学报 , 2013, 19 (6) : 990–996. Wang Y, Gao Q Q, Xin X J, et al. Expression of endoglucanase gene and β-glucosidase genes in Bacillus subtilis. Chin J Appl Environ Biol , 2013, 19 (6) : 990–996. DOI:10.3724/SP.J.1145.2013.00990 |
| [13] | Qiu D S, Liu X J, Wang J, et al. Artificial synthesis of TAT PTD-tachyplesin fusion gene by overlap extension PCR. Agricultural Biotechnology , 2013 (3) : 1–4. |
| [14] | Ho S N, Hunt H D, Horton R N, et al. Site-directedmutagenesis by overlap extension using the polymerase chain reaction. Gene , 1989, 77 (1) : 51–59. DOI:10.1016/0378-1119(89)90358-2 |
| [15] | 李瑞芳, 薛雯雯, 黄亮, 等. 枯草芽孢杆菌感受态细胞的制备及质粒转化方法研究. 生物技术通报 , 2011, 50 (5) : 227–230. Li R F, Xue W W, Huang L, et al. Competent preparation and plasmid transformation of Bacillus subtilis. Biotechnology Bulletin , 2011, 50 (5) : 227–230. |
| [16] | 温赛, 杨建国. 地衣芽孢杆菌原生质体电转化方法的研究. 中国生物工程杂志 , 2015, 35 (7) : 76–82. Wen S, Yang J G. Transformation of undomesticated strains of Bacillus licheniformis by protoplast electroporation. China Biotechnology , 2015, 35 (7) : 76–82. |
| [17] | 刘乐, 鞠美庭, 李维尊, 等. 纤维素降解细菌筛选及降解特性分析. 环境污染与防治 , 2012, 34 (4) : 40–43. Liu L, Ju M T, Li W Z, et al. Study on the screening of cellulose-degrading bacteria and the degradation characteristics. Environmental Pollution & Control , 2012, 34 (4) : 40–43. |
| [18] | 罗紫臣.纤维素酶的分泌表达及其在生物炼制中的应用[D].上海:华东理工大学, 2015. Luo Z C. Secretive Expression of Cellulose Enzyme and Its Application in Biorefinery Processes. Shanghai:East China University of Science and Technology, 2015. |
| [19] | Sakaguchi K, He J L, Tani S, et al. A targeted gene knockout method using a newly constructed temperature-sensitive plasmid mediated homologous recombination in Bifidobacterium longum. Applied Microbiology and Biotechnology , 2012, 95 (2) : 499–509. DOI:10.1007/s00253-012-4090-4 |
| [20] | Sung B H, Lee J H, Kim S C. Scarless chromosomal geneknockout methods. Methods Mol Biol , 2011, 765 (765) : 43–54. |
| [21] | VanVliet O P R, Faaij A P C, Turkenburg W C. Fischer-tropsch diesel production in a well-towheel perspective:a carbon, energy flow and cost analysis. Energy Convers Manage , 2009, 50 (4) : 855–876. DOI:10.1016/j.enconman.2009.01.008 |
| [22] | 张森翔, 尹小燕, 龚志伟, 等. 纤维素酶降解秸秆特性及其基因工程研究进展. 生物技术通报 , 2015, 31 (5) : 20–26. Zhang S X, Yin X Y, Gong Z W, et al. Advances in research of straw degradation with cellulase and Its genetic engineering. Biotechnology Bulletin , 2015, 31 (5) : 20–26. |
 2016, Vol. 36
2016, Vol. 36




