文章信息
- 钱建瑛, 许正宏, 窦文芳.
- QIAN Jian ying, XU Zheng hong, DOU Wen fang.
- 融合蛋白GGH粉针剂制备工艺研究
- Study on the Preparation Technology of Injectable Powder of Fusion Protein GGH
- 中国生物工程杂志, 2016, 36(11): 48-53
- China Biotechnology, 2016, 36(11): 48-53
- http://dx.doi.org/DOI:10.13523/j.cb.20161107
-
文章历史
- 收稿日期: 2016-07-21
- 修回日期: 2016-09-09
GGH是江南大学药学院制药工程实验室自行研制开发的创新药物,是胰高血糖素样多肽-1(GLP-1)突变串联体与人血清白蛋白的表达质粒pPIC9K/(GLP-1A2G)2-HSA在毕赤酵母KM71中表达的融合蛋白,用于治疗糖尿病。
GLP-1是由肠道L细胞合成和分泌的由30个氨基酸组成的多肽[1-2],体内外研究显示GLP-1具有增强葡萄糖依赖性的胰岛素分泌、减少食物的摄取、减慢胃的排空及抑制胰高血糖素的分泌、刺激胰β细胞增殖、促进胰岛再生及抑制胰β细胞的凋亡等功能,且无胰岛素和磺脲类降糖药物的低血糖危险[3-7]。GLP-1独特的降血糖作用机制,是现有抗糖尿病药物无可比拟的。但在体内其极易被二肽酰基肽酶Ⅳ(DPPⅣ)降解,限制了GLP-1药物化的进展[8]。
为提高GLP-1的长效性,江南大学药学院制药工程实验室利用PCR法克隆获得GLP-1及其突变体GLP-1A2G的基因,用生物信息学软件InsightII、ICM pro、Amber计算得出GLP-1的突变体GLP-1A2G与其突变体的串联体(GLP-1A2G)2的合理构象,利用重叠PCR技术,在体外成功拼接获得了(GLP-1A2G)2和HSA的融合基因(GGH),构建重组表达质粒pPIC9K-GGH,并将其通过电转化法转入毕赤酵母表达系统,诱导表达了GLP-1突变体和HSA的杂合分子[9]。因其属多肽类生物药物,口服会使生物活性破坏,只能通过皮下注射或静脉给药,结合该药物的特性,预将其制备成冻干粉针剂。本研究采用HPLC方法检测GGH的纯度,结合活性检测指标并将冻干粉针剂的成型性、溶解性等作为辅料筛选的依据,筛选了制备粉针剂的辅料和pH,进行了6个月的长期稳定性试验,取得了对同类研究有借鉴价值的实验结果。
1 材料与方法 1.1 药品与试剂重组胰高血糖素样多肽-1融合蛋白GGH(江南大学药学院制药工程实验室提供);cAMP检测试剂盒(R&D System公司);3-异丁基-1-甲基黄嘌呤(IBMX)、Ro-20-1724、DPBS缓冲液(不含Ca2+、Mg2+)(Sigma公司);RPMI1640培养液(含25mmol/L HEPES、L-谷氨酰胺)、胎牛血清(FBS)和胰蛋白酶(Gibco公司);台盼蓝染料、低分子质量标准蛋白(上海生工);大鼠β胰岛素瘤细胞系RIN m5f(购于ATCC);乙腈(色谱纯)、三氟乙酸(色谱纯)、氯化钠、葡萄糖、甘露醇、山梨醇等其他试剂均为分析纯(国药集团化学试剂有限公司)。
1.2 仪器与耗材高效液相色谱仪Ultimate 3000(戴安公司);色谱柱(DELTA PAK C18,5μ,300Å,3.9×150mm)(Waters公司);电子天平EL204、pH计320、水分测定仪(梅特勒公司);低温离心机(艾本德公司);全功能细胞振荡培养箱(Infors HT公司);二氧化碳培养箱(Thermo Forma公司);冻干机(Labconco公司);培养皿、12孔板(Greiner公司)。
1.3 方法 1.3.1 高效液相色谱检测融合蛋白GGH含量的方法色谱柱:Waters DELTA PAK C18,5μ,300Å,3.9×150mm;流动相:A为乙腈,B为含0.1%TFA的纯水。梯度洗脱20min:B,90%→40%;流速,1ml/min;检测波长,280nm;进样量,10μl。
1.3.2 融合蛋白GGH含量检测的方法学考察线性:取融合蛋白GGH 100mg,精密称定,置10ml容量瓶中,加纯水溶解并稀释至刻度,摇匀,得母液。精密量取0.2ml、0.4ml、0.6ml、0.8ml、1.0ml、1.2ml分别置于10ml容量瓶中,用纯水稀释至刻度,摇匀。分别用0.45μm滤膜过滤后,按1.3.1 高效液相检测方法操作,记录色谱图,以进样浓度C对峰面积A做线性回归。
精密度:准确量取融合蛋白GGH母液1.0ml于10ml容量瓶中,用纯水稀释至刻度,摇匀,0.45μm滤膜过滤后即为精密度供试品溶液,按1.3.1高效液相检测方法操作,重复进样6次,记录色谱图,按峰面积计算RSD。
稳定性:取精密度供试品溶液,室温放置0h、2h、4h、6h、8h,分别用0.45μm滤膜过滤后按1.3.1高效液相检测方法操作,记录色谱图,按峰面积计算RSD。
回收率:取空白辅料用纯水溶解,加入融合蛋白GGH母液适量,配制高、中、低3个浓度(1.2mg/ml、0.8mg/ml、0.4mg/ml)的溶液各3份作为供试品溶液,分别用0.45μm滤膜过滤后按1.3.1高效液相检测方法操作,记录色谱图,按峰面积计算平均回收率和RSD。
1.3.3 活性检测方法[10]用融合蛋白GGH原液或冻干粉针剂溶解后的溶液刺激大鼠β胰岛素瘤细胞RIN m5f后,100nmol/L IBMX作为cAMP保护剂、DPBS作为药物稀释剂,采用液氮-100℃反复冻融2次裂解细胞,再用酶联免疫法测定cAMP含量用以表征活性。
1.3.4 pH对融合蛋白GGH稳定性的影响考察用磷酸盐配制成终浓度为20mmol/L的缓冲液,分别调节pH为4.0、5.0、6.0、7.0、8.0,加入1mg/ml的GGH原液,37℃恒温放置24h,每间隔4h取样用HPLC检测纯度。
1.3.5 不同种类填充剂对粉针剂剂成型及稳定性的影响考察根据冻干粉针剂质量筛选4种常用填充剂。分别准确称取氯化钠、葡萄糖、甘露醇、山梨醇适量,配成浓度为4%的水溶液,用磷酸盐调节pH,然后分别配制成浓度为100mg/ml的GGH溶液,分装1ml/瓶,冷冻干燥。观察冻干品外观及成型性,测定含水量及复溶速率。
复溶速率的测定[11]:用注射器向冻干粉针剂西林瓶中快速注入5ml蒸馏水,让液体贴瓶壁流下,以减小水流冲击的搅拌作用,然后上下反复颠倒(1次/s),摇至粉末完全溶解,秒表记录从液体加入到完全溶解的时间,以此复溶时间的长短来表征冻干粉针剂的复溶性。
1.3.6 不同用量填充剂对融合蛋白GGH粉针剂成型及稳定性的影响考察准确称取甘露醇适量,配成浓度为1%、2%、3%、4%、5%的水溶液,用磷酸盐调节pH,然后分别配制成浓度为100mg/ml的GGH溶液,分装1ml/瓶,冷冻干燥。观察冻干品外观及成型性,测定复溶速率及活性保留率。活性测量方法参照1.3.3 ,按式(1)计算活性保留率。
 |
(1) |
按照筛选后的工艺条件制备三批样品(编号091001、091002、091003)GGH粉针剂,分别取150mg,精密称定,置100ml容量瓶中,加纯水溶解并稀释至刻度作为供试溶液,按1.3.1 高效液相色谱法操作,记录峰面积,按1.3.2线性考察项下标准曲线计算三批样品中GGH的含量,计算含量百分比。
1.3.8 粉针剂长期稳定性试验方法取三批样品(编号091001、091002、091003),西林瓶密封包装,置冷藏柜中(2~8℃),分别在0月、3月、6月取样测定与0月数据进行比较。考察项目及测定
方法性状、溶液澄清度与颜色考察采用目测法;含量检测参照1.3.7 三批样品含量检测方法,按式(2)计算;按1.3.3进行活性检测,按式(3)计算。
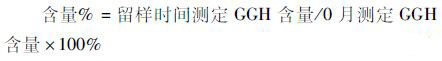 |
(2) |
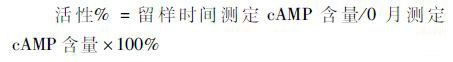 |
(3) |
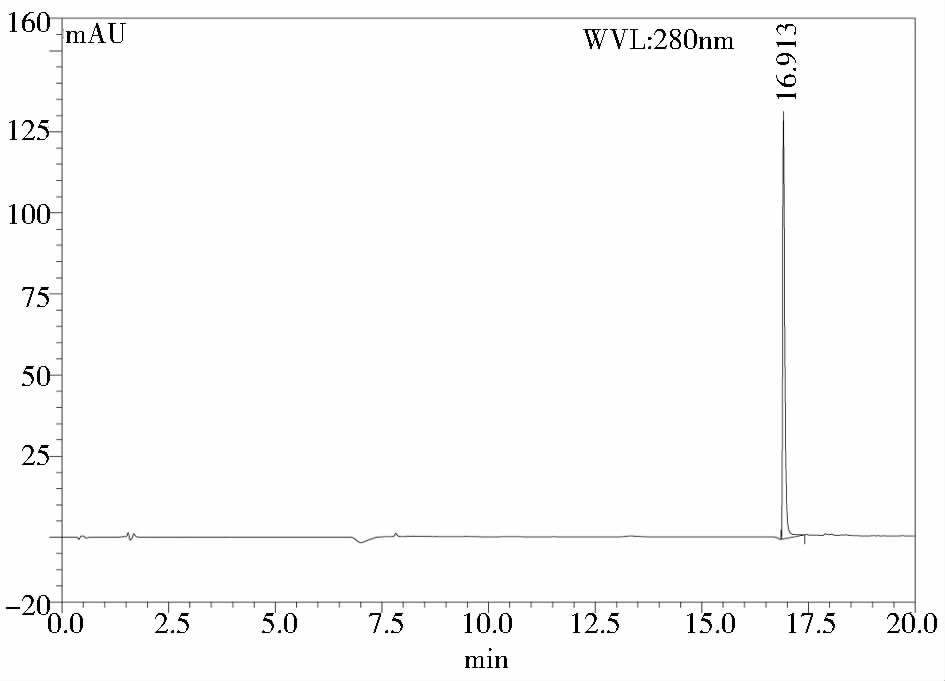
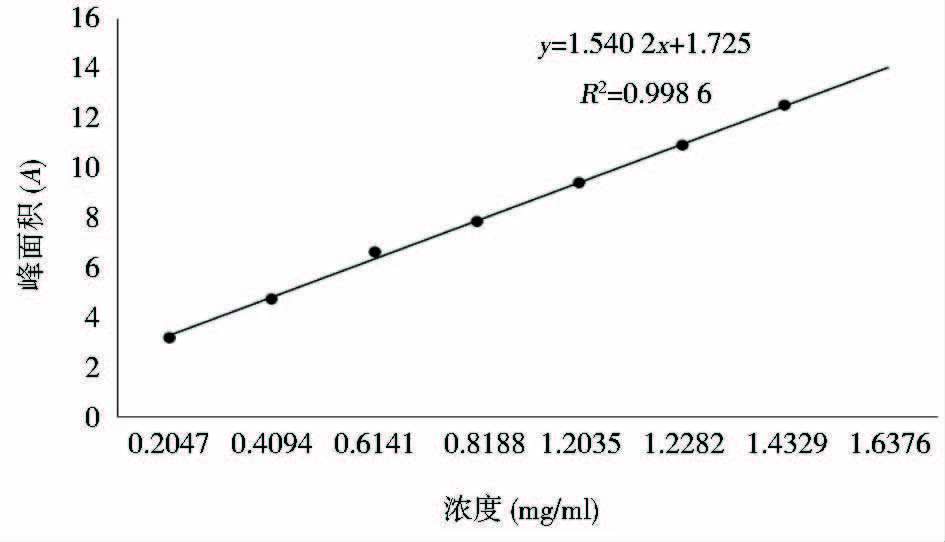
GGH的高效液相色谱图见图 1,浓度与对应峰面积数据、标准曲线方程见图 2。结果表明,GGH在0.2~1.6mg/ml浓度范围内线性关系良好,线性方程y=1.540 2x+1.725(R2=0.998 6)。
|
| 图 1 GGH高效液相色谱图 Figure 1 The chromatograph of GGH by HPLC |
|
| 图 2 GGH标准曲线 Figure 2 Standard curve of GGH |
峰面积、RSD见表 1。结果表明样品峰面积RSD<2%,符合分析要求。
| No. | 1 | 2 | 3 | 4 | 5 | 6 |
| 峰面积 | 7.858 | 7.87 | 7.867 | 7.84 | 7.87 | 7.847 |
| 含量(mg/ml) | 1.0205 | 1.0221 | 1.0217 | 1.0181 | 1.0221 | 1.0191 |
| RSD(%) | 0.17 | |||||
2.1.3 稳定性考察结果
0、2h、4h、6h、8h的分析结果见表 2。结果表明,样品溶液在8h内稳定,检测数据可靠。
| 时间(h) | 0 | 2 | 4 | 6 | 8 |
| 峰面积 | 7.858 | 7.876 | 7.679 | 7.843 | 7.87 |
| 含量(mg/ml) | 1.020 5 | 1.022 9 | 0.996 8 | 1.018 5 | 1.022 1 |
| RSD(%) | 1.08 | ||||
2.1.4 回收率考察结果
回收率结果见表 3,结果表明,该方法回收率为98.37%~101.63%,符合分析要求,辅料对测定无干扰。
| 加入量 (mg/ml) | 测得量 (mg/ml) | 回收率 (%) | 平均回收率 (%) | RSD (%) |
| 0.415 9 | 0.423 1 | 101.731 2 | 101.63 | 1.5 |
| 0.428 8 | 103.101 7 | |||
| 0.416 1 | 100.048 1 | |||
| 0.831 8 | 0.837 7 | 100.709 3 | 100.57 | 0.75 |
| 0.842 1 | 101.238 3 | |||
| 0.829 7 | 99.7475 4 | |||
| 1.247 7 | 1.2171 | 97.547 49 | 98.37 | 0.8 |
| 1.228 4 | 98.453 15 | |||
| 1.236 6 | 99.110 36 |
2.2 pH对GGH稳定性的影响
溶液pH对蛋白质的影响是首要因素之一,针对某一范围内pH对蛋白质影响的研究工作已有很多,蛋白质的稳定性、可溶性和pH的关系通常遵守某些规律,如pH离蛋白质等电点越远,蛋白质溶解性越好,物理稳定性越高,化学稳定性越差;相反pH越接近蛋白质等电点,蛋白质越难溶解,导致物理稳定性的降低却提高了化学稳定性[12]。GGH的等电点为5.2,从图 3可以看出纯度随pH变化的结果。结果表明,从纯度来看,确实pH接近等电点时其稳定性更高,pH5~6时稳定性最佳,因此确定将冻干前配制的GGH水溶液pH调为5.5,兼顾其物理稳定性和化学稳定性。
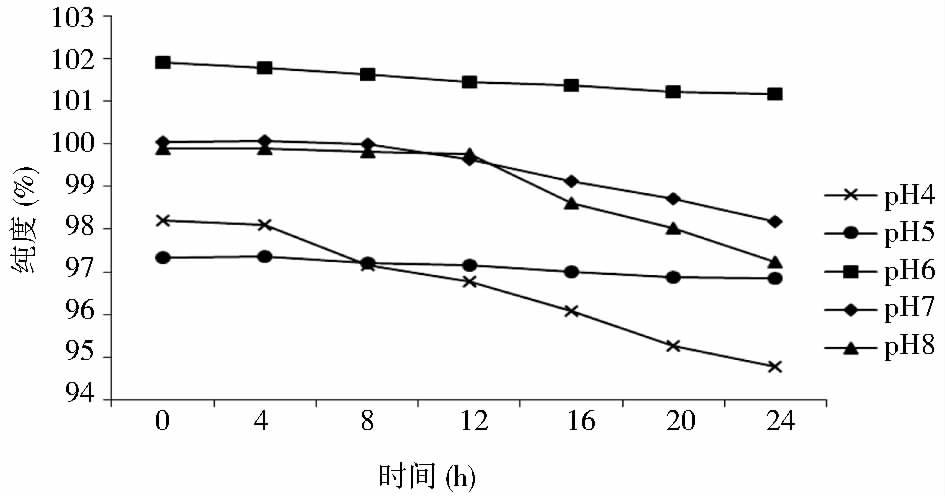
|
| 图 3 pH对GGH溶液稳定性的影响 Figure 3 Effects of pH on the stability of GGH solution |
适当的填充剂可以使制剂易于冻干并能保持较好的外形和机械强度。目前冻干粉针剂常添加氯化钠、葡萄糖、甘露醇、山梨醇等填充剂,以改善产品的外观,使产品的外形饱满、疏松而易溶、含水量较低等。对冻干品的含水量、成型性、外观、色泽、溶解性等指标进行考察的结果见表 4。辅料对含水量影响不大,而成型性甘露醇的效果最好,冻干后结晶均匀、疏松,基本可保持原液体积;氯化钠萎缩成团,形成较粗大结晶;葡萄糖和山梨醇冻干后固体不能维持原液体积;且后三者的溶解性较甘露醇差,故最终选择甘露醇为本品的填充剂。
| 填充剂 | 外观 | 含水量 (%) | 成型性 | 复溶性 |
| 甘露醇 | 白色块状 | 3.54 | 好,基本保持原液体积 | 好 |
| 氯化钠 | 白色粉末 | 3.50 | 差,萎缩成团 | 较好 |
| 葡萄糖 | 白色块状 | 3.72 | 较好,体积有缩小 | 较好 |
| 山梨醇 | 白色块状 | 3.61 | 较好,体积有缩小 | 较好 |
2.4 填充剂用量
由于冻干填充剂的用量会对粉针剂的外观和复溶产生影响,因此对适宜的填充剂用量进行考察。填充剂加入量对粉针剂质量的影响见表 5。用量太低时,粉针剂外观结构松散,呈粉末状,个别有皱缩或呈网状、膜状,活性保留率也较低。4%甘露醇冻干品外观、复溶情况和活性保留均较好,因此确定选用4%甘露醇作为GGH粉针剂的填充剂。
| 填充剂用量(%) | 外观 | 成型性 | 机械强度 | 复溶情况 | 活性保留率(%) |
| 1 | 底部萎缩,僵块 | 较差 | 较差 | 50s,溶液无色澄明 | 64.5 |
| 2 | 白色块状 | 较差 | 较差 | 40s,溶液无色澄明 | 78.28 |
| 3 | 饱满疏松白色块状 | 好 | 好 | 30s,溶液无色澄明 | 87.91 |
| 4 | 饱满疏松白色块状 | 好 | 好 | 30s,溶液无色澄明 | 99.84 |
| 5 | 边缘有裂纹 | 较好 | 较好 | 30s,溶液无色澄明 | 89.11 |
因融合蛋白GGH分子中杂合有白蛋白,可以对GLP-1突变体起到稳定和保护的作用,因此不再额外添加保护剂。根据以上结果确定GGH冻干粉针剂的制剂处方为:甘露醇4g,注射用水加至100ml,调pH 5.5,加入GGH 10g,溶解混匀后1ml/瓶分装,冷冻干燥约36h,自动压盖,无菌封口。分别制备三批次产品091001、091002、091003各100支,待检测。
2.5 三批样品含量测定结果按1.3.7 含量测定方法检测GGH冻干粉针剂样品,结果见表 6。
| 批号 | 091001 | 091002 | 091003 |
| 含量(%) | 97.68 | 101.29 | 97.46 |
2.6 三批样品长期稳定性考察结果
三批样品在2~8℃冷藏柜中放置6个月后,基本性质见表 7,不管是外观性状,还是含量、活性,都较为稳定。
| 样品 | 时间(月) | 性状 | 溶液澄清度与颜色 | 含量(%) | 活性(%) |
| 0 | 白色疏松块状 | 澄清无色 | 97.96 | # | |
| 91001 | 3 | 白色疏松块状 | 澄清无色 | 97.53 | 99.9 |
| 6 | 白色疏松块状 | 澄清无色 | 97.65 | 99.8 | |
| 0 | 白色疏松块状 | 澄清无色 | 101.28 | # | |
| 91002 | 3 | 白色疏松块状 | 澄清无色 | 101.33 | 99.9 |
| 6 | 白色疏松块状 | 澄清无色 | 101.25 | 99.9 | |
| 0 | 白色疏松块状 | 澄清无色 | 97.4 | # | |
| 91003 | 3 | 白色疏松块状 | 澄清无色 | 97.36 | 99.8 |
| 6 | 白色疏松块状 | 澄清无色 | 97.21 | 99.7 |
3 讨论
多肽药物大多比活高、稳定性差,制剂一般都采用原液加入适当的赋形剂分装冻干成注射用粉针剂。一般选用优质原液,采用多种含量测定的方法进行赋值,然后再用这批原液作为含测的对照品,以HPLC标准曲线为冻干制剂进行赋值[13]。本文采用GGH原液测定并绘制工作曲线,用于冻干粉针剂辅料的筛选和三批样品的含量测定,方法学考察表示该方法可行,并对制剂工艺进行了初步探讨,确定使用4%的甘露醇作为冻干粉针剂的填充剂,pH为5.5时GGH较为稳定。
徐岩[14]在对干扰素α2b-29肽融合蛋白制剂处方筛选时,通过对外观、成型性、复溶时间、活性保留的比较,选择2%的甘露醇作为冻干支架剂效果最好,同时添加表面活性剂吐温80可以阻止蛋白质降解和活性降低;于忠喜[15]对重组人生长激素冻干配方进行筛选时,也发现添加表面活性剂能够对复溶性和蛋白质稳定性有帮助,他选择的表面活性剂是泊洛沙姆188,配合3%甘露醇、2%海藻糖、2%甘氨酸作为冻干粉针的填充剂;然而罗文[16]在对重组白介素-2的冻干粉针制备时发现,添加表面活性剂吐温80反而促进了主药的降解,因此筛选出的处方为添加2.3%的甘氨酸,能保持主药在6个月内的稳定;田洪斌[17]对艾塞那肽冻干粉针进行了处方研究,筛选出1%的甘露醇作为冻干支架剂。甘露醇作为填充剂,对冻干粉针的外形、水分、复溶性及稳定性的作用基本得到一致的肯定,根据本研究的筛选结果,也是选用甘露醇作为填充剂,调整预冻液pH,三批样品6个月留样观察稳定性良好,说明使用该方法制备的冻干粉针剂性质稳定,为申报新药提供了参考。
| [1] | Hui H, Zhao X, Perfetti R. Structure and function studies of glucagon-like peptide-1(GLP-1):the designing of a novel pharmacological agent for the treatment of diabetes. Diabetes Metab Res Rev , 2005, 21 (2) : 313–331. |
| [2] | Drucker D J. Minireview:the glucagon-like peptides. Endocrinology , 2001, 142 (2) : 521–527. DOI:10.1210/endo.142.2.7983 |
| [3] | Kreymann B, Williams G, Ghatei M A, et al. Glucagon-like peptide-17-36:a physiological incretin in man. Lancet , 1987, 2 (8571) : 1300–1303. |
| [4] | Vahl T P, Paty B W, Fuller B D, et al. Effects of GLP-1-(7-36)NH2, GLP-1-(7-37), and GLP-1-(9-36)NH2 on intravenous glucose tolerance and glucose-induced insulin secretion in healthy humans. Clin Endocrinol Metab , 2003, 88 (4) : 1772–1779. DOI:10.1210/jc.2002-021479 |
| [5] | Turton M D, O'Shea D, Gunn I, et al. A role for glucagon-like peptide-1 in the central regulation of feeding. Nature , 1996, 379 (6560) : 69–72. DOI:10.1038/379069a0 |
| [6] | Deacon C F, Wamberg S, Bie P, et al. Preservation of active incretin hormones by inhibition of dipeptidyl peptidase IV suppresses meal-induced incretin secretion in dogs. J Endocrinol , 2002, 172 (2) : 355–362. DOI:10.1677/joe.0.1720355 |
| [7] | Pospisilik J A, Stafford S G, Demuth H U, et al. Long-term treatment with the dipeptidyl peptidase IV inhibitor P32/98 causes sustained improvements in glucose tolerance, insulin sensitivity, hyperinsulinemia, and beta-cell glucoseresponsi-veness in VDF (fa/fa) Zucker rats. Diabetes , 2002, 51 (4) : 943–950. DOI:10.2337/diabetes.51.4.943 |
| [8] | Deacon C F, Johnsen A H, Holst J J. Degradation of glucagon-like peptide-1 by human plasma in vitro yields an N-terminally truncated peptide that is a major endogenous metabolite in vivo. J Clin Endocrinol Metab , 1995, 80 (3) : 952–957. |
| [9] | 窦文芳. 长效融合蛋白GGH的构建、表达、纯化及其初步药效学和药代动力学. 无锡:江南大学,生物工程学院 , 2010 : 1–59. Dou W F. Construction, Expression and Purification of the Long-term Fusion Protein GGH and Its Preliminary Pharmacodynamic and Pharmacokinetics. Wuxi:Jiangnan University,School of Biotechnolog , 2010 : 1–59. |
| [10] | 耿燕, 任怡琳, 许正宏, 等. 基于胞内cAMP浓度测定融合蛋白GGH活性的改良方法. 中国生物工程杂志 , 2013, 33 (11) : 63–67. Geng Y, Ren Y L, Xu Z H, et al. An improved method to measure bioactivity of the fusion protein GGH based on the intracellular cAMP level. China Biotechnology , 2013, 33 (11) : 63–67. |
| [11] | 胡雄伟, 宋洪涛. 核黄素磷酸钠粉针剂处方及制备工艺研究. 解放军药学学报 , 2011, 27 (4) : 314–317. Hu XW, Song H T. A study on the formulation and preparation technology of riboflavin sodium phosphate injectable powder. Pham J Chin PLA , 2011, 27 (4) : 314–317. |
| [12] | 那伊, 阿凯尔斯. 蛋白质药物——开发与生产. 北京: 化学工业出版社, 2006 : 35 -37. Nail S L, Akers M J. Development and Manufacture of Protein Pharmaceuticals. Beijing: Chemical Industry Press, 2006 : 35 -37. |
| [13] | 丁晓丽, 张金亮, 张慧, 等. 重组胰高血糖素样肽-1受体激动剂(rExendin-4)原液质量研究. 中国新药杂志 , 2015, 2 (12) : 1358–1363. Ding X L, Zhang J L, Zhang H, et al. Study on the quality of bulk solution of recombinant pancreatic glucagon-like peptide-1 receptor agonist(rExendin-4). Chinese Journal of New Drugs , 2015, 2 (12) : 1358–1363. |
| [14] | 徐岩. 干扰素α2b-29肽融合蛋白的制剂处方筛选及稳定性研究. 哈尔滨:东北农业大学,生命学院 , 2013 : 18–20. Xu Y. Formulation and Stability Study of Interferon α2b-endothelial Inhibitory Peptide Fusion Protein. Ha'erbin:Northeast Agricultural University, College of Life Science , 2013 : 18–20. |
| [15] | 于忠喜. 重组人生长激素冻干配方筛选和稳定性研究. 长春:吉林大学,生命科学学院 , 2012 : 34–43. Yu Z X. Screening and Stability Study of Freeze-drying Formula for Recombinant Human Growth Hormone. Changchun:Jilin University,College of Life Science , 2012 : 34–43. |
| [16] | 罗文. rIL2-HSA融合蛋白注射剂型的开发研究. 无锡:江南大学,药学院 , 2012 : 48–49. Luo W. Research on Injection Formulation of the Fusion Protein of rIL2-HSA. Wuxi:Jiangnan University,School of Pharmaceutical Sciences , 2012 : 48–49. |
| [17] | 田洪斌. 注射用艾塞那肽冻干粉针剂的研究. 长春:吉林大学,生命科学学院 , 2008 : 33–36. Tian H B. The Study on Exenatide Freeze-dried Powder for Injection. Changchun:Jilin University,College of Life Science , 2008 : 33–36. |
 2016, Vol. 36
2016, Vol. 36




