文章信息
- 王浩, 张敬书, 丁健, 罗洪镇, 陈锐, 史仲平.
- WANG Hao, ZHANG Jing-shu, DING Jian, LUO Hong-zhen, CHEN Rui, SHI Zhong-ping.
- 限制葡萄糖、葡萄糖/乙酸双底物条件下自由控制丙丁梭菌ABE发酵丙酮浓度和丙酮/丁醇比
- Control of Acetone Concentration and Acetone/Butanol Ratio in ABE Fermentation by C. acetobutylicum with a Novel Glucose/Acetate Co-substrate System Incorporating Glucose Limitation
- 中国生物工程杂志, 2016, 36(10): 60-71
- CHINA BIOTECHNOLOGY, 2016, 36(10): 60-71
- http://dx.doi.org/DOI:10.13523/j.cb.20161009
-
文章历史
- 收稿日期: 2016-04-18
- 修回日期: 2016-05-03
2. 石家庄制药集团有限公司 石家庄 050038
2. China Shijiazhuang Pharmaceutical Group Company Limited, Shijiazhuang 050035, China
丁醇和丙酮都是重要的平台化合物,在化工、塑料、医药、有机合成、涂料和印染等行业具有广泛用途[1]。生物丁醇是一种极具潜力、清洁可再生的新型液态燃料,可作为化石燃料的替代品;而丙酮则是优良的柴油助燃剂,它可以提高柴油的燃烧性能、减少有害气体(NOX、SOX等)的排放,环境效益明显[2-4]。丙酮-丁醇-乙醇发酵也称为ABE发酵,其主产品是丁醇,丙酮是主要副产品,发酵产物中丁醇/丙酮/乙醇的摩尔比率大约为6:3:1(质量比约为67:26:7)。目前,人们更为看中丁醇发酵生产,几乎所有研究都集中于高效生产丁醇、抑制丙酮合成,增加丁醇在总溶剂中所占有的比率(等同于降低丙酮/丁醇比),提高原料对丁醇转化率等方面[5-7]。
2014年,我国丙酮消费量达130万吨,年增加率逾10%。目前,由于没有专一性发酵生产丙酮的微生物菌株[8],丙酮基本上(83%以上)依靠不可再生的化石原料合成生产,其可持续发展和碳排放存在很大问题。ABE发酵可以生产少量丙酮,多年来,丙酮生物合成并不受重视。其原因在于:(1)发酵浓度太低(一般只有5 6 g/L);(2)与主产品(丁醇)抢夺发酵原料、降低原料目标转化率。但是,即便丙酮浓度很低,它毕竟也是一个副产品,不能简单地抛弃,其产量仍旧要统计到ABE发酵原料利用报表中。目前,发酵法生产丙酮仍利用传统梭菌菌种(丙丁梭菌、拜氏梭菌等)进行,生产效率低[9]。生命周期评价(life cycle assessment,LCA)法是一种对多重产品生产过程进行经济评价的有效方法。它通过对某一过程产品多样性、产品价格、温室气体排放以及生产原料的物性和能量特征进行评估,找出过程经济性、环境效益和产品多样性的最佳切入点,从而实现生产过程性能的整体最优。有研究报道指出,ABE发酵的LCA和经济性依赖于将丙酮作为重要平台化合物和高效清洁燃料添加剂的评价[10-11]。实际上,侧重LCA的ABE发酵等同于同时强化丙酮和丁醇的合成、同时最大可能地提高丙酮/丁醇质量比。另外,丁醇和丙酮的市场价格往往会有较大幅度的波动,据日本石油化学工业协会(JPCA, http://www.jpca.or.jp/4stat/02stat/y1seisan.htm)公布的数据显示,2012年丁醇和丙酮的价格分别为$1 200/t和$3 000/t,丙酮价格几乎是丁醇价格的2.5倍[12]。因此,侧重丙酮合成的ABE发酵在经济上也非常重要。
传统丙丁梭菌实际上也具备高产丙酮的能力。由于ABE发酵存在严重的丁醇产物抑制,一旦传统分批式ABE发酵开始,丁醇浓度迅速上升,在较短时间内(30~40 h)达到抑制浓度,丙丁梭菌产丙酮能力无法得到体现。一般情况下,最终丁醇浓度和丙酮浓度停留在11~13 g/L和5~6 g/L。现在,丁醇和丙酮生物合成的主流依旧是分批发酵。丙丁梭菌代谢葡萄糖进行ABE发酵的一个最主要特征是:合成主产品丁醇需要还原力烟酰胺腺嘌呤二核苷酸(NADH)的参与,而合成丙酮则不需要。上述差异理论上为优化控制丙酮浓度和丙酮/丁醇比提供了前提条件和可能性。因此,从以下几个方面对ABE发酵过程实施调控来提高生物丙酮产量、提高或控制丙酮/丁醇比:(1)通过环境胁迫,强化丙丁梭菌对于高丁醇浓度的耐受能力[13-15];(2)通过适度降低梭菌胞内NADH再生速度,改变梭菌胞内碳代谢流分配,使较多的碳流走向丙酮合成途径,降低细胞的能量供给压力,使得ABE发酵以高效NADH再生模式运转[15];(3)由于NADH全部来自糖酵解途径和与其相关联的电子穿梭往复系统,控制发酵体系还原糖(葡萄糖)浓度于低水平,弱化梭菌糖酵解主路的碳代谢速度,进而限制NADH生成,为高丙酮/丁醇比率形成创造条件;(4)外添乙酸作为共同碳源,维持胞内乙酸浓度于较高水平,提高催化丙酮合成的辅酶A转移酶(CoAT)的活性[16],进而强化ABE整体代谢网络中的丙酮合成途径。
针对尚无专一性发酵生产丙酮的微生物菌株,丙酮基本上完全依靠不可再生的、化石原料合成生产,其可持续发展和碳排放存在问题的现状,结合LCA的评价方法,提出了可以提高和自由控制丙丁梭菌ABE发酵丙酮浓度和丙酮/丁醇比的方法。针对玉米原料、传统ABE发酵中丙酮/丁醇质量比低(约0.5)、丁醇产物抑制严重等问题,通过调控玉米培养基的初始葡萄糖浓度,结合使用丙丁梭菌/酿酒酵母混菌发酵体系和外添乙酸的操作策略,形成双底物(葡萄糖/乙酸)ABE发酵环境,试图提高和自由控制ABE发酵的丙酮浓度和丙酮/丁醇比,且维持甚至提高总溶剂浓度和丁醇浓度。
1 材料与方法 1.1 菌种丙酮丁醇梭菌(Clostridium acetobutylicum ATCC 824),本研究室保藏。酿酒酵母,购自安琪酵母股份有限公司。
1.2 培养基及制备方法丙酮丁醇梭菌活化培养基和玉米发酵培养基制备方法同前期研究报道[17]。酿酒酵母培养基(g/L):葡萄糖20,酵母提取物8.5,(NH4)2SO4 1.3,MgSO4·7H2O 0.1,CaCl2·2H2O 0.06。
1.3 培养方法 1.3.1 菌种活化方法丙酮丁醇梭菌和酿酒酵母活化方法同前期研究报道[18]。
1.3.2 酿酒酵母培养在5 L通气发酵罐中获取活性酿酒酵母培养液。发酵温度30℃,pH维持在6.0~6.2。培养开始15 h,葡萄糖耗尽后,利用DO-Stat法流加500 g/L高浓度葡萄糖溶液。向ABE发酵液添加活性酿酒酵母时,培养液OD600达到90~100、折合细胞干重20.0~22.5 g/L,pH为5.5~6.0,培养液中乙醇和葡萄糖浓度基本为0 g/L。
1.3.3 ABE发酵发酵培养基为15%(w/v)玉米粉双酶水解液。制备方法:第一步在95℃环境下加入高温淀粉酶,添加量为8 U/g淀粉,液化45 min。第二步将第一步水解得到的酶解液冷却至50~62℃,在50~62℃下添加糖化酶,两步水解结束所得到的玉米酶解液即为ABE发酵培养基。通过调节糖化酶用量、糖化温度和时间,控制培养基初始葡萄糖浓度于期望水平。糖化酶用量、糖化温度和时间与培养基初始葡萄糖浓度之间的对应关系为:糖化酶用量120 U/g淀粉,温度62℃,反应时间60 min,初始葡萄糖浓度60 g/L;用量60 U/g淀粉,温度55℃,反应时间50 min,初始葡萄糖浓度35 g/L;用量60 U/g淀粉,温度50℃,反应时间40 min,初始葡萄糖浓度20 g/L。ABE发酵在7 L静态厌氧罐中进行,装料量3.5 L。接种前,向发酵罐持续通氮气20~30 min。发酵温度37℃,初始pH 6.0,种子液接入量为10%(v/v)。接种后继续通入氮气,将罐内压力调节至0.04 MPa后停止通气。发酵过程中,通过调节通气阀的开度将罐内压力维持在0.04~0.05 MPa范围内。
在ABE发酵过程中,初次乙酸溶液和初次酵母培养液添加时间为丙丁梭菌进入产溶剂期5 h以后(大约20~24 h),表征为产酸期积累的乙酸和丁酸被逐步消耗,pH探底后逐渐上升0.3。初次乙酸添加量为4.0 g/L,pH调为5.0加入,之后每5 h加入1.5 g/L乙酸(pH 4.0),初次酵母培养液添加量约为1%(v/v,相当于接入约0.20~0.25 g-DCW/L-broth活性酵母),之后按需要加入酵母培养液,每次添加量为0.5%。
1.4 分析方法发酵过程中pH、产气量、葡萄糖、发酵液中有机酸和溶剂浓度等发酵参数的测定方法同前期研究报道[18]。糖化酶酶活按照标准手册GB8276-2006的方法测定。发酵参数取三次测定的平均值。
2 结果与讨论 2.1 葡萄糖充足条件下,外添乙酸和丙丁梭菌/酿酒酵母混合培养耦联外添乙酸体系提高ABE发酵性能如图 1所示,丙丁梭菌代谢葡萄糖进行ABE发酵的一个最主要特征是:合成主产品丁醇需要还原力NADH,而合成丙酮则不需要。前期研究[15]发现,在葡萄糖充足条件下,添加4 g/L-broth少量乙酸(发酵批次#5,表 1)进行ABE发酵,与传统发酵(对照,发酵批次#1)比较,批次#5梭菌胞内NADH合成速度可降低约50%,进而营造出有利于丙酮合成的低还原力环境。丙丁梭菌利用少量外添乙酸、改变胞内环境条件,可以使较多的葡萄糖走向丙酮合成途径。发酵50 h结束时,丙酮浓度、丁醇浓度和丙酮/丁醇质量比分别达到7.34 g/L、12.18 g/L和0.60,比对照分别提高了25%、5%和20%。为了进一步提高ABE发酵性能,将混菌体系与少量外添乙酸相耦联,迫使酵母大量分泌释放有利于丙丁梭菌生存和丁醇合成的芳香族氨基酸(苯丙氨酸/酪氨酸)和天冬氨酸族氨基酸(赖氨酸/蛋氨酸)[19-20],提高丙丁梭菌对高丁醇浓度的耐受能力。与此同时,ABE发酵较低的NADH合成速度也不受影响[15]。
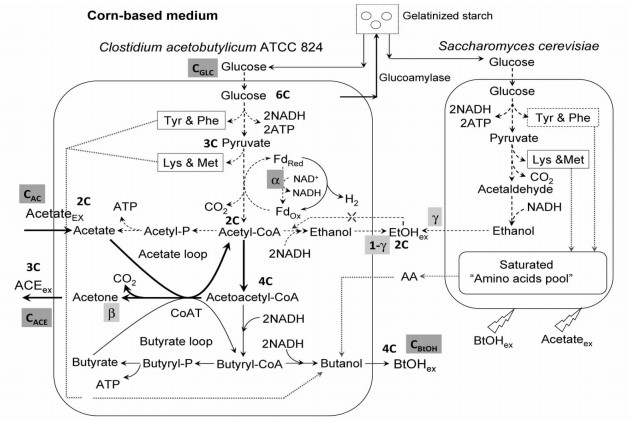
|
| 图 1 丙丁梭菌/酿酒酵母混合培养耦联外添乙酸体系的代谢 Figure 1 Simplified metabolic network map indicating C. acetobutylicum and S. cerevisiae metabolisms |
| Culture mode | Run # | Acetone (g/L) |
Butanol (g/L) |
Ethanol (g/L) |
A/B ratio (-) |
A/ABEratio (-) |
ABE (g/L) |
ABE prod (g/L/h) |
Time (h) |
| Control, G0=60g/L | #1 | 5.86 | 11.63 | 1.28 | 0.50 | 0.312 | 18.77 | 0.289 | 65 |
| Control, G0=20g/L | #2 | 4.25 | 7.67 | 0.77 | 0.55 | 0.335 | 12.69 | 0.254 | 50 |
| Co-culture, G0=60g/L | #3 | 5.36 | 11.91 | 8.42 | 0.45 | 0.209 | 25.69 | 0.485 | 53 |
| Co-culture, G0=20g/L | #4 | 5.23 | 9.53 | 3.85 | 0.55 | 0.281 | 18.61 | 0.332 | 56 |
| Acetate addition, G0=60g/L | #5 | 7.34 | 12.18 | 1.72 | 0.60 | 0.346 | 21.24 | 0.425 | 50 |
| Acetate addition, G0=25g/L | #6 | 9.15 | 11.84 | 1.84 | 0.77 | 0.401 | 22.83 | 0.457 | 50 |
| Co-culture+acetate, G0=60g/L | #7 | 8.27 | 13.91 | 3.40 | 0.59 | 0.323 | 25.58 | 0.465 | 55 |
| Co-culture+acetate, G0=36g/L | #8 | 9.28 | 13.44 | 3.96 | 0.69 | 0.348 | 26.68 | 0.513 | 52 |
| Co-culture+acetate, G0=20g/L | #9 | 10.38 | 11.44 | 3.06 | 0.91 | 0.417 | 24.88 | 0.478 | 52 |
| Co-culture+acetate, G0=20g/L | #10 | 11.74 | 11.46 | 3.73 | 1.02 | 0.436 | 26.93 | 0.421 | 64 |
| G0: Initial glucose concentration; A/B, A/ABE and ABE: acetone/butanol ratio, acetone/total-solvents ratio and total solvents concentration (g/L); ABE prod.: Total solvents productivity (g/L/h) | |||||||||
2.2 葡萄糖浓度受限条件下ABE发酵的机制和特征
丁醇合成需要还原力NADH的参与,在NADH充足条件下,丁醇迅速积累,达到抑制浓度,丙丁梭菌丙酮合成能力还没有得到充分发挥,发酵就已经结束。由于NADH全部来源于糖酵解途径和与其相关联的电子穿梭往复系统,外添乙酸既可以降低NADH再生速度、又可以作为ABE发酵底物,所以限制NADH和丁醇合成速度的途径有两个:(1)外添乙酸;(2)控制葡萄糖浓度于低水平。
丙丁梭菌具有分泌淀粉酶和糖化酶的复杂酶系。梭菌首先利用培养基中原有的葡萄糖,当葡萄糖浓度降至接近于0 g/L后,梭菌可以分泌释放糖化酶、分解寡糖,将葡萄糖控制在低浓度,维持丙丁梭菌正常的碳代谢和能量代谢。发酵批次#2中,将玉米培养基中初始葡萄糖浓度调制到20 g/L。ABE发酵后期(约30 h),葡萄糖耗尽后,梭菌自动释放糖化酶水解培养基中的寡糖,可以将葡萄糖浓度控制在低水平(0~4 g/L)。如图 2所示,由于葡萄糖受限,又没有其他碳源可以替代使用,ABE发酵不完全。50 h发酵结束时,丙酮和丁醇浓度只能达到4.25 g/L和7.67 g/L的低水平。但是,与对照相比,丙酮/丁醇比却略有提高、达到0.55(对照,0.50)。这里,需要指出的是,在葡萄糖受限条件下,梭菌为了自身生存,维持正常的碳代谢和能量代谢,其糖化酶的分泌释放能力得到了诱导和强化,与对照和其他高初始葡萄糖浓度的发酵体系相比,糖化酶酶活几乎提高了1~2倍(图 2d)。
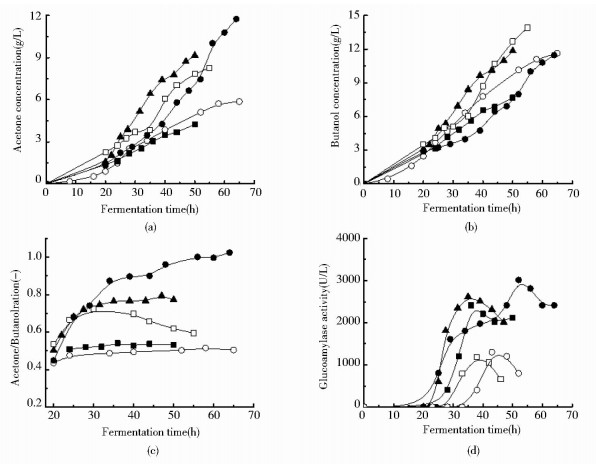
|
| 图 2 不同发酵批次下,丙酮和丁醇浓度、丙酮/丁醇比、糖化酶活力的变化 Figure 2 Change patterns of acetone and butanol concentrations, acetone/ butanol ratios and glucoamylase activity with different ABE fermentation strategies ○: Traditional fermentation, G0=60 g/L, run #1 (control); ■: Traditional fermentation, G0=20 g/L, run #2; ▲: Fermentation with acetate addition, G0=25 g/L, run #6; □:Fermentation with the co-culturing system and acetate addition, G0=60 g/L, run #7; ●: Fermentation with the co-culturing system and acetate addition, G0=20 g/L, run #10 |
初始葡萄糖浓度控制在20~25 g/L的低水平,ABE发酵约25 h时,葡萄糖全部耗尽,但丁醇浓度只有4~5 g/L,远未达到抑制浓度(11~13 g/L)。如图 2d和图 3a所示,梭菌分泌糖化酶,将葡萄糖浓度控制在低水平(0~4 g/L),限制糖酵解途径碳代谢速度(图 3c)和NADH生成速度。葡萄糖处于低水平,能够维持梭菌正常的生理代谢和合成丙酮所需要的Acetoacetyl-CoA,此时,添入乙酸,可以形成葡萄糖/乙酸双底物体系。发酵批次#6中,玉米培养基初始葡萄糖浓度为25g/L。发酵21h时,一次性添加乙酸4g/L(pH 5.0)。之后,约5 h间歇式添加1.5 g/L(pH 4.0)乙酸溶液,乙酸总添加量为10 g/L。50 h发酵结束时,丙酮和丁醇浓度、丙酮/丁醇质量比分别达到9.15 g/L、11.84 g/L和0.77的较高水平,比对照分别提高了56%、2%和54%。发酵批次#10中,玉米培养基中初始葡萄糖浓度为20g/L。发酵24h时,一次性添加乙酸4g/L(pH5.0)和1%(v/v)的酿酒酵母。之后,约5 h间歇式添加1.5g/L(pH 4.0)乙酸溶液,乙酸总添加量为13.0g/L。如图 3a所示,由于活性酿酒酵母利用葡萄糖的能力较强,如果残留葡萄糖浓度超过2.0 g/L,继续添加0.5%(v/v)酿酒酵母培养液,将葡萄糖浓度严格控制在0.0~2.0 g/L的极低水平,强化丙酮合成。64 h发酵结束时,丙酮浓度和丙酮/丁醇比分别达到11.74 g/L和1.02的最高水平,丁醇浓度也达到了11.46 g/L的较高水平。两个发酵批次中,外添乙酸基本耗尽,残留乙酸浓度停留在2.0~4.0 g/L的较低水平。
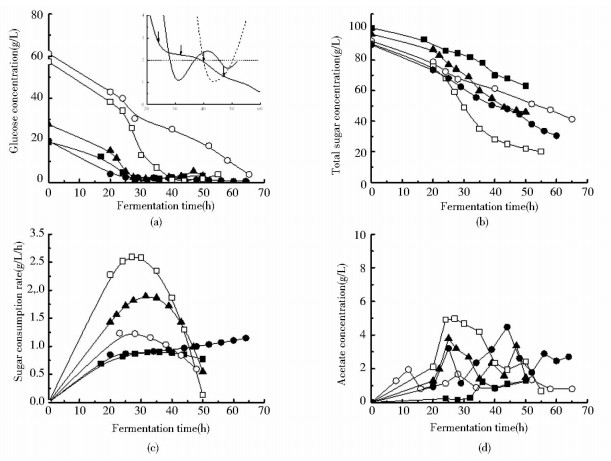
|
| 图 3 不同发酵批次下葡萄糖、总糖、乙酸浓度以及总糖消耗速度变化 Figure 3 Change patterns of glucose, total sugar and acetate concentrations, and sugar consumption rates with different ABE fermentation strategies ○: Traditional fermentation, G0=60 g/L, run #1 (control); ■: Traditional fermentation, G0=20 g/L, run #2; ▲: Fermentation with acetate addition, G0=25 g/L, run #6; □:Fermentation with the co-culturing system and acetate addition, G0=60 g/L, run #7; ●: Fermentation with the co-culturing system and acetate addition, G0=20 g/L, run #10. Condensed small figure inside (a): glucose concentrations variations during 20h~60 h for runs #7 (┄), #9 (─) and #10 (━). →: S. cerevisiae additions |
具体而言,各个可操作因子的主要功能如下:(1)限制培养基中初始葡萄糖浓度和发酵过程中葡萄糖浓度可以限制梭菌胞内糖酵解途径的碳代谢速度和NADH合成速度,间接限制丁醇的合成速度;(2)添加乙酸提高了催化丙酮合成的辅酶A转移酶(CoAT)活性,以乙酸为第二碳源,强化丙酮合成;(3)在ABE发酵中,引入酵母混菌培养体系的主要作用在于以下两点:由于酿酒酵母在高丁醇浓度环境下,胞内翻译过程中的真核起始因子2B(eIF2B)被强烈地抑制,细胞中的氨基酸池(Amino acid pools)处于饱和状态,胞内的氨基酸会释放到胞外、其中的一些游离氨基酸是有利于梭菌细胞生长和丁醇合成的“有益”氨基酸(赖氨酸、蛋氨酸、苯丙氨酸和酪氨酸)[21]。更加重要的是,在丁醇和乙酸浓度较高、存在活性酵母的环境下,发酵体系分泌的“有益”氨基酸主要来自于丙丁梭菌,表明上述“有益”氨基酸在丙丁梭菌胞内得到有效的积累,进而增强了梭菌抵御高丁醇浓度恶劣环境的能力。ABE发酵的最主要特征就是,丁醇合成需要NADH的参与,而丙酮合成则不需要。丙丁梭菌胞内的NADH合成速率与梭菌代谢主路中糖酵解速率正相关,限制梭菌代谢主路中糖酵解速率可以弱化丁醇合成途径的代谢强度,使更多的碳流走向丙酮合成途径、提高丙酮浓度和丙酮/丁醇比。引入酵母混菌培养体系,即便在37℃、严格厌氧、丁醇和乙酸浓度较高的条件下,酿酒酵母为了自我生存、仍可以优先利用发酵液中的游离葡萄糖,将发酵液中的残留葡萄糖浓度维持在0~2 g/L的极低水平,有效限制了梭菌代谢主路中的糖酵解速率,进而实现强化丙酮合成和丙酮/丁醇比的目标。因此,限制葡萄糖浓度、使用葡萄糖/乙酸双底物的发酵调控策略可以在丁醇浓度基本不变或略有提高的前提下,将ABE发酵的丙酮/丁醇比自由控制在0.5~1.0的范围内。
2.4 葡萄糖/乙酸双底物ABE发酵下的碳/能量代谢和最大丙酮/丁醇比的理论分析在外添乙酸和活性酿酒酵母条件下,假定梭菌的葡萄糖和乙酸消耗量分别为CGLC和CAC,丁醇、丙酮和乙醇的生成量分别为CBtOH、CACE和CEtOH(均为摩尔基准)。根据图 1,NADH合成由糖酵解主路和电子穿梭传递系统两部分构成:总NADH产生量:Glucose→2 Acetyl-CoA + 2 CO2 + 2 (1+α) NADH(摩尔基准)。α是电子穿梭传递系统中NADH的产生比率(0≤α≤1)。α=0,电子全部用于合成H2;α=1,电子全部用于合成NADH。在丙丁梭菌代谢中,无论丁醇来源于葡萄糖还是外添乙酸,生成1 mol丁醇需要消耗4 mol的NADH;生成1 mol乙醇需要消耗2 mol的NADH。NADH能量平衡式为CBtOH×4+CEtOH×(1-γ)×2=CGLC×2(1+α),则:
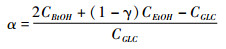 |
(1) |
这里,γ是酿酒酵母对乙醇合成量的贡献率(0≤γ≤1,图 1)。根据前期研究结果[15],单纯丙丁梭菌ABE发酵,γ=0;单纯丙丁梭菌/酿酒酵母共混ABE发酵,γ≈0.8;丙丁梭菌/酿酒酵母共混+乙酸外添ABE发酵,酿酒酵母合成乙醇能力受到抑制,γ≈0.4。在无乙酸外添的条件下,理论上,如果α=1(NADH最大)且合成的NADH可全部用于丁醇合成,1 mol葡萄糖最多可生成1 mol丁醇,丁醇的碳摩尔得率为0.67(质量基准43%)[22]。酿酒酵母不能利用乙酸,但是,计算CGLC时,必须要扣除酿酒酵母所消耗的葡萄糖。混菌培养过程中,酵母代谢葡萄糖时,1 mol葡萄糖生成2 mol乙醇。CAC则等于乙酸的总添加量减去发酵结束时的乙酸残留量。
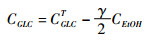 |
(2) |
这里,CGLCT是葡萄糖的总消耗量。从葡萄糖到乙酰辅酶A(Acetyl-CoA)的糖酵解反应为:Glucose→2 Acetyl-CoA + 2 CO2。按照图 1,外添乙酸全部进入到Acetyl-CoA代谢节点,在该节点处,总碳流(碳流总量)为CGLC×2/3+CAC,因为1 mol葡萄糖已经脱去了2 mol的CO2。单纯由乙酸向丙酮转化的反应为:1)Acetate + Acetoacetyl-CoA→Acetyl-CoA + Acetoacetate;2)Acetoacetate→Acetone + CO2;3)2 Acetyl-CoA→Acetoacetyl-CoA。总反应式为:Acetate + Acetyl-CoA→Acetone + CO2。因为Acetyl-CoA由来于乙酸,所以,在乙酰乙酰辅酶A(Acetoacetyl-CoA处)节点处,最多有CGLC×2/3+2 CAC的总碳流(总碳量)可向丙酮转化。另外,总碳流分配还必须与还原力NADH供求相匹配,由于丙酮合成不需要NADH参与,按照碳流和NADH的匹配要求,此时有(1-α)/2的总碳走向丙酮合成途径,而余下的(1+α)/2的总碳走向丁醇合成途径。假定在该节点由来自于外添乙酸的碳流走向丙酮合成途径的比例为β (摩尔基准),则走向丙酮合成的总碳(流)为(1-α)/2×(CGLC×2/3 +β×2CAC),亦即β与CGLC、CACE、CAC间存在以下关系:
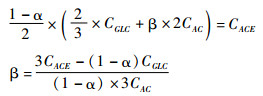 |
(3) |
这样,混菌培养耦联乙酸外添的ABE发酵体系可以按照上述碳和NADH平衡的原则,通过改变培养基配制条件和发酵环境条件,自由调节α和β的比例。其中,α是根据NADH的平衡计算得到的,而β则是根据葡萄糖、丙酮、乙酸之间的碳摩尔平衡以及α值计算得到的。不同操作条件下,电子穿梭传递系统对NADH的贡献率α变化不大,基本在0.1~0.2的范围内徘徊(表 2)。使用化学合成乙酸时,无论其填加量多少,β也大致在0.72~0.89的范围内波动(表 2,发酵批次#8是个例外),表明外添的乙酸绝大部分可以转化为丙酮,这就是丙酮浓度和丙酮/丁醇比率得以提高的直接原因。Gao等[23]通过添加少量13C标记乙酸(4 g/L)进行ABE发酵,实验分析外添乙酸条件下的碳代谢走向,结果发现约1/3的外添乙酸走向丙酮合成(相当于β=0.33),丙酮和丁醇产量均有提高,丙酮/丁醇比率提高了27%,但远低于批次#10的提高幅度(最大增幅超过100%)。上述差异可能是使用菌株和操作条件不同所致。
| Culture mode | Run # | Total sugar consumed (g/L) |
GLCCA (g/L) |
Acetate consumed (g/L) |
α | 1-γ | β |
| Control, G0=60g/L | #1 | 51.30 | 51.30 | 0.00 | 0.20 | 1.0 | 0.00 |
| Control, G0=20g/L | #2 | 38.00 | 38.00 | 0.00 | 0.06 | 1.0 | 0.00 |
| Co-culture, G0=60g/L | #3 | 71.30 | 57.00 | 0.00 | 0.13 | 0.2 | 0.00 |
| Co-culture, G0=20g/L | #4 | 50.00 | 43.97 | 0.00 | 0.12 | 0.2 | 0.00 |
| Acetate addition, G0=60g/L | #5 | 57.50 | 57.50 | 2.84 | 0.15 | 1.0 | 0.89 |
| Acetate addition, G0=25g/L | #6 | 51.00 | 51.00 | 8.52 | 0.27 | 1.0 | 0.86 |
| Co-culture+acetate, G0=60g/L | #7 | 70.40 | 66.50 | 3.32 | 0.14 | 0.6 | 0.76 |
| Co-culture+acetate, G0=36g/L | #8 | 68.00 | 64.90 | 8.46 | 0.15 | 0.6 | 0.48 |
| Co-culture+acetate, G0=20g/L | #9 | 55.50 | 53.10 | 10.08 | 0.18 | 0.6 | 0.72 |
| Co-culture+acetate, G0=20g/L | #10 | 59.50 | 56.58 | 10.29 | 0.14 | 0.6 | 0.76 |
| GLCCA: Glucose consumption amount by C. acetobutylicum | |||||||
理论上,丁醇的生成量CBtOH*、丙酮的生成量CACE*与CGLC和CAC间存在式4的关系(摩尔基准):
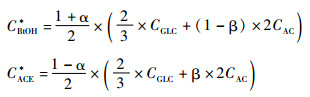 |
(4) |
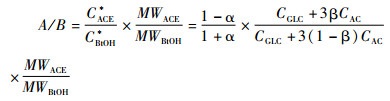 |
(5) |
其中MWACE、MWBtOH表示丙酮和丁醇相对分子质量,CBtOH*和CACE*分别为理论丁醇和丙酮浓度(摩尔基准)。根据式5,不同α和β、不同乙酸/葡萄糖消耗比条件下的理论丙酮/丁醇质量比(A/B比)如图 4所示。实际数据表明,α、β和CAC/CGLC(质量基准)在0.0≤α≤0.30,0.5≤β≤1.0,0≤CAC/CGLC≤0.2的区间范围内,因此,我们重点分析了该区域内乙酸/葡萄糖消耗比与理论丙酮/丁醇比之间的关系。在所有添加乙酸的发酵批次(#5~#10)中,梭菌的葡萄糖消耗量在50~70 g/L之间,故将基准葡萄糖消耗量G设定在60 g/L。图 4a结果显示,在α固定的条件下,β越大则A/B比越大。当α=0.15、β=0.8时,乙酸/葡萄糖消耗比等于0.2时,A/B比可以达到1.04,这与实际数据A/B比等于1.02基本吻合(发酵批次#10,CAC/CGLC=0.18,α=0.14,β=0.76)。因为不同操作条件基本不影响α(α=0.1~0.2),如果外添乙酸有70%~80%(β=0.7~0.8)可以转化成为丙酮,理论丙酮/丁醇比最大也只能达到1.0左右。如果β=0.5~0.6或者更低,即便提高乙酸/葡萄糖消耗比率也无法继续提升A/B比,模拟结果表明,此时A/B比将停留在0.58的水平不变,这与实验数据也是基本相符的。
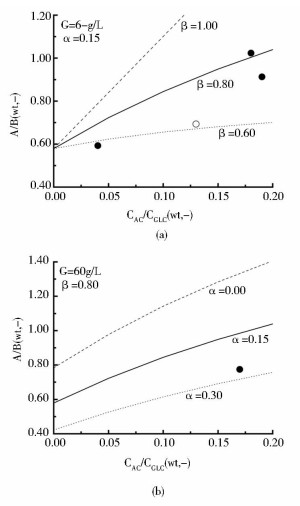
|
| 图 4 不同α和β条件下,乙酸/葡萄糖消耗比与丙酮/丁醇比率之间的关系 Figure 4 The relationships of acetate/glucose consumption ratio and acetone/butanol ratio at different α and β ●: β≈0.7~0.8, α≈ 0.1~0.2 or β≈0.8, α≈0.3; ○:β≈ 0.3~0.5, α≈0.1~0.2 |
减少电子穿梭传递系统中NADH的产生比率α,是提高A/B比的另一要素。模拟结果(图 4b)显示,当α=0.0、β=0.8时,最大A/B比可以达到1.41。前期研究[15]表明,与对照(发酵批次#1,表 2)相比,外添少量乙酸(批次#5和#7)确实可以降低发酵还原力(α,0.20→0.14~0.15,表 2)。但是,继续提高乙酸/葡萄糖消耗比率无法进一步降低α(表 2),A/B比也无法进一步得到提高。如图 1所示,理论上,有一个方法可以进一步提高A/B比:ABE发酵进入到溶剂生产期,梭菌细胞得到合成积累,可以迅速地将碳源从葡萄糖切换到乙酸,因为乙酸代谢不产生任何NADH,可以合成丙酮而不合成丁醇(β=1.0)。为此,我们做了以下尝试:将发酵培养基中的玉米粉含量从15%(w/v)降低到5%(总糖浓度约30 g/L),同时将初始葡萄糖浓度控制在20 g/L左右。其目的在于,试图在总糖消耗殆尽后,以外添乙酸作为唯一碳源进行ABE发酵,发酵在34 h结束,丙酮和丁醇浓度为2.6 g/L和4.5 g/L,丙酮/丁醇比0.58。此时,由于NADH无法生成,外添乙酸必须全部走丙酮合成路径,理论上可100%向丙酮转化。但是,这种操作方式破坏了丙丁梭菌的能量(ATP)和碳代谢模式:(1)厌氧发酵中ATP主要来源于乙酸和丁酸代谢闭环回路。ATP不参与代谢产物合成,但必须用来维持细胞代谢[24]。总糖消耗殆尽后,NADH无法合成;外添乙酸破坏了乙酸代谢闭环,乙酸也无法进入丁酸代谢闭环,最终导致ATP无法生成、细胞正常的能量代谢无法维持,梭菌细胞迅速死亡、溶剂生产彻底停止。(2)根据丙丁梭菌的代谢途径(图 1),外添乙酸需要耦联Acetoacetyl-CoA来合成丙酮前体物质乙酰乙酸(Acetoacetate)以及Acetyl-CoA。但是,在主代谢途径Acetyl-CoA→Acetoacetyl-CoA中,合成1 mol Acetoacetyl-CoA需要2 mol的Acetyl-CoA,因此,总糖耗尽,糖酵解途径完全截断后,中间代谢物质Acetoacetyl-CoA入不敷出,乙酸合成丙酮的途径也无法走通。所以,以乙酸为唯一碳源来进行丙酮生物合成的方法是不可行的。丙酮浓度12 g/L、丙酮/丁醇比1.0似乎就是利用丙丁梭菌生产丙酮的最高极限。
2.5 可行性和经济前景表 1和表 2总结归纳了共10批次的整体发酵性能。利用限制初始葡萄糖、葡萄糖/乙酸双底物的发酵策略可以大幅度提高丙酮浓度和丙酮/丁醇比,其目的在于,增加ABE发酵产品的多样性和利用生物质原料生产丙酮。在ABE发酵工业中,原料成本一般占总成本的70%[4]。2012年化学合成乙酸价格只有$500/t [12]。在工业领域利用煤焦化生产过程的主要副产物水煤气(主要成分是CO)合成工业乙酸时(乙酸含量在95%以上),其市场价格仅为$480/t(¥1 800~¥3 000/t,山东金沂蒙集团有限公司)。因此,利用乙酸作为发酵原料进行ABE发酵在经济上具有可行性。
图 5总结了利用化学合成乙酸策略下ABE总溶剂、丙酮和丁醇毛利润,在批次#10中,乙酸价格$800/t是ABE总溶剂取得利润的临界点,由于较高的丙酮/丁醇比,乙酸价格从$0~$1 300/t,丙酮利润一直高于对照而丁醇低于对照。这里,我们没有采用日本石油化学工业协会的数据,而是将丙酮和丁醇的价格分别设定在$1 600/t和$1 800/t这样一种较为公认的水平。假设乙酸价格为$500/t,总溶剂和丙酮利润提高20%和68%(run #10),假设化学合成乙酸$1 200/t(http://detail.1688.com/offer/521031233142.html,分析纯),直接导致了使用化学合成乙酸进行ABE发酵总溶剂利润降低22%(run #10),由于该策略较高的丙酮/丁醇比(1.02,run #10),即使较高的乙酸价格$1 200/t,丙酮利润也提高8%。由于化石燃料价格的不稳定,尤其是丙酮作为主要需求产物,价格反超丁醇时,ABE发酵的经济效益将更加显著。另外,我国食醋(乙酸5%~10%,v/v)销售市场鱼目混珠、假冒伪劣产品充斥市场。充分利用下架的劣质食醋($100/t,收集和运输成本)作为ABE发酵的第二底物,ABE总利润提高43%,丙酮利润提高100%。10%的操作成本和20%的产物蒸馏成本也是两个重要的指标[4],而ABE总溶剂浓度的增加(18.77g/L→26.93g/L)(run #10)可以抵消一定的蒸馏成本。
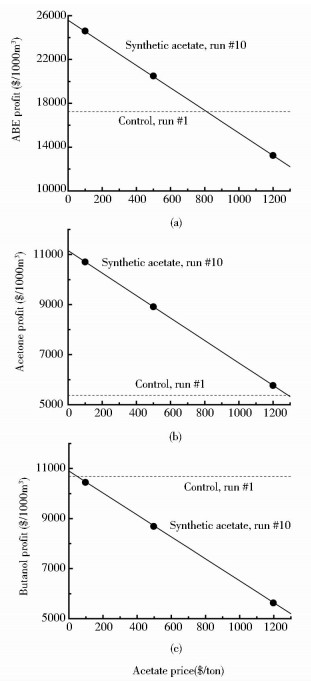
|
| 图 5 限制葡萄糖,外添乙酸策略下,ABE发酵的经济性评估 Figure 5 The economical feasibility of ABE fermentations with the proposed strategy of consecutive acetate addition and glucose limitation The standard unit prices ($/ton) of acetone/butanol were set at $1 600/$1 800, the prices of ethanol, corn-starch and acetate were set at $600, $300 and $500/$1 200, respectively. In the cases of using counterfeit vinegar collected in black markets, a price of $100/ton was applied for collection/transportation charges |
酿酒酵母培养是好氧过程,但与ABE发酵相比,酵母细胞浓度高(20~30 g-DCW/L),投放量少、投放总量为0.2~0.3 g-DCW/L-ABE-Broth,总投放体积仅占ABE发酵液体积的1/100。另外,酵母生长速度快,只要酵母培养与ABE发酵同步进行,在取出并使用部分酵母培养液、重新向酵母发酵罐添加新鲜培养基后,酵母浓度可在短时间内恢复到原有水平。因此,酵母培养罐体积可以控制得很小(ABE发酵罐体积的1%左右),酵母培养的原料成本、操作成本和设备投资可以基本忽略。因此,将酿酒酵母培养体系引入到ABE发酵过程中具有实际操作的可行性。生物能源的生产过程通常是一个厌氧发酵过程。在使用化学合成乙酸、特别是乙酸投放量较大的条件下,整个ABE发酵体系虽然不是一个完整的生物质原料利用体系,但却是一个近乎100%的准厌氧发酵的体系(忽略酵母培养的好氧操作成本和设备投资)。在化学合成乙酸的价格低廉($500/t)、且丙酮价格较高的前提下,本文所提出的限制葡萄糖浓度、葡萄糖/乙酸双底物体系提高丙丁梭菌ABE发酵中丙酮浓度和丙酮/丁醇比的调控策略具有较高的经济效益。另外,可以利用发酵法合成ABE的底物(之一)-乙酸,而乙酸的发酵底物是乙醇,绝大部分利用生物质原料生产,酿酒酵母培养的主要原料(碳源)是葡萄糖。因此,混菌培养同时外添乙酸发酵上清液的ABE发酵是一个不折不扣、完整的生物质原料利用体系。但是,乙酸发酵是好氧发酵,因此,上述ABE发酵体系又是一个半厌氧的发酵过程(厌氧兼好氧)。本研究室对此也开展了相关实验和研究[15]。混菌培养同时外添乙酸时,只要丁醇浓度没有达到抑制水平,就可以不断地向ABE发酵液添加乙酸溶液(或其发酵上清液),以强化丙酮和总溶剂的合成,乙酸和淀粉(葡萄糖)的用量比可以达到接近20%的较高水平。但是,乙酸发酵周期长(80 h)、乙酸生产速率低、发酵上清液中的乙酸浓度只有75~80 g/L,折算成纯乙酸量后的乙酸发酵上清液添加体积可以高达ABE发酵液体积的约15%。因此,乙酸投放量大时,所提出的混菌培养同时外添乙酸发酵上清液的ABE发酵体系,需要另外添加一个体积相当于ABE发酵罐体积15%~20%左右的罐体进行好氧型乙酸发酵。整体ABE发酵体系设备投资大、操作成本高,经济效益下降,并不适合生物能源的生产和制造。最后,在经济性评估时,我们忽略了以下成本:(1)ABE发酵的运行成本(耗电、劳动力费用等);(2)酵母培养成本(少量的原料成本、耗电、通气和劳动力费用等)。
3 结论提出了一种可以自由控制和提高丙丁梭菌ABE发酵丙酮/丁醇比率和丙酮浓度的方法。以玉米粉为发酵原料,通过调控玉米培养基的初始葡萄糖浓度于适当低的水平,在丙丁梭菌产溶剂期,按照需要添加适量乙酸溶液和活性酿酒酵母,形成丙丁梭菌/酿酒酵母混合培养和葡萄糖/乙酸双底物体系。调控玉米培养基初始葡萄糖至20 g/L,在丙丁梭菌产溶剂期,多次间歇式添加总量10~13 g/L乙酸溶液和活性酿酒酵母培养液时,可以同时将乙酸和葡萄糖浓度控制在较高(≥3 g/L)和极低(0.0~1.5 g/L)的水平,丙酮/丁醇比和丙酮浓度可以达到1.02和11.74 g/L,丙酮占总溶剂的比例也可从传统发酵(对照)的31%提高到44%,提高幅度达42%。丙酮/丁醇比和丙酮浓度两项指标是利用野生丙丁梭菌进行ABE分批发酵相关研究报道的最高水平,为实现利用生物质原料替代化石原料合成丙酮、自由调控ABE发酵的丙酮/丁醇比、实现ABE发酵产品的多样化提供参考,对侧重于LCA指标的ABE发酵具有重要指导意义。另外,该ABE发酵优化控制策略还大幅降低了调制培养基时的糖化酶用量、缩短或降低了糖化时间或温度,对降低ABE发酵操作成本有利。
致谢 作者感谢江南大学111项目(#111-2-06)和中央研究院基本科研项目(#JUSRP51504)的资助。| [1] | 顾阳, 蒋宇, 吴辉, 等. 生物丁醇制造技术现状和展望. 生物工程学报 , 2010, 26 (7) : 914–923. Gu Y, Jiang Y, Wu H, et al. Current status and prospects of biobutanol manufacturing technology. Chinese Journal of Biotechnology , 2010, 26 (7) : 914–923. |
| [2] | Wu H, Nithyanandan K, Zhang J, et al. Impacts of acetone-butanol-ethanol (ABE) ratio on spray and combustion characteristics of ABE-diesel blends. Applied Energy , 2015, 149 : 367–378. DOI:10.1016/j.apenergy.2014.11.053 |
| [3] | Wu H, Nithyanandan K, Zhou N, et al. Impacts of acetone on the spray combustion of acetone-butanol-ethanol (ABE)-diesel blends under low ambient temperature. Fuel , 2015, 142 : 109–116. DOI:10.1016/j.fuel.2014.10.009 |
| [4] | Xue C, Zhao X Q, Liu C G, et al. Prospective and development of butanol as an advanced biofuel. Biotechnology Advances , 2013, 31 (8) : 1575–1584. DOI:10.1016/j.biotechadv.2013.08.004 |
| [5] | Jang Y S, Lee J Y, Lee J, et al. Enhanced butanol production obtained by reinforcing the direct butanol-forming route in Clostridium acetobutylicum. MBio , 2012, 3 (5) : e00314–12. |
| [6] | Jiang Y, Xu C, Dong F, et al. Disruption of the acetoacetate decarboxylase gene in solvent-producing Clostridium acetobutylicum increases the butanol ratio. Metabolic Engineering , 2009, 11 (4) : 284–291. |
| [7] | Wang S, Zhu Y, Zhang Y, et al. Controlling the oxidoreduction potential of the culture of Clostridium acetobutylicum leads to an earlier initiation of solventogenesis, thus increasing solvent productivity. Applied Microbiology and Biotechnology , 2012, 93 (3) : 1021–1030. DOI:10.1007/s00253-011-3570-2 |
| [8] | Zhou J, Zhang H, Zhang Y, et al. Designing and creating a modularized synthetic pathway in cyanobacterium Synechocystis enables production of acetone from carbon dioxide. Metabolic Engineering , 2012, 14 (4) : 394–400. DOI:10.1016/j.ymben.2012.03.005 |
| [9] | Ezejt T, Milne C, Price N D, et al. Achievements and perspectives to overcome the poor solvent resistance in acetone and butanol-producing microorganisms. Applied Microbiology and Biotechnology , 2010, 85 (6) : 1697–1712. DOI:10.1007/s00253-009-2390-0 |
| [10] | Köhler K A, Rühl J, Blank L M, et al. Integration of biocatalyst and process engineering for sustainable and efficient n-butanol production. Engineering in Life Sciences , 2015, 15 (1) : 4–19. DOI:10.1002/elsc.v15.1 |
| [11] | Wu M, Wang M, Liu J H, et al. Life-cycle Assessment of Corn-based Butanol as a Potential Transportation Fuel. Illinois: Argonne National Laboratory, Argonne, 2007 : 1 -39. |
| [12] | Gao M, Tashiro Y, Wang Q H, et al. High acetone-butanol-ethanol production in pH-stat co-feeding of acetate and glucose. Journal of Bioscience and Bioengineering , 2016 . DOI:10.1016/j.jbiosc.2016.01.013 |
| [13] | Luo H Z, Ge L B, Zhang J S, et al. Enhancing butanol production under the stress environments of co-culturing Clostridium acetobutylicum/Saccharomyces cerevisiae integrated with exogenous butyrate addition. PLoS One , 2015, 10 (10) : e0141160. DOI:10.1371/journal.pone.0141160 |
| [14] | 毛绍名, 章怀云. 丙酮丁醇梭菌丁醇耐受性. 中国生物工程杂志 , 2012, 32 (9) : 118–124. Mao S M, Zhang H Y. The advance of research on the butanol tolerance of Clostridium acetobutylicun. China Biotechnology , 2012, 32 (9) : 118–124. |
| [15] | Luo H Z, Ge L B, Zhang J S, et al. Enhancing acetone biosynthesis and acetone-butanol-ethanol fermentation performance by co-culturing Clostridium acetobutylicum/Saccharomyces cerevisiae integrated with exogenous acetate addition. Bioresource Technology , 2016, 200 : 111–120. DOI:10.1016/j.biortech.2015.09.116 |
| [16] | Chen C K, Blaschek H P. Effect of acetate on molecular and physiological aspects of Clostridium beijerinckii NCIMB 8052 solvent production and strain degeneration. Applied and Environmental Microbiology , 1999, 65 (2) : 499–505. |
| [17] | Li X, Li Z, Zhang J, et al. Yeast extract promotes phase shift of bio-butanol fermentation by Clostridium acetobutylicum ATCC824 using cassava as substrate. Bioresource Technology , 2012, 125 : 43–51. DOI:10.1016/j.biortech.2012.08.056 |
| [18] | 李志刚. 基于代谢网络的线图理论提高丙酮-丁醇-乙醇发酵丁醇产量和比率的研究 , 2014 . Li Z G. Improving butanol concentration and butanol/acetone ratio in acetone-butanol-ethanol fermentation by metabolic network based graph theory , 2014 . |
| [19] | Heluane H, Evans M R, Dagher S F, et al. Meta-analysis and functional validation of nutritional requirements of solventogenic Clostridia growing under butanol stress conditions and coutilization of D-glucose and D-xylose. Applied and Environmental Microbiology , 2011, 77 (13) : 4473–4485. DOI:10.1128/AEM.00116-11 |
| [20] | Masion E, Amine J, Marczak R. Influence of amino acid supplements on the metabolism of Clostridium acetobutylicum. FEMS Microbiology Letters , 1987, 43 (3) : 269–274. DOI:10.1111/fml.1987.43.issue-3 |
| [21] | Ashe M P, Slaven J W, Long S K, et al. A novel eIF2B-dependent mechanism of translational control in yeast as a response to fusel alcohols. EMBO Journal , 2001, 20 (22) : 6464–6474. DOI:10.1093/emboj/20.22.6464 |
| [22] | Tashiro Y, Shinto H, Hayashi M, et al. Novel high-efficient butanol production from butyrate by non-growing Clostridium saccharoperbutylacetonicum N1-4 (ATCC 13564) with methyl viologen. Journal of Bioscience and Bioengineering , 2007, 104 (3) : 238–240. DOI:10.1263/jbb.104.238 |
| [23] | Gao M, Tashiro Y, Yoshida T, et al. Metabolic analysis of butanol production from acetate in Clostridium saccharoperbutylacetonicum N1-4 using 13C tracer experiments. RSC Advances , 2015, 5 (11) : 8486–8495. DOI:10.1039/C4RA09571E |
| [24] | Li X, Shi Z P, Li Z G. Increasing butanol/acetone ratio and solvent productivity in ABE fermentation by consecutively feeding butyrate to weaken metabolic strength of butyrate loop. Bioprocess and Biosystems Engineering , 2014, 37 : 1609–1616. DOI:10.1007/s00449-014-1133-5 |
 2016, Vol. 36
2016, Vol. 36




