文章信息
- 王彩霞, 张腾江, 滕杰, 冯旭东, 李春.
- WANG Cai-xia, ZHANG Teng-jiang, TENG Jie, FENG Xu-dong, LI Chun.
- 荒漠微藻的碳氧转换与调控
- The Efficient Carbon-oxygen Transformation and Regulation of Desert Microalgaes
- 中国生物工程杂志, 2016, 36(10): 45-52
- CHINA BIOTECHNOLOGY, 2016, 36(10): 45-52
- http://dx.doi.org/DOI:10.13523/j.cb.20161007
-
文章历史
- 收稿日期: 2016-03-25
- 修回日期: 2016-04-19
2. 北京理工大学生命学院 北京 100081
2. School of Life Science, Beijing Institute of Technology, Beijing 100081, China
随着21世纪人类生产的快速发展以及化石燃料的大量使用,能源危机日益严重,同时化石燃料的过度消耗也产生了大量的温室气体,导致全球气候变化和温室效应[1]。因此,寻找可持续的、再生的能源来替代化石能源具有重大的战略意义。由于微藻生物柴油是一种无毒、可再生和环境友好性的能源[2],微藻能源的产业化已成为世界各国研究和发展的重点[3-4]。
荒漠藻类是土壤藻(Soil Algae)的一个群体,主要是指生长在荒漠化地区的藻类[5]。与传统农作物和其他藻类相比,由于其生存环境具有高辐射、高盐碱和剧烈温度变化的特点,使得荒漠微藻不仅具有藻类生长周期短、光合效率高、可同时固定CO2[6]和去除氮磷[7]等特点,还具有抗辐射、抗高渗等高抗逆性和较好地适应环境变化等特点[8]。这些优良特性使荒漠微藻成为生产生物燃料和适应苛刻环境的潜在生物介质。目前已经有许多优良的荒漠微藻被筛选和应用,如祖路皮亚等[9]从新疆尉犁县筛选出3株荒漠微藻,并对其进行重金属抗性分析。孔任秋等(见参考文献[10])从内蒙古盐碱地区采集分离得到一些生长较快、含油量较高并且可以耐受较高浓度碳酸氢钠的藻株,并在库布齐沙漠地区进行开放式培养研究。李春等[11]从新疆荒漠化土样中筛选出1株富油荒漠蛋白核小球藻,并研究了氮、磷含量对其生长及总脂的影响。但是目前尚未见文献报道荒漠微藻的碳氧转化,特别是在静态及通气培养中来考察其碳氧转化效率。
本课题组前期从新疆荒漠戈壁地区筛选得到两株荒漠微藻BG18-3和BE6-2。为了研究荒漠微藻的碳氧转换效率和应用前景,本文考察了荒漠微藻BG18-3与BE6-2在干旱、高盐、温差变化、极端pH等逆境条件下的生长状况,筛选出抗逆性高、鲁棒性好的藻株。同时结合静态培养条件与通气培养条件下生物量的积累与氮、磷的去除率确定了最佳藻株。最后对筛选出的藻株进行分子生物学鉴定。
1 材料与方法 1.1 藻种及培养基本文研究中用到了3株微藻,分别是实验室前期从新疆荒漠戈壁地区筛选得到的荒漠微藻BG18-3与荒漠微藻BE6-2,还有购自武汉水生所的蓝藻(编号7942)。
BG11培养基(1.5 g/L NaNO3;0.04 g/L K2HPO4·3H2O;0.075 g/L MgSO4·7H2O;0.036 g/L CaCl2·2H2O;0.006 g/L C6H8O7·H2O;0.006 g/L Fe(NH4)3(C6H5O7)2;0.001 g/L Na2-EDTA;0.02 g/L Na2CO3)用于微藻的培养。
1.2 培养条件 1.2.1 正常培养条件微藻的正常培养在光照培养箱中进行,培养条件是温度25℃,湿度50%,光照周期12/12,置于BG11培养基中500ml三角瓶静态培养。
1.2.2 抗干旱特性将三种正常培养条件下生长10天的微藻细胞过滤到滤纸上,放到烘箱中65℃烘干2 h,将干燥的滤纸剪成均匀的小片,装在培养皿中置于光照培养箱中,间隔9 h、24 h、48 h、96 h取干燥的滤纸片接种于BG11培养基中。
1.2.3 抗温差特性取准备好(正常状态下培养10天)的三种微藻在光照培养箱中培养12 h,然后置于4℃冰箱中黑暗培养12 h。
1.2.4 荒漠微藻的通气培养及分析荒漠微藻BG18-3通气培养实验系统的结构如图 1所示,首先向该系统通入空气,考察生物量细胞干重。然后重新接种通入3% CO2配气,提高CO2的供给量,考察荒漠微藻BG18-3对CO2的固定能力和光合强度。同时收集荒漠微藻BG18-3的尾气,用尾气分析仪记录进气与尾气中的CO2含量,并且对荒漠微藻BG18-3的色素含量进行测量。
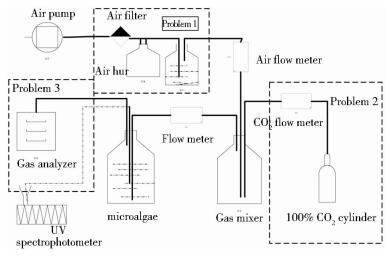
|
| 图 1 荒漠微藻BG18-3通气培养系统结构 Figure 1 The schematic of aerated culture of desert microalgae |
取生长至对数期的微藻培养液,采用U-2900紫外可见分光光度计,进行从190~1100 nm的全波长扫描,确定所筛微藻的最大吸收峰分别是:荒漠微藻BG18-3 690nm,荒漠微藻BE6-2 685nm,蓝藻680nm。并且通过血球计数板计数与特征吸光值条件下的吸光值建立标准曲线,得出吸光值与微藻细胞数之间的经验公式。
荒漠微藻BG18-3:Cell count (cell/ml)=1.079×107×OD690+4.21×105 (R2=0.996)
荒漠微藻BE6-2: Cell count (cell/ml)=1.730×107×OD685+2.66×105 (R2=0.997)
蓝藻:Cell count (cell/ml)=1.572×107 ×OD680+5.12×105 (R2=0.990)
1.3.2 磷酸盐测定方法磷酸盐的测定方法采用GB11893-89钼酸铵分光光度计法来测定[12]。
本实验中磷酸盐浓度的计算公式为:磷酸盐浓度(mg/L)=1.79×OD700-0.02 (R2=0.99)
1.3.3 硝酸盐的测定方法硝酸盐的测定方法采用GB3838-2002紫外分光光度计法来测定[13]。
本实验中硝酸盐浓度计算公式为:硝酸盐浓度(mg/L)=4.10×(OD220-2×OD275)-0.02(R2=0.99)。
1.3.4 叶绿素的测量取一定量的藻液经8000 r/min离心10 min后弃上清液,溶于少量90%丙酮的有机溶剂中,并超声破碎5min,然后用上述丙酮溶剂定容至原来体积,于4℃静置24h后用该丙酮溶剂作对照,测定其在663 nm、645 nm和630 nm波长下的吸光值[14]。藻液的叶绿素含量按下式计算:
叶绿素a (mg/L)=11.64×OD663-2.16×OD645+0.1×OD630
叶绿素b (mg/L)=3.94×OD663+20.97×OD645-3.66×OD630
叶绿素c (mg/L)=5.53×OD663-14.81×OD645+50.42×OD630
1.3.5 微藻基因组提取基因组DNA的提取在传统的CTAB法[15]的基础上略有修改。简而言之,取1.5 ml微藻培养液,12 000r/min离心10 min后取藻细胞沉淀。加入600 μl裂解液和玻璃珠破碎2 min后混匀。65℃保温2 h后在4℃下12 000r/min离心10 min。用Tris-酚1:1抽提,在4℃下12 000r/min离心10 min。然后用氯仿1:1抽提,4℃条件下12 000r/min离心10 min。用异丙醇1:1沉淀,-20℃静置2 h。最后用75%乙醇漂洗,风干30 min~1 h,加30μl TE。用0.8%琼脂糖凝胶电泳检测DNA的分子量并测定DNA浓度。
1.3.6 18s rDNA序列的PCR扩增根据绿藻18s rDNA的共有序列设计两条引物[16]:
18sF:5′-GGG TGA CGG AGA ATT AGG GT-3′
18sR:5′-GGT CAT TCG CGT TCA GTA GT-3′
以荒漠微藻BG18-3的基因组DNA为模板,30 μl的反应体系:DDW 3μl、Ex Taqbuffer 21.5 μl、dNTP 2μl、引物18sF 1 μl、引物18sR 1 μl、模板DNA 1 μl、ExTaq酶0.5 μl。
PCR反应程序为94℃预变性8 min;94℃变性1 min,60℃退火1 min,72℃延伸90 s,30个循环;72℃延伸10 min,4℃终止反应。
2 结果与结论 2.1 荒漠微藻抗逆性研究 2.1.1 荒漠微藻的抗干旱能力一般来说,在相同的培养条件下,培养液的密度越高,颜色越绿,表明微藻的长成状况越好。从图 2中可以看出,干燥9 h后接种的三种微藻都可以恢复生长,但生长状况差异明显。具体来说,荒漠微藻BG18-3生长最佳,荒漠微藻BE6-2恢复最慢。而干燥24 h、48 h、96 h接种的微藻中只有荒漠微藻BG18-3恢复了生长,其它两株微藻都没有恢复生长。本研究表明荒漠微藻BG18-3的抗干旱能力比较强,其应对环境变化的能力比荒漠微藻BE6-2与蓝藻要高。

|
| 图 2 荒漠微藻的抗干旱能力验证 Figure 2 The drought resistance of desert microalgae (a) The growth of BE6-2, BG18-3, freshwater cyanobacterial strain 7924 before dry processing for 9 h (b) 24 h (c) 36 h (d) 96 h |
由图 3可以看出,荒漠微藻BG18-3和荒漠微藻BE6-2在温差条件下可以正常生长。而蓝藻在经历过短暂的迅速生长期后,细胞密度便开始下降,在实验后期观察到蓝藻培养液的外观已经由蓝绿色变为黄褐色,蓝藻细胞开始死亡。微藻对温度的耐受能力因种而异,如新月菱形藻(Nitzscnia closterium)的适温范围为10~20℃,巴夫藻(Pavlova sp.)为15~30℃[17]。当温度超出适温范围时,微藻的生长代谢受到抑制可能是由于质壁分离现象[18]。本实验表明生长于荒漠等昼夜温差较大地区的荒漠微藻可以耐受剧烈的温差变化。荒漠微藻BG18-3和荒漠微藻BE6-2经过长期的进化,其胞内的代谢机制可以应对快速变化的环境温度;而蓝藻细胞内与代谢相关的酶的活性可能由于温度剧烈变化而受到抑制,导致其无法正常生长和细胞衰亡。
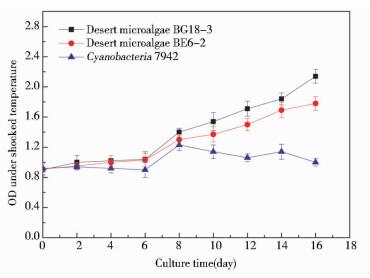
|
| 图 3 温差条件下微藻的生长曲线 Figure 3 The growth curve of microalgae under shocked temperature |
由图 4可以看出,在pH=12.0的碱性条件下,三种微藻生长前期都受到影响,随着微藻对碱性环境的适应,荒漠微藻BG18-3在第6天开始恢复生长,细胞密度逐渐增长;荒漠微藻BE6-2延滞期较长,在培养第10天细胞密度才开始增长;而蓝藻不能适应高碱性环境,出现细胞死亡。同时,三种微藻都不能适应pH=3.0的酸性环境,接种6天后微藻细胞基本全部死亡。尹建云等[19]以酶解糖异养培养小球藻(Chlorella vulgaris)时发现,初始pH低于6.0或高于7.0,对小球藻生长均不利。Jiang等[20]异养培养隐甲藻(Crypthecodinium cohnii)时,发现其最适宜的pH值为7.2。本实验中正常培养条件BG11培养基的pH为8.0,实验结果表明酸性条件时三种微藻细胞的生长都受到抑制,不能生长;在碱性条件下,荒漠微藻BG18-3在经过短暂的延滞期后可以正常生长。以上结果说明荒漠微藻BG18-3对碱性环境具有更好的适应性。
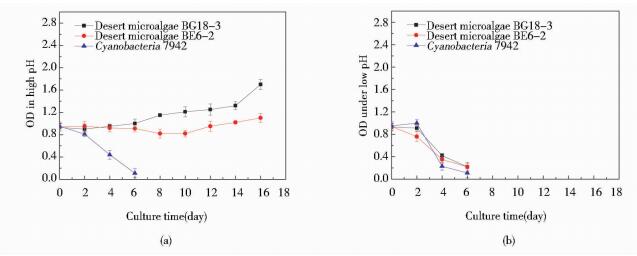
|
| 图 4 微藻在不同pH条件下的生长曲线 Figure 4 The growth curve of microalgae under different pH (a) pH=12.0 (b) pH=3.0 |
由图 5可以看出,在微藻培养基盐度提高为0.4%时,荒漠微藻BG18-3和蓝藻在经过6天的延滞期后,微藻细胞密度开始增长,但是荒漠微藻BE6-2的生长受到抑制。本实验说明荒漠微藻BG18-3和蓝藻可以适应较高的盐度,而荒漠微藻BE6-2在高盐条件下的生长与代谢受到影响。可能原因是由于盐度升高导致的渗透压变化,使荒漠微藻BE6-2对营养物质的吸收能力降低;过高的盐度还可能降低了荒漠微藻BE6-2细胞内某些酶或者转运载体的活性,使细胞生存能力下降。
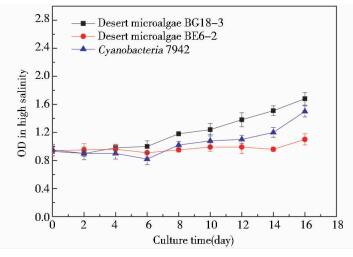
|
| 图 5 微藻在高盐条件下的生长曲线 Figure 5 The growth curve of microalgae under high salinity |
由表 1可以看出,经过16天的静态培养,荒漠微藻BG18-3的生物质干重达到0.26 g/L,比荒漠微藻BE6-2和蓝藻7942的干重稍高,这表明荒漠微藻BG18-3的CO2固定能力要优于荒漠微藻BE6-2和蓝藻。虽然三种微藻都对磷酸盐具有较强的去除能力,但是荒漠微藻BE6-2和蓝藻对硝态氮的去除能力不是很高,只有荒漠微藻BG18-3对硝态氮有明显的去除速率,最后去除率达到近36%,是其它两种藻类的2倍,这表明荒漠微藻BG18-3在无机盐离子去除方面具有明显的优势。
| 藻类 | 干重(g/L) | 氮移除率(%) | 磷移除率(%) |
| 荒漠微藻BG18-3 | 0.26 | 36 | 99 |
| 荒漠微藻BE6-2 | 0.24 | 18 | 99 |
| 蓝藻7942 | 0.22 | 18 | 99 |
2.3 荒漠微藻BG18-3的通气培养 2.3.1 通气培养的生物量与色素含量变化
由图 6可以看出,通气培养条件下荒漠微藻BG18-3的生物量积累要比静态培养优势明显,通入空气可以达到1.93 g/L,生物量产率为120.8 mg/L·d。并且通入CO2气体后,微藻的生物量明显增加,第16天的生物量可以达到2.63 g/L,生物量产率高达164.0 mg/L·d,接近实验室前期混合培养的最高生物量产率176.5 mg/L·d。
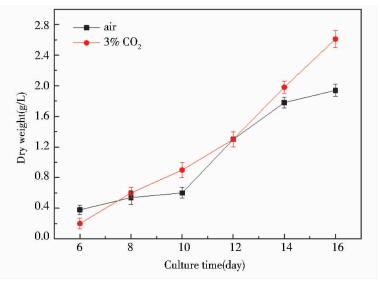
|
| 图 6 荒漠微藻BG18-3细胞干重曲线 Figure 6 The dry weight curve of microalgae under aerated culture |
由图 7可以看出,通入3% CO2配气培养时色素含量水平明显高于通入空气培养,两个阶段的培养细胞干重大约相差1.36倍,但微藻细胞内的色素水平却相差约7.42倍。通气培养最终色素含量达到96.59 g/L。表明通气培养时的CO2含量升高时,光合作用增强,随之色素含量迅速升高。
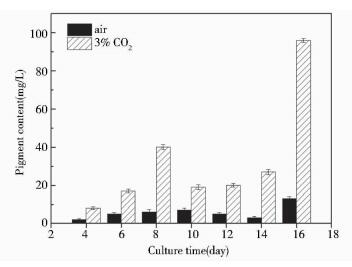
|
| 图 7 荒漠微藻BG18-3通气培养色素含量变化 Figure 7 The pigment content of desert microalgae BG18-3 under aerated culture |
由图 8可以看出,培养初期,由于微藻细胞密度较低,光合作用释放的O2较少,除去溶于培养基中的气体,O2释放浓度变化不大。而CO2固定量较高,应该是由于初期通入的CO2气体溶于藻液中。在培养中后期,随着微藻密度的增加,CO2的固定量和O2的释放量都随之增大。培养后期,尾气CO2浓度最低降至0.04%,O2净含量增加0.68%,达到21.66%(进气O2浓度为20.98%),这与正常大气中的CO2含量(0.04%)[21]和O2含量(20.8%)[22]一致,保证航天员的健康和正常工作。这表明荒漠微藻BG18-3完全可以胜任密闭空间中的碳氧转换任务,具有成为未来生命保障系统的生物转化介质的潜质。
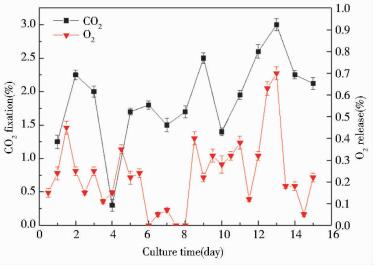
|
| 图 8 荒漠微藻BG18-3的CO2固定与O2的释放 Figure 8 The CO2 fixation and O2 release of desert microalgae BG18-3 |
采用CTAB法提取藻株BG18-3的基因组DNA后,利用设计的18s rDNA引物经过PCR扩增得到其18s rDNA,图 9为BG18-3的基因组和18s rDNA的电泳图。切胶回收后送至上海生工测序。用clustalx构建的系统进化树如图 10所示。

|
| 图 9 BG18-3的基因组(a)和18s rDNA(b)电泳图 Figure 9 Electrophoresis of genome (a) and 18s rDNA (b) of BG18-3 |
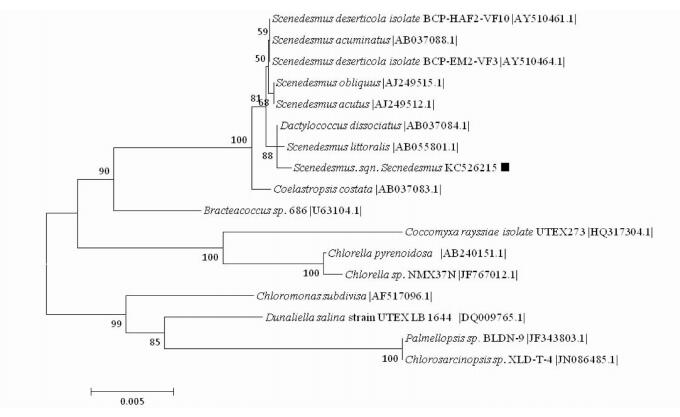
|
| 图 10 基于18s rDNA保守序列构建的微藻系统进化树 Figure 10 Phylogenetic tree of microalgae based on 18s rDNA conserved sequences from different microalgae spieces |
根据藻株BG18-3的形态结构,细胞大小以及基因测序结果将其初步归属于Scenedesmus。进化树上与栅列藻Scenedesmus littoralis (Genbank登录号:AB055801)和Dactylococcus dissociates(Genbank登录号:AB057084)的序列相似度最大为99%,表明该藻株BG18-3与Scenedesmus littoralis和Dactylococcus dissociates进化关系最为接近。其中Dactylococcus dissociates是从美国西北部沙漠地区筛选得到的栅藻,与荒漠微藻BG18-3的原始生存环境非常相似。本实验最终确定的用于密闭环境中碳氧转换的生物介质的荒漠微藻BG18-3属于绿藻门,绿藻纲,绿球藻目,栅藻科,栅列藻属的一株微藻,申请Genbank登录号为KC526215。
3 结论(1) 本文为提高生物在密闭环境中的碳氧转换效率,以来源于荒漠地区的两株荒漠微藻BG18-3、BE6-2和购自武汉水生所的一株淡水蓝藻为研究对象,对其进行逆境条件培养,考察三株微藻对不同变化环境的抗逆性和鲁棒性,发现荒漠微藻BG18-3在干旱、温差、高pH和高盐环境中表现最佳。
(2) 在静态培养中,发现荒漠微藻BG18-3相对于其他两株微藻在生物量积累和氮、磷去除上更有优势,生物量干重达到0.26 g/L,硝态氮去除率达到36%,是其他两株微藻的两倍,对磷酸盐的去除率高达99%。
(3) 对荒漠微藻BG18-3的通气培养中,获得干重生物量最高(3% CO2通气培养16天)达到2.63 g/L,生物量产率为164.0 mg/L·d。在3% CO2通气培养中,出气CO2浓度最低降到0.04%,O2净含量增加0.68%,表明了荒漠微藻BG18-3具有成为密闭环境碳氧生物转化系统生物介质的潜质。
(4) 经过分子生物学鉴定,通过18s rDNA保守序列比对,荒漠微藻BG18-3为一株栅列藻,Genbank登录号KC526215。
| [1] | Vasudevan P T, Briggs M. Biodiesel production current state of the art and challenges. J Ind Microbiol Biotechnol , 2008, 35 : 421–430. DOI:10.1007/s10295-008-0312-2 |
| [2] | Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances. The Plant Journal , 2008, 54 (4) : 621–639. DOI:10.1111/j.1365-313X.2008.03492.x |
| [3] | DOE U S. National Algal Biofuels Technology Roadmap. U.S. Department of Energy, Office of Energy Efficiency and Renewable Energy, Biomass Program, 2010. |
| [4] | 首届先进生物燃料论坛在京召开取得5项重要成果. [2010-07-15]. http://www.gov.cn/gzdt/2010-06/16/content_1628515.htm. |
| [5] | Hu C X, Liu Y D, Huang Z B, et al. The fine structure and development of algal crust in desert area. Acta Hydrobiological Sinica , 2000, 24 (1) : 11–18. |
| [6] | Miyachi S, Tsuzuki M, Avramova S T. Utilization modes of inorganic carbon for photosynthesis in various species of Chlorella. Plant and Cell Physiol , 1983, 24 (3) : 441–445. |
| [7] | Singh N K, Dhar D W. Nitrogen and phosphorus scavenging potential in microalgae. Indian J Biotechnol , 2007, 6 (1) : 52–56. |
| [8] | 陈兰周, 刘永定, 李敦海, 等. 荒漠藻类及其结皮的研究. 中国科学基金 , 2003, 2 : 90–93. Chen L Z, Liu Y D, Li D H, et al. The research process/progress of desert algae and crust. Bulletin of National Natural Science Foundation of China , 2003, 2 : 90–93. |
| [9] | 祖路皮亚·载买尔, 阿曼古力·海瓦尔, 吾甫尔·米吉提. 新疆尉犁县3株荒漠微藻的重金属抗性初步分析. 安徽农业科学 , 2015, 43 (15) : 205–208. Zulpiye Zemir, Amangul Hewer, Ghopur Mijit. Preliminary analysis of heavy metal resistance of the three desert microalgae in Yuli County of Xinjiang. Journal of Anhui Agri , 2015, 43 (15) : 205–208. |
| [10] | 席玮芳, 高宏, 兰波, 等. 适于沙漠地下水培养的耐碳酸氢钠产油微藻. 水生生物学报 , 2015, 39 (2) : 414–418. Xi W F, Gao H, Lan B, et al. Na2HCO3-tolerant oil-producing microalgae that are suitable for cultivation with desert groundwater. Acta Hydrobiologica Sinica , 2015, 39 (2) : 414–418. |
| [11] | 李春, 徐檬, 徐小琳. 氮, 磷对富油荒漠微藻混养生长及总脂的影响. 石河子大学学报:自然科学版 , 2012, 30 (4) : 401–406. Li C, Xu M, Xu X L. Effects of nitrogen and phosphorus on the mixotrophic growth and total Lipid of high-lipid desert microalgae. Journal of Shihezi University(Natural Science) , 2012, 30 (4) : 401–406. |
| [12] | 夏春, 陈琨, 苏维词. 水中磷酸盐测定方法对比. 贵州科学 , 2014, 32 (4) : 86–89. Xia C, Chen K, Su W C. Comparison on study of methods for determination of phosphate in water. Guizhou Science , 2014, 32 (4) : 86–89. |
| [13] | 冷家峰, 刘仙娜, 王泽俊. 紫外吸收光度法测定蔬菜鲜样中硝酸盐. 理化检验:化学分册 , 2004, 40 : 288–289. Leng J F, Liu X N, Wang Z J. UV-spectrophotometric determination of nitrates in fresh vegetables. Physical Testing and Chemical Analysis Part B:Chemical Analgsis , 2004, 40 : 288–289. |
| [14] | Cheng L. Study on CO2 removal from closed air by microalgae (enzyme) integrated membrane bioreactor. Hangzhou: Zhejiang University, 2006. |
| [15] | Li Y Q, Zhang X W. Comparison study of genome and extraction methods from Cyanobacterium. Journal of Shaanxi University of Science & Technology , 2009, 3 (27) : 9–16. |
| [16] | 李芳芳, 隋正红, 龚春霞, 等. 5种沙漠微藻的分离鉴定及其18S rDNA保守区片段差异分析. 石河子大学学报(自然科学版) , 2012, 30 (3) : 265–270. Li F F, Sui Z H, Gong C X, et al. Isolation and identification of five desert microalgae and analysis of 18S rDNA conserved fragment. Journal of Shihezi University(Natural Science) , 2012, 30 (3) : 265–270. |
| [17] | 周洪琪, RenaudS M, ParryD L, 等. 温度对析月泛形藻、护状麦形藻和巴夫藻的生长、总脂肪含量以及脂肪酸组成的影响. 水产学报 , 1996, 20 (3) : 235–240. Zhou H Q, Renaud S M, Parry D L, et al. Effect of temperature on growh, total lipid content and fatty acid composition of the microalgae, Nitzschia clostorium, Nitzschia paleacea and Pa vlova sp. Journal of Fisheries of China , 1996, 20 (3) : 235–240. |
| [18] | Raven J A, Geider R J. Temperature and algal growth. New Phycol , 1988, 110 (4) : 441–461. DOI:10.1111/nph.1988.110.issue-4 |
| [19] | 尹建云, 孟海华, 张学松, 等. 酶解糖异养培养微藻发酵条件的优化及生产试验. 食品与发酵工业 , 2006, 32 (5) : 55–61. Yin J Y, Meng H H, Zhang X S, et al. Optimization on fermentation conditions and its production for heterotrophic culture of microalgae with enzymolyzed starch sugar. Food and Fermentation Industries , 2006, 32 (5) : 55–61. |
| [20] | Jiang Y, Chen F. Effects of temperature and temperature shift on docosahexaenoic acid production by the marine microalga Crypthecodinium cohnii. J Am Oil Chem , 2000, 77 (6) : 613–617. DOI:10.1007/s11746-000-0099-0 |
| [21] | Rochell G T. Amine scrubbing for CO2 captur. Science , 2009, 325 (5948) : 1652–1654. DOI:10.1126/science.1176731 |
| [22] | Yuichiro Kitagawa, Keita Suzuki, Akihiro Yoneda, et al. Effects of oxygen concentration and antioxidants on the in vitro developmental ability, production of reactive oxygen species (ROS), and DNA fragmentation in porcine embryos. Theriogenology , 2004, 62 (7) : 1186–1197. DOI:10.1016/j.theriogenology.2004.01.011 |
 2016, Vol. 36
2016, Vol. 36




