文章信息
- 公颜慧, 马三梅, 张云, 王永飞, 胡云峰.
- GONG Yan-hui, MA San-mei, ZHANG Yun, WANG Yong-fei, HU Yun-feng.
- 新颖微生物低温酯酶EstP8的酶学性质研究与在手性催化中的应用
- Functional Characterization of a Novel Microbial Psychrophilic Lipase and Its Utilization in Stereo-Selective Biocatalysis
- 中国生物工程杂志, 2016, 36(10): 35-44
- CHINA BIOTECHNOLOGY, 2016, 36(10): 35-44
- http://dx.doi.org/DOI:10.13523/j.cb.20161006
-
文章历史
- 收稿日期: 2016-03-16
- 修回日期: 2016-05-30
2. 中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室 广州 510301;
3. 中国科学院南海海洋研究所 广东省海洋药物重点实验室 广州 510301
2. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China;
3. Guangdong Key Laboratory of Marine Materia Medica, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China
酯酶是一类可以将酯类水解成酸类和醇类的水解酶。酯酶主要来源于动物的胰脏,高等植物及微生物[1-2]。酯酶属于α/β折叠水解酶超家族[3]。催化中心一般由丝氨酸、天冬氨酸和组氨酸组成[4]。丝氨酸通常位于活性位点基序G-X-S-X-G中[5-6]。微生物酯酶是一种重要的工业酶,能催化酯的合成、转酯和水解等反应[7-9],具有反应条件温和、催化活性高、选择性强、产物易于分离回收等优点,可广泛地应用于食品加工、精细化工、手性化合物合成以及环境治理等工业领域[2, 4, 10-17]。
微生物脂肪酶分为15个家族,假单胞菌酯酶主要集中在脂肪酶家族Ⅰ。脂肪酶家族Ⅳ是激素敏感脂肪酶(HSL),与哺乳动物的HSL的氨基酸序列相似[18-19]。尽管许多家族Ⅳ的脂肪酶基因被报道,但是对其酶学性质的报道却很少[20-21]。
含芳香基的光学醇是手性药物合成中重要的手性中间体。微生物酶法拆分手性醇是获得单一对映体手性醇的一种重要途径[8, 22]。光学纯α-苯乙醇在药物和精细化工中具有重要的应用价值。例如,光学纯α-苯乙醇可通过抑制吸收来降低胆固醇水平,光学纯α-苯乙醇由于具有温和的花香气味还被广泛应用于香料行业[23]。为获得具备专一性拆分制备光学纯α-苯乙醇的酯酶,本研究对Pseudomonas antitumoralis HUP007的全基因组进行测序,克隆了酯酶EstP8的编码基因,并在大肠杆菌中实现了EstP8的重组表达,对其酶学性质和在手性催化中的应用进行了研究,为其工业化应用奠定了良好的基础。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒大肠杆菌E.coli DH5α,E. coli BL21(DE3)和载体pET28a(+)均为本实验室保存。假单胞菌Pseudomonas antitumoralis HUP007由本实验室从中山大学校园土壤样品中筛选获得。
1.1.2 试剂主要试剂:限制性内切酶EcoRI、Xho I等购自Thermo Fisher Scientific公司; T4 DNA连接酶和Taq DNA聚合酶购自北京全式金生物科技有限公司;DNA Marker,DNA凝胶回收试剂盒购自Omega公司;质粒提取试剂盒购自上海捷瑞生物科技有限公司;Ni SephraoseTM 6 Fast Flow和PD-10脱盐柱购自GE Healthcare Life Sciences公司;乙酸苏合香酯购自上海阿达玛斯试剂有限公司,产品编号90936A;其他试剂皆为分析纯。
1.1.3 仪器PCR仪:美国伯乐S1000TM Thermal Cycler;摇床:上海世平叠加式摇床PJS-2012R;冷冻离心机:德国Beckman Allegra X-30R;酶标仪:瑞士Tecan Infinite M200 Pro;高压灭菌锅:日本松下MLS-3781L-PC;超声破碎仪:宁波新芝生物科技股份有限公司SCIENTZ-ⅡD;冷冻干燥机:宁波新芝生物科技股份有限公司;气相色谱仪:浙江福立分析仪器有限公司;pH计:德国Sartorius DB-10。
1.2 方法 1.2.1 酯酶EstP8基因序列分析利用生物信息学手段对基因组进行注释,确定酯酶EstP8的开放阅读框,信号肽序列采用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)进行预测,预测氨基酸一致性分析采用PSI-BLAST (http://blast.ncbi.nlm.nih.gov)。Clustal W 1.81c对测序后的基因进行拼接,软件DNAMAN分析同源性,软件MEGA 5构建进化树。酯酶基因的理论蛋白质分子量及等电点采用Compute pI/Mw (http://web.expasy.org/compute_pi/)来预测。
1.2.2 酯酶基因的克隆及载体构建EstP8成熟肽利用软件Primer Premier 5设计引物如下:上游引物:5′-CATGAATTCGACGCTGGCGTCGAGCAC-3′下游引物:5′-CACCTCGAGTTACTTCAAATGCACTTTCAGCGCCTC -3′,下划线部分分别为EcoR I和XhoI酶切位点。以Pseudomonas antitumoralis HUP007的总DNA为模板,PCR扩增成熟酯酶序列。具体过程:95℃预变性5min,95℃变性30s,55~65℃退火30s,72℃延伸2min,进行32个循环,72℃ 10min。凝胶电泳检测PCR产物并割胶回收。PCR产物经EcoRI和Xho I双酶切后与载体pET28a(+)连接,转化至感受态细胞E. coli DH5α。将重组菌涂布到筛选平板,37℃培养24h,挑选阳性克隆,提取质粒并进行序列测序。
1.2.3 酯酶EstB5的表达和纯化将测序正确的重组质粒pET28(+)-EstP8转入E. coli BL21(DE3)中,将E. coli BL21(DE3)涂布到100mg/ml卡那霉素的LB平板,37℃培养过夜后,挑取单菌落于含卡那霉素LB液体培养基中进行培养。取样测定菌体浓度达到OD600为0.8左右时,加入0.2mmol/L IPTG在22℃诱导16~20h。4℃离心收集菌体,用预冷的50mmol/L pH 8.0的Tris-HCl缓冲液冲洗菌体并重悬浮,置于冰上超声破碎,将破碎完的菌体裂解液在4℃下9 000 r/min离心30 min,将10ml上清转移到50mmol/L的pH7.5的Tris-HCl缓冲溶液预先平衡的镍柱中,用40mmol/L咪唑缓冲溶液冲洗杂蛋白,用300mmol/L的咪唑缓冲溶液洗脱目的蛋白。得到的酶溶液用脱盐柱脱盐。取全菌体、上清和沉淀用12%的SDS-PAGE进行凝胶电泳检测。
1.2.4 酯酶活性测定酯酶活性测定采用比色法,酶活力单位定义为每分钟水解p-NPO为1μmol p-NP所需要的酶量。蛋白浓度采用Bradford法测定,以牛血清蛋白为标准蛋白。
1.2.5 酯酶EstP8的底物特异性以不同长度酰基的对硝基苯酚酯(C2-C12)为底物,在标准条件下测定EstP8最适底物的相对活性,以不加酶的作为对照组。
1.2.6 酯酶EstP8的最适反应温度及温度稳定性利用p-NP法在10℃~70℃之间测定酯酶EstP8酶活力,确定最适温度,以酶活力最高点的相对酶活力为100%。将酶溶液于不同温度(10℃~60℃)处理不同时间,每隔15min测一次酶活,以不处理的酶活力为对照,设为100%。
1.2.7 酯酶EstP8的最适pH及pH稳定性配制不同pH(6.0~9.5)缓冲液(其中6.0~8.0为50mmol/L PBS; 8.0~9.5为50mmol/L Tris-HCl),室温条件下反应5 min,测定酶活力,以酶活力最高点的相对酶活力为100%,确定最适pH。将酶溶液置于不同pH缓冲液中,4℃处理12h,测定残余酶活力,以不做处理的酶活力为100%,探究酯酶EstP8的pH稳定性。
1.2.8 金属离子对酶的影响将终浓度为1mmol/L、5mmol/L、10mmol/L的金属离子(Zn2+、Mn2+、Ca2+、Cu2+、Mg2+、K+)与适当浓度的EstP8混匀,室温处理1h,在50℃,pH8.0 Tris-HCl缓冲体系中测定残余酶活力,处理前的酶活力为100%。
1.2.9 有机溶剂及表面活性剂对酯酶EstP8活性的影响将不同终浓度的有机溶剂、表面活性剂与适当浓度的酯酶EstP8混匀,室温条件下处理3h,在最适条件下测定酶活力。以未做任何处理的酶活力为100%。
1.2.10 酯酶EstP8水解拆分乙酸苏合香酯将10mg的粗酶粉和50mmol/L的底物加入到500μl Tris-HCl缓冲液(50mmol/L pH8.0)中,37℃反应6h,乙酸乙酯1:1萃取,无水Na2SO4除水,进行手性气相色谱检测。色谱条件:进样口、检测口250℃(初温100℃,10℃/min升温至250℃并保留10min)。计算转化率(c)和对映体过量值(e.e.)。在上述体系中加入10%的有机溶剂(甲苯、异辛烷、庚烷、正己烷等)同样条件下反应6h,进行手性气相检测并计算转化率及对映体过量值,考察有机溶剂对EstP8催化乙酸苏合香酯手性拆分的影响。
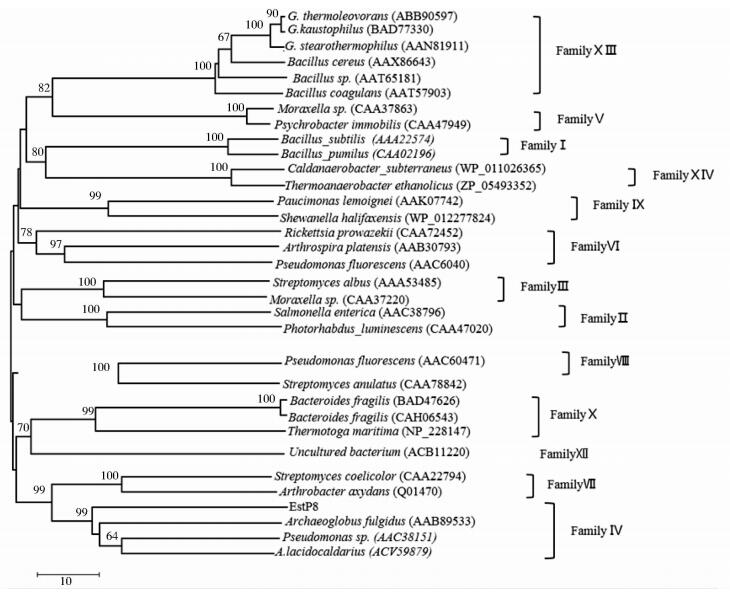
2 结果与讨论 2.1 酯酶EstP8的序列分析酯酶基因EstP8全长1041bp,编码337个氨基酸残基,Primer Premier 5软件分析表明其G+C含量59%。ExPASy分析显示该酯酶含有大小为22个氨基酸残基的信号肽。切除信号肽后的酯酶由315个氨基酸残基组成,理论蛋白质分子量为36.5kDa,等电点为8.10。NCBI比对结果显示:EstP8基因序列与来自Pseudomonas sp. 250J和Pseudomonas mosselii的假定α/β水解酶基因有98%的相似性,与来自Pseudomonas sp. GM67的假定酯酶有94%相似性,与Pseudomonas batumicl的假定α/β水解酶具有94%的相似性,与来自Pseudomonas sp. GM55的假定酯酶、Pseudomonas lutea的假定α/β水解酶、Pseudomonas viridiflava的假定α/β水解酶序列相似性分别为93%、89%和88%(图 1)。虽然EstP8与这些序列的相似性很高,但它们均来自全基因组测序,并没有进行过系统的酶学性质研究。EstP8编码区蛋白质序列及结构分析结果表明:EstP8属于脂肪酶家族Ⅳ,具有脂肪酶家族Ⅳ特征序列HGGG[16, 18]。与所有水解酶类似,EstP8具有α/β水解酶折叠结构域,催化中心由Ser180、Asp277、His307组成,其中Ser180位于脂肪酶特征序列Gly178-Gln179-Ser180-Val181-Gly182(GXSXG)中[24],是组氨酸水解酶最保守的区域,也是水解机制所必需的序列。采用Mega5软件的邻接法对EstP8进行系统树分析,构建进化树如图 2所示。

|
| 图 1 EstP8全序列比对图 Figure 1 Multiple sequence alignment of EstP8 Note: Amino acid residues belonging to catalytic triad were presented as filled circles (↓). These sequences share a conserved motif Gly-Gln-Ser-Val-Gly, containing a serine residue located at the putative active site. The aligned sequences are EstP8; WP_008020173.1: Pseudomonas sp. GM55; WP_040063475.1: Pseudomonas_batumici; WP_057715326.1: Pseudomonas fluorescens; WP_008037818.1: Pseudomonas sp. GM67; WP_028689874.1: Pseudomonas_mosselii; WP_050703686.1: Pseudomonas mosselii; AAB89533.1: Archaeoglobusfulgidus DSM4304; AAC38151.1: Pseudomonas sp. B11-1; ACV59879.1: Alicyclobacillus acidocaldarius subsp. Acidocaldarius DSM446 |
|
| 图 2 酯酶EstP8系统进化树 Figure 2 Phylogenetic tree of esterases generated with MEGA v5.0 using the neighbor-joining meth |
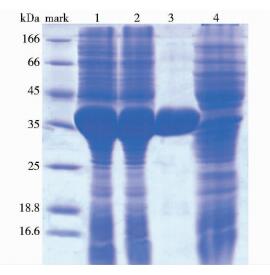
成功构建的表达载体pET28a(+)-EstP8,转入感受态E.coli BL21(DE3),并实现在E.coli BL21(DE3)中的高效表达。通过Ni-NTA柱纯化,SDS-PAGE检测显示单一目的蛋白条带大约为36.5kDa(图 3),说明EstP8与理论大小一致。
|
| 图 3 酯酶EstP8的蛋白表达、纯化 Figure 3 Expression and purification of EstP8 1: Protein supernatants of EstP8 after IPTG induction; 2: Total proteins after IPTG induction 3: Purified EstP8; 4: Total proteins before IPTG induction |
EstP8对不同长度酰基的对硝基苯酚酯活性如表 1,该酶能催化C2-C10链的对硝基苯酚酯,催化短链酯的活性高于中链和长链酯。EstP8最佳的作用底物是对硝基苯酚乙酸酯C2(p-NPO)。以p-NPO为底物,酯酶EstP8的活性达到105.19U/mg,Km和Vmax分别为1.144mmol/L、89.4μM/min。
| Substrats | Specific activity(U/mg) | Relative activity(%) |
| p-NP acetate (C2) | 105.19±5.28 | 100 |
| p-NP butyrate (C4) | 43.11±3.23 | 41 |
| p-NP hexanoate (C6) | 34.22±1.81 | 33 |
| p-NP caprylate (C8) | 16.67±0.99 | 16 |
| p-NP decanoate (C10) | 5.26±0.31 | 5 |
2.4 酯酶EstP8的最适pH和pH稳定性
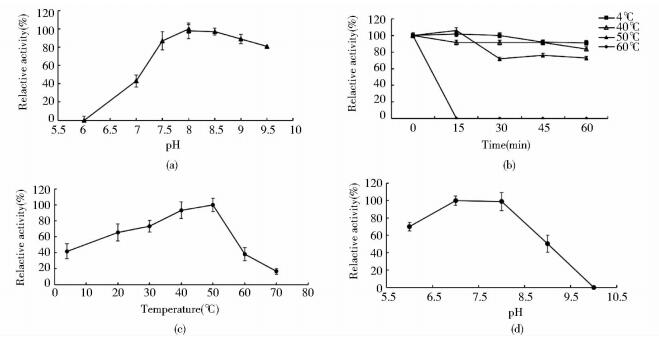
pH对重组酯酶EstP8活性的影响见图 4a,在50mmol/L的Tris-HCl缓冲体系中,EstP8在pH8.0时活性最高,pH值在7.0~9.5之间时EstP8有较高的酶活性。当pH低于7或高于9时,EstP8活性迅速降低。EstP8用不同pH的缓冲液处理22h后,pH在8.0时酶活性较稳定(图 4d),pH9.0时酶活性残余50.35%。而在过酸或过碱条件下,酶活力丧失则较为明显。
|
| 图 4 pH与温度对EstP8的活性及稳定性的影响 Figure 4 Effect of pH and temperature on the activity of EstP8 (a) Effect of pH on the activity of EstP8 (b) pH stability of EstP8 (c) Effect of temperature on the activity of EstP8 (d) Temperature dependence of EstP8 enzymes activity |
在最适反应pH条件下测得酯酶EstP8催化水解p-NPO反应最适温度为50℃(图 4c),酯酶EstP8在4℃时残余酶活力达41.78%,在20℃酶残余活力达到89.48%,温度大于50℃时酶活性急剧下降。EstP8在0~50℃经不同时间处理保持稳定的酶活力,随着处理温度的升高,EstP8残余酶活力逐渐下降,当温度高于50℃时酶活性急剧降低(图 4c)。在60℃处理15min后,基本完全失活(图 4c)。
2.6 不同浓度金属离子对酯酶EstP8水解活性的影响不同浓度的金属离子对酶活性的影响见表 2:在最适条件下测定酶活,1mmol/L Cu2+、Mn2+、Zn2+对EstP8具有明显的激活作用,分别达到对照的118.50±0.315%、131.89±0.017%、175.35±0.093%、当浓度达到10 mmol/L时,Mg2+、Zn2+对EstP8酶活性产生明显的抑制,分别为对照的38.53±0.076%和11.40±0.029%。K2+、Ca2+、Mg2+对酶活性影响较小。本部分结果表明酯酶EstP8对多种金属离子具有很好的耐受性。
| metalions | Relative activity (%, x±s) | metalions | Relative activity (%, x±s) | ||
| 1mmol/L | 10mmol/L | 1mmol/L | 10mmol/L | ||
| Control | 100 | Control | 100 | ||
| K+ | 104.82±0.128 | 103.50±0.081 | Ca2+ | 104.08±0.048 | 122.01±0.14 |
| Mn2+ | 131.89±0.017 | 121.01±0.079 | Zn2+ | 175.35±0.093 | 11.40±0.029 |
| Cu2+ | 118.50±0.315 | 38.53±0.076 | Mg2+ | 113.10±0.166 | 77.29±0.052 |
2.7 有机溶剂、表面活性剂及变性剂对酯酶EstP8水解活性的影响
10%的异辛烷、庚烷、1, 4-二氯六环、甲苯、丙酮和DMF能够不同程度地促进EstP8活性,其中丙酮和DMF的促进作用比较明显,分别达到对照的140.92±0.061%、177.36±0.083% (表 3)。甲醇、乙醇、二氯甲烷、乙腈、DMSO对EstP8的活性具有不同程度的抑制作用,乙醇和乙腈的抑制作用较强;加入10%浓度的上述溶剂,残余酶活力分别为35.01±0.019%和27.10±0.043%。随着有机溶剂浓度的升高,对EstP8的抑制作用加强,但在90%的异辛烷和庚烷中EstP8的残余酶活力仍保留对照的50%以上,因此EstP8对异辛烷及庚烷具有很强的耐受性。0.1%的TritonX-100、Tween-80、Tween-20能对EstP8产生不同程度的抑制作用。
| Organic solvents | Relative activity (%, x±s) | |||
| 10% | 20% | 50% | 90% | |
| Control | 100% | |||
| Methanol | 78.03±0.094 | 41.04±0.022 | 32.95±0.027 | - |
| Ethanol | 35.01±0.019 | 20.46±0.021 | - | - |
| Isooctane | 122.22±0.054 | 120.80±0.036 | 54.92±0.046 | 50.02±0.039 |
| Dichloromethane | 77.02±0.063 | 32.41±0.052 | - | - |
| Heptane | 115.25±0.05 | 73.46±0.050 | 92.19±0.068 | 59.84±0.016 |
| 1, 4-Dioxane | 116.15±0.03 | 61.24±0.050 | - | - |
| Methylbenzene | 130.95±0.042 | 47.94±0.057 | 55.55±0.066 | 6.32±0.056 |
| Acetonitrile | 27.10±0.043 | 42.88±0.018 | - | - |
| Acetone | 140.92±0.061 | 62.24±0.09 | - | - |
| DMF | 177.36±0.083 | 80.72±0.033 | - | - |
| DMSO | 85.06±0.03 | 97.71±0.132 | 35.84±0.037 | - |
表面活性剂对酯酶水解活性的影响见表 4。
| chemical reagent | Relative activity (%, x±s) | |
| 0. 1% | 0.5% | |
| Control | 100% | |
| Triton-X100 | 79±0.048 | 89±0.054 |
| Tween-80 | 58±0.069 | 54±0.078 |
| Tween-20 | 75±0.057 | 44±0.038 |
2.8 酯酶EstP8水解拆分制备手性1-苯基乙醇及有机溶剂对拆分的影响
EstP8能高对映选择性水解乙酸苏合香酯制备手性(R)-1-苯基乙醇,有效转化率(c)为39%,产物e.e.值(e.e.p)达78%。研究表明反应体系中加入10%(v/v)的甲苯、丙酮、庚烷、正己烷等有机溶剂均能够提高产物(R)-1-苯基乙醇eep值,分别达到91%、86%、86%、85%。而在10% DMSO存在的情况下,底物(S)-乙酸苏合香酯的e.e.s达到98%,转化率提高至60%(表 5)。本部分结果表明酯酶EstP8具有很高的拆分制备(R)-1-苯基乙醇等手性化合物的能力,添加有机溶剂可以提高该酯酶的光学选择性和产率。
| Organic solvents(10%) | e.e.s(%) | e.e.p(%) | c(100%) |
| Control | 50 | 78 | 39 |
| Methylbenzene | 20 | 91 | 18 |
| Acetone | 58 | 86 | 40 |
| Heptane | 70 | 86 | 45 |
| Isooctane | 75 | 84 | 47 |
| 1, 4-Dioxane | 77 | 83 | 48 |
| Hexane | 56 | 85 | 40 |
| DMSO | 98 | 64 | 60 |
| DMF | 74 | 78 | 49 |
3 结论
EstP8属于脂肪酶家族Ⅳ,具有脂肪酶家族Ⅳ保守序列HGGG[16, 18]。与其他低温酯酶相比较,EstP8具有更好的温度稳定性(表 5)。EstP8的最适反应温度为50℃。4℃时,酯酶EstP8的相对活力为41.78%。EstP8在40℃处理60min后残余酶活力保持在80%以上,50℃处理60min后的残余酶活力仍然保持在60%以上。EstP8的最适pH为8.0,pH在7.0~8.0之间酶活力稳定。pH9.0时残余酶活力为50.35%。低浓度的Cu2+、Mn2+、Zn2+等对酯酶具有明显的激活作用,而K+、Ca2+、Mg2+对酶活性影响较小。异辛烷、庚烷、1, 4-二氯六环、甲苯、丙酮和DMF等有机溶剂也能够促进酶活,且EstP8对异辛烷和庚烷等有机溶剂具有很强的耐受性,浓度为90%时残余酶活力仍然保持在50%以上。因此,EstP8在有机溶液中催化酯交换作用来改变低价脂肪性能,生产一些重要的多不饱和脂肪酸及生物柴油工业等方面都具有潜在的应用价值[25]。EstP8与其它低温酯酶酶学性质的比较见表 6。
| 酯酶名称 | 菌株来源 | 最适底物 | 最适温度 | 最适pH | 相对酶活力 | 参考文献 |
| EstP8 | Pseudomonas antitumoralis | C2 | 50℃ | 8.0 | 42%(4℃) | 本研究 |
| EstS9N | Pseudomonas sp. | C4 | 35℃ | 9.0 | 40%(10℃) | [26] |
| Est2349 | Thalassospira sp. | C2 | 45℃ | 8.5 | 24%(10℃) | [27] |
| Est01 | Biogas Slurry Metagenomic Library | C4 | 20℃ | 8.0 | 43%(10℃) | [28] |
| EstC | Streptomyces coelicolor | C5 | 35℃ | 8.5-9 | 25%(10℃) | [29] |
| EstTB11 | Pseudomonas sp. | 短链 | 25℃ | 8.5 | 36%(0℃) | [30] |
EstP8具有高对映选择性水解乙酸苏合香酯的能力,能够专一性拆分制备手性(R)-1-苯基乙醇。其有效转化率为39%,e.e.p为78%。低浓度的甲苯、丙酮、异辛烷、正己烷等有机溶剂对EstP8的对映选择性具有明显的影响。在10%甲苯存在的情况下,e.e.p达到91%;而在10% DMSO存在的情况下,底物(S)-乙酸苏合香酯的e.e.s达到98%,转化率提高至60%。Liang等[31]研究的酯酶BSE01281在优化后通过水解乙酸苏合香脂制备(R)-1-苯基乙醇的e.e.可以达到99%,但底物(S)-乙酸苏合香酯的e.e.为95%,转化率为49%。因此EstP8在手性化工产品的制备具有重要的潜在应用价值。
综上所述,酯酶EstP8是一种新型的低温微生物酯酶,具有耐金属离子、耐有机溶剂的特性;酯酶EstP8能通过选择性水解乙酸苏合香酯来制备手性(R)-1-苯基乙醇,不同有机溶剂的加入可以极大促进该酯酶拆分的光学选择性和产率。本工作所鉴定的酯酶EstP8具有良好的产业化应用前景。
| [1] | Zhu Y, Zheng W, Ni H, et al. Molecular cloning and characterization of a new and highly thermostable esterase from Geobacillus sp. JM6. Journal of basic microbiology , 2015, 55 (10) : 1219–1231. DOI:10.1002/jobm.v55.10 |
| [2] | 张敏文, 刘悦, 李荷. 微生物酯酶的研究进展. 广东第二师范学院学报 , 2012, 32 (3) : 66–71. Zhang M W, Liu Y, Li H. The Research progress of microbiol esterase. Journal of Guangdong University of Education , 2012, 32 (3) : 66–71. |
| [3] | Zhang T, Chen H, Ni Z, et al. Expression and characterization of a new thermostable esterase from Clostridium thermocellum. Appl Biochem Biotechnol , 2015, 177 (7) : 1437–1446. DOI:10.1007/s12010-015-1824-7 |
| [4] | Treichel H, de Oliveira D, Mazutti M A, et al. A review on microbial lipases production. Food and Bioprocess Technology , 2010, 3 (2) : 182–196. DOI:10.1007/s11947-009-0202-2 |
| [5] | Romano D, Bonomi F, de Mattos M C, et al. Esterases as stereoselective biocatalysts. Biotechnol Adv , 2015, 33 (5) : 547–565. DOI:10.1016/j.biotechadv.2015.01.006 |
| [6] | Vaquero M E, Barriuso J, Martinez M J, et al. Properties, structure, and applications of microbial sterol esterases. Appl Microbiol Biotechnol , 2016, 100 (5) : 2047–2061. DOI:10.1007/s00253-015-7258-x |
| [7] | Tian X, Zheng G W, Li C-X, et al. Enantioselective production of (S)-1-phenyl-1, 2-ethanediol from dicarboxyesters by recombinant Bacillus subtilis esterase. Journal of Molecular Catalysis B: Enzymatic , 2011, 73 (1-4) : 80–84. DOI:10.1016/j.molcatb.2011.07.022 |
| [8] | 谷耀华, 薛屏, 李鹏, 等. 固定化假单胞菌脂肪酶催化R-S-3-羟基丁酸乙酯转酯化拆分. 应用化工 , 2015, 44 (9) : 1621–1626. Gu Y H, Xue P, Li P, et al. Tranesterification resolution of (R, S) -ethyl-3-hydroxybutyrate catalyzed by immobilized Pseudomonas sp lipase. Applied Chmical Industry , 2015, 44 (9) : 1621–1626. |
| [9] | 张敏, 贾承胜, 张晓鸣, 等. 脂肪酶催化合成亲水性植物甾醇酯. 中国油脂 , 2015, 40 (2) : 77–80. Zhang M, Jia C S, Zhang X M, et al. Lipase-catalyzed synthesis of hydrophilic phytosterol esters. China Oils and Fats , 2015, 40 (2) : 77–80. |
| [10] | Shah Z, Hasan F, Krumholz L, et al. Degradation of polyester polyurethane by newly isolated Pseudomonas aeruginosa strain MZA-85 and analysis of degradation products by GC MS. International Biodeterioration & Biodegradation , 2013, 77 : 114–122. |
| [11] | Lee C, Kim J, Hong S, et al. Cloning, expression, and characterization of a recombinant esterase from cold-adapted Pseudomonas mandelii. Applied Biochemistry and Biotechnology , 2013, 169 (1) : 29–40. DOI:10.1007/s12010-012-9947-6 |
| [12] | Xu F, Chen S, Xu G, et al. Discovery and expression of a Pseudomonas sp. esterase as a novel biocatalyst for the efficient biosynthesis of a chiral intermediate of pregabalin. Biotechnology and Bioprocess Engineering , 2015, 20 (3) : 473–487. DOI:10.1007/s12257-015-0069-1 |
| [13] | Berger R G. Biotechnology as a source of natural volatile flavours. Current Opinion in Food Science , 2015, 1 : 38–43. DOI:10.1016/j.cofs.2014.09.003 |
| [14] | Luan Z J, Li F L, Dou S, et al. Substrate channel evolution of an esterase for the synthesis of cilastatin. Catalysis Science & Technology , 2015, 5 (5) : 2622–2629. |
| [15] | Novotny C, Erbanova P, Sezimova H, et al. Biodegradation of aromatic-aliphatic copolyesters and polyesteramides by esterase activity-producing microorganisms. International Biodeterioration & Biodegradation , 2015, 97 : 25–30. |
| [16] | Yan Q j, Yang S Q, Duan X J, et al. Characterization of a novel hormone-sensitive lipase family esterase from Rhizomucor miehei with tertiary alcohol hydrolysis activity. Journal of Molecular Catalysis B: Enzymatic , 2014, 109 : 76–84. DOI:10.1016/j.molcatb.2014.08.008 |
| [17] | Liu Z, Xie J, Shi Y, et al. Isolation of an organophosphorus-degrading strain Pseudomonas sp strain YF-5 and cloning of mpd gene from this strain. Journal of Pure and Applied Microbiology , 2014, 8 : 587–591. |
| [18] | Kim H J, Jeong Y S, Jung W K, et al. Characterization of novel family IV esterase and family I.3 lipase from an oil-polluted mud flat metagenome. Mol Biotechnol , 2015, 57 (9) : 781–792. DOI:10.1007/s12033-015-9871-4 |
| [19] | Rao L, Xue Y, Zheng Y, et al. A novel alkaliphilic bacillus esterase belongs to the 13(th) bacterial lipolytic enzyme family. PLoS One , 2013, 8 (4) : e60645. DOI:10.1371/journal.pone.0060645 |
| [20] | Lopez G, Chow J, Bongen P, et al. A novel thermoalkalostable esterase from Acidicaldus sp. strain USBA-GBX-499 with enantioselectivity isolated from an acidic hot springs of Colombian Andes. Applied Microbiology and Biotechnology , 2014, 98 (20) : 8603–8616. DOI:10.1007/s00253-014-5775-7 |
| [21] | Biver S, Vandenbol M. Characterization of three new carboxylic ester hydrolases isolated by functional screening of a forest soil metagenomic library. Journal of Industrial Microbiology & Biotechnology , 2013, 40 (2) : 191–200. |
| [22] | 李冬桂, 马丽, 刘雄民, 等. 生物法拆分-苯乙醇. 应用化学 , 2011, 40 (2) : 239–242. Li D G, Ma L, Liu X M. Biological resolution of phenylethanol. Applied Chemical Industry , 2011, 40 (2) : 239–242. |
| [23] | Liang J, Zhang Y, Sun A, et al. Enantioselective resolution of (+/-)-1-phenylethanol and (+/-)-1-phenylethyl acetate by a novel esterase from Bacillus sp. SCSIO 15121. Appl Biochem Biotechnol , 2016, 178 (3) : 588–595. |
| [24] | Kumari A, Gupta R. Functional characterisation of novel enantioselective lipase TALipA from Trichosporon asahii MSR54: sequence comparison revealed new signature sequence AXSXG among yeast lipases. Applied Biochemistry and Biotechnology , 2015, 175 (1) : 360–371. DOI:10.1007/s12010-014-1268-5 |
| [25] | Su E Z, Zhang J G, Huang M G, et al. Optimization of the lipase-catalyzed irreversible transesterification of Pistacia chinensis bunge seed oil for biodiesel production. Russian Chemical Bulletin , 2014, 63 (12) : 2719–2728. DOI:10.1007/s11172-014-0805-2 |
| [26] | Wicka M, Wanarska M, Krajewska E, et al. Cloning, expression, and biochemical characterization of a cold-active GDSL-esterase of a Pseudomonas sp S9 isolated from Spitsbergen island soil. Acta Biochimica Polonica , 2016, 63 (1) : 117–125. DOI:10.18388/abp.2015_1074 |
| [27] | De Santi C, Leiros H K, Di Scala A, et al. Biochemical characterization and structural analysis of a new cold-active and salt-tolerant esterase from the marine bacterium Thalassospira sp. Extremophiles , 2016, 20 (3) : 323–336. DOI:10.1007/s00792-016-0824-z |
| [28] | Cheng X J, Wang X M, Qiu T L, et al. Molecular cloning and characterization of a novel cold-adapted family VIII esterase from a biogas slurry metagenomic library. Journal of Microbiology and Biotechnology , 2014, 24 (11) : 1484–1489. DOI:10.4014/jmb.1406.06071 |
| [29] | Brault G, Shareck F, Hurtubise Y, et al. Isolation and Characterization of EstC, a new cold-active esterase from Streptomyces coelicolor A3(2). Plos One , 2012, 7 (3) : e3041. |
| [30] | Dong J, Zhao W, Gasmalla M A, et al. A novel extracellular cold-active esterase of Pseudomonas sp. TB11 from glacier No.1: Differential induction, purification and characterisation. Journal of Molecular Catalysis B: Enzymatic , 2015, 121 : 53–63. DOI:10.1016/j.molcatb.2015.07.015 |
| [31] | Liang J, Zhang Y, Sun A, et al. Enantioselective resolution of (+/-)-1-phenylethanol and (+/-)-1-phenylethyl acetate by a novel esterase from Bacillus sp. SCSIO 15121. Appl Biochem Biotechnol , 2016, 178 (3) : 558–575. DOI:10.1007/s12010-015-1894-6 |
 2016, Vol. 36
2016, Vol. 36




