文章信息
- 施慧琳, 王泽建, 吴杰群, 郭美锦, 储炬, 庄英萍.
- SHI Hui-lin, WANG Ze-jian, WU Jie-qun, GUO Mei-jin, CHU Ju, ZHUANG Ying-ping.
- 透明颤菌vgb基因在脱氮假单胞菌中的表达及对维生素B12合成的碳中心代谢流分析
- Expression of Vitreosicilla Hemoglobin Gene(vgb) In Pseudomonas denitrificans and the Central Carbon Metabolic Flux Analysis on Vitamin B12 Production
- 中国生物工程杂志, 2016, 36(9): 21-30
- China Biotechnology, 2016, 36(9): 21-30
- http://dx.doi.org/DOI:10.13523/j.cb.20160903
-
文章历史
- 收稿日期: 2016-06-06
2. 中国科学院上海生命科学研究院湖州工业生物技术中心 湖州 333000
2. Shanghai Insitiutute of Organic Chemistry Huzhou Center of Bio-synthetic Innovation, Huzhou 333000, China
维生素B12作为甲基转移酶的辅因子,既能增强营养代谢,也能促进红细胞的发育和成熟,使肌体造血机能处于正常状态,从而达到预防恶性贫血、维护神经系统健康的效果,目前多应用于食品、保健品和化妆品行业,是安全的添加剂[1]。关于维生素B12的制备,相较于繁琐复杂的化学合成方法,通过微生物代谢合成维生素B12成为目前主流合成方法,而由脱氮假单胞菌好氧合成维生素B12过程是一种典型的生产方式。
作为维生素B12好氧合成工艺的生产菌株,脱氮假单胞菌具有生长速率快、使用安全的特点。目前针对其生物合成维生素B12的过程优化,主要涉及培养基包括碳氮源和金属离子的优化[2],工艺条件包括pH、残糖、残留甜菜碱[3]和供氧的控制[4]等。脱氮假单胞菌合成维生素B12的发酵过程高耗氧,发酵过程中氧的消耗用于菌体生长、产物合成和细胞代谢维持作用。传统的生产工艺操作主要是通过增大通气流量或加大转速来改善供氧条件,这些措施必将带来较高的能耗。因而,进一步增强脱氮假单胞菌对氧的亲和力,提升对氧的利用效率,降低由于供氧产生的动力消耗成本,从细胞分子水平上解决氧的需求及利用效率是非常关键的问题[5]。vgb基因已经被证明具有携带氧至呼吸链终端,改善细胞色素呼吸链传递的效果,进而改善细胞氧供应的功效,可以说是一个经济可行的方法[6]。近年来已经有不少学者将vgb基因应用于细菌[7]、真菌[8]和植物细胞[9]的发酵过程,多数情况下产生了积极的影响,获得了生物量和产物产量的提高。
关于VHb蛋白表达对发酵过程代谢情况影响的作用机制研究发现,大肠杆菌中VHb的表达增加了呼吸链中NADH的消耗,从而增加了TCA循环通量,降低了副产物乙酸的生成[10]。Ramachandran等通过蛋白质组分析发现,在微量溶解氧浓度条件下vgb重组菌株与有氧呼吸及能量代谢有关的酶的表达水平与对照相比都有上升的趋势,氧浓度的限制会给vgb重组菌株一个代谢压力,使重组菌株采用更有效的能量代谢途径来适应这种压力[11]。总体来说,目前一般把异源表达vgb基因的作用归因于VHb增强了氧气传递至呼吸链的过程,进而增加了ATP的生成。也有一些研究认为,氧气作为生物化学反应的底物参与反应,而VHb则有利于氧气参与合成反应,最终有利于产物的合成。
因此,建立合适的脱氮假单胞菌基因改造平台,通过基因工程菌的构建,增强脱氮假单胞菌对氧的亲和力,提升对氧的利用效率,降低由于供氧引起的动力消耗成本,对提高维生素B12产品的市场竞争力非常关键。本研究在确定合适的接合转移操作条件的基础上,通过单交换的方式,将包含天然启动子Pvgb(受氧浓度调控)的vgb基因整合到脱氮假单胞菌染色体上,并通过同位素标记代谢实验,探索VHb蛋白对于脱氮假单胞菌碳中心代谢流变化和维生素B12合成的影响。为进一步基因改造和重组菌株的生产应用推广奠定基础。
1 材料与方法 1.1 材 料 1.1.1 菌株与质粒脱氮假单胞菌由华东理工大学国家生工中心保存。大肠杆菌S17-1、DH5α及质粒pOJ260-vgb(其中,vgb基因片段长度约750bp,包含天然启动子Pvgb)由中国科学院上海有机所保存。
1.1.2 培养基IWL4(g/L):可溶性淀粉 10,KH2PO4 1,MgSO4 1,NaCl 1,(NH4)2SO4 2,CaCO3 2,FeSO4 0.001,MnCl2 0.001,ZnSO4·7H2O 0.001,酵母提取物 0.5,蛋白胨 1,琼脂 20,pH通过NaOH控制在7.2。
YMA(g/L):麦芽提取物 10,酵母提取物 4,葡萄糖 4,ZnCl2 0.000 8,FeCl3 0.004,CuCl2·2H2O 0.000 2,MnCl2·4H2O 0.000 2,Na2B4O7·10H2O 0.000 2,(NH4)6Mo7O24·4H2O 0.000 2,琼脂 20,pH通过NaOH控制在7.2。
TY(g/L):蛋白胨 10,酵母提取物 5,葡萄糖 1,NaCl 5,琼脂 20,pH通过NaOH控制在7.2。
MS(g/L):甘露醇 20,黄豆饼粉 20,琼脂 20,pH通过NaOH控制在7.2。
CCM(g/L):蔗糖 40,玉米浆 20,甜菜碱 4.8,(NH4)2SO4 0.8,(NH4)2HPO4 2.2,MnSO4·H2O 0.8,CoCl2·6H2O 0.022,MgO 0.3,DMBI 0.006,ZnSO4·7H2O 0.022,琼脂 20,pH通过NaOH控制在7.2。
种子培养基(g/L):蔗糖 40,玉米浆 20,甜菜碱 5,(NH4)2SO4 1,(NH4)2HPO4 2,MnSO4·H2O 0.8,CoCl2·6H2O 0.02,MgO 0.3,DMBI 0.01,ZnSO4·7H2O 0.01,CaCO3 1.5,pH通过NaOH控制在7.2~7.4。
发酵培养基(g/L):葡萄糖 40,MgSO4 2,(NH4)2HPO4 5.7,KCl 1,urea 2,Na2HPO4 2,(NH4)2SO4 6,betaine 4,DMBI 0.05,MnSO4 0.002,ZnSO4 0.002,FeSO4 0.003,NaMoO4 0.002,CoCl2 0.0025,CaCO3 1.5,pH利用NaOH控制在7.2。
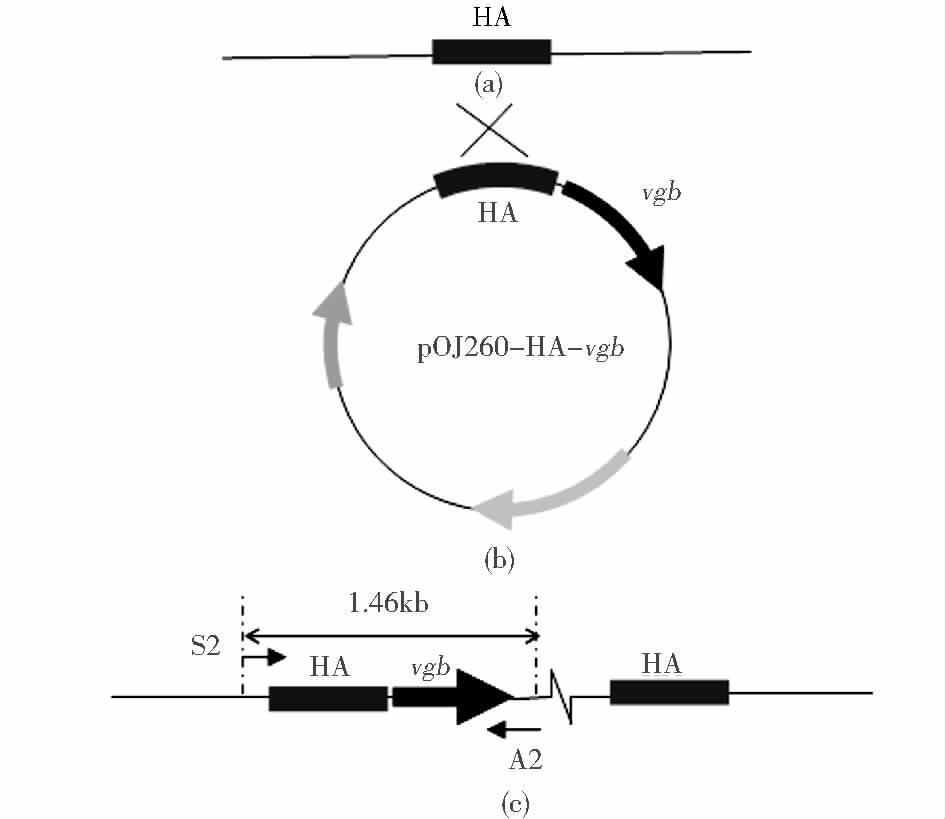
1.2 方 法 1.2.1 载体构建选择自杀性质粒pOJ260,带有阿普拉抗性,拥有转移性复制子oriT,vgb基因通过XbaI/EcoRI双酶切,插入pOJ260的lacZα基因中的多克隆位点。经过比对,选择脱氮假单胞菌染色体上非看家基因,没有明确功能的长度为550bp的片段作为同源臂(HA),以脱氮假单胞菌为模板,设计引物S1:ATTAAGCTTGAAGCCGAAGCAGGAGAAGG(引入HindⅢ酶切位点)和A1:ATTTCTAGAATCCACGACAGCGAAACCCA(引入XbaI酶切位点),PCR扩增出HA。通过XbaI/HindⅢ双酶切与质粒pOJ260-vgb连接,如图 1所示,构建载体pOJ260-HA-vgb。
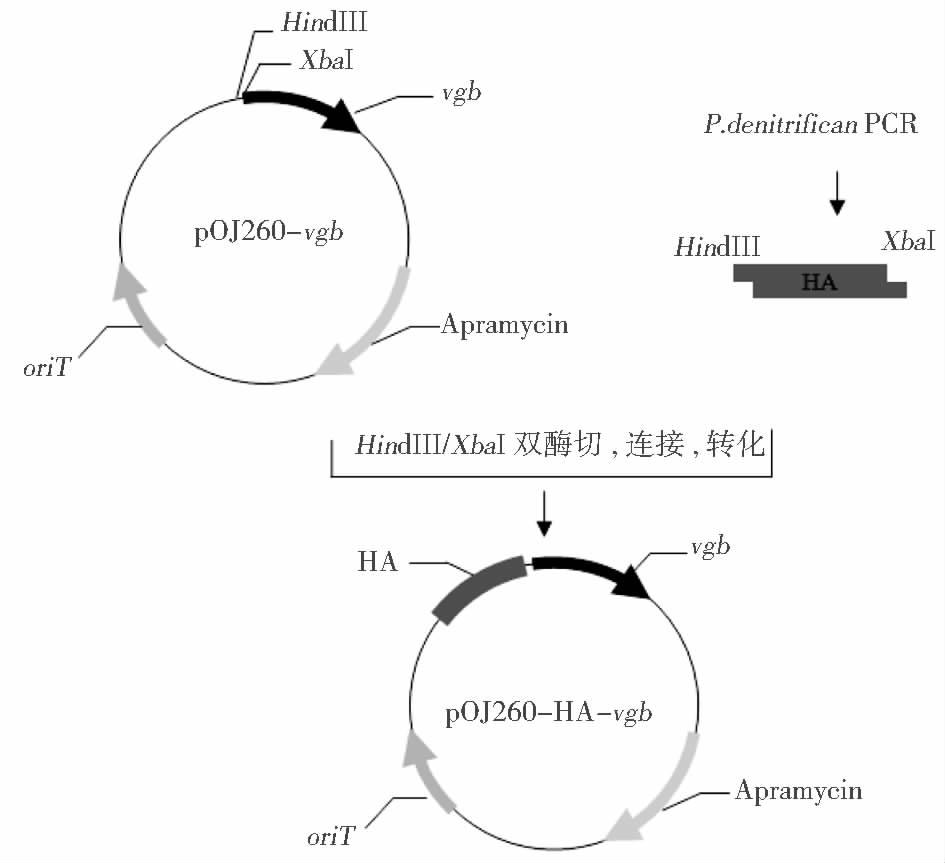
|
| 图 1 载体pOJ260-HA-vgb构建 Figure 1 The construction of vector pOJ260-HA-vgb |
构建载体送测序公司测序,验证正确后通过电激的方式转入大肠杆菌S17-1。
1.2.2 接合转移操作挑E.coli S17-1单菌落至含有抗生素的LB试管过夜培养,转接至35ml/250ml三角瓶中,培养至OD为0.4~0.6,3 500r/min,离心10min,收集菌体,用新鲜的LB培养基洗涤2次,菌体用1ml LB培养基悬浮,在EP管中加入200μl。挑脱氮假单胞菌单菌落至TSB试管中培养24h,离心浓缩至2ml,用匀浆器上下抽拉70次,EP管中加入200μl。混匀涂布在平板上。另外将同样处理的脱氮假单胞菌单独涂布在对照板上,每块200μl,作为阴性和阳性对照,超净台上吹干,30℃培养。16h后除阳性对照外,每块平板覆盖1ml抗生素,超净台吹干。30℃培养3天。
1.2.3 接合子PCR验证挑接合子在含有抗生素的TSB试管中,30℃培养24h,设计外围引物,对菌液进行PCR,以出发菌株作为对照。
1.2.4 摇瓶发酵工艺条件用无菌水将培养好的菌种斜面洗下的菌液接种到500ml的种子培养摇瓶中,培养24h后,取10ml种子液无菌条件下离心收集菌体,用无菌水重悬后接种到发酵摇瓶中培养,培养温度32℃,500ml发酵摇瓶装液量为120ml,摇床转速180r/min。
1.2.5 脱氮假单胞菌合成维生素B12代谢网络的构建根据课题组之前研究建立的脱氮假单胞菌的代谢网络途径,加上对该菌的全基因组扫描及功能基因统计分析,我们建立了维生素B12合成的代谢网络模型(表 1)。该模型包括碳中心代谢的EMP、ED、PPP、TCA、C1途径和产物维生素B12的合成途径。
| r1 | glucose + ATP → glucose-6-p + ADP |
| r2 | glucose-6-p → fructose-6-p |
| r3 | fructose-6-p + ATP →2 glyceraldehyde-3-p + ATP |
| r4 | glyceraldehyde-3-p + NAD+ + ADP → 3-phosphoglycerate + NADH + ATP |
| r5 | 3-phosphoglycerate → phosphoenolpyruvate |
| r6 | phosphoenolpyruvate + ADP → pyruvate + ATP |
| r7 | pyruvate + NAD+ → acetyl-CoA + CO2+NADH |
| r8 | glucose-6-p + NADP+ →6-p-gluconate + NADPH |
| r9 | glucose-6-p +2 NADP+ → pentose-5-p + CO2 + 2 NADPH |
| r10 | 2 pentose-5-p → sedoheptulose-7-p + glyceraldehydes-3-p |
| r11 | sedoheptulose-7-p + glyceraldehyde 3-p → erythrose-4-p + fructose-6-p |
| r12 | erythrose-4-p + pentose-5-p→ fructose-6-p + glyceraldehydes-3-p |
| r13 | 6-p-gluconate →2-keto-3-deoxy -6-gluconate |
| r14 | 2-keto-3-deoxy -6-gluconate → glyceraldehyde-3-p + pyruvate |
| r15 | acetyl-CoA + oxaloacetate → citrate |
| r16 | citrate + NADP+ → α-ketoglutarate + CO2 + NADPH |
| r17 | α-ketoglutarate → succinyl-CoA + CO2 + ATP+FADH |
| r18 | succinyl-CoA + NAD+ → succinate + NADH |
| r19 | succinate + NAD+ = oxaloacetate + NADH |
| r20 | pyruvate + CO2 + ATP→ oxaloacetate + ADP |
| r21 | oxaloacetate + ATP→ phosphoenolpyruvate + CO2 + ADP |
| r22 | 3-phosphoglycerate → serine |
| r23 | serine = glycine + mTHF |
| r24 | glycine + succinyl-CoA → δ-aminolevulinic acid + CO2 |
| r25 | α-ketoglutarate → glutamate |
| r26 | glutamate → δ-aminolevulinic acid |
| r27 | 8 δ-aminolevulinic acid + 10 NADPH + 17 ATP → vitamin B12 + 10 NADP+ + 17 ADP |
| r28 | betaine → glycine + 3 CH3- |
| r29 | glutamate → out |
| r30 | glycine→ out |
| r31 | NADPH + 0.5 O2 → NADP+ + 1.3 ATP |
| r32 | NADH + 0.5 O2 → NAD+ + 1.3 ATP |
| r33 | FADH + 0.5 O2 → FAD+ + ATP |
| r34 | Biomass synthesis: C4.09H7.26 N0.84O1.98 and ash 2.63% 0.156 glucose-6-P + 0.149 fructose-6-P + 0.96 pentose-5-P + 0.44 erythrose-4-P + 0.338 glyceraldehyde 3-P + 0.963 phosphoenolpyruvate + 3.272 pyruvate + 0.883 serine + 2.320 acetyl-CoA + 0.035 citrate + 1.782 oxaloacetate + 1.562 glutamate + 0.096 succinyl-CoA + 0.035 δ-aminolevulinic acid + 38.267 ATP +16.294 NADPH + 3.102 NAD+ → biomass + 38.267 ADP+16.294 NADP+ + 3.102 NAD+ |
在代谢网络构建时,已经作了以下假设和简化:
(1) 假定不同发酵阶段和不同条件下菌体组成成分一致;
(2) 没有支路的代谢反应合并为一个反应。
在代谢网络中,参照文献[12]中的方法,建立每一个节点流入和流出的代谢速率平衡方程,形成化学计量矩阵,该代谢模型矩阵平衡方程见下式。
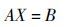 |
(1) |
式中,对于有N种代谢物、M个代谢反应的代谢网络,A是N×M化学计量关系矩阵,X是M维反应速率向量,B是M维代谢物的质量变化速率和环境交换速率的差。
在该代谢网络模型中,矩阵包含36个未知数,32个代谢物平衡关系方程。可测得有效的速率常数有比葡萄糖消耗速率、比谷氨酸合成速率、比甘氨酸生成速率、比甜菜碱消耗速率、比维生素B12合成速率。同时利用13C全标记葡萄糖和1位标记葡萄糖的同位素标记实验的数据,根据得到的中间代谢物的碳原子同位素标记丰度信息,得到相关的7个途径通量的比率(表 2),作为代谢模型的约束条件,所以共有方程数39个,代谢通量矩阵方程组有最优解。
| 代谢节点通量比率 | 方程 |
| SER from EMP pathway | 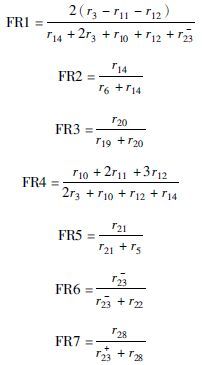 |
| PYR from ED pathway | |
| OAA through PYR | |
| PEP from PP pathway | |
| PEP through OAA | |
| SER through GLY | |
| GLY through BET | |
| Note:“+” and “-” represent the forward and the reverse direction of the reaction respectively | |
1.2.6 代谢物同位素标记丰度测定与代谢途径节点通量比率计算
在全合成培养基中葡萄糖的标记模式为两种:一种为4∶1摩尔比的天然葡萄糖:全碳标记葡萄糖[U-13C];另一种标记模式为4∶1摩尔比的天然葡萄糖∶1位碳标记葡萄糖[1-13C]。对培养到86h的出发菌株和重组菌株的发酵液分别取样5ml离心得到菌体,用6mol/L盐酸95℃酸水解24h,将水解液干燥得到黄色氨基酸晶体加入100μl吡啶溶解,再加50μl衍生剂N-(叔丁基二甲基硅)-N-甲基三氟乙酰胺(MBDSTFA)混匀后于60℃衍生30min,过滤后进行GC-MS测定分析。
得到的不同的氨基酸碎片总同位素标记丰度(SFL)的计算见式(2),
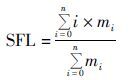 |
(2) |
式中,n是氨基酸的碳原子数;mi是矫正后氨基酸含有i个标记原子的质量同位素丰度。
利用同位素标记代谢物丰度处理与途径通量比率统计软件Fiatflux软件[13],通过各节点相关的代谢物同位素标记质量丰度向量信息,进行通量比率的统计计算[14],获得如表 2所示的部分代谢途径通量的比率。
2 实验结果 2.1 接合转移条件确定 2.1.1 合适培养基初选考察供体菌大肠杆菌S17-1和受体菌脱氮假单胞菌在IWL4、MS、TY、YMA和CCM培养基上的长势。挑取单菌落至试管培养过夜,离心收集菌体,加入1ml无菌水,悬浮菌体,分别涂布于平板上,30℃下培养,在16h和48h观察供体菌大肠杆菌和受体菌脱氮假单胞菌的生长情况,结果见表 3。
| 培养基 | 大肠杆菌S17-1 | 脱氮假单胞菌 |
| IWL4 | 生长 | 生长 |
| MS | 生长 | 不生长 |
| TY | 生长,出现菌苔 | 不生长 |
| YMA | 生长,出现菌苔 | 生长 |
| CCM | 生长 | 生长 |
接合转移培养基必须满足当大肠杆菌和脱氮假单胞菌在同一平板上生长时,两者具有合适的生长速率,在14~18h覆盖抗生素之前,避免大肠杆菌生长过快形成的菌苔对脱氮假单胞菌生长的抑制,提升结合转移效率。合理的培养基同时也必须适合受体菌脱氮假单胞菌的生长需求,这是获得接合子的保障。从结果可以看出,IWL4和CCM培养基是进行接合转移操作合适的培养基,在16h左右,供体菌大肠杆菌的生长未出现菌苔,且受体菌脱氮假单胞菌在两种培养基上可以生长。而另外几种培养基存在大肠杆菌生长过快,或脱氮假单胞菌难于生长的问题,不予采用。
2.1.2 脱氮假单胞菌对不同抗生素敏感性试验在接合转移的操作中,由于是二亲本杂交过程,因此必须选定一种抗生素能够抑制大肠杆菌的生长但不影响脱氮假单胞菌的生长,在适当的时机覆盖在培养基平板上。分别考察脱氮假单胞菌对常用抗生素卡那霉素、氯霉素、氨苄青霉素、阿普拉霉素、红霉素、萘啶酮酸的敏感性,每种抗生素选择两种适用浓度。挑取脱氮假单胞菌单菌落至试管,培养过夜,收集菌体,加入1ml无菌水悬浮,分别涂布于添加相应抗生素的平板上,30℃下培养48h,观察结果。
从表 4所示结果中可以看到,受体菌脱氮假单胞菌自身只对卡那霉素表现出抗性,且在25μg/ml和50μg/ml两种浓度的平板上都能生长,因此选用卡那霉素作为结合转移实验中大肠杆菌的抑制剂。从抗生素敏感性实验也可以确定,脱氮假单胞菌对阿普拉霉素敏感,可以选择阿普拉霉素作为重组株的筛选标记。
| 抗生素 | 含量(μg/ml) | 生长 | 含量(μg/ml) | 生长 |
| 卡那霉素 | 25 | + | 50 | + |
| 氯霉素 | 10 | - | 20 | - |
| 氨苄青霉素 | 100 | - | 200 | - |
| 阿普拉霉素 | 50 | - | 100 | - |
| 红霉素 | 100 | - | 200 | - |
| 萘啶酮酸 | 20 | - | 50 | - |
| Note: (+) represented growing; (-) represented non-growing | ||||
2.2 vgb重组菌株的构建 2.2.1 大肠杆菌S17-1-脱氮假单胞菌的接合转移效率
从表 5所示结果来看,CCM培养基接合效率较高,适合脱氮假单胞菌的接合转移操作,而在IWL4培养基上并没有长出接合子,该培养基对于脱氮假单胞菌的接合转移操作来说不合适。虽然在前期的培养基初选过程中,脱氮假单胞菌能够在IWL4上生长,但对于接合转移操作来说,并没有好的效果,这种情况在许多微生物接合转移实验中都有出现,可以说培养基的选择是影响接合转移效率的重要因素之一。
| 供体菌OD700 | 受体菌OD700 | 培养基 | 接合转移效率 |
| 0.4~0.6 | 0.4~0.6 | IWL4 | 0 |
| 0.4~0.6 | 0.4~0.6 | CCM | 6.45×10-6 |
| 0.4~0.6 | IWL4 | (+)长满 | |
| (-)无 | |||
| 0.4~0.6 | CCM | (+)长满 | |
| (-)无 | |||
| Note: (+) represented the positive control and 200μl P. denitrificans were spread on the plate with no antibiotic; (-) represented the negative control and 200μl P. denitrificans were spread on the plate with addition of 1ml antibiotic at 16h to achieve 100μg/ml apramycin and 50μg/ml kanamycin finally | |||
2.2.2 接合子PCR验证
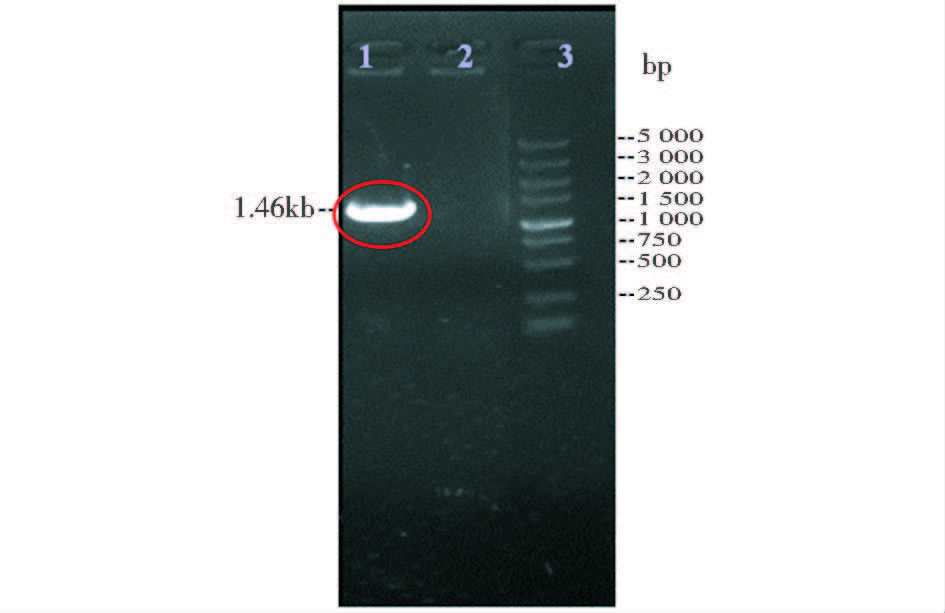
如图 2所示,分别设计外围引物S2和A2,利用S2和A2对出发菌株和经过阳性克隆菌株挑选及发酵初筛得到的重组菌株Pvgb-16进行PCR验证。从图 3可以看到,对于出发菌株,没有电泳条带,而对于重组菌株Pvgb-16,得到1.46kb左右的电泳条带。由此可以确定vgb基因成功通过单交换的方式结合在脱氮假单胞菌染色体上,将该菌株以vgb重组菌株Pvgb-16表示。
|
| 图 2 单交换重组菌株示意图 Figure 2 The sketch map of the single crossover mutant (a) Original strain (b) Plasmid pOJ60-HA-vgb (c) vgb recombinant strain Pvgb-16 |
|
| 图 3 S2/A2 PCR结果 Figure 3 S2/A2 PCR result 1:vgb recombinant strain Pvgb-16; 2:Original strain;3:DL 5000marker |
为了更好地了解vgb重组菌株Pvgb-16与出发菌株在胞内代谢途径通量上的差异,本研究利用不同的标记模式的葡萄糖,分别对重组菌株和出发菌株进行发酵过程代谢途径通量的13C同位素标记代谢考察。宏观代谢参数见表 6和图 4。
| Parameter | Symbol | P. d control | P. d vgb | ||
| 1-13C | U-13C | 1-13C | U-13C | ||
| 标记葡萄糖:天然葡萄糖 | 20:80 | 20:80 | 20:80 | 20:80 | |
| 比生长速率 | /h | 0.053 | 0.056 | 0.067 | 0.065 |
| 比葡萄糖消耗速率 | mmol/(gDCW·h) | 0.82 | 0.85 | 0.94 | 0.96 |
| 比谷氨酸生成速率 | mmol/(gDCW·h) | 0.014 | 0.012 | 0.019 | 0.021 |
| 比甜菜碱消耗速率 | mmol/(gDCW·h) | 0.022 | 0.024 | 0.049 | 0.051 |
| 比产物合成速率 | mg/(gDCW·h) | 0.08 | 0.09 | 0.12 | 0.14 |
|
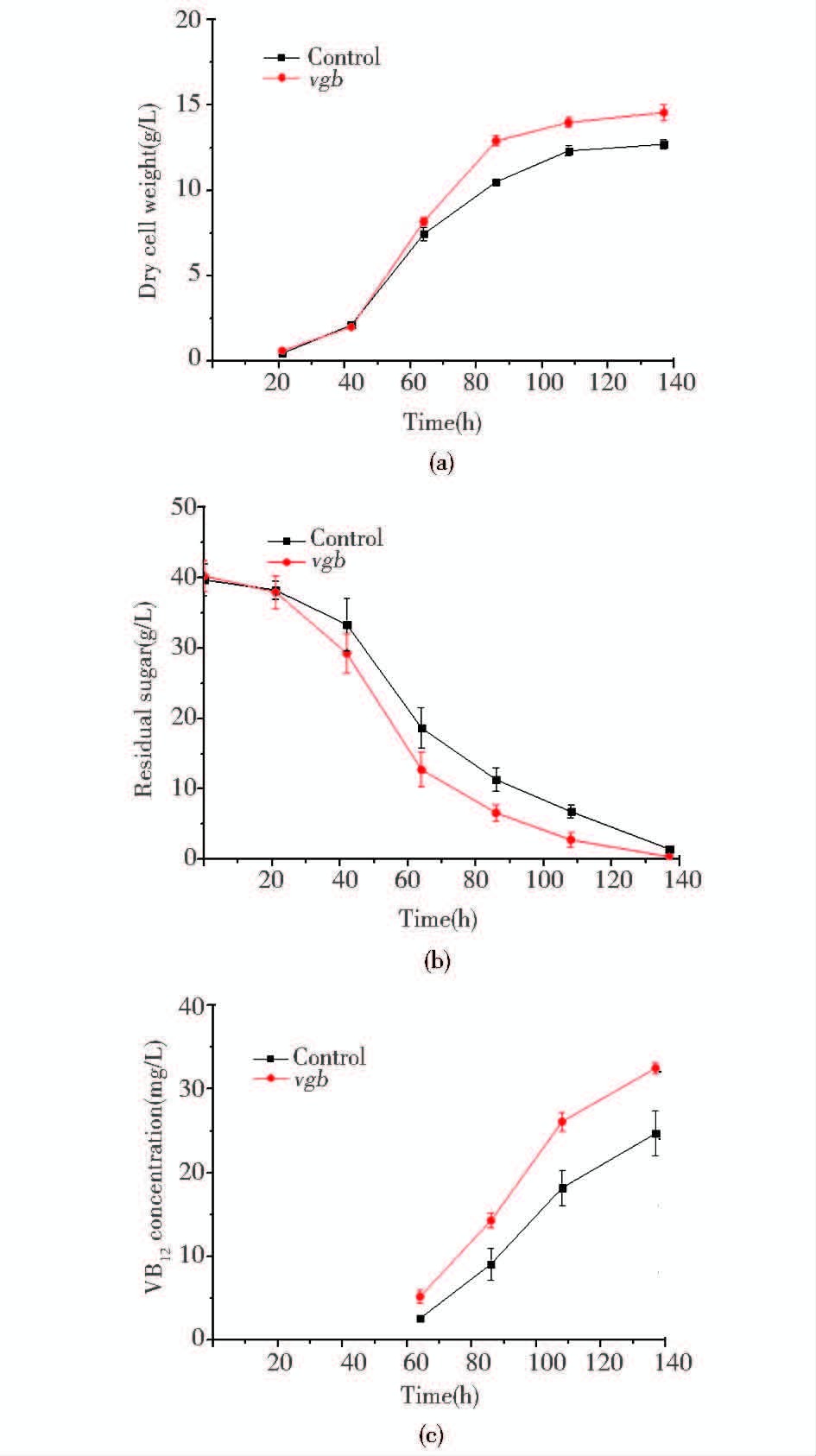
| 图 4 出发菌株和vgb重组菌株Pvgb-16发酵特性比较 Figure 4 The comparison of fermentation characteristic of original strain and vgb recombinant strain Pvgb-16 |
从菌浓的变化趋势中可以看出,vgb重组菌株Pvgb-16能够维持较高的比生长速率,培养60h后的菌浓高于出发菌株。64~86h的比生长速率平均为0.066/h,高于出发菌株的0.054/h。同时,底物葡萄糖的残留浓度变化表明,vgb重组菌株Pvgb-16糖消耗的速率也明显增加,比葡萄糖消耗速率[0.95mmol/(gDCW·h)]比出发菌株[0.84mmol/(gDCW·h)]高出了13.1%。维生素B12在菌体对数生长期后期开始快速合成,发酵糖耗尽后,vgb重组菌株的发酵单位(32.5±1.6)mg/L,明显高于出发菌株的(24.7±2.1)mg/L。通过胞外代谢物检测显示,vgb重组菌株Pvgb-16有较多谷氨酸的积累,而甜菜碱的比消耗速率在重组菌株中达到了0.050mmol/(gDCW·h),高于出发菌株的0.023mmol/(gDCW·h)。该阶段vgb重组菌株维生素B12的比合成速率也显著高于出发菌株。
2.3.2 氨基酸标记信息与代谢途径通量估算分析将86h(维生素B12产物合成期)采样点的菌体蛋白经水解衍生后进行GC-MS测定及矫正分析,得到的在1-13C标记葡萄糖情况下测得氨基酸的标记丰度信息,见表 7。
| 衍生后氨基酸 | MIAF | 前体 | 对映C原子 | SFL(%) | |
| P.d vgb | P.d control | ||||
| Glucose | 331 | G6P | 1,2,3,4,5,6 | 24.6 | 22.0 |
| Glycine | 175 | PGA | 1,2 | 1.3 | 1.4 |
| Glycine | 144 | PGA | 1,2 | 1.4 | 1.5 |
| Glycine | 85 | PGA | 2 | 0.6 | 0.7 |
| Serine | 390 | PGA | 1,2,3 | 0.7 | 0.9 |
| Serine | 362 | PGA | 2,3 | 0.5 | 0.6 |
| Alanine | 232 | PYR | 2,3 | 0.6 | 0.9 |
| Alanine | 260 | PYR | 1,2,3 | 8.4 | 10.7 |
| Leucine | 274 | PYR+AcCoA | 2,2,3,3+2 | 1.6 | 1.9 |
| Valine | 186 | PYR | 2,2,3,3 | 1.1 | 2.0 |
| Valine | 260 | PYR | 2,2,3,3 | 1.1 | 1.8 |
| Valine | 302 | PYR | 1,2 | 7.8 | 10.4 |
| Aspartate | 390 | OAA | 2,3,4 | 3.8 | 4.2 |
| Aspartate | 418 | OAA | 1,2,3,4 | 5.1 | 5.7 |
| Threonine | 302 | OAA | 1,2 | 3.3 | 3.5 |
| Isoleucine | 274 | OAA+PYR | 2,3,4+2,3 | 3.9 | 4.4 |
| Glutatmate | 302 | α-KG | 1,2 | 1.6 | 2.1 |
| Glutatmate | 404 | α-KG | 2,3,4,5 | 1.9 | 2.1 |
| Glutatmate | 432 | α-KG | 1,2,3,4,5 | 3.6 | 3.9 |
| Phenylalanine | 302 | PEP | 1,2 | 1.8 | 1.5 |
| Phenylalanine | 308 | PEP+E4P | 2,2,3,3+1,2,3,4 | 1.3 | 1.8 |
| Note:MIAF,Mass of lightest isotopomer for amino acid fragments(m/z) | |||||
结果显示,丙氨酸(Ala)的第一位及第二位碳原子Ala (1-2)和缬氨酸(Val)第一及第二位碳原子Val(1-2)的标记丰度明显高于碎片Ser (2-3)、Ala (2-3)和Val (2-5)的碳原子的总标记丰度值,说明该菌的代谢途径主要走ED途径,EMP途径通量很低。因为葡萄糖经EMP、ED或PP途径产生的丝氨酸、磷酸烯醇式丙酮酸和丙酮酸的标记信息完全不一样。尽管由EMP或ED途径生成的丙酮酸都是50%标记的和50%未标记的,但在EMP途径中生成的丙酮酸的标记碳原子在第三位上,而由ED途径生成的丙酮酸的标记碳原子却是在第一位,经过PP途径生成的丙酮酸没有标记信息。该结果与本课题之前的研究一致[14],也与报道的P. putida的结果相似[15]。
根据相应的氨基酸和中间代谢物的质量同位素分布向量(MDV),计算得到相关代谢途径通量比率如表 8所示。
| Flux point | 通量比率(%) | ||
| P.d control | P.d vgb | ||
| Ser from EMP pathway | FR1 | 2.9 ± 1.3 | 6.2 ± 4.1 |
| PYR from ED pathway | FR2 | 76.3 ±3.8 | 66.4 ± 5.5 |
| OAA through PYR | FR3 | 46.3 ± 3.3 | 52.2 ± 2.9 |
| PEP from PP pathway | FR4 | 20.3 ± 2.8 | 39.2 ± 2.6 |
| PEP through OAA | FR5 | 20.5 ± 1.9 | 28.2 ± 2.4 |
| Ser through Gly | FR6 | 27.8 ± 4.3 | 24.2 ± 3.5 |
| Gly through Bet | FR7 | 30.8 ± 2.0 | 47.4 ±3.2 |
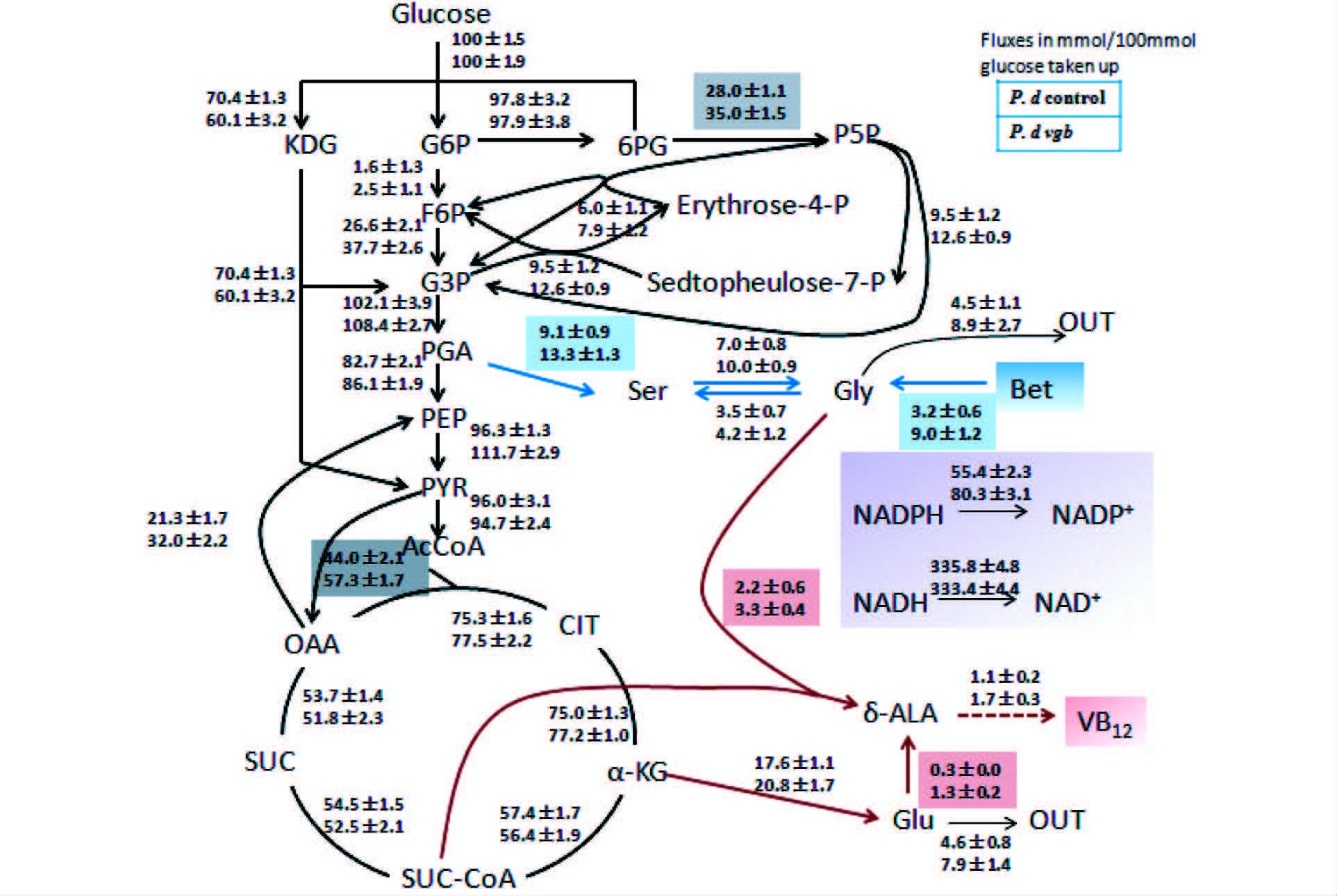
根据可测得的比葡萄糖消耗速率、比谷氨酸合成速率、比甘氨酸生成速率、比甜菜碱消耗速率、比维生素B12合成速率及由标记实验获得的代谢节点生成通量的比率关系,利用MATLAB进行回归计算,得到了代谢网络通量分布模型(图 5),模型验证评价分析总体偏差低于5%,可以认为模型可靠。
|
| 图 5 P. denitrificans出发菌株及vgb重组菌株产物合成期(64~86h)的中心碳代谢通量分析计算(mmol/100 mmol 葡萄糖) Figure 5 Metabolic fluxes in the central metabolism and VB12 biosynthetic pathways of original P. denitrificans and recombinant strain with vgb gene integration during product synthesis stage (64-86h)(mmol/100mmol glucose) Up: Original strain; Down: vgb recombinant strain |
(1) PP途径。微生物胞内磷酸戊糖(PP)途径为菌体生长和产物的合成代谢过程提供前体及能量。例如,为核苷酸、核苷酸辅酶的合成提供5-磷酸核糖,为芳香族氨基酸合成提供4-磷酸赤藓糖,为维生素B12、脂肪酸、胆固醇的生物合成途径提供NADPH。6-磷酸葡萄糖酸是该菌胞内ED、EMP和PP途径的关键节点,代谢流通量分布信息表明,在vgb重组菌株Pvgb-16中由6-磷酸葡萄糖酸(6PG)生成5-磷酸核酮糖(P5P)的通量为(35±1.5)mmol/100mmol葡萄糖,比出发菌株的通量(28±1.1)mmol/100mmol葡萄糖高出了25%,而且PP途径中其它反应的相关通量也高于出发菌株。该途径通量的增强为促进菌体比生长速率提供了必要的前体物质和还原力支持。
(2) TCA循环。是糖氧化分解生成二氧化碳、NADH,以及底物氧化磷酸化生成能量维持菌体代谢的重要途径。代谢途径通量分析显示,vgb重组菌株Pvgb-16与出发菌株对应的代谢流通量基本一致。
(3) C1单位的代谢途径。丝氨酸从3-磷酸甘油酸(PGA)合成的通量变化较大,vgb重组菌株Pvgb-16中丝氨酸从PGA生成的通量为(13.3±1.3)mmol/100mmol葡萄糖,明显高于出发菌株的通量(9.1±0.9)mmol/100mmol葡萄糖。代谢途径通量比率统计结果显示,丝氨酸由甘氨酸合成的通量比率在vgb重组菌中为24.2%,在出发菌株中为27.8%,而在vgb重组菌中甘氨酸由甜菜碱生成的通量比率占到了47.4%,明显高于出发菌株的30.8%,说明vgb基因的导入促进了甜菜碱的代谢速率。甜菜碱是维生素B12合成的重要甲基供体前体物质,甜菜碱的快速利用会促进产物合成途径通量的增加。
(4) 维生素B12合成途径。甘氨酸和琥珀酰辅酶A(C4途径)与谷氨酸(C5途径)两条途径用于合成重要代谢物前体氨基乙酰丙酸(ALA)。代谢途径通量分析表明,vgb重组菌株Pvgb-16中谷氨酸和甘氨酸流向产物合成途径的通量明显高于出发菌株,并伴随着较大通量的谷氨酸和甘氨酸的胞外释放。由甘氨酸和琥珀酰辅酶A合成ALA是该生产菌株维生素B12合成的主要途径,在重组菌株Pvgb-16中甜菜碱代谢生成甘氨酸速率的提升,促进了前体甘氨酸和次级代谢过程甲基供体的供给速率,提升了产物的合成通量比率。
(5) 回补途径。vgb重组菌株Pvgb-16中的通量高于出发菌株,该通量的增加补充了TCA途径中的前体代谢物(琥珀酰辅酶A和α-酮戊二酸),被用于菌体生长。
(6) 辅酶和能量的代谢。维生素B12是复杂的大分子化合物,在其合成过程中,无论是卟啉环的合成、低位配基的合成还是多步的甲基化和氨基化的过程都需要大量NADPH的参与[12],因此一定通量的还原力和能荷水平对产物的合成非常关键。从辅酶和能量的代谢变化分析中可以看出,虽然NADH的通量在两个菌种中没有明显差异,但NADPH的通量在vgb重组菌株Pvgb-16中明显高于出发菌株,该还原力对维生素B12次级代谢合成和菌体生长过程起着重要的促进作用。
3 结 论本文为脱氮假单胞菌建立了完整的接合转移操作流程,选用载体pOJ260-vgb,连接长度以550bp片段为同源臂,通过属间接合转移的方式,利用大肠杆菌S17-1将质粒载体转移至受体菌脱氮假单胞菌中,并以单交换的方式整合到菌体染色体上,首次实现了外源vgb基因在维生素B12生产菌株脱氮假单胞菌染色体上的整合。具体接合转移条件为:选择CCM培养基,培养温度为30℃,选用卡那霉素作为抑制大肠杆菌生长的抗生素,阿普拉霉素作为抗性筛选标记,分别以终浓度50μg/ml和100μg/ml在16h添加。通过对vgb重组菌株Pvgb-16和出发菌株的碳中心代谢和维生素B12合成情况分析,明确了在相同供氧条件下,vgb基因的导入有利于增强PP途径通量,为菌体生长提供前体和还原力。同时增强了甜菜碱代谢合成甘氨酸途径,进一步促进C4途径合成前体物质ALA的通量,进而加速产物维生素B12的合成。相关研究为进一步的基因改造和重组菌株的生产应用推进奠定基础。
| [1] | 马蕙, 王丽丽, 张春晓, 等. 维生素B12的生物合成, 发酵生产与应用. 生物工程学报 , 2008, 24 (6) : 927–932. Ma H, Wang L L, Zhang C X, et al. The biosynthesis, fermentation and application of vitamin B12. Chinese Journal of Biotechnology , 2008, 24 (6) : 927–932. |
| [2] | Li K T, Liu D H, Zhuang Y P, et al. Influence of Zn2+, Co2+ and dimethylbenzimidazole on vitamin B12 biosynthesis by Pseudomonas denitrificans. World Journal of Microbiology and Biotechnology , 2008, 24 (7) : 2525–2530. |
| [3] | Li K T, Liu D H, Chu J, et al. An effective and simplified pH-stat control strategy for the industrial fermentation of vitamin B12 by Pseudomonas denitrificans. Bioprocess and Biosystems Engineering , 2008, 31 (6) : 605–610. DOI:10.1007/s00449-008-0209-5 |
| [4] | Wang Z J, Wang H Y, Li Y L, et al. Improved vitamin B12 production by step-wise reduction of oxygen uptake rate under dissolved oxygen limiting level during fermentation process. Bioresource Technology , 2010, 101 (8) : 2845–2852. DOI:10.1016/j.biortech.2009.10.048 |
| [5] | Pablos T E, Mora E M, Borgne S L, et al. Vitreoscilla hemoglobin expression in engineered Escherichia coli:improved performance in high cell-density batch cultivations. Biotechnolology Journal , 2011, 6 (8) : 993–1002. |
| [6] | Stark B C, Pagilla K R, Dikshit K L. Recent applications of Vitreosicilla hemoglobin technology in bioproduct synthesis and bioremediation. Applied Microbiology and Biotechnology , 2015, 99 (4) : 1627–1636. DOI:10.1007/s00253-014-6350-y |
| [7] | Shen X W, Yang Y, Jian J, et al. Production and characterization of homopolymer poly (3-hydroxyvalerate) (PHV) accumulated by wild type and recombinant Aeromonas hydrophila strain 4AK4. Bioresource Technology , 2009, 100 (18) : 4296–4299. DOI:10.1016/j.biortech.2009.03.065 |
| [8] | Zhu H, Sun S, Zhang S. Enhanced production of total flavones and exopolysaccharides via Vitreoscilla hemoglobin biosynthesis in Phellinus igniarius. Bioresource Technology , 2011, 102 (2) : 1747–1751. DOI:10.1016/j.biortech.2010.08.085 |
| [9] | Li X, Peng R H, Fan H Q. Vitreoscilla hemoglobin overexpression increases submergence tolerance in cabbage. Plant Cell Reports , 2005, 23 (10) : 710–715. |
| [10] | Pablos T E, Sigala J C, Borgne S L, et al. Aerobic expression of Vitreoscilla hemoglobin efficiently reduces overflow metabolism in Escherichia coli. Biotechnology Journal , 2014, 9 (6) : 791–799. DOI:10.1002/biot.201300388 |
| [11] | Ramachandran B, Dikshit K L, Dharmalingam K, Recombinant E. coil expressing Vitreoscilla haemoglobin prefers aerobic metabolism under microaerobic conditions:a proteome-level study. Journal of Biosciences , 2012, 37 (4) : 617–633. DOI:10.1007/s12038-012-9245-z |
| [12] | 王泽建. 宏观和微观代谢分析相结合的系统生物过程研究-微生素B12发酵过程优化. 上海:华东理工大学,生物工程学院,2010. Wang Z J. Optimization of Vitamin B12 Fermentation Process by Integration of Microbial Macro and Micro Metabolic Analysis in the Context of Industrial Systems Bioprocess Engineering in Pseudomonas denitrificans. Shanghai:East China University of Science and Technology, School of Biological Engineering, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10251-1012250622.htm |
| [13] | Nanchen A, Fuhrer T, Sauer U. Determination of metabolic flux ratios from 13C-experiments and gas chromatography-mass spectrometry data:protocol and principles. Methods in Molecular Biology , 2007, 358 (5) : 177–197. |
| [14] | Wang Z J, Wang P, Liu Y W, et al. Metabolic flux analysis of the central carbon metabolism of the industrial vitamin B12 producing strain Pseudomonas denitrificans using 13C-labeled glucose. Journal of the Taiwan Institute of Chemical Engineers , 2012, 43 (2) : 181–187. DOI:10.1016/j.jtice.2011.09.002 |
| [15] | Wierckx N, Ruijssenaars H J, Winde J H D, et al. Metabolic flux analysis of a phenol producing mutant of Pseudomonas putida S12:verification and complementation of hypotheses derived from transcriptomics. Journal of Biotechnology , 2009, 143 (2) : 124–129. DOI:10.1016/j.jbiotec.2009.06.023 |
 2016, Vol. 36
2016, Vol. 36




