文章信息
- 康国凯, 冯国栋, 曹坤琳, 陈正军, 葛向阳.
- KANG Guo-kai, FENG Guo-dong, CAO Kun-lin, CHEN Zheng-jun, GE Xiang-yang.
- 重组毕赤酵母(Pichia pastoris)高产Lunasin的发酵工艺优化
- Optimization for High Production Fermentation of Lunasin from Recombinant Pichia pastoris
- 中国生物工程杂志, 2016, 36(8): 73-79
- CHINA BIOTECHNOLOGY, 2016, 36(8): 73-79
- http://dx.doi.org/DOI:10.13523/j.cb.20160810
-
文章历史
- 收稿日期: 2016-03-03
- 修回日期: 2016-03-29
Lunasin蛋白分子量很小,是一个由43个氨基酸组成的多肽[1]。1987年,日本新泻大学医学部在寻找蛋白酶抑制剂过程中从大豆中发现并分离出Lunasin。在以后的研究中发现Lunasin具有抗炎,抗氧化,抗癌和降低胆固醇等生物活性。此后在小麦、大麦等作物中发现也有Lunasin的存在,但是植物蛋白中Lunasin浓度范围在0.013~70.5mg/g[2],远低于作用浓度所需的水平。
虽然多种植物中都含Lunasin,但含量均较低,且人工合成Lunasin成本昂贵,导致Lunasin原料的缺乏,从而制约了其研究和应用的发展[3]。
治疗性多肽和蛋白质的生产方法主要有化学合成法和微生物工程法。化学合成可以作为一种高效的生产方式,但是超过35个氨基酸序列的多肽在工艺以及经济上通常是不可行的[4],Kyle等[5]通过大肠杆菌表达了CBD-Lunasin融合蛋白,但是最终产量只有210 mg/L。
构建了带有6个his标签的重组载体,并转化入毕赤酵母,成功表达出具有生物活性的Lunasin。通过高密度发酵将Lunasin表达量提高到了3.27 g/L,为该蛋白的工业化生产打下了基础。
1 材料与方法 1.1 菌株毕赤酵母Pichia pastoris GS115 LN菌株:由华中农业大学发酵工程研究室构建,同时具有His+和Mut+表型,目标蛋白在N端带有His·Tag。
1.2 培养基YPD培养基:葡萄糖2%,蛋白胨2%,酵母提取物1%。
YPG培养基:甘油2%,蛋白胨2%,酵母提取物1%。
BMGY生长培养基:酵母提取物10 g/L,蛋白胨20 g/L,121 ℃灭菌后添加过滤除菌的100 ml 10%甘油,100 ml 13.4%无氨基酸酵母氮源,2 ml 0.02%生物素,100ml l mol /L磷酸缓冲液(pH6.0)。
BMMY诱导培养基:酵母提取物10 g/L,蛋白胨20 g/L,121 ℃灭菌后添加过滤除菌的100 ml 5%甲醇,100 ml 13.4%无氨基酸酵母氮源,2 ml 0.02%生物素,100 ml l mol/L磷酸缓冲液(pH6.0)。
分批发酵培养基(BSM):85%磷酸26.7 ml/L,CaSO4·2H2O 0.93 g/L,K2SO4 18.2 g/L,MgSO4·7H2O 14.9 g/L,KOH 4.13 g/L,甘油40.0 g/L,PTM1 4.35 ml/L。
PTM1微量元素溶液:CuSO4·5H2O 6.0 g/L,NaI 0.08 g/L,MnSO4·H2O 3.0 g/L,Na2MoO4·2H2O 0.2 g/L,H3BO 0.02 g/L,COCl2 0.5 g/L,ZnCl2 20.0 g/L,FeSO4·7H2O 65.0 g /L,生物素0.2 g /L,浓H2SO4 5.0 ml,0.22 μm膜过滤除菌,备用。
1.3 发酵工艺优化 1.3.1 发酵条件的优化设计取出-20 ℃保存的工程菌甘油管,用接种环取菌液在YPD平板上划线,30 ℃培养2 d,至长出单菌落。挑取单菌落,接种到若干瓶50 ml的BMGY培养基中,30 ℃,250 r/min摇床培养约40 h,至菌液OD600达到20左右。将30 ml上述BMGY菌液转移至50 ml无菌离心管中,6 000 r/min离心10 min,去上清,将沉淀转移到50 ml BMMY新鲜培养基中,30℃,250 r/min摇床培养,0h时均加入0.5 ml甲醇,之后每12 h分别添加0.5%的甲醇,诱导96 h结束。
(1) 最适温度确定。诱导阶段设定摇床温度分别为24 ℃、28 ℃、30 ℃。每隔12 h添加0.5%的甲醇,诱导96 h后取样测定发酵上清液中Lunasin含量。
(2) 双碳源对Lunasin表达的影响。将酵母转移到BMMY培养基后,在24 ℃下进行诱导蛋白表达,按终体积浓度30、40、50、60、70、80 g/L山梨醇含量设置6个实验组,每隔12 h按比例加入山梨醇,同时加0.5 %的甲醇,诱导96 h后结束,测定Lunasin浓度。
甘露醇作为碳源添加时,设置实验组终浓度分别为20、30、40、50、60 g/L,其他条件相同。
1.3.2 高密度发酵优化(1) 一级种子液的制备:单菌落接种50ml YPG培养基中,30 ℃ 250 r/min摇床培养28 h,作为一级种子液。
(2) 二级种子液的制备:从28 h的一级种子中取2ml菌液接种到装有100ml YPG培养基中,30 ℃,250 r/min摇床培养20 h,作为二级种子液。
(3) 甘油分批发酵阶段:配制BSM基础盐培养基,校正pH电极后,将培养基加入100 L全自动发酵罐(宝兴生物公司)中,装料量40 L,121 ℃灭菌30 min后,冷却加入174 ml PTM1溶液。通过控制流加氨水使pH稳定在5.0左右。将二级种子液按接种量5%(v/v)接入发酵罐。发酵过程中,控制发酵温度30±0.5 ℃,保持DO值20%以上。初始通气比为1.67 vvm,转速为300 r/min。约24 h后,甘油消耗完(DO>60%)此阶段结束。
(4) 甘油补料发酵阶段:之后开始流加8 L 50%(w/v)甘油(含12ml/L PTM1),补料速度10ml/L·h,通气比为2.5 vvm,转速500 r/min。当甘油耗完(DO>60%),碳源饥饿0.5 h。
(5) 甲醇补料发酵阶段:之后开始流加100%甲醇(含有12ml/L PTM1微量盐),转速700 r/min,通气比2.5 vvm,通过控制甲醇补料速度控制溶氧,每隔6 h取样一次。
1.3.3 检测方法菌体湿重:取发酵液40 ml,8 000 r/min离心10 min弃上清液,计算湿重(g/L)。
蛋白浓度:经镍柱(全式金生物工程公司)纯化后由BCA Protein Assay Kit(Thermo公司,USA)测定。
镍柱纯化条件试验:用5~10倍柱体积的20 mmol/L平衡缓冲液液平衡层析柱,上样,用5~10倍柱体积的平衡液洗涤层析柱,分别用1ml的50、100、200、300、400、500 mmol/L的咪唑进行梯度洗脱,之后用ddH2O洗涤,20%乙醇洗涤后4 ℃封存。
2 结果与分析 2.1 Lunasin蛋白镍柱纯化条件Lunasin蛋白定量测定必须先进行纯化。用不同浓度的咪唑洗脱镍柱,如图 1所示,泳道1~7分别为20、50、100、200、300、400、500mmol/L浓度的咪唑洗脱结果,在400mmol/L咪唑下的洗脱效果最好。

|
| 图 1 镍柱纯化结果 Figure 1 The result of Ni-NTA purification |
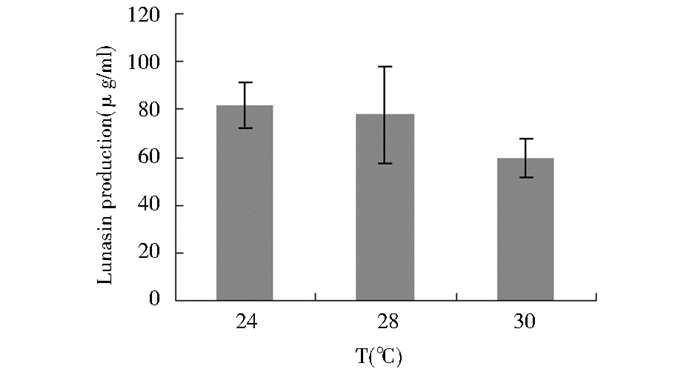
由摇瓶结果可知,在BMMY培养基中,诱导温度为24 ℃时,Lunasin表达量最高,达到81μg/ml。因此选择24 ℃为诱导温度(图 2)。
|
| 图 2 温度对Lunasin表达量的影响 Figure 2 Effect of temperature on the expression of Lunasin |
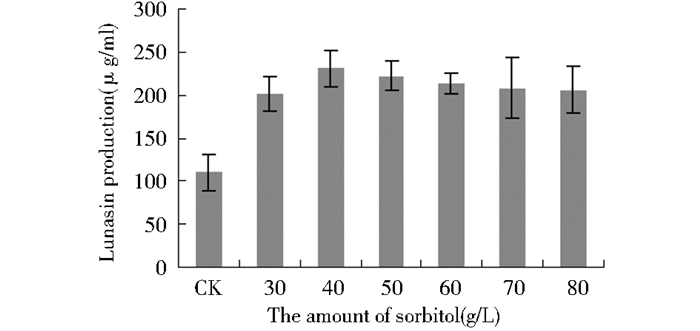
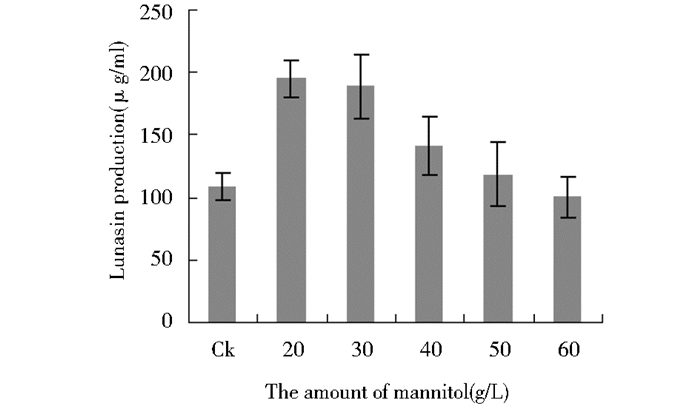
对山梨醇、甘露醇的不同添加量实验,结果显示在山梨醇添加量为40 g/L时Lunasin表达量最高(图 3)。甘露醇添加量为20 g/L时Lunasin表达量最高(图 4)。
|
| 图 3 山梨醇对Lunasin表达量的影响 Figure 3 Effect of sorbitol on the expression of Lunasin |
|
| 图 4 甘露醇对Lunasin表达量的影响 Figure 4 Effect of mannitol on the expression of Lunasin |
诱导期采用溶氧反馈补料(DO>20%连续补料至溶氧DO < 20%停止补料)和指数-恒速补料(指数补料[6],设置比生长速率μ=0.01,诱导期菌体对碳源得率Yx/s=0.42。至甲醇流加速率达到10 ml/L·h后恒速补料)的甲醇流加策略来进行诱导。
按照指数公式流加碳源能够使碳源与酵母指数生长规律相适应,使碳源能够满足酵母生长需要[7]。一段时间后由于供氧等因素无法维持毕赤酵母对甲醇的高消耗,造成甲醇积累,改用恒速补料来维持酵母生长。而溶氧反馈补料在诱导期内对毕赤酵母造成间歇性的碳源饥饿,对菌体生长不利,导致菌体浓度低(图 5a)。

|
| 图 5 不同补料方式对Lunasin表达的影响 Figure 5 Effect of methanol feeding strategies on Lunasin production (a) and biomass (b) in the induction phase |
由图 5(b)可知,在诱导54 h和第78 h均出现Lunasin表达量高峰,但是溶氧反馈补料最高峰在78 h达到0.889 g/L,指数-恒速补料在54 h达到1.805g/L,是溶氧反馈补料的2.03倍。过量流加甲醇会抑制菌体的生长与蛋白的合成,破碎的细胞释放的蛋白酶使合成的蛋白降解。此外,过低的甲醇流加速率会导致能量供给不足,从而影响目的蛋白的高表达[8]。
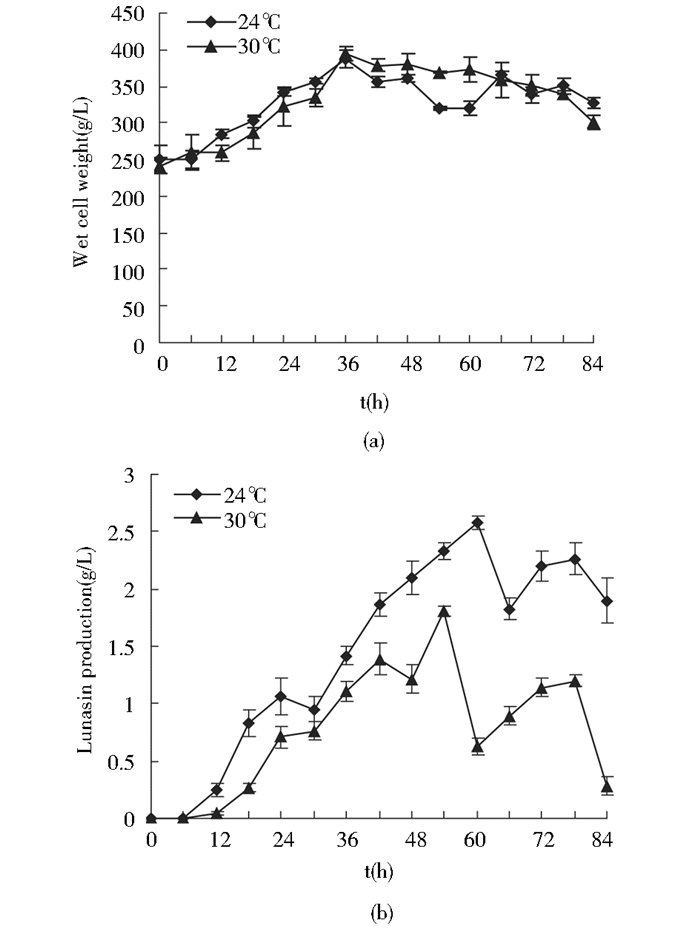
2.3.2 不同诱导温度对Lunasin表达的影响在摇瓶实验的基础上,高密度发酵采用24 ℃进行诱导,诱导期菌体湿重变化如图 6a所示,30 ℃与24 ℃条件下,菌体湿重差异并不明显。但是在低温条件下AOX1活性更高[9]。由图 6b可知,在24 ℃条件下,分别在诱导60 h和78 h时出现了表达峰值,且在60 h峰值更高,表达量为2.57 g/L,为30 ℃下的1.43倍。低温诱导能够降低蛋白酶活性,减少蛋白酶对重组蛋白的水解作用进而提高重组蛋白的积累。
|
| 图 6 不同诱导温度对Lunasin表达的影响 Figure 6 Effect of induction temperature on Lunasin production (a) and biomass (b) in the induction phase |
山梨醇是一种非抑制性碳源,甘露醇是山梨醇的同分异构体同样也是一种非抑制性碳源,并且还可以诱导重组蛋白的表达[10-11]。
在摇瓶实验的基础上,研究了在发酵罐中采用甲醇-山梨醇、甲醇-甘露醇双碳源补料方式对重组蛋白表达的影响。
由图 7a可知,与对照组相比在诱导前期山梨醇和甘露醇对菌体湿重的增长无显著影响,诱导42 h后单一甲醇诱导下菌体湿重开始下降,而流加山梨醇和甘露醇组菌体湿重持续增加,至发酵结束甘露醇组菌体湿重达到469 g/L,山梨醇组菌体湿重达446.25 g/L,分别为单一流加甲醇组的1.44、1.37倍。由图 7b可知,添加甘露醇组使Lunasin表达高峰提前,在诱导48 h时表达量达到3.02 g/L,而添加山梨醇组在诱导66 h后达到2.98 g/L,分别为单一甲醇碳源的1.17、1.16倍。
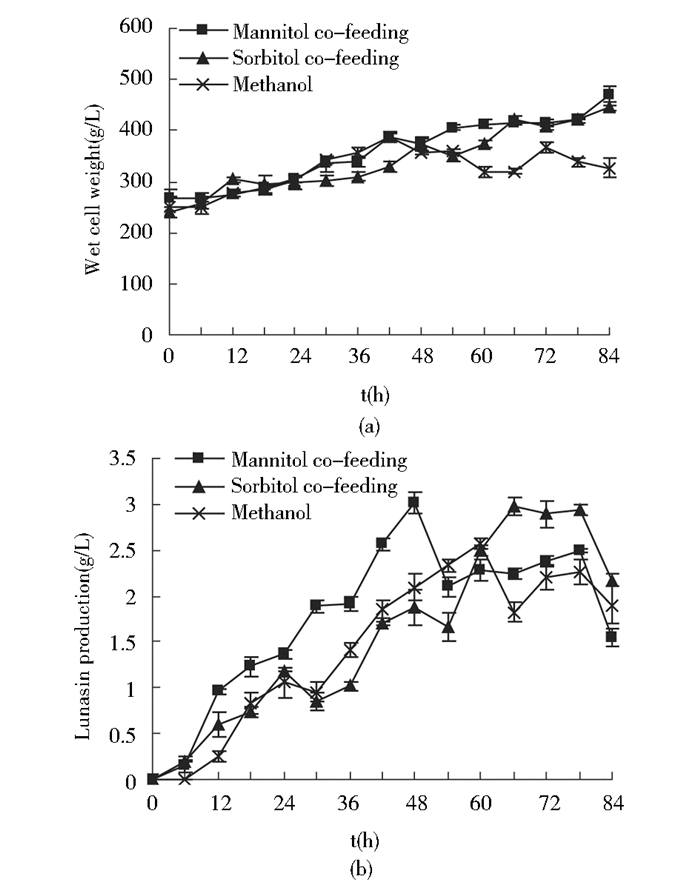
|
| 图 7 甘露醇、山梨醇与甲醇混合补料对Lunasin表达的影响 Figure 7 Effect of induction mannitol and sorbitol co-feeding strategies on Lunasin production (a) and biomass (b) in the induction phase |
在诱导阶段培养基中加酵母提取物,酪蛋白,蛋白胨等复合培养基能够增加重组蛋白的表达、降低蛋白分解,防止毕赤酵母聚沉[12-14],Zhao等[15]在发酵Pppmr1过程中添加2%大豆蛋白胨使产量提高了80%并且将生产阶段延长至60 h。本实验中在诱导阶段流加1%大豆蛋白胨并在诱导阶段开始时添加0.02%的天冬氨酸。
由图 8a可知,在诱导过程中,菌体湿重持续增长,最高湿重达到464.25 g/L,是单一甲醇碳源的1.42倍,在诱导72 h后蛋白表达量达到最高3.27 g/L(图 8b),为单一甲醇碳源的1.27倍。大豆蛋白胨的主要成分为短肽和游离氨基酸,它们的成分可能成为提高Lunasin产量的有效因子,另外Lunasin结构中含有一个连续9个天冬氨酸的多肽尾巴,在培养基中添加了天冬氨酸可以为Lunasin合成提供前体物质减轻毕赤酵母的合成压力来提高Lunasin产量。

|
| 图 8 复合培养基混合补料对Lunasin表达的影响 Figure 8 Effect of complex media co-feeding strategy on Lunasin production (a) and biomass (b) in the induction phase |
高细胞密度培养是用于提高生产重组蛋白的最重要策略之一,某些蛋白质浓度在培养上清液甚至可超过10 g/L[16]。本实验探究了诱导期补料方式,诱导温度,双碳源补料以及复合培养基共补料方式下对重组毕赤酵母高密度发酵影响以及对重组蛋白表达的影响。
由研究可知,诱导期采用指数-恒速补料的方式比溶氧反馈补料有显著的优势。有研究表明溶氧反馈并不能有效地控制发酵液中的甲醇浓度[17],发酵过程中溶氧反馈补料对毕赤酵母造成间歇性碳源饥饿,可能是受甲醇饥饿的影响, 甲醇仅能供重组菌继续生长, 不能再高效诱导外源蛋白的表达[18-19]。而诱导前期采用指数补料既满足了毕赤酵母生长需求又有不造成甲醇积累避免了过多甲醇对毕赤酵母的毒害作用[20]。
诱导期温度对毕赤酵母重组蛋白的表达有明显的影响,有多个报道证实了诱导期温度低于30℃有利于重组蛋白的表达[21-23],较低的诱导温度还可以增加酵母细胞中可利用的氧气和ATP水平[24],低温可以降低折叠压力,更有利于新生肽链的正确折叠[25]。Li等[26]研究表明鲱鱼的抗冻蛋白在23 ℃的表达量比30℃的表达量提高了10倍,Jia等[27]为抑制蛋白酶对tPVADH的水解作用,将诱导温度降低到22 ℃,使得tPVADH酶活提高了1.5倍。本研究采用24 ℃的诱导温度使得Lunasin产量达到30 ℃条件下的1.42倍。
山梨醇和甘露醇均为非抑制性碳源,此外甘露醇可以作为AOX1启动子的诱导物[28]。甘露醇比山梨醇代谢更快[29]。山梨醇在D-山梨醇脱氢酶的作用下氧化成D-果糖,然后在果糖激酶作用下磷酸化形成果糖-6-磷酸;然而甘露醇可以经过两种方式进入糖酵解途径,其中之一和山梨醇相同,另外还可以由甘露糖醇激酶磷酸化形成甘露醇-1-磷酸,然后通过甘露醇-1-磷酸脱氢酶氧化为果糖-6-磷酸[30]。另外山梨醇和甘露醇也可以降低系统产热以及好氧速率[31],整个发酵过程中甘露醇消耗量仅仅为山梨醇的50%,重组蛋白的表达量却更高。从经济角度考虑,甘露醇消耗量为山梨醇的1/2,而价格不足山梨醇的2倍,所以甘露醇比山梨醇更适合用于毕赤酵母的高密度发酵。
在以0.02%的天冬氨酸作为前体物质,与1%的大豆蛋白胨作为复合培养基加到发酵液中诱导后得到了重组蛋白的最高产量3.27 g/L。
本研究的不足之处在于以前期摇瓶优化结果作为发酵罐中高密度发酵的参考。在摇瓶发酵与发酵罐高密度发酵中可能存在一定的差异,而无法准确模拟。另外,本实验也未对发酵pH进行优化,巴斯德毕赤酵母可在pH 3.0~7.0范围内正常生长,但适宜外源蛋白表达的pH随着目的蛋白不同而有很大的差异。低pH可以有效地降低发酵液中蛋白酶的活性而有利于某些蛋白的表达,也有报道高pH对有些蛋白的表达更为有效[32-33]。由于设备限制等原因,在高密度发酵中并未进行更低诱导温度的探究,诱导温度越低能耗越大,在工业生产上会增加相应的成本。
| [1] | 盖文丽, 颜冬菁, 王伟, 等. 生物活性肽Lunasin的原核表达和分离纯化. 现代生物医学进展 , 2011, 11 (5) : 805–807. Ge W L, Yan D J, Wang W, et al. Pro-karyotic expression and the separation and purification of bioactive peptides Lunasin. Progress in Modern Biomedicine , 2011, 11 (5) : 805–807. |
| [2] | Liu J, Jia S H, Kirberger M, et al. Lunasin as a promising health-beneficial peptide. European Review for Medical and Phar-macological Sciences , 2013, 18 (14) : 2070–2075. |
| [3] | 干飞, 薛承斌, 陈正望. 多肽Lunasin的生物活性和药理作用研究进展. 中国药房 , 2015, 26 (28) : 3993–3995. Gan F, Xue C B, Chen Z W. Advances in biological and pharmacological effects of polypeptide Lunasin. China Pharmacy , 2015, 26 (28) : 3993–3995. |
| [4] | Kyle S, Aggeli A, Ingham E, et al. Production of self-assembling biomaterials for tissue engineering. Trends in Biotechnology , 2009, 27 (7) : 423–433. DOI:10.1016/j.tibtech.2009.04.002 |
| [5] | Kyle S, James K A, McPherson M J. Recombinant production of the therapeutic peptide Lunasin. Microbial Cell Factories , 2012, 11 (28) : 1–8. |
| [6] | Celik E, Çalik P, Oliver S G. Fed-batch methanol feeding strategy for recombinant protein production by Pichia pastoris in the presence of co-substrate sorbitol. Yeast , 2009, 26 (9) : 473–484. DOI:10.1002/yea.v26:9 |
| [7] | 钟秦, 崔有信. 酵母生产培养基指数流加的研究. 南京理工大学学报(自然科学版) , 1988, 4 : 8. Zhong Q, Cui Y X. The study of yeast production medium exponential feed-ing. Journal of Nanjing University of Science and Technology , 1988, 4 : 8. |
| [8] | 任海涛, 袁景淇, 邓建慧, 等. 毕氏酵母流加发酵过程的比生长速率控制. 上海交通大学学报 , 2004, 38 (5) : 799–801. Ren H T, Yuan J Q, Deng J H, et al. The specific growth rate control of Pichia pastoris fed fermentation process control. Journal of Shanghai Jiaotong University, , 2004, 38 (5) : 799–801. |
| [9] | Jin H, Liu G, Dai K, et al. Improvement of porcine interferon-α production by re-combinant Pichia pastoris via induction at low methanol concentration and low temperature. Applied Biochemistry and Biotechnology , 2011, 165 (2) : 559–571. DOI:10.1007/s12010-011-9275-2 |
| [10] | Inan M, Meagher M M. Non-repressing carbon sources for alcohol oxidase (AOX1) promoter of Pichia pastoris. Journal of Bioscience and Bioengineering , 2001, 92 (6) : 585–589. DOI:10.1016/S1389-1723(01)80321-2 |
| [11] | Sears I B, O'Connor J, Rossanese O W, et al. A versatile set of vectors for constitutive and regulated gene expression in Pichia pastoris. Yeast , 1998, 14 (8) : 783–790. DOI:10.1002/(ISSN)1097-0061 |
| [12] | Jung Hee W, Yuan Yi L, Scott S, et al. In-creasing secretion of a bivalent anti-T-cell immunotoxin by Pichia pastoris. Applied & Environmental Microbiology , 2004, 70 (70) : 3370–3376. |
| [13] | Woo J H, Liu J S, Kang S H, et al. GMP production and characterization of the bivalent anti-human T-cell immunotoxin, A-dmDT390-bisFv(UCHT1) for phase I/Ⅱ clinical trials. Protein Expression & Purification , 2008, 58 (1) : 1–11. |
| [14] | Wang J, Nguyen V, Glen J, et al. Improved yield of recombinant merozoite surface protein 3(MSP3). Biotechnology & Bioengineering , 2005, 90 (7) : 838–847. |
| [15] | Zhao H L, Xue C, Wang Y, et al. Increasing the cell viability and heterologous protein expression of Pichia pastoris mutant deficient in PMR1 gene by culture condition optimization. Applied Microbiology & Biotechnology , 2008, 81 (2) : 235–241. |
| [16] | Khatri N K, Frank H. Impact of methanol concentration on secreted protein produc-tion in oxygen-limited cultures of recom-binant Pichia pastoris. Biotechnology & Bioengineering , 2006, 93 (5) : 871–879. |
| [17] | 周祥山, 范位民, 张元兴. 不同甲醇流加策略对重组毕赤酵母高密度发酵生产水蛭素的影响. 生物工程学报 , 2002, 18 (3) : 348–351. Zhou X S, Fan W M, Zhang Y X. Effects of different methanol feeding strategy on hirudin production in high-density fer-mentation by recombinant Pichia pastoris. Chin J Biotech , 2002, 18 (3) : 348–351. |
| [18] | Lee J, Sang Y L, Park S, et al. Control of fed-batch fermentations. Biotechnology Advances , 1999, 17 (1) : 29–48. DOI:10.1016/S0734-9750(98)00015-9 |
| [19] | Ohashi R, Mochizuki E, Suzuki T. A mini-scale mass production and separation system for secretory heterologous proteins by perfusion culture of recombinant Pichia pastoris using a shaken ceramic membrane flask. Journal of Bioscience & Bioengineering , 1999, 87 (5) : 655–660. |
| [20] | 吴丹, 储炬, 王永红, 等. 甲醇浓度对毕赤酵母表达重组人复合α干扰素分离纯化得率的影响. 生物工程学报 , 2011, 27 (12) : 1789–1796. Wu D, Chu J, Wang Y H. Influence of methanol concentration on purification recovery of consensus interferon-α produced by Pichia pastoris. Chin J Biotech , 2011, 27 (12) : 1789–1796. |
| [21] | Li J, Tang C, Shi H, et al. Cloning and optimized expression of a neutral endoglucanase gene (ncel5A) from Volvariella volvacea WX32 in Pichia pastoris. Journal of Bioscience & Bioen-gineering , 2011, 111 (5) : 537–540. |
| [22] | Dragosits M, Frascotti G, Bernardgranger L, et al. Influence of growth temperature on the production of antibody Fab frag-ments in different microbes:A host comparative analysis. Biotechnology Progress , 2012, 28 (4) : 1114–1114. DOI:10.1002/btpr.v28.4 |
| [23] | Batra G, Gurramkonda C, Nemani S K, et al. Optimization of conditions for secretion of Dengue virus type 2 envelope domain Ⅲ using Pichia pastoris. Journal of Bioscience & Bioengineering , 2010, 110 (110) : 408–414. |
| [24] | Gao M, Dong S, Yu R, et al. Improvement of ATP regeneration efficiency and opera-tion stability in porcine interferon-α pro-duction by Pichia pastoris under lower induction temperature. Korean Journal of Chemical Engineering , 2011, 28 (6) : 1412–1419. DOI:10.1007/s11814-010-0527-6 |
| [25] | Daly R, Hearn M T. Expression of het-erologous proteins in Pichia pastoris:a useful experimental tool in protein engi-neering and production. Journal of Mo-lecular Recognition , 2005, 18 (2) : 119–138. DOI:10.1002/(ISSN)1099-1352 |
| [26] | Li Z, Xiong F, Lin Q, et al. Low-temperature increases the yield of biologically active herring antifreeze protein in Pichia pastoris. Protein Expression and Purification , 2001, 21 (3) : 438–445. DOI:10.1006/prep.2001.1395 |
| [27] | Jia D, Liu L, Wang H, et al. Overproduc-tion of a truncated poly (vinyl alcohol) dehydrogenase in recombinant Pichia pastoris by low-temperature induction strategy and related mechanism analysis. Bioprocess and Biosystems Engineering , 2013, 36 (8) : 1095–1103. DOI:10.1007/s00449-012-0863-5 |
| [28] | Sears I B, O'Connor J, Rossanese O W, et al. A versatile set of vectors for constitutive and regulated gene expression in Pichia pastoris. Yeast , 1998, 14 (8) : 783–790. DOI:10.1002/(ISSN)1097-0061 |
| [29] | Walker G M. Yeast Physiology and Bio-technology. Hoboken, New Jersey:John Wiley & Sons, 1998. |
| [30] | Eskitoros M S, Çalik P. Co-substrate mannitol feeding strategy design in semi-batch production of recombinant human erythropoietin production by Pichia pastoris. Journal of Chemical Technology and Biotechnology , 2014, 89 (5) : 644–651. DOI:10.1002/jctb.2013.89.issue-5 |
| [31] | Ramón R, Ferrer P, Valero F. Sorbitol co-feeding reduces metabolic burden caused by the overexpression of a Rhizopus oryzae lipase in Pichia pastoris. Journal of Biotechnology , 2007, 130 (1) : 39–46. DOI:10.1016/j.jbiotec.2007.02.025 |
| [32] | Jahie M, Gustavsson M, Jansen A K, et al. Anabsis and control of proteolysis of a fusion protein in Pichia pastoris fed-batchprocesses. Bioteehnol , 2003, 102 (1) : 45–53. |
| [33] | He X, Liu N, Li W, et al. Inducible and constitutive expression of a novel thermostable alkaline β-mannanase from alkaliphilic Bacillus sp. N16-5 in Pichia pastoris and characterization of the re-combinant enzyme. Enzyme and Microbial Technology , 2008, 43 (1) : 13–18. DOI:10.1016/j.enzmictec.2008.03.011 |
 2016, Vol. 36
2016, Vol. 36




