文章信息
- 刘婧莹, 刘晨浪, 张允雷, 王世奇, 夏立秋, 张友明.
- LIU Jing-ying, LIU Cheng-lang, ZHANG Yun-lei, WANG Shi-qi, XIA Li-qiu, ZHANG You-ming.
- 牛乳铁蛋白肽(LfcinB)在苏云金芽胞杆菌中的融合表达
- The Fusion Expression of Bovine Lactoferricin (LfcinB) in Bacillus thuringiensis
- 中国生物工程杂志, 2016, 36(8): 23-30
- CHINA BIOTECHNOLOGY, 2016, 36(8): 23-30
- http://dx.doi.org/DOI:10.13523/j.cb.20160804
-
文章历史
- 收稿日期: 2016-01-27
- 修回日期: 2016-03-23
抗菌肽是一类具有抗菌、抗病毒、抗寄生虫、抑制肿瘤细胞及免疫调节活性的小分子多肽[1-2],热稳定性好,无免疫原性,不易产生耐药性[3]。同时作用机制独特、理化性质稳定、只作用于病原微生物而对人体正常细胞无副作用[4]。迄今为止,已在许多生物包括昆虫、鸟类、动物、植物及原核生物中发现了800多种抗菌肽,它们多由30~50个氨基酸残基组成[5]。乳铁蛋白(lactoferrin,LF)是一种存在于高等胎生动物乳汁中的天然的糖蛋白,由转铁蛋白在体内经过生化反应转变而来,分子量约80kDa,因为其与血清中结合并转运铁的β球蛋白有60%的氨基酸序列具有同源性,所以将其列为转铁蛋白家族[6]。1938年由Sorensen M和Sorensen SPL首次从牛奶中分离得到,因其在结晶状况下呈红色,也称之为“红蛋白”[7]。乳铁蛋白肽(lactoferricin,Lfcin)又称乳铁素,是由LF在酸性条件下通过水解获得的,具有抗菌活性的短肽。牛乳铁蛋白肽(bovine lactoferricin,LfcinB)来源于牛乳铁蛋白bLF的第17~41位氨基酸,分子量3.1kDa,由于富含大量的碱性氨基酸,等电点pI>12,具有较强的阳离子特征,水溶性好[8]。研究发现LfcinB不仅具备乳铁蛋白的大部分生物活性,如参与免疫反应、消除炎症,抗菌活性、同时具有抗肿瘤、抗真菌和抗病毒的功能,而且其抗菌活性比牛乳铁蛋白高400倍[9],同时所有乳铁蛋白肽中牛乳铁蛋白肽的抗菌活性是最高的,从而备受研究者的关注。
苏云金芽胞杆菌(Bacillus thuringiensis,Bt)是一种革兰氏阳性菌,在大自然中含量丰富,分布的范围也很广。根据《伯杰氏细菌鉴定手册》第九版,将其归类于第二类第十八群中的芽胞杆菌属(Bacillus)[10],与蜡状芽胞杆菌(Bacillus cereus)、炭疽芽胞杆菌(Bacillus anthracis)同属于蜡状芽胞杆菌群[11]。苏云金芽胞杆菌能在芽胞期形成一种由δ-内毒素组装成的杀虫晶体蛋白(insecticidal crystal proteins,ICPs),对昆虫有独特的毒害作用[12]。Cry60Ba是一种来自于Bt菌株以色列亚种ATCC 35646的晶体蛋白,大小约为35kDa,对致倦库蚊(Culex quinquefasciatus)有一定杀虫活性[13]。
LfcinB作为一种具有广谱高效抗菌活性的蛋白肽,引起了极大的关注,是一种很有潜力的抗生素替代药物,同时,近期的研究表明,LfcinB还具有抗肿瘤的作用,很有可能作为未曾开发过的的抗肿瘤药物用于临床治疗中。国内外都在研究如何通过生物学方法得到高产量且有活性的LfcinB,目前的研究进展是,已经可以利用动物乳腺表达系统、毕赤酵母表达系统和大肠杆菌原核表达系统成功表达LfcinB,并且证明,异源表达的LfcinB重组蛋白对很多细菌都有抑制作用[14-19]。可是问题的关键在于,怎样才能得到质量好产量高的LfcinB产品。本研究在此背景下,试图构建一种新的乳铁蛋白肽表达体系。设计合成了LfcinB基因,设想通过与苏云金芽胞杆菌晶体蛋白Cry60Ba进行融合表达,形成晶体,一方面缓解抗菌肽对宿主本身的抑菌作用,另一方面试图解决LfcinB由于片段过小,单独表达不稳定的问题。同时,晶体蛋白在苏云金芽胞杆菌工程菌中有高效的表达,通过融合蛋白的形式来增大LfcinB的表达量,为采用基因工程的方法大量生产牛乳铁蛋白肽LfcinB药物奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株及质粒本研究中使用的菌株:大肠杆菌DH5α(克隆宿主)、苏云金芽胞杆菌4Q7/pPFT60B(Cry60Ba表达宿主)、4Q7(无晶体突变Bt菌株)。
本研究中使用的质粒:pMD-18T vector(大肠杆菌克隆载体,Amp抗性),购于上海宝生物公司,pPFT60B(Cry60Ba表达载体), 来源于本实验室菌种保藏。
1.1.2 培养基LB液体培养基(1 L):胰蛋白胨(Tryptone)10 g,氯化钠(NaCl)10 g,酵母提取物(Yeast extract) 5 g,加蒸馏水定容至1 000 ml,pH值调至7.0。
LB固体培养基:在液体LB培养基中加入2%的琼脂粉。
GYS液体培养基(1L): Yeast extract 2 g,K2HPO4 2 g,(NH4)2SO4 1 g,25% Glucose 4 ml,20% MgSO4 1 ml,8% CaCl2 1 ml,5% MnSO4 1ml,加蒸馏水定容至1 000 ml。
1.2 方法 1.2.1 LfcinB编码基因的设计与合成根据GenBank中已报道的牛乳铁蛋白基因(登录号NM_180998)序列和Cry60Ba表达载体pPFT60B设计引物P1和P2,其中上游引物P1为5′-CGGAATTCTATTTTCGATTTCAAATTTTCCAAACTTAAATATG-3′,粗体为EcoRⅠ酶切位点,下游引物P2为5′-CGGGATCCTTAGAACGCACGACGAACGCAGGTGATAGACGGAGCACCCAGTTTTTTCATACGCCACTGCCAACGACGGCATTTGAACCATTCCGGGTCAGATCTATCACAATATGG-3′,粗体为BamHI酶切位点。在编码Cry60Ba、LfcinB的基因之间插入编码盐酸水解的密码子DP,所有引物由上海生工生物工程技术服务有限公司合成。
以pPFT60B为模板,通过PCR扩增Cry60Ba-LfcinB的ORF基因序列,将PCR产物用2%琼脂糖凝胶电泳,回收目的片段。
1.2.2 重组表达载体的构建将PCR扩增获得的1.7kb cry60Ba-LfcinB基因片段,分别克隆至表达载体pPFT60B的EcoRI和BglⅡ之间,获得了在Bt中表达的重组质粒pPFT60B-LfcinB(图 1)。转化到E. coliDH5α中,挑取单克隆转化子培养后提取质粒并双酶切鉴定。将酶切鉴定及测序结果正确的质粒转化到无晶体突变菌株Bt 4Q7中, 挑取单克隆转化子培养后,利用PCR鉴定筛选含有目的基因的重组表达载体。获得重组工程菌4Q7/pPFT60B-LfcinB。
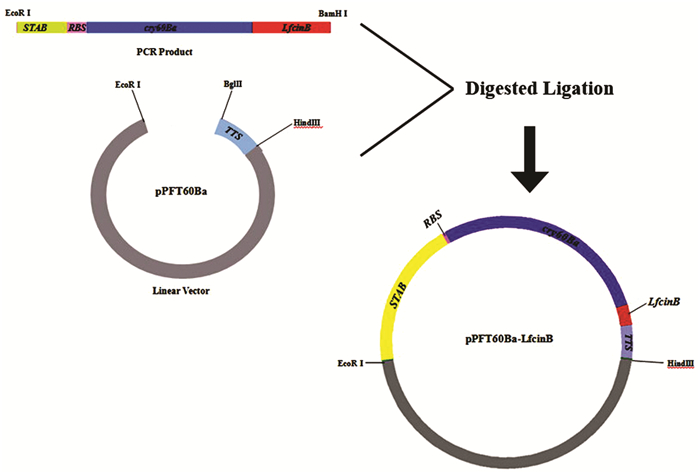
|
| 图 1 pPFT60B-LfcinB构建示意 Figure 1 Construction of vector pPFT60B-LfcinB |
将经活化的重组工程菌4Q7/pPFT60B-LfcinB液按1∶100的比例,接种于GYS液体发酵培养基,于30℃摇床中震荡培养48h,直到芽胞晶体与菌体完全分离。离心收集100ml的GYS发酵培养液,沉淀用30ml的0.5mol/L NaCl溶液悬浮混匀后超声处理(3s,3s,30次),离心。沉淀用生理盐水洗涤两次,离心后,用50ml超纯水再洗涤沉淀一次。最后用2ml超纯水洗涤晶体蛋白沉淀至1.5ml的EP管中,离心去上清,用适量的超纯水悬浮,再加入等量的5×SDS-PAGE loading buffer,沸水浴放置10min。12 000r/min离心5min,取上清蛋白样品进行SDS-PAGE分析。
1.2.4 Cry60Ba-LfcinB蛋白的水解与LfcinB的鉴定将提取到的融合蛋白用90mmol/L HCl制成浓度约为500mg/ml的悬液,取100μl分装至1.5ml EP管中,置于55℃的混匀仪中,1 000r/min水解。时间分别为0h,3h,5h,7h。完成之后将上述水解液8 000r/min离心5min,取上清,用等体积的90mmol/L NaOH调pH值至中性。加入等量的5× SDS-PAGE loading buffer,沸水浴放置10~12min。12 000r/min离心4 min,取上清蛋白样品进行SDS-PAGE分析。切取SDS-PAGE胶块上的目的蛋白条带进行胶内酶解和质谱分析。
2 结果 2.1 编码基因的设计与合成以Cry60Ba表达载体pPFT60B为模板,利用设计的含有LfcinB编码序列的引物进行PCR扩增,经过1%琼脂糖凝胶电泳检测,得到了1700 bp的融合表达基因片段,如图 2所示。与预期的条带大小相符,表明已成功克隆获得cry60Ba-LfcinB基因。
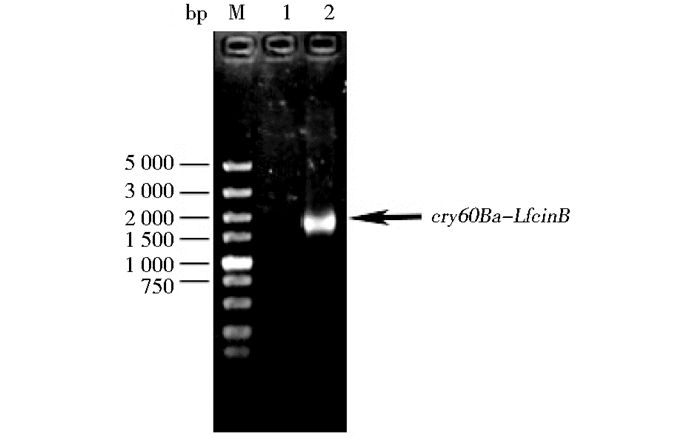
|
| 图 2 PCR扩增Cry60Ba-LfcinB编码基因琼脂凝胶电泳 Figure 2 Agarose electrophoresis of the PCR amplification of Cry60Ba-LfcinB M:DL5000 DNA Marker; 1:CK; 2:Cry60Ba-LfcinB |
将以上PCR扩增获得的1.7kb cry60Ba-LfcinB基因片段,克隆至表达载体pPFT60B的EcoRI和BglⅡ之间,获得了在Bt中表达的重组质粒pPFT60B-LfcinB。重组质粒经酶切鉴定,得到了一条大小为1 700bp的cry60Ba-LfcinB基因条带和一条6 500bp左右的载体条带,结果如图 3所示。将鉴定正确的重组质粒送去测序,测序结果如图 4所示。以上结果显示,已成功构建了融合表达载体pPFT60B-LfcinB,且在cry60Ba-LfcinB基因的PCR和构建载体的过程中没有基因突变。
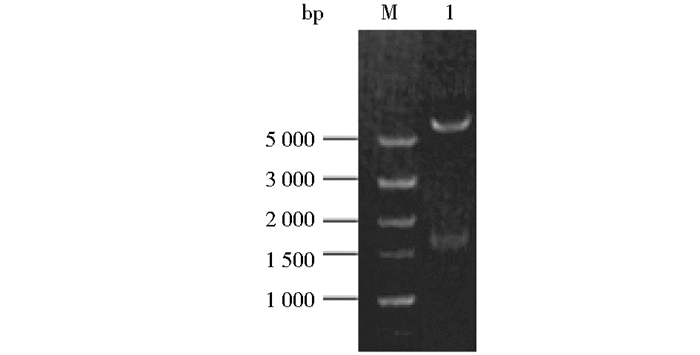
|
| 图 3 pPFT60B-LfcinB重组质粒的琼脂糖凝胶电泳酶切鉴定 Figure 3 Agarose electrophoresis of the recombinant plasmids pPFT60B-LfcinB by restriction enzyme identification M:DL5000 DNA Marker; 1:pPFT60B-LfcinB digested byEcoRI-HindIII |

|
| 图 4 重组质粒pPFT60B-LfcinB测序结果 Figure 4 Partial sequence of pPFT60B-LfcinB Blue bold:hydrochloric acid hydrolysis site. Red bold:inserted LfcinB coding sequence |
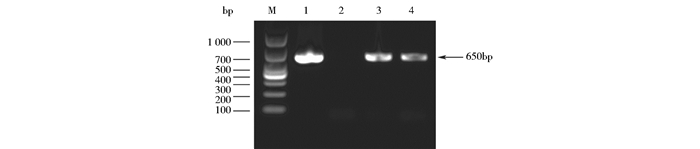
将重组质粒pPFT60B-LfcinB电转至无晶体突变株4Q7中,利用红霉素抗性平板初步筛选,得到了重组工程菌4Q7/pPFT60B-LfcinB。对重组工程菌进行菌落PCR鉴定,结果如图 5,得到了一条650bp左右大小的基因条带,与设计引物扩增的条带大小相符。说明,工程菌中已经含有重组表达载体pPFT60B-LfcinB。通过相差显微镜观察菌体中芽胞和晶体的形态,结果如图 6所示。图 6a为无晶体突变株4Q7,细胞内只有芽胞,不含有深色的晶体蛋白;图 6b为4Q7/pPFT60B,图中的Cry60Ba的晶体形态呈椭圆形,有一头或两头都带有尖头;图 6c为4Q7/pPFT60B-LfcinB,图中的pPFT60B-LfcinB融合蛋白的晶体形态呈月牙形,有一边呈现内凹,两头成尖头形态。
|
| 图 5 重组菌株菌落PCR鉴定 Figure 5 Agarose electrophoresis of the recombinant strain by PCR identification M:DL1000 DNA Marker; 1:pPFT60B-LfcinB as positive control; 2:Bt4Q7 without crystal body; 3~4:Bt4Q7/ pPFT60B-LfcinB |
|
| 图 6 表达Cry60Ba-LfcinB的重组工程菌的相差显微镜观察 Figure 6 Phase-contrast micrographs of B.thuringiensis recombinants producing Cry60Ba-LfcinB (箭头所示为伴胞晶体) a:CK 4Q7; b:4Q7/pPFT60B; c:4Q7/pPFT60B-LfcinB |
将重组工程菌采用GYS液体培养基发酵培养48h后,提纯芽胞晶体蛋白混合物,进行SDS-PAGE电泳分析,结果如图 7所示。泳道1所示者为融合蛋白Cry60Ba-LfcinB,与泳道2的Cry60Ba相比,分子量稍大一些。可以说明,工程菌4Q7/pPFT60B-LfcinB表达了融合蛋白Cry60Ba-LfcinB。
|
| 图 7 重组工程菌株表达Cry60Ba-LfcinB融合蛋白的SDS-PAGE分析 Figure 7 SDS-PAGE analysis of expression products fromB.thuringiensis recombinants producing Cry60Ba-LfcinB M:Protein molecular weight marker; 1:Cry60Ba-LfcinB; 2:Cry60Ba |
离心收集100 ml的GYS发酵培养液,提取芽胞晶体混合物后,将提取的蛋白用90mmol/L的HCl进行酸水解,将每个时间段的取样进行SDS-PAGE电泳分析,结果如图 8所示,首先,两种蛋白在水解液中的溶解度远大于在双蒸水中的溶解度,并且在同种溶液中融合蛋白的溶解度比Cry60Ba晶体蛋白都要大,说明在插入LfcinB基因后,对晶体蛋白的溶解性可能有正向的作用。其次,随着水解时间的增加,两种蛋白的浓度都逐渐减少,融合蛋白浓度减小是因为部分蛋白水解成了更小的蛋白条带,而Cry60Ba晶体蛋白的浓度减小推测可能的原因是在酸水解的过程中,溶液中pH值和温度的变化导致Cry60Ba晶体蛋白溶解度的变化。最后,也是最重要的一点,在酸水解了3h,5h,7h后,融合蛋白中水解出了一条3kDa左右的条带,而没有经过水解的融合蛋白以及经过水解的Cry60Ba晶体蛋白都没有相近大小的条带。由此可以认为,这条条带就是我们的目的条带LfcinB。
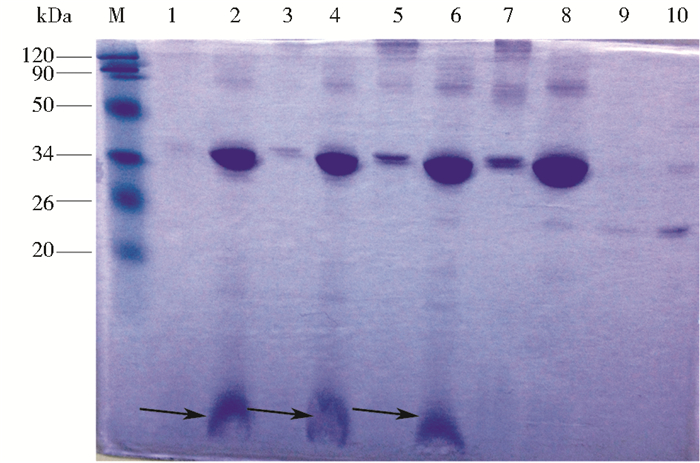
|
| 图 8 融合蛋白水解之后的SDS-PAGE分析 Figure 8 SDS-PAGE analysis of Cry60Ba-LfcinB after hydrolysis M:Protein molecular weight marker; 2, 4, 6, 8:Cry60Ba-LfcinB after acid hyolrolysis 7、5、3、0h;1, 3, 5, 7:Cry60Ba after acid hydrolysis 7、5、3、0h;9:Water-soluble Cry60Ba; 10:Water-soluble Cry60Ba-LfcinB |
挖取图 8中的疑似条带进行胶内酶解,送去进行质谱分析,以融合蛋白的氨基酸序列为比对数据库,经SEQUEST软件搜库后,覆盖率为77.78%,得分为44.15,共鉴定到49条肽段,其中,特异性属于LfcinB蛋白的肽段共有6条,分析结果见表 1。图 9中红色方框中的LfcinB氨基酸序列均被搜索到,可以说明,我们得到的蛋白中含有从融合蛋白中分离出来的LfcinB。以上结果可以说明,在经过盐酸水解之后,融合蛋白Cry60Ba-LfcinB中的Cry60Ba和LfcinB被分离开来,形成了单独的LfcinB。
| Sequence | # PSMs | Modifications | MH+ [Da] | ΔM | RT [min] |
| KLGAPSITcVR | 15 | C9(Carbamidomethyl) | 1201.67266 | -658.68 | 19.31 |
| mKKLGAPSITcVR | 10 | M1(Oxidation); C11(Carbamidomethyl) | 1478.72466 | 599.96 | 25.86 |
| SDPEWFKcR | 9 | C8(Carbamidomethyl) | 1227.56375 | 1785.71 | 14.88 |
| MKKLGAPSITcVR | 9 | C11(Carbamidomethyl) | 1463.70757 | 1277.23 | 28.27 |
| WQWRmK | 7 | M5(Oxidation) | 951.52458 | 400.93 | 19.96 |
| LGAPSITcVRR | 11 | C8(Carbamidomethyl) | 1232.62993 | 1746.06 | 18.92 |
|
| 图 9 目的蛋白LfcinB的切胶质谱鉴定比对结果 Figure 9 Results of confirming the interest protein LfcinB by excising target protein band from SDS-PAGE gel and LC-MS/MS analysis |
传统的蛋白异源表达体系有大肠杆菌表达体系和毕赤酵母表达体系,它们都具有遗传背景清晰、生产发酵成本低,过程控制简单、表达能力较强以及能将表达产物从一系列的代谢产物中提纯且过程相对容易等优点[20]。研究者也通过以上的系统成功地在体外表达出了有活性的LfcinB蛋白,但是在此过程中,也存在着一些问题。融合蛋白技术是一种很有发展潜力的生物工程技术,可以实现单一蛋白异源表达所不能达到的效果。在本研究中,我们将LfcinB与Cry60Ba进行融合表达,形成融合晶体蛋白,将LfcinB的抗菌活性肽段包裹在晶体内,既可以缓解LfcinB对宿主本身的抗菌作用,维持宿主菌的稳定生长,提高LfcinB的产量;又可以利用晶体蛋白易于纯化的特点,解决大肠杆菌中不易于纯化,包涵体需要复性的问题。
LfcinB肽段的蛋白量仅为3.1kDa,传统的原核表达方式将LfcinB进行单独表达,普通的SDS-PAGE很难检测到如此小的条带,为检测带来了一定的困难,一般使用Tricine-SDS-PAGE进行检测[21],但是Tricine-SDS-PAGE电泳过程比较复杂,且需要比较苛刻的条件才能得到较干净和整洁的电泳图。本研究中,我们通过融合表达的方式简化了检测蛋白表达这一步骤。
苏云金芽胞杆菌能够大量表达Cry蛋白,在转录水平上,主要是指导它们表达的启动子具有很高的活性[22]。在经过基因改造后,工程菌有了更强的启动子和终止子。本研究中我们将LfcinB基因克隆至cry60Ba基因的下游,利用Cry60Ba ORF中已构建好的强启动子cyt1A和STAB-SD序列,增强融合蛋白的表达量,从而提高LfcinB的产量。
Bt晶体蛋白分子量都比较大,常见的和常用的几种晶体蛋白蛋白量一般为130kDa(http://www.lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/)[23]。由于LfcinB只有3kDa左右,在融合表达过程中,若晶体蛋白的蛋白量与LfcinB的比例过于悬殊,则LfcinB在融合蛋白中所占比例过小,不能达到增加产量的目的。在本研究中,我们使用大小为35kDa的Cry60Ba,在其与LfcinB融合表达时,LfcinB在总蛋白中所占比例为7.8%,比较合适。另一方面,考虑到晶体蛋白的表达量,同样来自Bt subsp. Jegathesan的Cry60Aa与Cry60Ba蛋白大小相近,但是Cry60Ba在同样的重组工程菌中的表达量明显高于Cry60Aa。
LfcinB与晶体蛋白Cry60Ba在苏云金芽胞杆菌中融合表达有望成为高效的LfcinB表达体系,更可能拓展成为所有抗菌肽的高效表达体系。
| [1] | Knappe D, Stegemann C, Nimptsch A, et al. Chemical modifications of short antimicrobial peptides from insects and vertebrates to fight multi-drug resistant bacteria. Advances in Experimental Medicine Biology , 2009, 611 : 395–396. DOI:10.1007/978-0-387-73657-0 |
| [2] | Xu P, Shi M, Chen X X. Antimicrobial peptide evolution in the Asiatic honey bee Apis cerana. PLoS One , 2009, 4 (1) : e4239. DOI:10.1371/journal.pone.0004239 |
| [3] | 汪银锋, 李素平, 陆东峰. 抗菌肽研究进展及其在饲料中的应用. 养猪 , 2009, 4 (4) : 14–16. Wang Y F, Li S P, Lu D F. Antibacterial peptide research progress and its application in feed. Swine Production , 2009, 4 (4) : 14–16. |
| [4] | Chang T L, Klotman M E. Defensins:natural anti-HIV peptides. AIDS Reviews , 2004, 6 (3) : 161–168. |
| [5] | Jeffrey K, Shen-An Hwang, Marian L. Lactoferrin as a natural immune modulator. Curr Pharm Des , 2009, 15 (17) : 1956–1973. DOI:10.2174/138161209788453202 |
| [6] | Dominique Legrand, Joël Mazurier. A critical review of the roles of host lactoferrin in immunity. BioMetals , 2010, 2 : 365–376. |
| [7] | 杨巍, 马雪莹, 王晓宇. 乳铁蛋白的生物学活性. 黑龙江科学 , 2011, 4 : 43–45. Yang W, Ma X Y, Wabg X Y. The biological activities of lactoferritin. Heilongjiang Science , 2011, 4 : 43–45. |
| [8] | Ning Zhou, Tieleman D P, Vogel H J. Molecular dynamics simulations of bovine lactoferricin:turning a helix into a sheet. BioMetals , 2004, 17 : 217–223. DOI:10.1023/B:BIOM.0000027695.99874.ea |
| [9] | Tania S, María Á, Abengó Z, et al. Enhanced leishmanicidal activity of cryptopeptide chimeras from the active N1 domain of bovine lactoferrin. Amino Acids , 2012, 43 : 2265–2277. DOI:10.1007/s00726-012-1304-0 |
| [10] | 中国科学院微生物研究所. 伯杰氏细菌鉴定手册. 北京: 科学出版社, 1994 . Chinese Academy of Sciences Institute of Microbiology. Berger's Manual Bacteria Identification. Beijing: Science Publisher, 1994 . |
| [11] | Rasko D A, Altherr M R, Han C S, et al. Genomics of the Bacillus cereus group of organisms. FEMS Microbiology Reviews , 2005, 29 (2) : 303–329. |
| [12] | Park T J, Choi S K, Jung H C, et al. Spore display using Bacillus thuringiensis exosporium protein InhA. Journal of Microbiology and Biotechnology , 2009, 19 (5) : 495–501. DOI:10.4014/jmb.0802.163 |
| [13] | Anderson I, Sorokin A, Kapatral V, et al. Comparative genome analysis of Bacillus cereus group genomes with Bacillus subtilis. FEMS Microbiol Lett , 2005, 250 (2) : 175–184. DOI:10.1016/j.femsle.2005.07.008 |
| [14] | 马凤龙, 张瑜, 刘焕珍, 等. 牛乳素Lfcin B基因的合成及其在酵母菌中的表达研究. 安徽农业科学 , 2008, 36 (2) : 446–448. Ma F L, Zhang Y, Liu X Z, et al. Study on the synthesis of lactoferricin bovine(LfcinB) gene and its expression in Microzyme. Journal of Anhui Agri Sci , 2008, 36 (2) : 446–448. |
| [15] | 邢芳芳, 印遇龙, 黄瑞林, 等. 重组牛乳铁蛋白素在大肠杆菌中的表达. 食品科学 , 2008, 29 (4) : 221–224. Xing F F, Yin Y L, Huang R L. Expression of recombinant lactoferricin B in E.coli. Food Science , 2008, 29 (4) : 221–224. |
| [16] | 郭东华, 孙东波, 孙斌, 等. 牛乳铁蛋白肽基因(LfcinB)的合成及其在大肠杆菌中的表达. 农业生物技术学报 , 2009, 17 (3) : 451–454. Guo D H, Sun D B, Sun B, et al. Synthesis of bovine lactoferricin B gene (LfcinB) and its expression in Escherichia coli. Journal of Agricultural Biotechnology , 2009, 17 (3) : 451–454. |
| [17] | 张锦霞, 王铁东, 张守峰, 等. 乳铁蛋白肽基因的合成及其在动物乳腺中的表达. 天然产物研究与开发 , 2006, 18 : 229–233. Zhang J X, Wang T D, Zhang S F, et al. Synthesis of bovine lactoferricin gene and expression in animal mammary glands. Nat Prod Res Dev , 2006, 18 : 229–233. |
| [18] | 何佳, 黄薇薇, 孟庆森, 等. 表达猪乳铁蛋白的重组乳酸乳球菌对断奶仔猪应用效果的研究. 动物营养学报 , 2014, 26 (6) : 1579–1586. He J, Huang W W, Meng Q S, et al. Application effects of recombinant Lactococcus lactis expressing porcine lactoferrin of weaner piglets. Chinese Journal of Animal Nutrition , 2014, 26 (6) : 1579–1586. |
| [19] | 史芳芳, 王亮, 吕自力, 等. 牛乳铁蛋白多肽的合成及抗菌活性试验. 西北农业学报 , 2009, 18 (1) : 20–23. Shi F F, Wang L, Lv Z L, et al. Antibacterial activity experiment and synthesis of LfcinB gene. Acta Agriculturae Boreali-occidentalis Sinica , 2009, 18 (1) : 20–23. |
| [20] | Dong X, Tang B, Li J, et al. Expression and purification of intact and functional soybean (glycine max)seed ferritin complex in Escherichia coli. J Microbiol Biotechnol , 2008, 18 (2) : 299–307. |
| [21] | Hermann Schägger. Tricine-SDS-PAGE. Nature Protocols , 2006, 1 : 16–23. DOI:10.1038/nprot.2006.4 |
| [22] | 刘春霞, 武建博, 彭琪, 等. cry8E启动子指导的非晶体蛋白GabR在苏云金芽胞杆菌HD73菌株中的表达. 微生物学通报 , 2014, 41 (2) : 290–296. Liu C X, Wu J B, Peng Q, et al. Expression of GabR protein in Bacillus thuringiensis HD73 strain directed by cry8E promoter. Microbiology China , 2014, 41 (2) : 290–296. |
| [23] | Crickmore N, Zeigler D R, Feitelson J, et al. Revision of the nomenclature for the Bacillus thuringiensis pesticidal crystal proteins. Microbiol Mol Biol Rev , 1998, 62 (3) : 807–813. |
 2016, Vol. 36
2016, Vol. 36




