文章信息
- 薛玲, 刘江宁, 张耀, 张纯, 王祺, 秦川, 刘永东, 苏志国.
- XUE Ling, LIU Jiang-ning, ZHANG Yao, ZHANG Chun, WANG Qi, QIN Chuan, LIU Yong-dong, SU Zhi-guo.
- EV71多表位抗原亲和纯化及类病毒颗粒胞外自组装
- Affinity Purification of Enterovirus 71 Fused Multi-Epitope Protein Antigen and Assembling It as Virus-like Particles in Vitro
- 中国生物工程杂志, 2016, 36(7): 34-40
- CHINA BIOTECHNOLOGY, 2016, 36(7): 34-40
- http://dx.doi.org/DOI:10.13523/j.cb.20160706
-
文章历史
- 收稿日期: 2016-02-03
- 修回日期: 2016-02-26
2. 中国科学院大学 北京 100049;
3. 中国医学科学院实验动物研究所 北京 100021
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences, Beijing 100021, China
肠道病毒71型(Enterovirus 71,EV71)是引起手足口病(handfootandmouth disease,HFMD)的主要病原体之一,主要感染5岁以下儿童,严重病例会伴有心肌炎、脑膜炎、肺水肿等并发症[1],甚至死亡。自2009年以来,中国疾病预防控制中心每年报告的HFMD病例有上百万例,位居丙类传染病之首。迄今还没有治疗HFMD的特效药物,安全有效的预防疫苗是防控HFMD的关键。
EV71灭活全病毒疫苗和由衣壳结构蛋白组成的类病毒颗粒疫苗是目前最有前景的两种HFMD疫苗品种。灭活病毒疫苗由于制备技术成熟、经验丰富,发展最快,国内有三家机构完成了EV71灭活疫苗的临床3期试验[2-4],其中两家机构的疫苗品种已获上市批准。但全病毒灭活疫苗由于包含病毒的全部核酸物质被认为存在一定的安全隐患。仅含有病毒结构蛋白不含核酸的类病毒颗粒疫苗则成为一种更为安全的疫苗种类[5-6]。类病毒颗粒疫苗一般通过感染重组杆状病毒的昆虫细胞体系生产,生产周期长并且表达量低[7]。对灭活病毒或病毒样颗粒的分离纯化多采用传统的密度梯度离心[8-9],这种方法耗时长、规模化生产困难。虽然层析分离手段也逐渐用于灭活或类病毒颗粒的分离纯化,但生物大分子的复杂结构往往导致在层析过程中发生颗粒结构解聚或聚集,颗粒完整结构被破坏,从而导致目标蛋白的活性回收率低。已有文献报道采用三步组合层析方法可以将EV71类病毒颗粒纯度显著提高到95%[10],这种多步层析方式不仅收率低,而且生产成本高。因此,采用动物细胞或昆虫细胞直接扩增在胞内形成病毒或类病毒颗粒的制备策略存在生产周期长、生产效率低且生产成本高等问题。
EV71是一种二十面体球形结构的单链RNA病毒,成熟病毒粒子衣壳由20个VP1、VP2、VP3和VP4 4种结构蛋白组成[11],其中VP1、VP2、VP3是抗原分布的主要区域[12]。已有文献对EV71表位肽段进行了全面的筛选,一些关键表位肽段得以确认。以此为基础开发了SP55、SP70表位肽段疫苗[13],以及VP1蛋白为基础的亚单位疫苗[14]等。这些疫苗候选可通过多肽合成或原核体系进行表达,生产成本较灭活全病毒及病毒样颗粒疫苗显著降低,但免疫效果也明显低于前两者。
在前期研究中,我们发现由EV71衣壳蛋白VP1-VP3的优势表位肽段组成融合蛋白抗原不仅可以通过原核体系成功表达,而且融合抗原蛋白表现出与灭活病毒相似的抗体滴度和对新生小鼠的抗病毒保护[15-16],但融合蛋白在E. coli细胞中表达为包涵体及分离纯化困难使得无法对该融合蛋白进行全面的药效及安全性评价。因此,本文在原有融合抗原蛋白N端引入组氨酸标签,利用金属螯合介质在蛋白质变性的条件下进行一步分离纯化,确定了变性剂的完全脱除方式,获得了结构稳定的蛋白质溶液,透射电镜分析表明该融合蛋白在pH 8.0的磷酸盐缓冲液中呈现为10nm的粒径均一的类病毒蛋白颗粒。研究结果为发展安全、高效且低成本的新型HMFD疫苗奠定了基础。
1 材料与方法 1.1 材料与设备含重组EV71多表位融合蛋白抗原的DNA序列的重组质粒pET30-VacA由中国医学科学院实验动物研究所提供。用NdeI和EcoRI对该质粒进行酶切,分离VacA的DNA片段并将该片段插入pET28a,在蛋白质N端引入组氨酸标签,获得His-VacA重组质粒,扩增后转入E.coli BL21感受态细胞,获得His-VacA重组蛋白工程菌。
蛋白质分子质量标准购自日本TaKaRa公司,230目碳膜支持铜网购自北京中镜科仪技术有限公司,其余试剂为国产分析纯。
Äkta purifier100层析系统(GE Healthcare,美国);Sephadex G25脱盐柱(GE Healthcare,美国);cOmplete His-tag金属螯合层析柱(Roche,美国);Superdex200 10/300(GE Healthcare,美国);Zetasizer Nano ZS90激光粒度仪(Malvern,英国);Mini-PROTEAN Tetra System电泳仪(Bio-Rad,美国);Milli-Q超纯水机(Millipore,美国);高压匀浆机APV-2000(APV,德国);日立HT7700透射电子显微镜(Hitachi,日本)。
1.2 方法 1.2.1 诱导表达将过夜活化的His-VacA重组工程菌(BL21)按2%(V/V)接种到含100μg/ml卡那霉素的LB培养基(1%蛋白胨,0.5%酵母膏,1% NaCl)中,于37℃、200r/min摇床扩大培养。OD600nm达到0.8后,按5%(V/V)接种量转接到含100μg/ml卡那霉素的15L 2×LB培养基的发酵罐中,在37℃继续培养,当OD600nm达到5.0~8.0后添加0.5mmol/L IPTG诱导His-VacA蛋白表达,继续培养4h。
1.2.2 包涵体制备发酵结束,于4 000r/min离心20min收集细胞。将细胞沉淀按1∶10 (m/V)重悬于溶液A(20mmol/L Tris-HCl,1mmol/L EDTA,pH 8.3)中,高压匀浆破菌,操作压力800bar,反复3次。将破菌液10 000r/min离心30min后分别收集上清液和沉淀,进行12% SDS-PAGE检测。分别用含1% Triton X-100、1mol/L NaCl的溶液A重悬洗涤包涵体,最后用去离子水洗涤。每次洗涤后10 000r/min离心30min,弃去上清液。
1.2.3 包涵体变性将包涵体按1∶10(m/V)重悬于盐酸胍变性剂(6mol/L盐酸胍,20mmol/L Tris-HCl,1mmol/L EDTA,50mmol/L DTT,pH 8.3)中,室温转鼓震荡溶解7h后10 000r/min离心15min,变性蛋白质溶液冻于-70℃备用。
1.2.4 亲和层析纯化将盐酸胍变性溶解的His-VacA蛋白用Sephadex G25脱盐柱置换缓冲液到溶液B (8mol/L脲,5mmol/L DTT,20mmol/L Tris-HCl,1mmol/L EDTA)中,然后用溶液B平衡的cOmplete His-tag金属螯合层析柱纯化,用溶液B淋洗到基线平稳后,分别用含150mmol/L、300mmol/L和500mmol/L咪唑的溶液B进行阶跃洗脱。
1.2.5 复性和组装将纯化后的His-VacA蛋白稀释复性至2mol/L脲的复性缓冲液(2mol/L脲,50mmol/L PB,pH 8.0),4℃放置过夜。然后用Sephadex G25脱盐柱将蛋白置换至50mmol/L PB,pH 8.0缓冲液,4℃存放。
1.2.6 SDS-PAGE参照文献[17],浓缩胶和分离胶分别为5%和12%,考马斯亮蓝R-250染液染色。
1.2.7 凝胶过滤检测复性样品将Superdex200 10/300用溶液C(20mmol/L PB,1mmol/L EDTA,2mol/L脲,pH 8.0)平衡好后,上样0.5ml,流速0.5ml/min,检测波长为280nm。
1.2.8 动态光散射检测粒径样品以12 000r/min离心15min后,用Zetasizer Nano ZS90激光粒度仪检测粒径。先将样品平衡到25℃,每个样品测量5次。
1.2.9 透射电子显微镜观察融合蛋白形貌加5μl蛋白质滴加到亲水处理的230目的铜网上,吸附1min后,滤纸吸去多余的样品,然后滴加蒸馏水洗铜网表面后用滤纸吸干,最后用2%磷钨酸染色,滤纸吸去多余染色液后晾干铜网,用日立HT7700透射电子显微镜观察。
2 结果 2.1 融合蛋白诱导表达及包涵体提取制备图 1(a)是含His-VacA质粒的重组E.coli在15L发酵罐中的生长曲线。当菌体在发酵罐中培养4h后OD600nm达到6.0,菌体已进入对数生长期。加入0.5mmol/L IPTG诱导His-VacA蛋白表达,继续生长4h后OD600nm达到11左右,此时生长缓慢,停止培养。SDS-PAGE检测诱导前后目标蛋白的表达情况[图 1(b)]。His-VacA蛋白理论分子质量约为50kDa,与诱导前相比,加入IPTG后目标蛋白位置条带量增加明显,表达量约为8%。离心收集菌体共191.2g。采用高压匀浆破菌,离心后有大量沉淀,对上清液和沉淀分别电泳分析,发现目标蛋白全部位于沉淀中[图 1(b)],表明His-VacA以包涵体形式表达。离心后沉淀洗涤3次,纯度达到60%[图 1(c)],湿重共约23.3g包涵体。
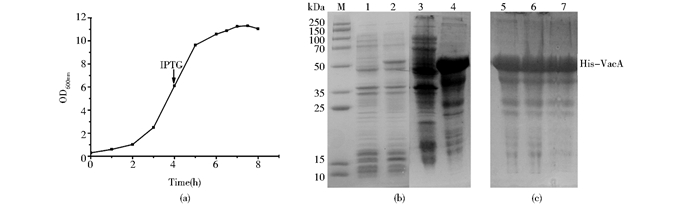
|
| 图 1 重组E.coli生长曲线(a)、SDS-PAGE检测诱导前后和破菌后(b)及包涵体洗涤(c)过程中目标蛋白含量及纯度 Figure 1 The growth curve of recombinant E. coli (a) and SDS-PAGE analysis of the expression of His-VacA (b), and the pellets of cell disruption after different washings(c) M: Molecular weights stand; Lane1-2: Before and after induction by IPTG; Lane3-4: Supernatant and pellets after cell disruption; Lane5-7: Inclusion bodies washed by Triton X-100, NaCl and ddH2O |
包涵体采用6mol/L盐酸胍变性溶解,同时变性过程加入过量还原剂DTT打开包涵体中分子内及分子间错误形成的二硫键。通常,还原剂和EDTA会引起金属螯合介质配基脱落,因此选用了能耐受还原剂及EDTA的cOmplete His-tag螯合介质对变性蛋白质直接进行分离纯化[图 2(a)],用SDS-PAGE对穿透峰及不同浓度咪唑的洗脱峰进行纯度分析[图 2(b)]。可以看出,穿透峰和150mmol/L咪唑的洗脱峰主要是结合能力相对弱的杂蛋白和少量的目标蛋白,300mmol/L咪唑洗脱收得的P2洗脱峰是目标蛋白主峰,纯度可达95%。最后用500mmol/L咪唑清洗柱子收到的P3洗脱峰是极少量残留的目标蛋白和杂蛋白。通过计算确定目标蛋白收率为46.8%(表 1)。
| 总蛋白质 (mg) |
纯度 (%) |
His-VacA (mg) |
His-VacA收率 (%) |
|
| 变性蛋白 | 22.72 | 60 | 11.63 | — |
| P2洗脱峰 | 5.73 | 95 | 5.44 | 46.8 |
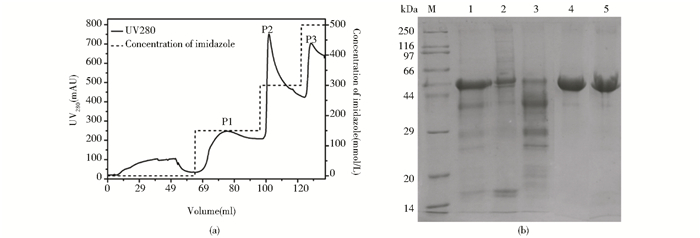
|
| 图 2 镍金属螯合亲和层析纯化His-VacA蛋白的层析图(a)和SDS-PAGE检测图(b) Figure 2 Chromatographic profile of His-VacA through cOmplete His-tag media (a) and SDS-PAGE analysis of the eluted peaks M: Molecular weights stand; Lane1: Denatured inclusion bodies; Lane2: The pass through peak of cOmplete His-tag purification; Lane3-5:P1, P2, P3 of cOmplete His-tag purification |
纯化后的蛋白质溶液中含有8mol/L脲,首先采用透析复性的方式降低脲浓度,希望获得具有稳定结构的蛋白质溶液。但当His-VacA变性蛋白直接透析至不含脲的PB缓冲液时,蛋白质几乎全部沉淀。而透析或直接稀释至含有2mol/L脲的相同缓冲液中无沉淀产生。Superdex200检测稀释后样品发现融合蛋白在外水体积出峰[图 3(a)],动态光散射检测蛋白质的水力学直径为22nm[图 3(b)]。凝胶过滤和DLS检测结果均表明2mol/L脲中融合蛋白无单体存在,而是形成了一种高分子质量的蛋白质聚集体。
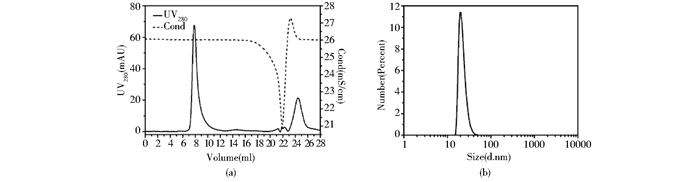
|
| 图 3 Superdex200 10/300 (a)和DLS (b)检测复性样品 Figure 3 Superdex200 (a) and DLS (b) analysis of the diluted sample in the presence of 2mol/L urea |
为避免残留脲对蛋白质结构的干扰,采用G25脱盐柱将2mol/L脲稀释复性样品置换至不含脲的PB缓冲液中,发现此时脱除脲后蛋白质不沉淀。采用透射电子显微镜观察2mol/L脲中的稀释复性及完全脱除脲后的蛋白质溶液,如图 4所示,2mol/L脲中蛋白质形成了无规则长短不一的聚集体,完全脱除脲后蛋白质则呈现为十分均匀的粒径为10nm左右的蛋白质颗粒。该蛋白质溶液可以直接和佐剂混合后进行免疫活性、稳定性及各种安全性评价。

|
| 图 4 透射电镜检测复性及组装样品:(a)含有2mol/L脲的复性样品(b)脱除脲后的组装样品 Figure 4 Transmission electron microscopy analysis of His-VacA protein in the presence of (a) and absence of (b) 2mol/L urea |
除去传染性核酸仅含病毒衣壳蛋白的病毒样蛋白颗粒是迄今最有潜力的新型疫苗品种。这种病毒样蛋白颗粒将全病毒疫苗的高效性及亚单位疫苗的安全性整合在同一体系中,是目前疫苗研发的热点及重要方向。病毒样颗粒多采用昆虫细胞表达,但随着宫颈癌疫苗[18]以及戊肝疫苗[19]通过原核体系成功制备,越来越多的类病毒蛋白颗粒正逐渐被生长迅速、低成本且制备技术成熟的重组大肠杆菌体系尝试表达和制备[20]。
在前期研究中,我们通过抗原表位筛选构建了EV71多表位融合抗原蛋白,虽然融合抗原能诱导与灭活病毒相似的免疫反应[15],但形成包涵体和难以分离纯化阻碍了对该融合抗原的进一步评价和开发。病毒衣壳蛋白独特的理化性质使得其易于结合宿主核酸及杂蛋白[21],但这种结合可以被高浓度的变性剂破坏,因此,以包涵体形式表达的抗原蛋白多在变性条件下进行分离纯化。研究过程发现,VacA多表位融合抗原很难通过常规层析介质实现与宿主蛋白的有效分离,因此本文在融合抗原蛋白N端引入组氨酸标签,通过耐受还原剂和EDTA的金属螯合介质成功获得了纯度大于95%的蛋白质纯品,极大地简化了融合抗原蛋白的分离纯化过程。由于包涵体是结构错误的蛋白质折叠体,需要通过变性/复性/组装操作恢复蛋白质及颗粒的正确结构及活性。采用常规透析方式脱除变性剂时蛋白质大量沉淀,而先稀释至2mol/L脲再进一步完全脱除脲则能完全避免蛋白质沉淀。透射电镜发现融合蛋白在2mol/L脲的缓冲液中表现为长短不均一的高分子聚集体。当脱除2mol/L脲后,发现这种聚集体能转化为粒径均一的类病毒蛋白颗粒。完整EV71病毒粒径一般为25~30nm,His-VacA多表位融合抗原蛋白只截取了VP1、VP2和VP3的部分肽段,从而导致融合蛋白形成的类病毒颗粒较小(10nm)。通过上述研究,我们建立了一种易于放大的EV71融合蛋白抗原的制备方法,并首次获得了粒径均一、结构稳定的类病毒蛋白颗粒,可直接用于随后的各种免疫活性评价、理化性质鉴定及安全性评价。上述研究不仅为新型安全的HFMD疫苗研发奠定了基础,同时本文所建立的融合衣壳蛋白包涵体分离纯化及胞外复性组装方法对其它病毒样颗粒疫苗的研发也具有借鉴参考价值。
| [1] | McMinn P C. An overview of the evolution of enterovirus 71 and its clinical and public health significance. Fems Microbiology Reviews , 2002, 26 (1) : 91–107. DOI:10.1111/j.1574-6976.2002.tb00601.x |
| [2] | Li R C, Liu L D, Mo Z J, et al. An inactivated enterovirus 71 vaccine in healthy children. New England Journal of Medicine , 2014, 370 (9) : 829–837. DOI:10.1056/NEJMoa1303224 |
| [3] | Xing W J, Liao Q H, Viboud C, et al. Hand, foot, and mouth disease in China, 2008-12:an epidemiological study. The Lancet Infectious Diseases , 2014, 14 (4) : 308–318. DOI:10.1016/S1473-3099(13)70342-6 |
| [4] | Zhu F C, Xu W B, Xia J L, et al. Efficacy, safety, and immunogenicity of an enterovirus 71 vaccine in China. New England Journal of Medicine , 2014, 370 (9) : 818–828. DOI:10.1056/NEJMoa1304923 |
| [5] | Zhang D M, Lu J Y, Lu J H. Enterovirus 71 vaccine:close but still far. International Journal of Infectious Diseases , 2010, 14 (9) : e739–743. DOI:10.1016/j.ijid.2009.12.002 |
| [6] | 罗雯. 肠道病毒71型疫苗研究进展. 实用预防医学 , 2013, 20 (12) : 1535–1537. Luo W. Research progress on the development of enterovirus 71 vaccines. Practical Preventive Medicine , 2013, 20 (12) : 1535–1537. |
| [7] | Chung Y C, Huang J H, Lai C W, et al. Expression, purification and characterization of enterovirus-71 virus-like particles. World Journal of Gastroenterology , 2006, 12 (6) : 921–927. DOI:10.3748/wjg.v12.i6.921 |
| [8] | Li H Y, Han J F, Qin C F, et al. Virus-like particles for enterovirus 71 produced from Saccharomyces cerevisiae potently elicits protective immune responses in mice. Vaccine , 2013, 31 (32) : 3281–3287. DOI:10.1016/j.vaccine.2013.05.019 |
| [9] | Zhang C, Ku Z Q, Liu Q W, et al. High-yield production of recombinant virus-like particles of enterovirus 71 in Pichia pastoris and their protective efficacy against oral viral challenge in mice. Vaccine , 2015, 33 (20) : 2335–2341. DOI:10.1016/j.vaccine.2015.03.034 |
| [10] | Zhao D, Sun B, Jiang H, et al. Enterovirus71 virus-like particles produced from insect cells and purified by multistep chromatography elicit strong humoral immune responses in mice. J Appl Microbiol , 2015, 119 (4) : 1196–1205. DOI:10.1111/jam.12922 |
| [11] | Cifuente J O, Lee H, Yoder J D, et al. Structures of the procapsid and mature virion of enterovirus 71 strain 1095. Journal of Virology , 2013, 87 (13) : 7637–7645. DOI:10.1128/JVI.03519-12 |
| [12] | Ho M. Enterovirus 71:the virus, its infections and outbreaks. Journal of Microbiology, Immunology, and Infection , 2000, 33 (4) : 205–216. |
| [13] | Foo D G, Alonso S, Phoon M C, et al. Identification of neutralizing linear epitopes from the VP1 capsid protein of Enterovirus 71 using synthetic peptides. Virus Research , 2007, 125 (1) : 61–68. DOI:10.1016/j.virusres.2006.12.005 |
| [14] | Chiu C H, Chu C, He C C, et al. Protection of neonatal mice from lethal enterovirus 71 infection by maternal immunization with attenuated Salmonella enterica serovar Typhimurium expressing VP1 of enterovirus 71. Microbes and Infection , 2006, 8 (7) : 1671–1678. DOI:10.1016/j.micinf.2006.01.021 |
| [15] | Liu J N, Wang W, Duo J Y, et al. Combined peptides of human enterovirus 71 protect against virus infection in mice. Vaccine , 2010, 28 (46) : 7444–7451. DOI:10.1016/j.vaccine.2010.08.080 |
| [16] | 郝翊, 秦川. 人肠道病毒71型亚单位疫苗的研制. 中国比较医学杂志 , 2010, 20 (6) : 7–12. Hao Y, Qin C. Preparation of subunit vaccine for human enterovirus 71. Chinese Journal of Comparative Medicine , 2010, 20 (6) : 7–12. |
| [17] | Laemmli U K. Cleavage of structural proteins during assembly of head of bacteriophage-T4. Nature , 1970, 227 (5259) : 680–685. DOI:10.1038/227680a0 |
| [18] | Chen X J S, Casini G, Harrison S C, et al. Papillomavirus capsid protein expression in Escherichia coli:Purification and assembly of HPV11 and HPV16 L1. Journal of Molecular Biology , 2001, 307 (1) : 173–182. DOI:10.1006/jmbi.2000.4464 |
| [19] | Yang C Y, Pan H R, Wei M X, et al. Hepatitis E virus capsid protein assembles in 4M urea in the presence of salts. Protein Science , 2013, 22 (3) : 314–326. DOI:10.1002/pro.2213 |
| [20] | Zhang Y, Song S X, Liu C Y, et al. Generation of chimeric HBc proteins with epitopes in E.coli:formation of virus-like particles and a potent inducer of antigen-specific cytotoxic immune response and anti-tumor effect in vivo. Cellular Immunology , 2007, 247 (1) : 18–27. DOI:10.1016/j.cellimm.2007.07.003 |
| [21] | Lipin D I, Chuan Y P, Lua L H L, et al. Encapsulation of DNA and non-viral protein changes the structure of murine polyomavirus virus-like particles. Archives of Virology , 2008, 153 (11) : 2027–2039. DOI:10.1007/s00705-008-0220-9 |
 2016, Vol. 36
2016, Vol. 36




