文章信息
- 刘帅, 邱金奎, 年洪娟.
- LIU Shuai, QIU Jin-kui, NIAN Hong-juan.
- 土生隐球酵母14-3-3蛋白耐铝能力的研究
- Study on Aluminum Resistant Capacity of 14-3-3 Protein from Cryptococcus humicola
- 中国生物工程杂志, 2016, 36(7): 27-33
- CHINA BIOTECHNOLOGY, 2016, 36(7): 27-33
- http://dx.doi.org/DOI:10.13523/j.cb.20160705
-
文章历史
- 收稿日期: 2016-01-12
- 修回日期: 2016-03-14
铝是地壳中含量最丰富的金属元素之一,是酸性土壤中影响农作物产量的主要因子。农业上通常靠施加大量的生石灰来解除铝毒害,但成本高,且对深层土壤的铝毒害没有实质性的改变。通过遗传改良获得抗铝毒害能力较强的植物品种,是解决酸性土壤中铝毒害的有效途径之一。因此,研究生物中的耐铝机制和寻找耐铝基因对农业生产具有重要意义。
14-3-3蛋白是存在于真核生物中高度保守的调控蛋白,植物中14-3-3蛋白通过与磷酸化或非磷酸化的靶蛋白相互作用,这些靶蛋白几乎涉及生物细胞中的各个过程[1]。有关研究表明,14-3-3蛋白参与植物对多种胁迫的应答过程,过量表达14-3-3蛋白可以提高植物抗胁迫的能力。近几年越来越多的研究结果表明,14-3-3蛋白对质膜H+-ATPase的活性有重要的调控作用, 质膜H+-ATPase是14-3-3蛋白在质膜上的主要结合靶点, 14-3-3通过与质膜H+-ATPase的C端结合而增加其活性[2]。Hyun等[3]发现在亚麻荠和油菜籽中质膜H+-ATPase和14-3-3蛋白在3天的冷胁迫后活性与翻译能力都有所增加,但是在正常条件下又恢复正常水平,14-3-3蛋白与H+-ATPase活性的增加是平行的。Manak和Ferl[4]的研究表明,在植物中增加多聚阳离子的浓度能提高14-3-3蛋白与其靶蛋白的互作水平。当植物细胞遇到毒素、pH变化、胁迫时,14-3-3蛋白更易与H+-ATPase结合。
14-3-3蛋白在微生物细胞分裂中起着关键作用。将条件致死的BMH基因突变的酿酒酵母从条件适宜的环境转移到限制型条件中会使芽殖细胞大量积累[5]。粟酒裂殖酵母rad24缺失突变体及少量的rad25缺失突变体过早地进入有丝分裂,这表明14-3-3蛋白在细胞何时进入有丝分裂期中具有决定作用[6]。14-3-3蛋白对于液泡的靶向运输也是很重要的。在细胞中过表达BMH2p C端区域的酵母会导致液泡转运的障碍和肌动蛋白细胞骨架的崩溃[7]。此外,在酵母细胞接合生殖过程中过量表达rad24和rad25基因会影响粟酒裂殖酵母的结合及孢子的形成[8]。在土生隐球酵母中,通过全基因组测序,发现了一种编码14-3-3蛋白的基因,该基因在铝胁迫下呈上调表达。本研究通过构建该蛋白质的原核表达载体,纯化重组蛋白进而得到14-3-3蛋白的抗体,从而为研究14-3-3蛋白在土生隐球酵母中铝胁迫下的作用机制做准备。通过构建14-3-3蛋白的过表达转基因酵母菌株,进一步说明14-3-3蛋白在耐铝中所起的作用。
1 材料与方法 1.1 实验材料本实验材料为土生隐球酵母菌株BSLL1-1,是从云南保山茶园土壤中筛选出的耐铝酵母菌株,最高可耐200mmol/L浓度的铝[9]。大肠杆菌DH5α和BL21购于北京全式金生物科技有限公司,克隆载体pMD18-T试剂盒购于大连宝生物公司(TaKaRa),原核表达载体pET32a、酵母表达载体pYES3/CT和酿酒酵母菌株INVSc1 (MATa his3D1 leu2 trp1-289 ura3-52)为本实验室保存。
PCR mix购自天根生化科技(北京)有限公司。限制性核酸内切酶、RNA酶抑制剂、dNTP和Taqplus聚合酶等为大连宝生物工程有限公司产品,M-MLV Reverse Transcriptase购于美国Promega公司,PCR产物纯化试剂盒、质粒提取试剂盒购自北京百泰克生物技术有限公司,Ni琼脂糖凝胶购自康为世纪生物科技有限公司。
1.2 RNA提取及cDNA的合成RNA的提取使用TRIzoL(大连宝生物工程有限公司)的方法,具体步骤如下。
(1)收集土生隐球酵母菌株材料0.1g,加入液氮研磨成粉末后,加入1ml TRIzoL提取液。
(2)将液体转入Eppendorf管中,室温静置5min,再加入0.2ml氯仿,剧烈震荡,置于冰上5min,4℃12 000r/min离心5min。
(3)取上清液,用等体积的氯仿抽提,剧烈震荡,置于冰上5min,4℃12 000r/min离心5min。
(4)取上清液,加入等体积的异丙醇,-20℃沉淀至少30min,在4℃12 000r/min离心30min。
(5)弃上清液,加入1ml 75%的乙醇冲洗沉淀两次,4℃12 000r/min离心5min,取沉淀。
(6)将沉淀真空干燥或是自然干燥,再用适量的DEPC水溶解,-80℃保存备用。
用M-MLV Reverse Transcriptase反转录试剂盒将RNA反转录成cDNA,如表 1所示。
| 反转录体系1 | 反转录体系2 | |||
| 组分 | 使用量 | 组分 | 使用量 | |
| 总RNA | 1ng~1μg | 5×M-MLV Buffer | 4μl | |
| Oligo(dT) | 1μl | 10mmol/L dNTP mix | 1μl | |
| DEPC水 | Added to12μl | RNase Inhibitor | 1μl | |
| M-MLV (RNaseH) | 0.5~1μl | |||
| DEPC水 | Added to 13μl | |||
1.3 基因的克隆及序列测定
以土生隐球酵母的cDNA为模板,利用特异性引物(14-3-3F: GGATCCATGTCTACTGTTTCGCGTGAAGACT和14-3-3R: GAATTCTTAGGCCGCAGCGGGCTCCTCCTTG)扩增14-3-3基因片段,将其连接到pMD-18T上得到pMD-18T-14-3-3,连接体系如表 2所示。连接产物通过热刺激法转入到大肠杆菌DH5α感受态中,将大肠杆菌涂布在含有氨苄青霉素(Amp)抗性的LB平板上,37℃培养10~12h后,挑取单菌落,在Amp的液体LB中培养。用碱裂解法提取大肠杆菌中的质粒,用XhoI、BamH I限制性核酸内切酶对该质粒酶切鉴定,酶切鉴定正确的质粒送上海生工生物工程有限公司测序。
| 反应体系组分 | 体积 |
| 目的片段DNA | 2.5μl(0.1~0.2pmol) |
| pMD-18T载体 | 0.5μl(50μg/ml) |
| Ligation solutionⅠ | 3μl |
1.4 构建14-3-3蛋白原核表达载体
用XhoI、BamH I限制性核酸内切酶酶切pMD-18T-14-3-3重组质粒和pET32a载体,得到含有XhoI、BamHI限制性切核内酸酶位点的14-3-3基因片段和原核表达载体片段,用DNA纯化试剂盒按照说明书回收目的片段和载体片段,将回收的14-3-3片段连接到pET32a原核表达载体上,成功构建了含有目的基因的pET32a-14-3-3原核表达载体。
1.5 14-3-3重组蛋白诱导表达及纯化用热刺激法将pET32a-14-3-3重组质粒转入到大肠杆菌BL21感受态细胞中,均匀涂布于含Amp的LB固体平板上;次日挑取pET32a-14-3-3重组菌落,接种于含Amp的LB液体培养基中,200r/min、37℃培养过夜,当大肠杆菌处于对数生长期时,加入ITPG至终浓度为1mmol/L,对含有14-3-3目的基因的表达载体进行诱导表达。收集菌体进行超声波破碎,破碎上清液在4℃、12 000r/min,离心20min,收集上清液与沉淀,用SDS-PAGE检测蛋白质的最优表达条件和表达形式。将表达的重组蛋白用Ni琼脂糖凝胶进行纯化。
1.6 14-3-3蛋白抗体的制备取1mg 14-3-3重组蛋白,用生理盐水稀释到1ml,再加入等体积弗氏佐剂,用研钵将溶液和佐剂混匀,形成油包水的状态。免疫用兔子为2.5~3.0kg的雄性新西兰大白兔;免疫之前,耳静脉取阴性血清。将混匀的免疫原进行背部皮下注射。
心脏采血,将血液于10 000r/min、4℃离心15min,取上清液,分装后置-20℃冰箱中保存备用。用Western blotting方法检测得到的多克隆抗体,用阴性血清作为负对照。
1.7 酵母表达载体及转基因酵母的构建和验证分别用BamH I、EcoR I限制性核酸内切酶酶切pMD18-T-14-3-3重组质粒和pYES3/CT空载体,得到含有BamH I、EcoR I限制性核酸内切酶酶切位点的14-3-3片段和载体片段,将回收纯化的14-3-3片段连接到pYES3/CT表达载体上得到14-3-3的酵母表达载体pYES3/CT-14-3-3。pYES3/CT-14-3-3用乙酸锂的方法转入酿酒酵母INVSc1中,转化子在缺失色氨酸的选择培养基上(SC-trp:0.67%不含氨基酸但包含硫酸铵的酵母氮粉;2%葡萄糖;0.01%的腺嘌呤、精氨酸、半胱氨酸、亮氨酸、赖氨酸、苏氨酸、尿嘧啶;0.005%的天冬氨酸、组氨酸、异亮氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、酪氨酸、缬氨酸;2%琼脂粉)30℃生长2天,长出的菌落用于进一步研究。通过菌液PCR方法检测转基因酵母中重组质粒的转化,14-3-3蛋白在转基因酵母中的表达用Western blotting验证。
1.8 测定转基因酵母的耐铝能力为了比较转基因酵母和转空载酵母的耐铝能力,分别测定了铝胁迫下它们在固体培养基和液体培养基中的生长状况。分别配制铝浓度为0mmol/L、0.1mmol/L、0.3mmol/L、0.5mmol/L、1mmol/L、2mmol/L、5mmol/L的pH 7.0的固体YPD诱导培养基(酵母膏10g,蛋白胨20g,半乳糖20g,琼脂粉20g,水1 000ml),初始菌液OD600为1,然后按照10、102、103、104、105的倍数稀释,分别取上述菌液5μl点种于固体平板培养基上,48h后观察生长情况并拍照。按初始OD600=0.1将菌株pYES3/CT-14-3-3、pYES3/CT分别接种于含0.2mmol/L和2mmol/L Al3+的YPD诱导型液体培养基,每隔2h取样测定菌液的OD600,然后绘制菌株的生长曲线。
2 结果与分析 2.1 14-3-3基因测序结果及进化树以土生隐球酵母的cDNA为模板,利用特异性引物扩增14-3-3基因片段,将其连接到pMD-18T上得到pMD-18T-14-3-3,通过测序可知14-3-3基因的序列全长为774bp。将所得序列提交到GenBank,登录号为:KU203774。下载已知菌株的相似序列构建系统进化树如图 1所示,该序列与Trametes versicolor FP 101664SS1菌株的14-3-3基因亲缘关系最近。

|
| 图 1 14-3-3蛋白基因序列系统进化树 Figure 1 Phylogenetic tree of 14-3-3 protein gene |
从pMD-18T-14-3-3质粒上得到酶切位点为XhoI和BamHI的14-3-3基因片段,与经XhoI和BamHI酶切的原核表达载体pET32a连接,得到重组质粒pET32a-14-3-3。该质粒酶切检测结果如图 2所示,用XhoI和BamH I酶切后得到与载体和目的片段大小相符的片段,说明该质粒构建成功。
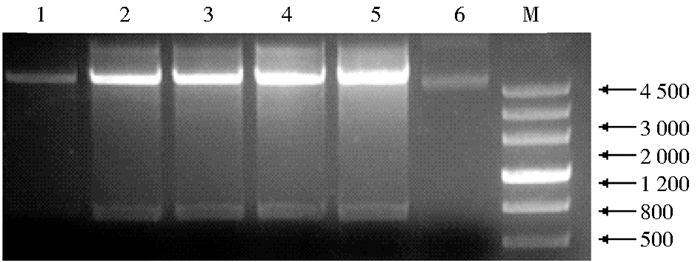
|
| 图 2 14-3-3原核表达载体的酶切检测 Figure 2 Enzyme analysis of pET32a-14-3-3 M: Marker; 1, 2, 3, 4, 5, 6: The number of recombinant plasmid |
分别在20℃、30℃、37℃条件下用1mmol/L IPTG诱导2h、4h、6h、8h、10h、12h后收集菌体,进行SDS-PAGE检测。20℃时诱导表达8h时的目的蛋白表达量最高[图 3(c)]。因此,以20℃、1mmol/L IPTG诱导8h作为最优的表达条件。将菌体扩大培养到3L,诱导结束后收集菌体,对菌体进行超声波破碎。将含有14-3-3蛋白的上清液经Ni亲和层析柱处理,用含有浓度为10mmol/L咪唑的洗脱液进行洗脱,收集洗脱液,通过SDS-PAGE检测洗脱的目的蛋白,从[图 3(d)]可以看出,纯化效果很好。以纯化出的14-3-3蛋白作为抗原免疫兔子,获得14-3-3蛋白抗体,通过Western blot检测抗体效果发现,抗体可以用于下一步实验[图 3(e)]。

|
| 图 3 14-3-3重组蛋白的纯化和抗体检测 Figure 3 The purification of the recombinant 14-3-3 protein and the detection of the anti-14-3-3 (a)Induction temperature is 37℃the quantity change of protein expression in different time, from left to right in the order is:protein marker; under 37℃induction 2h, 4h, 6h, 8h, 10h, 12h; empty vector1, 2, 3 (b)Induction temperature is 30℃the quantity change of protein expression in different time, from left to right in the order is: under 30℃induction 2h, 4h, 6h, 8h, 10h, 12h; empty vector (c)Induction temperature is 20℃the quantity change of protein expression in different time, from left to right in the order is:protein marker; under 20℃induction 2h, 4h, 6h, 8h, 10h, 12h; empty vector1, 2 (d)The effect of Protein purification (e) The detection of 14-3-3 antibody |
将该载体电击转化到对铝敏感的酵母菌株INVSc1中,获得过表达14-3-3的转基因酵母。利用菌液PCR方法可以扩增到目的条带,说明质粒已经成功转入酵母菌株中(图 4)。
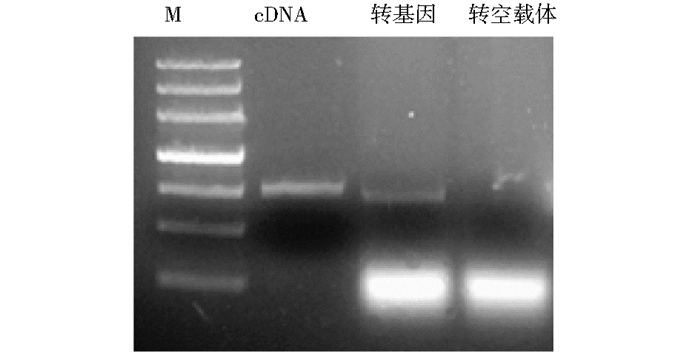
|
| 图 4 14-3-3转基因酵母的PCR验证 Figure 4 The PCR test of transgenic yeast M:DNA marker; cDNA:14-3-3 gene; Genetically modified:The PCR product of genetically modified yeast; Genetically modified empty vector:The PCR product of genetically modified empty vector yeast |
将检测正确的质粒电击转化酿酒酵母(INVSc1)感受态细胞,在SD-Trp平板上长2~3天,挑取单菌落,加入到YPD诱导培养基中,30℃培养过夜,收集菌体,提取总蛋白质,Western blotting检测结果如图 5所示,在转基因酵母中检测到了目的条带的存在,说明外源基因已经在酿酒酵母细胞中成功表达。

|
| 图 5 转基因酵母的Western blotting检测 Figure 5 Western blotting detection of genetically modified yeast |
为了比较转基因酵母和转空载酵母的耐铝能力,分别测定了它们在铝胁迫下的生长状况。通过图 6可知,随着铝浓度的提高,负对照菌株INVSc1、转空载菌株和转基因酵母菌株的菌落都不断缩小,但是相比较而言,转基因酵母的生长状况比转空载体酵母和负对照菌株长势好。在含5mmol/L铝的培养基上,负对照菌株和转空载酵母在菌液浓度为初始菌液浓度的10-4时长得不好或是基本不生长,但是转基因酵母却生长较好,这说明过表达14-3-3蛋白提高了铝敏感酵母的耐铝能力。

|
| 图 6 铝胁迫下转基因酵母的生长 Figure 6 The growth of transgenic yeast under aluminum stress |
为了验证转基因酵母在液体培养基中的耐铝能力,测定了菌株在含铝液体培养基中的生长状况。从图 7可以看出在0.2mmol/L铝时,对照酵母、转空载体酵母和转基因酵母的生长趋势并没有显著差别。而在2mmol/L铝时,转基因酵母对铝的耐受性高于对照酵母和转空载体酵母,进一步说明14-3-3蛋白能够提高酵母的耐铝胁迫能力。
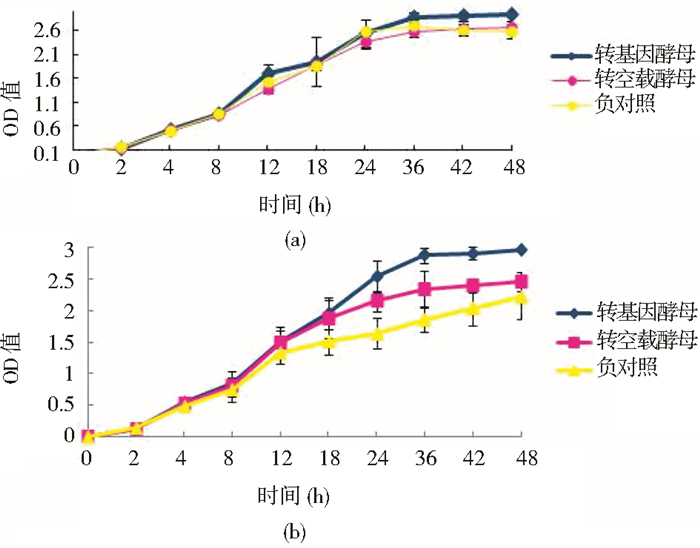
|
| 图 7 铝胁迫下转基因酵母的生长曲线 Figure 7 The growth curve of transgenic yeast under different Al concentration (a) The growth curve of yeast when the concentration of aluminum is 0.2mmol/L (b) The growth curve of yeast when the concentration of aluminum is 2mmol/L |
14-3-3作为一种高度保守的蛋白质家族成员参与很多胁迫反应,包括盐胁迫、冷胁迫、热胁迫,水分胁迫、干旱胁迫等[3, 10-15]。近年来发现,14-3-3蛋白也参与对铝胁迫的应答,在蚕豆中发现铝胁迫提高了H+-ATPase和14-3-3蛋白的表达量,增强了它们之间的互作[16]。前期研究发现,铝胁迫可以使土生隐球酵母的14-3-3蛋白基因表达增加。本研究通过构建14-3-3蛋白的转基因酵母,证明了14-3-3蛋白参与铝的抗性胁迫反应,为利用14-3-3基因进行植物耐铝遗传改良提供基因资源。
前期报道发现,来源于微生物中的14-3-3蛋白主要是在细胞发育中具有重要作用。本研究克隆于土生隐球酵母的14-3-3蛋白与植物中发现的功能类似,主要是参与胁迫应答过程,是否在细胞发育中发挥功能还有待于进一步研究。
| [1] | Maudoux O, Batoko H, Oecking C, et al. A plant plasma membrane H+-ATPase expressed in yeast is activated by phosphorylation at its penultimate residue and binding of 14-3-3 regulatory proteins in the absence of fusicoccin. J Biol Chem , 2000, 275 (23) : 17762–17770. DOI:10.1074/jbc.M909690199 |
| [2] | Bose J, Babourina O, Rengel Z. Role of magnesium in alleviation of aluminium toxicity in plants. J Exp Bot , 2011, 62 (7) : 2251–2264. DOI:10.1093/jxb/erq456 |
| [3] | Hyun S K, Jung M O, Sheng L, et al. Cold stress causes rapid but differential changes in properties of plasma membrane H+-ATPase of camelina and rapeseed. Journal of Plant Physiology , 2013, 170 (9) : 828–837. DOI:10.1016/j.jplph.2013.01.007 |
| [4] | Manak M S, Ferl R J. Divalent cation effects on interactions between multiple Arabidopsis 14-3-3 isoforms and phosphopeptide targets. Biochemistry , 2007, 46 (4) : 1055–1063. DOI:10.1021/bi061366c |
| [5] | van Heusden G P, Griffiths D J, Ford J C, et al. The 14-3-3 proteins encoded by the BMH1 and BMH2 genes are essential in the yeast Saccharomyces cerevisiae and can be replaced by a plant homologueue. Eur J Biochem , 1995, 229 (1) : 45–53. DOI:10.1111/ejb.1995.229.issue-1 |
| [6] | Ford J C, al-Khodairy F, Fotou E, et al. 14-3-3 protein homologues required for the DNA damage checkpoint in fission yeast. Scienc , 1994, 265 (5171) : 533–535. DOI:10.1126/science.8036497 |
| [7] | Roth D, Birkenfeld J, Betz H. Dominant-negative alleles of 14-3-3 proteins cause defects in actin organization and vesicle targeting in the yeast Saccharomyces cerevisiae. Febs Letters , 1999, 460 (3) : 411–416. DOI:10.1016/S0014-5793(99)01383-6 |
| [8] | Ozoe F, Kurokawa R, Kobayashi Y, et al. The 14-3-3 proteins Rad24 and Rad25 negatively regulate Byr2 by affecting its localization in Schizosaccharomyces pombe. Mol Cell Biol , 2002, 22 (20) : 7105–7119. DOI:10.1128/MCB.22.20.7105-7119.2002 |
| [9] | Nian H J, Wang G Q, Zhao L W, et al. Isolation of Al-tolerant yeasts and identification of their Al-tolerance characteristics. J Biol Res-Thessalon , 2012 (18) : 227–234. |
| [10] | Posas F, Chambers J R, Heyman J A, et al. The transcriptional response of yeast to saline stress. The Journal of Biological Chemistry , 2002, 275 (23) : 17249–55. |
| [11] | Janicka-Russak M, Kabaìa K, Wdowikowska A, et al. Modification of plasma membrane proton pumps in cucumber roots as an adaptation mechanism to salt stress. Journal of Plant Physiology , 2013, 170 (10) : 915–922. DOI:10.1016/j.jplph.2013.02.002 |
| [12] | Sondergaard T E, Schulz A, Palmgren M G. Energization of transport processes in plants.roles of the plasma membrane H+-ATPase. Plant Physiology , 2004, 136 (1) : 2475–2482. DOI:10.1104/pp.104.048231 |
| [13] | Dobrá J, Černý M, Štorchová H, et al. The impact of heat stress targeting on the hormonal and transcriptomic response in Arabidopsis. Plant Science , 2015, 231 : 52–61. DOI:10.1016/j.plantsci.2014.11.005 |
| [14] | He Y C, Wu J J, Lv B, et al. Involvement of 14-3-3 protein GRF9 in root growth and response under polyethylene glycol-induced water stress. Journal of Experimental Botany , 2015, 66 (8) : 2271–2281. DOI:10.1093/jxb/erv149 |
| [15] | Zhao P J, Liu P, Shao J F, et al. Analysis of different strategies adapted by two cassava cultivars in response to drought stress:ensuring survival or continuing growth. Journal of Experimental Botany , 2015, 66 (5) : 1477–1488. DOI:10.1093/jxb/eru507 |
| [16] | Chen Q, Guo C L, Wang P, et al. Up-regulation and interaction of the plasma membrane Ht-ATPase and the 14-3-3 protein are involved in the regulation of citrate exudation from the broad bean (Vicia faba L.) under Al stress. Plant Physiology and Biochemistry , 2013, 70 : 504–511. DOI:10.1016/j.plaphy.2013.06.015 |
 2016, Vol. 36
2016, Vol. 36




