文章信息
- 李枫, 周田甜, 刘萌, 董宁征.
- LI Feng, ZHOU Tian-tian, LIU Meng, DONG Ning-zheng.
- PCSK6对可溶性corin的活化作用研究
- Mechanism of Soluble Corin activation by PCSK6
- 中国生物工程杂志, 2016, 36(7): 15-20
- CHINA BIOTECHNOLOGY, 2016, 36(7): 15-20
- http://dx.doi.org/DOI:10.13523/j.cb.20160703
-
文章历史
- 收稿日期: 2016-02-01
- 修回日期: 2016-03-16
2. 江苏省血液研究所 卫生部血栓与止血重点实验室 苏州 215006;
3. 苏州大学唐仲英血液学研究中心 苏州 215123
2. Thrombosis and Hemostasis Key Laboratory of the Ministry of Health, Jiangsu Institute of Hematology, Suzhou 215006, China;
3. The Cyrus Tang Hematology Center, Soochow University, Suzhou 215123, China
心力衰竭是各种心血管疾病的严重和终末阶段,发病率和致死率高,是目前严重威胁人类健康的疾病之一,主要病因是高血压和冠心病[1]。目前心力衰竭的治疗主要依靠药物,包括利尿剂、肾素-血管紧张素-醛固酮系统抑制剂、受体阻滞剂、洋地黄类等。这些治疗手段虽然明显改善了心力衰竭的预后,但总体而言,心力衰竭的致死率仍居高不下。因此,对于心力衰竭新药的研发仍是心血管领域发展的一大挑战。
最近发现心脏酶corin具有调控血压和调节心脏功能的作用[2-3],corin缺乏或功能障碍与子痫前期及高血压的发生密切相关[4-7],心衰患者血浆中corin水平显著降低,且corin水平降低程度与心衰的严重程度相关[8-10]。提示补充外源性corin、提高机体内corin水平及活性,或许可作为治疗心衰的新方法。
Corin是一种在心脏中高表达的Ⅱ型跨膜丝氨酸蛋白酶[11],N端位于细胞内,有1个跨膜区,胞外区包含2个卷曲状结构(frizzled,Fz)、8个重复的低密度脂蛋白受体结构(low-density lipoprotein receptor,LDLR)、1个清道夫样受体结构(scavenger receptor,SR)及C端胰蛋白酶样蛋白酶(protease)区域,活化位点位于Arg801↓Ile802[12](图 1)。Corin主要以酶原形式合成,需要其它蛋白酶对其活化后才具有功能。最近Chen等[13]研究发现PCSK6为corin的活化酶,可以将表达于细胞膜上的corin活化,从而使corin具有将pro-ANP转化为ANP的功能。然而目前尚不清楚PCSK6是否能够剪切活化可溶性corin,从而使可溶性corin具有活性,用于心衰的治疗。本研究将就此展开,为可溶性corin治疗心力衰竭提供理论依据。
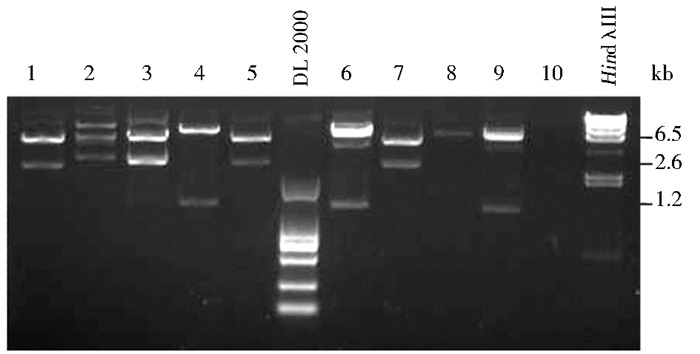
|
| 图 1 重组质粒酶切鉴定 Figure 1 Identification of expression plasmid pSECsolCorin The DNA fragment was inserted into the expression vector using the TOPO cloning method. The right orientation of the insert within the vector was determined by restriction digestion with Xba I, followed by agarose gel electrophoresis analysis. Results of ten XbaI-digested plasmids are shown in lane 1-10. Positive clones are 4 and 6. DL2000, HindλⅢwere DNA markers, being used as size standard |
分别将corin、pro-ANP及PCSK6全长cDNA克隆pcDNA3.1系列载体(Life Technology),构建corin及PCSK6表达质粒[2, 13]。
HEK293细胞购自美国ATCC公司。
pSec/FRT/V5-His-TOPO载体、V5-antibody、HRP-V5-antibody及质粒大量提取试剂盒购于美国Life Technology公司,质粒小量提取试剂盒、DNA凝胶回收试剂盒购于美国Axygen公司,FLAG-antibody、HRP-FLAG-antibody购于美国Sigma公司,T4 DNA连接酶、限制性内切核酸酶等购自日本TaKaRa公司,DNA和蛋白质分子质量标准Marker购于立陶宛Fermentas公司。
1.2 方法 1.2.1 可溶性corin表达载体构建为构建可溶性corin的表达质粒,选用具有Igκ信号肽的工具质粒pSec/FRT/V5-His-TOPO为载体,利用PCR技术,以野生型corin质粒为模板,扩增corin的胞外段全长“soluble corin”(463~3 219bp,长度2 756bp),克隆进载体pSec/FRT/V5-His-TOPO,测序验证。序列及方向正确的表达载体命名为“pSECsolCorin”。
(1)PCR扩增。根据NCBI Gene Bank公布的corin的基因序列号(NM_006587.3),使用Vector NTI软件设计引物,引物由上海生工生物技术有限公司合成。序列分别为:Forward primer,5′-GATGCTTCTCTCCCAGGGGACCAAAG-3′; Reverse primer,5′-GTTTAGGAGAAAGGTCTGGATGTAAATCTG-3′。反应条件:95℃预变性5min,95℃变性30s,58℃退火45s,72℃延伸3min,35个循环,最后68℃延伸5min。
(2)酶连、转化。取回收产物4μl与1μl pSec/FRT/V5-His-TOPO线性载体,在1μl T4 DNA连接酶及缓冲液作用下,室温静置3h,连接载体与目的片段后,转化TOP10感受态细胞,涂布LB/Amp+抗性平板,37℃倒置培养过夜后挑取单菌落提取重组体质粒进行Xba I酶切,然后进行凝胶电泳。
1.2.2 细胞培养及转染HEK293细胞培养于37℃、5% CO2的条件下,含10%胎牛血清的DMEM(Dulbecco’s modified Eagle’s medium,Thermo Hyclone)高糖培养基。转染前一日,将HEK293细胞以3×105细胞/孔的密度接种于六孔板,过夜培养至细胞汇合率为80%左右时,用TurboFect转染试剂(Thermo)进行转染,具体参见试剂说明书。于转染48h收集上清液备用,同时用含50mmol/L Tris-HCl(pH 8.0)、150mmol/L NaCl、1%(V/V)TritonX-100和蛋白酶抑制剂cocktail(Roche)的蛋白裂解液裂解细胞,检测corin的表达。
1.2.3 PCSK6稳定表达细胞系的建立HEK293细胞转染PCSK6表达载体,24h后胰酶消化细胞,重悬无限稀释法种于96孔板(1个细胞/孔),培养基中加入G418(500μg/ml),进行筛选,1月后得到HEK293-PCSK6稳定表达细胞系。
1.2.4 PCSK6对可溶性corin的活化作用分别收集表达可溶性corin及PCSK6的细胞上清液,将可溶性corin上清液与不同体积的PCSK6上清液孵育。具体为:1ml可溶性corin上清液中分别加入0ml、0.25ml、0.5ml和1.0ml的PCSK6上清液,37℃孵育2h。取样,Western blot检测corin的活化情况。同时向剩余样品中加入0.7μl/管FLAG-antibody和30μl protein A beads,4℃免沉2h,Western blot检测PCSK6的表达。
1.2.5 可溶性corin活化pro-ANP的功能研究将pro-ANP表达载体转染HEK293细胞,12h收集上清液。将PCSK6活化的可溶性corin上清液以体积梯度(0μl、25μl、50μl、100μl、200μl)加入pro-ANP上清液中,37℃孵箱反应0.5h后,每管加入0.7μl V5-antibody和30μl protein A beads,4℃免疫沉淀2h,Western blot检测pro-ANP的活化情况。
1.2.6 蛋白质免疫印迹实验(Western blot)按1∶1比例在蛋白质样品中加入还原型或非还原2×loading buffer,98℃加热1 min。进行SDS-PAGE电泳,每孔加入30μg蛋白质。转膜后,脱脂奶粉室温封闭2h,HRP-V5-antibody(1∶5 000)或HRP-FLAG-antibody(1∶8 000)稀释室温孵育2h,ECL显影。
2 结果 2.1 可溶性corin表达载体的构建为构建缺失胞内段和跨膜区的corin表达载体,即可溶性corin表达载体,以野生型corin表达载体为模板,PCR扩增corin cDNA(463~3 219bp),得到约2.6kb的片段,克隆入表达载体pSec/FRT/V5-His-TOPO载体,提取重组质粒。依据载体及插入corin片段的序列,载体及插入片段均含有一个Xba I位点,如插入序列方向正确,可获得约1.2kb的条带。Xba I酶切鉴定琼脂糖凝胶电泳结果见图 1,4号与6号质粒酶切后获得约1.2 kb的条带,与预计相符,再选取这2个质粒进行测序。测序结果显示6号质粒插入片段序列及方向完全正确,获得可溶性corin表达载体,命名为“pSECsolCorin”。由于该载体N端带有Igκ信号肽,使得缺失跨膜区的corin蛋白可以分泌到细胞外,载体的C端带有V5标签序列,便于Western blot检测重组蛋白的表达。
2.2 重组corin蛋白的表达与活化野生型corin和可溶性corin的结构见图 2(a),可溶性corin缺失胞内段及跨膜区,以Igκ信号肽引导。将WT corin、可溶性corin、corin裂解活化位点突变体R801A及活性位点突变体S985A分别转染HEK293细胞,裂解细胞,SDS-PAGE电泳,Western blot检测corin的表达及活化情况。结果如图 2(b)所示,可溶性corin、WT corin、R801A及S985A均能在HEK293表达。还原条件下,细胞裂解液可检测到170~200kDa的corin酶原条带及约40kDa的corin活化条带[13],活化位点突变的R801A及可溶性corin未见活化条带;而非还原条件下,蛋白酶结构域以二硫键与母链相连,仅能检测到酶原条带。同时还检测到细胞上清液中可溶性corin的表达,如图 2(c)所示。
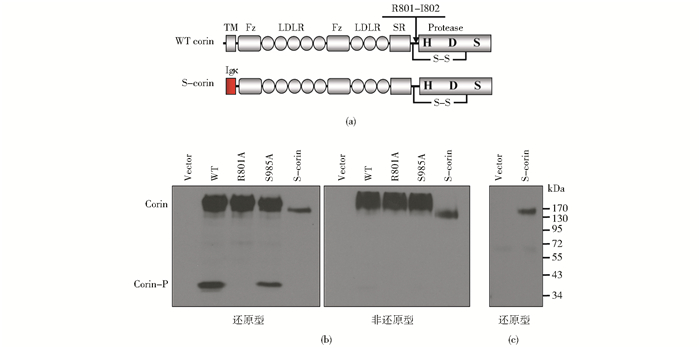
|
| 图 2 Corin及可溶性corin的表达 Figure 2 Expression of corin and soluble corin (a) Corin domains and soluble corin (b) Western blot analysis to assess expression of corin with the indicated plasmids under reducing and non-reducing conditions (c) Expression of soluble corin in conditioned medium |
通过建立稳定表达PCSK6的细胞系,收取PCSK6上清液,作用于可溶性corin上清液,Western blot方法检测corin蛋白的活化情况,结果见图 3。还原条件下,在未加入PCSK6时,corin可被HEK293细胞分泌的内源性PCSK6少量活化,产生活化条带corin-p,随着PCSK6的加入,可溶性corin的活化量增加,呈现剂量依赖性。证实可溶性corin可被PCSK6活化,且活化作用呈剂量依赖性。
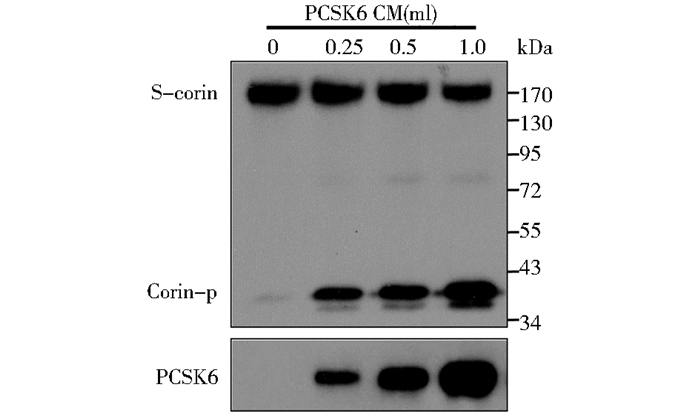
|
| 图 3 PCSK6对可溶性corin和活化作用 Figure 3 PCSK6 mediated activation of soluble corin |
同时免疫沉淀及Western blot检测反应体系中的PCSK6表达量(图 3下),随着加入PCSK6上清液体积的增加PCSK6蛋白量逐渐增加。
2.4 可溶性corin活化pro-ANP的功能实验细胞中表达的corin被PCSK6活化后才具有活化pro-ANP的功能。可溶性corin同样可以被PCSK6活化,但目前尚不知道活化后的可溶性corin是否具有活性。为此,将活化后的可溶性corin与pro-ANP上清液孵育,检测pro-ANP的活化,结果见图 4。未加入corin时,仅见到pro-ANP条带,加入corin后,便启动活化程序,检测到ANP(约13kDa)且随着corin浓度逐渐上升,pro-ANP的活化效率逐步提高。
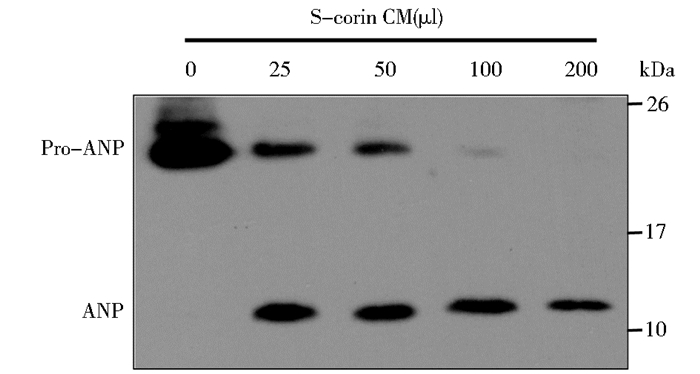
|
| 图 4 可溶性corin具有活化pro-ANP的生物学功能 Figure 4 Processing of pro-ANP by soluble corin |
Corin的生理功能是将利钠肽前体pro-ANP剪切活化为具有生物学活性的利钠肽,从而发挥降低血容量和血压、改善心功能的作用。Corin基因敲除小鼠缺少有活性的ANP,并出现高血压和心肌肥厚[4, 6, 14],表明corin具有调控血压和心脏形态的作用。而在扩张型心肌病小鼠模型中过表达corin则可改善心功能,延缓心力衰竭进展,从而延长生存时间[15]。在中国人高血压疾病患者中发现多个corin基因突变,并证实这些突变影响corin的功能[16-17]。前期研究发现心衰患者血浆中可溶性corin水平显著低于正常人,且降低程度与心衰严重程度相关。这些结果说明corin缺乏或功能障碍可能会导致高血压及心衰等心血管疾病的发生。
Corin-利钠肽途径在高血压及心衰发病机制中起着重要作用,而心钠素及脑钠肽已用于严重心力衰竭的临床试验及治疗,以达到缓解症状、改善血流动力及提高心功能的作用[18-19]。这些多肽的作用机制非常独特,不同于传统的利尿剂及扩血管药物,在接受利尿剂及扩血管剂的患者中也可取得了显著的疗效[20-21]。然而ANP和BNP的血浆半衰期都非常短(人体内分别为3min和18min),需要持续静脉输注[22-24]。Corin的发现为心衰的治疗提供了新思路。
由于corin是跨膜蛋白,为后期大量制备治疗用重组蛋白,本研究构建了表达缺失胞内段及跨膜区的可溶性corin,并在HEK293细胞中成功表达。但corin是以酶原形式合成的,需要其它蛋白酶地活化后才具有生物学功能。最近研究证实PCSCK6可以剪切并活化corin酶原。加入PCSK6酶抑制剂或小干扰RNA会阻断corin的活化。相反,过表达PCSK6则会增强corin的活化。在PCSK6敲除鼠中未检测到corin酶原的激活及pro-ANP活化反应,且在高盐饮食下容易诱发高血压。在高血压人群中发现了一例因PCSK6位点突变引起的corin的活性受损。在体内外证实PCSK6就是corin的活化酶[13]。
PCSK6是一种Ca2+依赖的枯草杆菌酶样内切蛋白酶,属于前蛋白转化酶家族(proprotein convertases,PCs),具有分泌属性,可以持续分泌到细胞外[25]。PCSK6通过富含半胱氨酸的区域定位于细胞膜,并与膜相关底物结合[26],通过对偶合氨基酸的裂解作用使神经和肽类激素、蛋白水解酶等无活性的前体物质转化为其活性形式来发挥作用[27-28]。PCSK6可以裂解活化细胞膜表达的corin,但目前尚不知道它是否同样也能活化可溶性corin。
为探讨PCSK6是否可以活化可溶性corin,在细胞水平开展了一系列研究。在HKE293细胞分别表达可溶性corin和PCSK6,并将PCSK6以剂量梯度加入可溶性corin中,发现PCSK6可以活化可溶性corin,且随着PCSK6剂量增加,可溶性蛋白的活化条带增强。同时也证实活化后的可溶性corin具有活化pro-ANP的生物学功能。本研究证实PCSK6能活化可溶性corin,使其具有生物学活性。此研究将为后期进一步纯化可溶性corin,并使之具有活性,最终应用于心衰的治疗打下基础。
| [1] | Jessup M, Brozena S. Heart failure. N Engl J Med , 2003, 348 (20) : 2007–2018. DOI:10.1056/NEJMra021498 |
| [2] | Yan W, Wu F, Morser J, et al. Corin, a transmembrane cardiac serine protease, acts as a pro-atrial natriuretic peptide-converting enzyme. Proc Natl Acad.Sci.USA , 2000, 97 (15) : 8525–8529. DOI:10.1073/pnas.150149097 |
| [3] | Armaly Z, Assady S, Abassi Z. Corin:a new player in the regulation of salt-water balance and blood pressure. Curr Opin Nephrol Hypertens , 2013, 22 (6) : 713–722. DOI:10.1097/01.mnh.0000435609.35789.32 |
| [4] | Chan J C, Knudson O, Wu F, et al. Hypertension in mice lacking the proatrial natriuretic peptide convertase corin. Proc Natl Acad Sci USA , 2005, 102 (3) : 785–790. DOI:10.1073/pnas.0407234102 |
| [5] | Cui Y J, Wang W, Dong N Z, et al. Role of corin in trophoblast invasion and uterine spiral artery remodelling in pregnancy. Nature , 2012, 484 (7393) : 246–250. DOI:10.1038/nature10897 |
| [6] | Wang W, Shen J Z, Cui Y J, et al. Impaired sodium excretion and salt-sensitive hypertension in corin-deficient mice. Kidney Int , 2012, 82 (1) : 26–33. DOI:10.1038/ki.2012.41 |
| [7] | Dries D L, Victor R G, Rame J E, et al. Corin gene minor allele defined by 2 missense mutations is common in blacks and associated with high blood pressure and hypertension. Circulation , 2005, 112 (16) : 2403–2410. DOI:10.1161/CIRCULATIONAHA.105.568881 |
| [8] | Dong N Z, Chen S H, Yang J H, et al. Plasma soluble corin in patients with heart failure. Circ Heart Fail , 2010, 3 (2) : 207–211. DOI:10.1161/CIRCHEARTFAILURE.109.903849 |
| [9] | Dong N Z, Dong J, Liu P, et al. Effects of anticoagulants on human plasma soluble corin levels measured by ELISA. Clin Chim Acta , 2010, 411 (23-24) : 1998–2003. DOI:10.1016/j.cca.2010.08.021 |
| [10] | Ibebuogu U N, Gladysheva I P, Houng A K, et al. Decompensated heart failure is associated with reduced corin levels and decreased cleavage of pro-atrial natriuretic peptide. Circ Heart Fail , 2011, 4 (2) : 114–120. DOI:10.1161/CIRCHEARTFAILURE.109.895581 |
| [11] | Yan W, Sheng N, Seto M, et al. Corin, a mosaic transmembrane serine protease encoded by a novel cDNA from human heart. J Biol Chem , 1999, 274 (21) : 14926–14935. DOI:10.1074/jbc.274.21.14926 |
| [12] | Wu Q Y, Cai O, Chen S H, et al. Corin:new insights into the natriuretic peptide system. Kidney Int , 2009, 75 (2) : 142–146. DOI:10.1038/ki.2008.418 |
| [13] | Chen S H, Cao P X, Dong N, et al. PCSK6-mediated corin activation is essential for normal blood pressure. Nat Med , 2015, 21 (9) : 1048–1053. DOI:10.1038/nm.3920 |
| [14] | Wang W, Cui Y J, Shen J Z, et al. Salt-sensitive hypertension and cardiac hypertrophy in transgenic mice expressing a corin variant identified in blacks. Hypertension , 2012, 60 (5) : 1352–1358. DOI:10.1161/HYPERTENSIONAHA.112.201244 |
| [15] | Gladysheva I P, Wang D, McNamee R A, et al. Corin overexpression improves cardiac function, heart failure, and survival in mice with dilated cardiomyopathy. Hypertension , 2013, 61 (2) : 327–332. DOI:10.1161/HYPERTENSIONAHA.112.193631 |
| [16] | Dong N Z, Fang C D, Jiang Y Z, et al. Corin mutation R539C from hypertensive patients impairs zymogen activation and generates an inactive alternative ectodomain fragment. J Biol Chem , 2013, 288 (11) : 7867–7874. DOI:10.1074/jbc.M112.411512 |
| [17] | Zhang Y, Li H, Zhou J P, et al. A corin variant identified in hypertensive patients that alters cytoplasmic tail and reduces cell surface expression and activity. Sci Rep , 2014, 4 : 7378. DOI:10.1038/srep07378 |
| [18] | Colucci W S, Elkayam U, Horton D P, et al. Intravenous nesiritide, a natriuretic peptide, in the treatment of decompensated congestive heart failure. Nesiritide Study Group.N Engl J Med , 2000, 343 (4) : 246–253. |
| [19] | Anker S D, Ponikowski P, Mitrovic V, et al. Ularitide for the treatment of acute decompensated heart failure:from preclinical to clinical studies. Eur Heart J , 2015, 36 (12) : 715–723. DOI:10.1093/eurheartj/ehu484 |
| [20] | Mitaka C, Kudo T, Haraguchi G, et al. Cardiovascular and renal effects of carperitide and nesiritide in cardiovascular surgery patients:a systematic review and meta-analysis. Crit Care , 2011, 15 (5) : R258. DOI:10.1186/cc10519 |
| [21] | Saito Y. Roles of atrial natriuretic peptide and its therapeutic use. J Cardiol , 2010, 56 (3) : 262–270. DOI:10.1016/j.jjcc.2010.08.001 |
| [22] | Ohashi M, Fujio N, Nawata H, et al. Pharmacokinetics of synthetic alpha-human atrial natriuretic polypeptide in normal men; effect of aging. Regul Pept , 1987, 19 (5-6) : 265–272. DOI:10.1016/0167-0115(87)90168-6 |
| [23] | Nakao K, Sugawara A, Morii N, et al. The pharmacokinetics of alpha-human atrial natriuretic polypeptide in healthy subjects. Eur J Clin Pharmacol , 1986, 31 (1) : 101–103. DOI:10.1007/BF00870995 |
| [24] | Vanneste Y, Pauwels S, Lambotte L, et al. In vivo metabolism of brain natriuretic peptide in the rat involves endopeptidase 24.11 and angiotensin converting enzyme. Biochem Biophys Res Commun , 1990, 173 (1) : 265–271. DOI:10.1016/S0006-291X(05)81051-4 |
| [25] | Nour N, Mayer G, Mort J S, et al. The cysteine-rich domain of the secreted proprotein convertases PC5A and PACE4 functions as a cell surface anchor and interacts with tissue inhibitors of metalloproteinases. Mol Biol Cell , 2005, 16 (11) : 5215–5226. DOI:10.1091/mbc.E05-06-0504 |
| [26] | Mains R E, Berard C A, Denault J B, et al. PACE4:a subtilisin-like endoprotease with unique properties. Biochem J , 1997, 321 (Pt 3) : 587–593. |
| [27] | Barr P J. Mammalian subtilisins:the long-sought dibasic processing endoproteases. Cell , 1991, 66 (1) : 1–3. DOI:10.1016/0092-8674(91)90129-M |
| [28] | Seidah N G, Chretien M. Proprotein and prohormone convertases:a family of subtilases generating diverse bioactive polypeptides. Brain Res , 1999, 848 (1-2) : 45–62. DOI:10.1016/S0006-8993(99)01909-5 |
 2016, Vol. 36
2016, Vol. 36




