文章信息
- 王小花, 李玉婷, 刘亚威, 桂金秋, 周晓杭, 袁晓环, 初彦辉, 刘海峰
- WANG Xiao-hua, LI Yu-ting, LIU Ya-wei, GUI Jin-qiu, ZHOU Xiao-hang, YUAN Xiao-huan, CHU Yan-hui, LIU Hai-feng
- 突变型人HGF(tvNK1)对CCl4诱导的大鼠肝纤维化的影响
- Effects of Human Truncated Variant of Hepatocyte Growth Factor (tvNK1) on Carbon Tetrachloride-induced Liver Fibrosis in Rat
- 中国生物工程杂志, 2016, 36(6): 18-23
- China Biotechnology, 2016, 36(6): 18-23
- http://dx.doi.org/10.13523/j.cb.20160603
-
文章历史
- 收稿日期: 2015-12-18
- 修回日期: 2016-01-30
2. 牡丹江医学院 黑龙江省抗纤维化重点实验室 牡丹江 157011
2. Heilongjiang Province Key Laboratory for Anti-Fibrosis Biotherapy, Mudanjiang Medical University, Mudanjiang 157011, China
肝脏受到慢性持续性损伤或反复的肝实质炎症坏死后,损伤的组织将不能通过肝细胞再生或基质金属蛋白酶(matrix metallo proteinases,MMPs)抵抗薄壁组织在损伤过程中产生过量的ECM,使其沉积下来而形成纤维化,最终将导致肝功能衰竭。因此,肝纤维化是其对持续性损伤的一种失衡应答,其实质是以I型胶原蛋白(Col1A1、Col4A1)和α-平滑肌肌动蛋白(α-SMA)为主的ECM合成与降解失衡。肝纤维化是各种慢性肝病的共同病理基础,也是各种慢性肝病向终末期肝硬化发展的必经阶段[1]。因此,如何逆转早期肝纤维化,进而控制慢性肝病的发展,成为国内外研究的热点问题。已有研究表明,肝细胞生长因子(hepatocyte growth factor,HGF)对各种因素引起的纤维化具有良好的拮抗作用[2, 3]。HGF是一种具有多种生物活性的细胞因子,在肝细胞增殖、抑制肝星状细胞活化、抑制肿瘤的生成、减少外界毒性物质引起的肝损害和治疗肝纤维化等方面具有重要作用[4, 5]。HGF作为一种干预手段已被广泛研究,但其在体内的半衰期短,需要反复应用才能维持体内血药浓度,难以满足临床上的需求,因此利用基因工程手段是获得大量具生物活性HGF的有效途径。前期我们已经将HGF的α链中的发卡结构和第一个环状结构域中的赖氨酸和精氨酸突变为谷氨酸(K132E 和 R134E)即tvNK1,并且已通过原核表达制备出大量具有活性的tvNK1,细胞实验结果表明,该tvNK1能有效抑制肝星状细胞中α-SMA和Col 1的表达[6],但其在动物模型中的功能尚未研究,因此,本研究将采用发酵制备tvNK1,并作用于四氯化碳(carbon tetrachloride,CCl4)诱导的纤维化SD大鼠模型,观察tvNK1对实验性肝纤维化大鼠的保护作用,为抗纤维化药物的开发提供切实可行的实验依据。
1 材料与方法 1.1 实验动物、材料与试剂SD大鼠,购自北京维通利华实验动物技术有限公司。带有pET28a-tvNK1重组质粒的大肠杆菌由本实验室保存。镍离子亲和层析柱(Ni2+-NTA)购自Novagen 公司。PCR中所用引物由上海生工生物工程技术有限公司合成,Trizol购自美国Invitrogen公司,SYBR Green Master检测试剂购自大连宝生物工程有限公司。抗体Col1A1、Col4A1和α-SMA和二抗购自美国Abcam公司,反转录试剂盒购自美国Roche公司,Masson染色试剂盒购自Sigma公司。蛋白标准分子量marker购自Thermo Scientific公司,其他试剂均为国产或进口分析纯。
1.2 方法 1.2.1 重组蛋白tvNK1的发酵和纯化将带有pET28a-tvNK1重组质粒的活化的大肠杆菌二级种液150 ml,无菌操作接种于3 L发酵罐中灭菌的基础培养基,同时加入终浓度为50 μg/ml卡那霉素,调整转速,待菌体密度OD600达到9.0左右,此时细菌处于对数生长期,开始加入乳糖诱导剂,加完诱导液后立即流加甘油补料液,持续诱导7 h,发酵结束。取诱导表达重组菌液,8 000 r/min离心10 min ,收集菌体,用20mmol/L Tris-HCl 重悬,冰浴超声破碎30 min至溶液变澄清,在4 ℃ 10 000 r/min 离心10 min,取上清加入Ni2+-NTA 树脂中,然后加入5倍柱体积的Washing Buffer (20 mmol/L Tris-HCl,0.5 mol/L NaCl,20 mmol/L 咪唑,pH 7.9)洗涤10 min后,用含有200 mmol/L 咪唑的Elution Buffer (20 mmol/L Tris-HCl,0.5 mol/L NaCl,pH 7.9)洗脱目的蛋白[7]。纯化后的目的蛋白用PBS透析过夜,冻干,保存于-80 ℃备用。
1.2.2 动物模型的制备和分组SD大鼠,雄性,体重350 g左右。适应性地饲养1周后,将实验大鼠随机分为 3组:对照组,模型组和处理组,每组 10 只。对照组:接受1.2 ml/kg纯橄榄油腹腔注射,每周2次,共8周。模型组:接受40 %的CCl4/橄榄油混合液按2 ml/kg腹腔注射,每周2次,连续8周。处理组:造模的同时给予腹腔注射纯化的tvNK1按1 mg/kg,每周两次,直至8周完成。实验期间所有大鼠食用标准饲料,处死前禁食24 h。平卧状态下剖腹,游离肝脏,置于冰的生理盐水中洗涤后,一部分用4 %甲醛固定,3天内石蜡包埋组织病理检测;其余肝组织迅速放入-80 ℃冰箱中保存。
1.2.3 Real-time PCR检测大鼠肝组织Col1A1、Col4A1和α-SMA mRNA的变化应用real-time PCR的方法,提取肝脏中的RNA,逆转录为cDNA,应用real-time PCR检测Col1A1、Col4A1和α-SMA mRNA的表达水平。引物序列如表 1。对于real-time PCR反应体系,遵循以下流程:cDNA 2 μl,正向和反向Primers各1 μl,SYBR Green Mix荧光染料9 μl,无菌蒸馏水7 μl。反应程序为50 ℃升温2 min;95 ℃预变性10 min;95 ℃变性 15 s;60 ℃退火1 min;扩增40个循环,以Rps16为内参,测出样品的相对表达。
| 引物名称 | 引物序列(5′~3′) |
| Col1A1-F | ACAGGCGAACAAGGTGACAGAG |
| Col1A1- R | GCCAGGAGAACCAGCAGAGC |
| Col4A1-F | ATGTCCAAGGAAACGAGCGG |
| Col4A1-R | GTTGTCCCCAGAGATAGGTG |
| α-SMA-F | CACCATCGGGAATGAACGCTTC |
| α-SMA-R | CTGTCAGCAATGCCTGGGTA |
| Rps16-F | AAGTCTTCGGACGCAAGAAA |
| Rps16- R | TTGCCCAGAAGCAGAACAG |
取适量肝组织液氮研磨,称重,加入裂解液,匀浆,离心取上清,加入2×loading buffer煮沸5 min,然后经12 %的SDS-PAGE分离,再将蛋白经恒流300 mA、1 h电转移至PVDF(Milipore)膜上。将膜取下经以PBST(含0.05% Tween 20)稀释的5 %脱脂牛奶封闭2 h,用兔抗人Col1A1、Col4A1或α-SMA单克隆抗体(1∶1 000)的PBST 中4 ℃轻摇孵育过夜。次日用PBST将膜洗涤3 次,每次10 min。用含辣根过氧化物酶标记鼠抗兔IgG 抗体(1∶5 000)的PBST 室温孵育膜1 h。再用PBST 洗涤3 次,每次10 min,用ECL 显色,并曝光观察结果[8],经Quantity One软件分析各组蛋白的灰度值。
1.2.5 肝组织病理学观察按照常规HE和Masson染色方法,对大鼠肝组织的石蜡切片进行 HE和Masson 染色,结果运用Nikon显微镜摄取图像。
1.2.6 统计学分析实验数据用均值±标准误差(X±SEM)表示,组间比较采用单因素方差分析,采用GraphPadPrism5.0统计软件进行分析,以P值 < 0.05视为有统计学意义。
2 结果 2.1 重组tvNK1 诱导表达和纯化离心收集在3 L 发酵罐中分批补料培养的含有重组pET28a-tvNK1菌体,分别取诱导前和诱导后菌液,同时超声破碎,进行SDS-PAGE电泳。结果表明,在分子量约为22.0 kDa处的位置出现单一的特异性条带,与理论值相符,表达量较高,约占菌体总蛋白的65%左右(图 1a)。由于我们构建的载体pET28a-tvNK1带有6×His-tag,所以我们用能特异性结合6×His的Ni2+-NTA 树脂对重组tvNK1蛋白进行纯化。经SDS-PAGE 分析结果表明,原核表达的重组蛋白tvNK1纯度达95%以上(图 1b)。
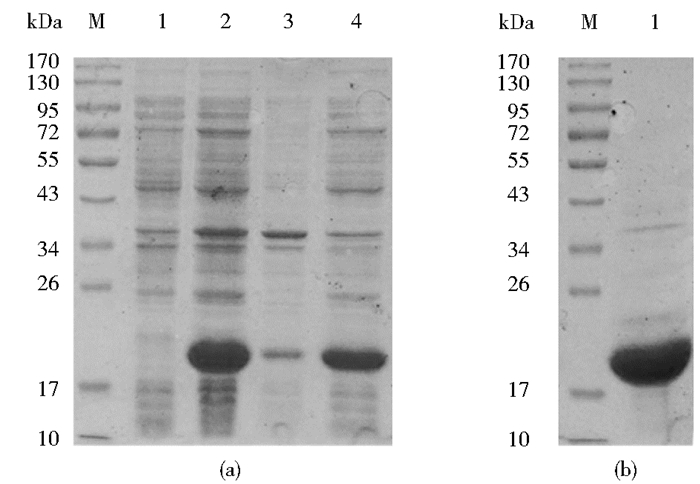
|
| 图 1 SDS-PAGE分析重组蛋白tvNK1诱导、表达和纯化 Fig. 1 SDS-PAGE analysis of the expression and purification of recombinant tvNK1 (a) M: protein marker; lane 1 the cell lysates of bacteria transformed with pET28a/tvNK1 without induction; lane 2 the cell lysates of bacteria transformed with pET28a/tvNK1 under induction; lane 3 the cell pellet of cell lysates after sonication; lane 4 the supernatant of cell lysates after sonicationlanes (b) lane 1 purified tvNK1 with 200 mmol/L imidazole by immobilized metal affinity chromatography |
为了研究tvNK1抗纤维化的功能,我们通过real time-PCR和Western blot分析tvNK1对纤维化大鼠肝脏中纤维化相关基因Col1A1、Col4A1和α-SMA在mRNA和蛋白表达的影响。Real time-PCR结果显示,与对照组(Control组)相比,模型组(CCl4组)的Col1A1、Col4A1和α-SMA mRNA的表达均显著升高 (P < 0.001; P < 0.01; P < 0.001);而与模型组相比,处理组(CCl4+tvNK1组)的Col1A1、Col4A1和α-SMA mRNA的表达均明显下降 (P < 0.01;P < 0.01和 P < 0.01) (图 2)。
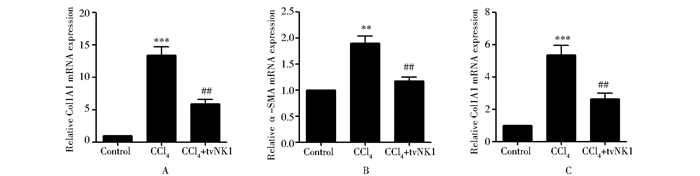
|
| 图 2 Real-time PCR分析处理组Col1A1、Col4A1和α-SMA mRNA表达 Fig. 2 The mRNA expressions of Col1A1、Col4A1and α-SMA in different treatment groups were assayed by real-time PCR *: compared to Control group; #: compared to CCl4 group |
另外,Western blot结果表明:模型组(CCl4组)中Col1A1、Col4A1和α-SMA蛋白的表达水平明显高于对照组(Control组),而处理组(CCl4+tvNK1组)中Col1A1、Col4A1和α-SMA蛋白的表达明显低于模型组(CCl4组)(图 3A)。为进一步明确蛋白表达差异,我们通过Quantity One软件对蛋白条带进行灰度扫描,结果如图 3B,C和D所示。以上结果表明,tvNK1能下调纤维化大鼠中纤维化相关基因Col1A1、Col4A1和α-SMA的mRNA和蛋白表达。
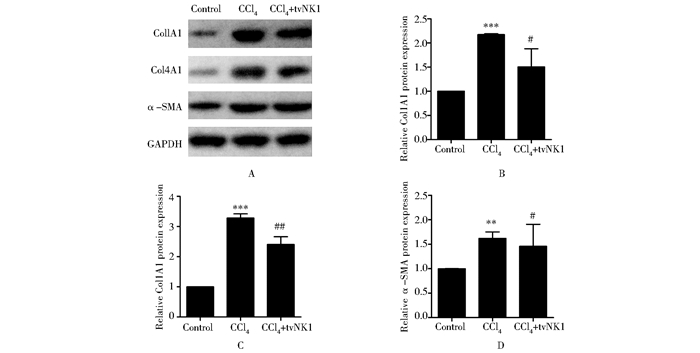
|
| 图 3 Western blot分析各处理组中Col1A1、Col4A1和α-SMA mRNA表达 Fig. 3 The protein expression of Col1A1、Col4A1和α-SMA in different treatment groups were assayed by Western blot *: compared to Control group; #: compared to CCl4 group |
为进一步研究tvNK1抗纤维化的功能,我们通过HE和Masson染色分析其对纤维化大鼠肝脏的结构和胶原纤维表达的影响。HE染色结果显示:正常组(Control组)的肝组织结构清晰,肝小叶结构正常,肝索排列整齐;模型组(CCl4组)的肝组织肝小叶结构破坏,肝索排列紊乱,有假小叶形成;处理组(CCl4+tvNK1组)中肝小叶结构和肝索排列基本恢复到正常结构(图 4)。Masson结果表明,正常组的肝组织在中央静脉和汇管区周围有少许胶原纤维存在;模型组的肝组织含有大量的胶原纤维;处理组中胶原纤维增生也明显减轻。
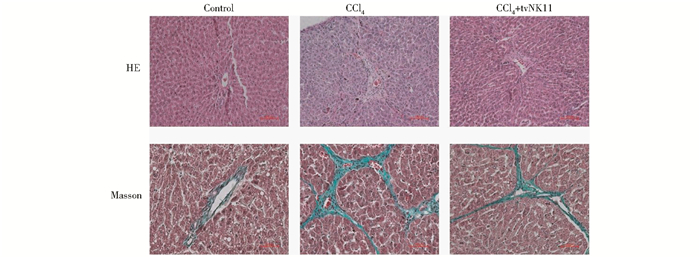
|
| 图 4 HE和Masson染色分别分析各处理组中组织形态和胶原纤维的变化 Fig. 4 The morphology and the collagen fiber of liver sections in different groups were assayed by HE and Masson staining, respectively |
肝纤维化是肝脏对慢性肝损伤的一种修复反应,也是慢性肝病进一步向肝硬化、肝癌发展的主要中间环节,其特征为肝内纤维组织异常增生,细胞外基质过度沉积和肝脏结构的改变。肝纤维化发生发展是一个复杂的多因素作用过程,众多的细胞因子和细胞共同参与,相互影响,形成网状作用体系,共同影响着肝纤维化的形成与发展[9]。近年来,众多研究证实纤维化的早期可逆性,因此,通过逆转或减缓肝纤维化的研究已成为控制肝硬化的热点。
HGF作为肝纤维化最重要的细胞生长因子之一,是肝细胞最强的丝裂原,对各种因素所致的实验性肝损伤均具有较好的保护作用。HGF可以通过促进其配体c-Met的磷酸化影响细胞信号转导,进而抑制肝星状细胞的活化和增殖,减少胶原纤维的合成[10],降解细胞外基质,促进基质金属蛋白酶的合成,同时通过保护肝细胞损伤、促进肝细胞再生等机制来预防和减缓肝纤维化的进程[11, 12],使肝功能得到有效的恢复[13, 14]。由于肝纤维化的可逆性在临床上具有重要应用价值[15],因此,我们希望在这一阶段阻断或者改善肝纤维化,从而控制肝病病程的发展。因此,迫切需要开发一种HGF药物来预防或治疗肝纤维化。
因为HGF的半衰期很短,所以必须频繁地给药。然而,大量生产具有生物活性的HGF是困难的。HGF前体为728个氨基酸残基组成的单链,经蛋白酶水解后产生具有生物活性的异二聚体[16, 17]。成熟HGF由α链和β链通过二硫键相连接。α链包含一个N端发夹样结构功能区及4个Kringle环样结构,β链含有一个丝氨酸蛋白酶样区[18]。因为它复杂的结构,很难获得具有生物活性的HGF,因而高的生产成本大大限制了其应用价值。随着DNA重组技术,大量快速制备具有生物活性的HGF或其变体成为现实。我们前期研究结果表明:将α链中的发卡结构和第一个环状结构域中的赖氨酸和精氨酸突变为谷氨酸(K132E 和 R134E)即tvNK1,并通过原核表达系统制备tvNK1,体外实验结果发现其具有抗纤维化的生物活性。为进一步明确tvNK1在动物体内抗纤维化的功能,于是我们通过发酵制备重组tvNK1,将制备的tvNK1腹腔注射于纤维化模型SD大鼠体内,观察tvNK1对CCl4所致的实验性肝纤维化的预防作用。研究表明,发现tvNK1可显著降低CCl4所致实验性肝纤维化大鼠Col1A1、Col4A1和α-SMA的mRNA和蛋白表达水平。我们通过HE和Masson染色进一步明确tvNK1对纤维化肝脏的形态学和胶原纤维的影响。结果表明:tvNK1处理组能够减缓纤维化肝脏中肝小叶和肝索的结构异变,同时降低纤维化肝脏的组织纤维增生、减少胶原纤维的含量。以上结果表明tvNK1对肝纤维化有一定的保护作用,可减轻CCl4所致大鼠肝纤维化。
综上所述,tvNK1有明显的抗肝纤维化活性,将有利于HGF更好地应用于肝纤维化的治疗,更广泛地应用于其他组织器官纤维化的治疗,可望成为控制慢性肝病的药物。
| [1] | Ghazwani M, Zhang Y, Gao X, et al. Anti-fibrotic effect of thymoquinone on hepatic stellate cells. Phytomedicine,2014,21(3):254-260. |
| [2] | Neaud V, Faouzi S, Guirouilh J, et al. Human hepatic myofibroblasts increase invasiveness of hepatocellular carcinoma cells: evidence for a role of hepatocyte growth factor. Hepatology,1997,26(6):1458-1466. |
| [3] | 晏维, 唐望先. 肝细胞生长因子与肝纤维化的研究进展. 国际消化病杂志,2007, 2(1):12-15. Yan W, Tang W X. Research progression of hepatocyte growth factor and liver fibrosis. Int J Dig Dis,2007, 2(1):12-15. |
| [4] | Patijn G A, Lieber A, Schowalter D B, et al. Hepatocyte growth factor induces hepatocyte proliferation in vivo and allows for efficient retroviral-mediated gene transfer in mice. Hepatology,1998,28(3):707-716. |
| [5] | Xue F, Takahara T, Yata Y, et al. Hepatocyte growth factor gene therapy accelerates regeneration in cirrhotic mouse livers after hepatectomy. Gut,2003,52(5):694-700. |
| [6] | Wang X, Liu H, Zhang Z, et al. High-level expression and characterization of bioactive human truncated variant of hepatocyte growth factor in Escherichia coli. World J Microbiol Biotechnol,2014,30(11):2851-2859. |
| [7] | 张西轩, 李晔, 王亚航, 等. 蜡样芽孢杆菌ColR75E 胶原酶的表达、纯化及酶学性质研究.中国生物工程杂志,2015,35(10):44-52. Zhang X X, Li Y, Wang Y H, et al. Expression, purification and enzymatic characterization of ColR75E collagenase of Bacillus cereus R75E. China Biotechnology,2015, 35(10):44-52. |
| [8] | Liu H, Wang X, Wang C, et al. Molecular cloning, in vitro expression and bioactivity of rabbit transforming growth factor-beta receptor type II (rTGF-betaRII). Vet Immunol Immunopathol,2011,140(1-2):55-62. |
| [9] | Sanchez-Valle V, Chavez-Tapia N C, Uribe M, et al. Role of oxidative stress and molecular changes in liver fibrosis: a review. Curr Med Chem,2012,19(28):4850-4860. |
| [10] | 李明月, 刘立忠, 黄尚志, 等.肝细胞生长因子抑制MRC-5成纤维细胞所致的纤维化作用.基础医学与临床,2002,22(5):422-427. Li M Y, Liu L Z, Huang S Z, et al. Hepatocyte growth factor suppress fibrogenic events in myofibroblastic MRC-5. Basic & Clinical Medicine,2002,22(5):422-427. |
| [11] | Masunaga H, Fujise N, Shiota A, et al. Preventive effects of the deleted form of hepatocyte growth factor against various liver injuries. Eur J Pharmacol,1998,342 (2-3):267-279. |
| [12] | Matsuda Y, Matsumoto K, Yamada A, et al. Preventive and therapeutic effects in rats of hepatocyte growth factor infusion on liver fibrosis/cirrhosis. Hepatology,1997,26(1):81-89. |
| [13] | Nakamura T, Sakata R, Ueno T, et al. Inhibition of transforming growth factor beta prevents progression of liver fibrosis and enhances hepatocyte regeneration in dimethylnitrosamine-treated rats. Hepatology,2000,32(2):247-255. |
| [14] | 周伟,沈薇.肝细胞生长因子对肝纤维化的保护作用及其机制研究. 重庆医学,2009, 38(4):398-402. Zhou W, Shen W. Protective effects of HGF on experimental liver fibrosis in rats and analysis of its mechanisms. Chongqing Yixue,2009,38(4):398-402. |
| [15] | 孙瑞芬,张艳芳,郭树春,等.向日葵ACC 氧化酶基因(HaACO1)的克隆及表达分析.中国生物工程杂志,2015,35(9):21-27. Sun R F, Zhang Y F, Guo S C, et al. Cloning and expression analysis of ACC oxidase gene ( HaACO1 ) from sunflower (Helianthus annuus L.). China Biotechnology,2015,35(9): 21-27. |
| [16] | Mars W M, Liu M L, Kitson R P, et al. Immediate early detection of urokinase receptor after partial hepatectomy and its implications for initiation of liver regeneration. Hepatology,1995,21(6):1695-1701. |
| [17] | Ross J, Gherardi E, Mallorqui-Fernandez N, et al. Protein engineered variants of hepatocyte growth factor/scatter factor promote proliferation of primary human hepatocytes and in rodent liver. Gastroenterology,2012,142(4):897-906. |
| [18] | Gherardi E, Sandin S, Petoukhov M V, et al. Structural basis of hepatocyte growth factor/scatter factor and MET signalling. Proc Natl Acad Sci U S A,2006,103(11):4046-4051. |
 2016, Vol. 36
2016, Vol. 36




