文章信息
- 李玲玉, 何松蔚, 郑辉
- LI Ling-yu, HE Song-wei, ZHENG Hui
- 维生素C对细胞增殖的挽救提高shDNMT1对重编程的促进作用
- The Abilities of ShDNMT1 to Promote Reprogramming are Enhanced by Vitamin C-recused Proliferation
- 中国生物工程杂志, 2016, 36(6): 1-8
- China Biotechnology, 2016, 36(6): 1-8
- http://dx.doi.org/10.13523/j.cb.20160601
-
文章历史
- 收稿日期: 2015-12-01
- 修回日期: 2016-03-11
2. 中国科学院广州生物医药与健康研究院 广州 510530
2. Guangzhou Institute of Biomedicine and Health, CAS, Guangzhou 510530, China
2006年,Takahashi等[1]报道了哺乳动物细胞重编程的成功,运用逆转录病毒为载体将4个转录因子(Oct4,Sox2,Klf4,c-Myc)转入小鼠胚胎成纤维细胞(MEFs)中,使其由分化状态重新转变为具有分化潜能的多能干细胞(iPSCs)。此后,研究人员致力于获得iPSC效率的研究。
维生素C(Vc)是自然界中常见的天然物质,最近有报道指出Vc可以加速重编程过程中基因表达谱的改变,抑制细胞衰老,促进pre-iPS向完全重编程的iPS转变,提高小鼠和人类体细胞的重编程效率[2]。Vc通过上调H3K9(Histone 3 Lysine 9)去甲基化酶家族中Kdm3/4的作用,使H3K9发生去甲基化,解除重编程过程中pre-iPSC向iPSC状态转变的路障[3]。此外,Vc也是决定重编程过程中Tet1(Ten eleven translocation 1)蛋白作用的关键物质,Tet1蛋白催化5-甲基胞嘧啶(5mC)转化为5-羟甲基胞嘧啶(5hMC)、5-醛基胞嘧啶(5fC),5-羰基胞嘧啶(5aC)促进去甲基化,是重编程的必要因素[4, 5]。
但是最近研究表明,在Vc存在的情况下,Tet1通过调节间充质-上皮细胞转换(MET)过程中关键基因在基因组上相关区域的甲基化,抑制重编程[6]。Vc还通过调控H3K36me2/3去甲基化酶Jhdm1a/1b在促进细胞增殖的基础上提高重编程效率。过表达Oct4时,Jhdm1b/vitamin C通过挽救G1期阻滞加速细胞周期[7]。但是,Vc对DNA甲基转移酶1(DNMT1)在重编程过程中作用的影响报道却很少。
获得iPSCs的过程被认为是一个表观遗传重塑的过程[8]。DNA甲基化,组蛋白乙酰化、磷酸化等表观遗传修饰的改变在体细胞重编程过程中发挥重要作用。其中DNA甲基化对重编程的影响尤其重要。例如,原本处于高甲基化状态的多能性基因如Nanog、Oct4的启动子发生去甲基化而被重新激活。机体内存在DNA甲基化修饰在细胞增殖过程中逐渐被稀释的被动去甲基化和Tet蛋白介导的主动去甲基化过程。DNMT1在DNA复制过程中以母链甲基化图式为模板催化子链以相同方式发生甲基化,从而维持DNA甲基化在细胞之间的稳定遗传[9, 10, 11]。Tet1蛋白介导的主动去甲基化在重编程过程中的作用已经阐明[4],而DNMT1表达量下调对重编程的影响尚未明确。本文通过构建针对DNMT1的和cDNA 高表达shRNA(shDNMT1)降低DNMT1的表达量来研究这一作用。
近年来对细胞周期状态与细胞命运决定关系的研究也取得了一定进展[12],完全的重编程必须要在细胞分裂到一定次数才能完成[13],在重编程的早期细胞周期明显加快[14, 15],最近报道表明只有经历细胞周期加速过程的细胞才能完成重编程[16]。Vc对iPS产生的促进作用或许部分归于其对细胞增殖速度的提高。考虑到细胞周期、DNMT1、DNA甲基化以及Vc在重编程中的相互作用,本文在确定DNMT1对iPSCs细胞的获得产生影响的基础上,研究Vc是如何通过调控细胞周期改变DNMT1对重编程的的影响。
但细胞周期的状态对iPSCs产生的影响机制尚不明确,本研究对比了pre-iPS和完全重编程的iPS细胞的细胞周期状态,并研究Vc及shDNMT1对MEF细胞和四因子诱导的重编程过程中细胞的细胞周期状态的影响,从而确定Vc、shDNMT1及细胞周期三者相互作用对iPS产生效率和pre-iPS命运转变的影响。
1 材料与方法 1.1 材料 1.1.1 细胞与培养基小鼠ES细胞系OG2-MEF,Plat-E,ICR-MEF,293T,iPSC、pre-iPSC1/2[3]为本课题组提供。ICR-MEF、OG2-MEF、Plat-E细胞使用MEF培养基,配方为:高糖DMEM(Dulbecco’s modification of Eagle’s medium)培养基(Hyclone),10%胎牛血清(EXCEL),1% 非必需氨基酸(NEAA,Gibco),1% L-谷氨酰胺(GlutaMAX,Gibco)。iPSC、pre-iPSC细胞及iPSC诱导均使用mES培养基,配方为:DMEM,15%胎牛血清(Gibco),1% NEAA,1% GlutaMAX(Gibco),0.1% β-巯基乙醇(Gibco)和小鼠白血病抑制因子mLIF (Millipore)。
1.1.2 过表达及基因敲降载体四因子过表达载体pMX-Oct4,pMX-Sox2,pMX-Klf4,pMX-cMyc及pSuper购自Addgene公司。ShDNMT1质粒的构建是将一段表达与DNMT1mRNA同源的小RNA的DNA片段连接到pSuper载体上。
1.1.3 试剂Vc购自Sigma公司,碘化丙啶(PI)购自Sigma公司。
1.2 方法 1.2.1 细胞培养ICR-MEF、OG2-MEF、Plat-E细胞使用MEF培养基,配方为:高糖DMEM(Dulbecco’s modification of Eagle’s medium)培养基(Hyclone),10%胎牛血清(EXCEL),1% 非必需氨基酸(NEAA,Gibco),1% L-谷氨酰胺(GlutaMAX,Gibco)。iPSC、pre-iPSC细胞及iPSC诱导均使用mES培养基,配方为:DMEM,15%胎牛血清(Gibco),1% NEAA,1% GlutaMAX(Gibco),0.1% β-巯基乙醇(Gibco)和小鼠白血病抑制因子mLIF (Millipore)。iPSC、pre-iPSC培养需在培养皿底部预先培养滋养层细胞。所有细胞均在含5% CO2的37℃恒温培养箱(Thermo)中培养。
1.2.2 病毒包装病毒包装使用聚乙烯亚氨(PEI,Ploysciences)转染法,逆转录病毒包装使用Plat-E包装细胞系,Plat-E细胞传代于10cm细胞专用培养皿中,接种密度约为 8×106/10cm盘,待细胞生长至覆盖皿底80%时转染,转染前1~2h换新鲜培养基。转染体系的配制:在1.5ml离心管中加入1ml Opti-MEM优化培养基(Gibco),再加入10μg质粒,混匀,室温放置5min,再加入40μl 1%PEI混匀,室温放置15min。将以上体系均匀加入Plat-E中,在恒温培养箱中培养8~12h,更换培养基,36h后用医用注射器收集培养基,经0.45μm滤膜(Millipore)过滤。向Plat-E培养皿中加入新鲜培养基,24h后再次收集。已包装好的逆转录病毒会将外源基因整合到目的细胞基因组上,并随基因组DNA复制而复制,从而稳定表达。
1.2.3 iPSC诱导分离具有Oct4-GFP的转基因小鼠胚胎成纤维细胞(OG2-MEF),通过逆转录病毒将4个转录因子Oct4、Sox2、Klf4、c-Myc导入OG2-MEF,将病毒感染后的细胞用含mLIF的mES培养基培养。具体方法如下,将收集到的病毒液加入25%的新鲜MEF培养基,并加入终浓度为8μg/ml polybrene(Sigma-Aldrich),将配好的感染体系感染OG2-MEF,24h后再次感染,48h后更换MES培养基,培养至第18~20天即出现GFP阳性克隆。需Vc诱导的用含Vc 50μg /ml的mES培养基培养至第8~12天即可出现GFP阳性克隆。Pre-iPSC感染需在细胞传代时细胞悬浮在病毒液中进行,待细胞贴壁后更换mES培养基。
1.2.4 流式细胞仪细胞周期分析不同细胞周期的细胞其DNA含量不同,G1期为1N,S期进行DNA复制DNA含量介于1N~2N之间,G2期DNA增加一倍为2N。运用经典的碘化丙啶法检测DNA含量以确定细胞所处的时期。具体方法如下,将细胞用0.25%胰酶(Gibco)消化成单细胞,DPBS缓冲液(Gibco)洗一遍,75%乙醇4℃固定过夜,离心去除乙醇,DPBS清洗,PBS+0.2% Tritonx-100室温处理5min,洗去Tritonx-100,用终浓度为0.25mg/ml的RnaseA(Tiangen)37℃处理20~30min,洗去RnaseA,用终浓度为50ng/ml的PI溶液重悬,室温孵育30min。流式细胞仪分析,用Modifit软件分析数据。
1.2.5 数据分析所有的结果均为多个独立实验的均值±标准差,重复次数N≥3。运用Student T 检验(Student’s t test)检测两组数据的均值差异,运用克鲁斯卡尔-沃利斯单向方差分析(One-way ANOVA)及邓恩的多重比较测试,分析两组以上数据的均值差异,运用费里德曼双因素方差分析(Two-way ANOVA)比较Vc及DNMT1表达量对重编程的影响。所有统计分析均使用GraphPad Prism5和SPSS 19.0软件。所有统计均为双向检测,认为P值 < 0.05具有统计学意义(* 表示P < 0.05,差别具有显著意义;** 表示P < 0.01差别具有非常显著意义;*** 表示P < 0.001差别具有极显著意义)。
2 结果 2.1 Vc进一步提高shDNMT1对重编程的促进作用为了探索DNMT1在细胞重编程过程中的功能,我们设计并构建了抑制DNMT1表达的短发夹(shRNA)质粒(shDNMT1)。以pSuper为载体构建shRNA质粒,包装病毒感染MEF,通过荧光定量PCR检测DNMT1的表达,结果发现在mRNA水平上,shDNMT1对DNMT1抑制效果较好(图 1)。
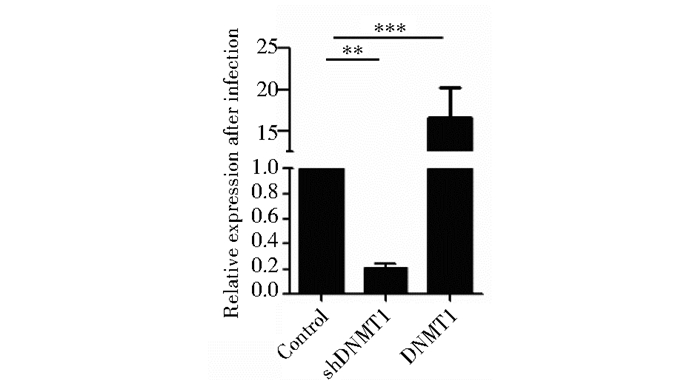
|
| 图 1 荧光定量PCR分析DNMT1表达量 Fig. 1 DNMT1 expression analysis by real time-PCR The effects of Dnmt1 and shDnmt1 on Dnmt1 expression in MEFs were examined by qPCR. The results indicated that shDNMT1 reduced DNMT1 expression to 25% of control, and DNMT1 increased DNMT1 expression to16 times |
为了研究Vc与DNMT1在MEFs向iPSCs转变过程中的相互作用,研究团队在使用和不使用Vc的重编程体系中,利用逆转录病毒体系调控DNMT1的表达,进而观察其对iPSC产生的影响。
在不使用Vc的情况下,在感染四因子的同时感染编码DNMT1或者shDNMT1的病毒,病毒感染结束后,用不含Vc的mES培养基培养。第一次感染时为第零天(D0),至D20在荧光显微镜下计数发绿色荧光的克隆。此时,与对照组相比,DNMT1过表达对iPSC的产生没有明显作用,而shDNMT1对iPSC的产生虽有一定的促进作用,但作用较弱,产生的GFP阳性克隆约为对照组的1.78倍(图 2b),DNMT1表达量的变化对诱导产生的iPSC形态无明显影响(图 2a)。
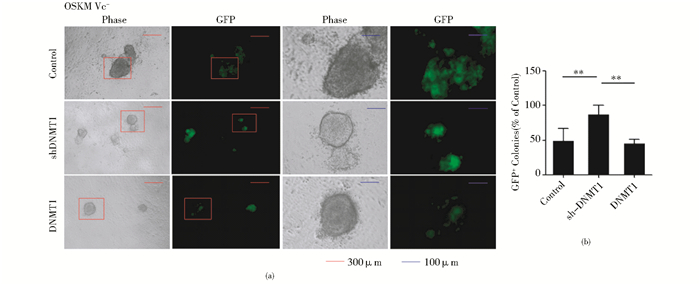
|
| 图 2 shDNMT1对iPSC产生有微弱的促进作用 Fig. 2 shDNMT1 can promote the formation of iPSC slightly (a) The morphology of GFP positive colonies has no obvious difference between DNMT1 up- and down-regulation untreated with Vc (b) Down-regulation of DNMT1 promotes iPSC generation slightly, the count of GFP positive colonies is about 1.78 times than that in the control group |
在使用Vc的情况下,OG2-MEF同时过表达4个转录因子与DNMT1或者shDNMT1,病毒感染后用含Vc(50μg/ml)的mES培养至D12计数GFP阳性的克隆,发现使用Vc时与对照组相比,DNMT1对 iPSC产生没有明显影响,shDNMT1却能明显促进iPSC的产生,其阳性克隆数约达对照组的3.47倍(图 3b),DNMT1表达量改变对iPSC形态无明显影响(图 3a)。所以,Vc可以使shDNMT1对重编程的促进作用更加显著。
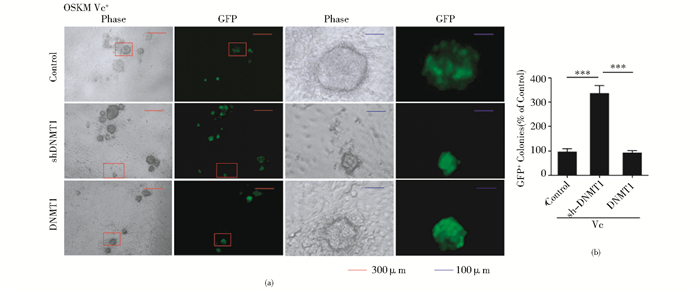
|
| 图 3 Vc进一步提高shDNMT1对重编程的促进作用 Fig. 3 Vc further improve the shDNMT1 promoting effect of reprogramming (a) The morphology of GFP positive colonies has no obvious difference between DNMT1 up- and down-regulation treated with Vc (b) Down-regulation of DNMT1 promotes iPSC generation significantly, the count of GFP positive colonies is about 3.47 times than that in the control group |
MEF向iPSC转变的过程中存在pre-iPSC的中间状态,且Vc能解除H3K9甲基化的路障使pre-iPSC转变为iPSC[3]。为了研究DNMT1对这一过程的影响及其与Vc的相互作用,本文用逆转录病毒体系过表达或敲降DNMT1,观察其对pre-iPSC向iPSC转变的作用。
不使用Vc的情况下,用悬浮感染的方法在pre-iPSC1和pre-iPSC2中用逆转录病毒感染调控DNMT1的表达,细胞贴壁后更换不含Vc的mES培养基,培养至D3,荧光显微镜下计数发绿色荧光的克隆。发现,Vc处理和DNMT1表达量的改变对pre-iPSC及iPSC的克隆形态无明显影响(图 4a,图 4b)。DNMT1对pre-iPSC向iPSC转变无明显影响,shDNMT1可以少量诱导pre-iPSC转变为iPSC(图 4a,图 4c)。使用含Vc(50μg/ml)的mES培养基培养至D3计数GFP阳性克隆,发现DNMT1无明显作用,而shDNMT1可以明显提高pre-iPSC向iPSC转变的效率,GFP阳性克隆数为对照组的2.69倍左右(图 4b,图 4c)。由pre-iPSC诱导产生的iPSC多能性基因Nanog、Sal4、Dppa2、Dppa4、Dppa5a、Utf1和Prdm14的表达显著上升(图 4d),这几个基因为pre-iPSC转化为iPSC的主要标志基因[3]。说明Vc使shDNMT1对pre-iPSC向iPSC转变的促进作用增强。
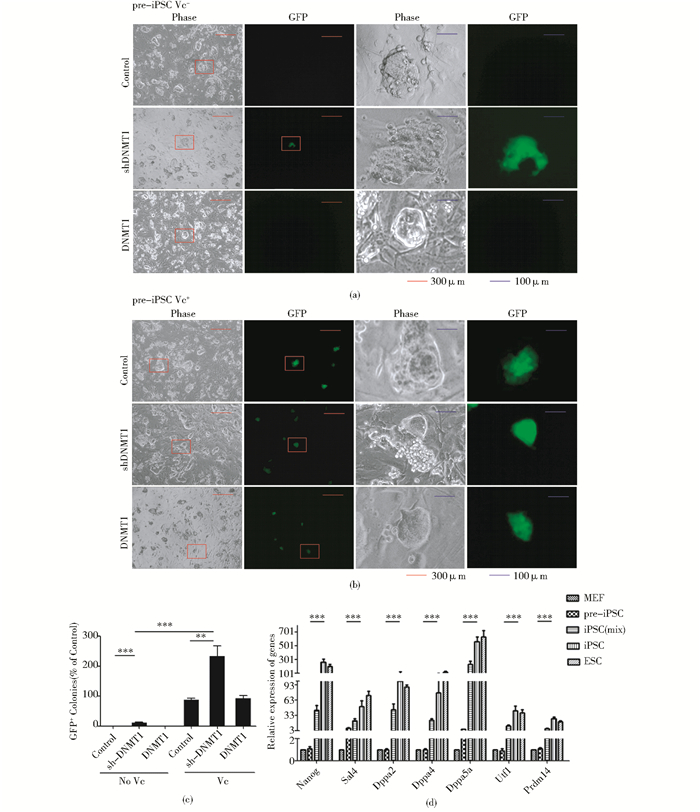
|
| 图 4 Vc增强shDNMT1促进pre-iPSC转变为iPSC的作用 Fig. 4 Vc enhance the effect of shDNMT1 to promote the transform from pre-iPSC to iPSC (a) The effect of DNMT1 expression on the morphology of pre-iPSC and iPSC is no obvious untreated with Vc (b) The effect of DNMT1 expression on the morphology of pre-iPSC and iPSC is no obvious while treated with Vc (c) DNMT1 has no obvious effect on the transform of pre-iPSC to iPSC while shDNMT1 promote the process slightly untreated with Vc. Treated with Vc, DNMT1 has no obvious effect on the transform of pre-iPSC to iPSC while shDNMT1 promote the process significantly, the count of GFP positive colonies is about 2.69 times than that in the control group (d) The expression of pluripotency genes in iPSC are higher than that in pre-iPSC |
细胞周期及各时期分布状态对重编程过程有重要影响,为了研究pre-iPSC与完全重编程的iPSC在增殖速度和细胞周期各时期分布状态的差异,我们用流式细胞技术对两者的细胞周期进行了分析。
以小鼠胚胎干细胞R1为对照,在细胞的指数增长期,消化计数,计算其倍增时间,同时将细胞用70%乙醇固定,用流式细胞仪分析细胞周期各时期所占的比例。发现两株pre-iPSCs与R1和iPSC的细胞周期长度相似,倍增时间均为13~15h,但G1期的时长和占整个细胞周期的比例明显较大(图 5a,图 5b),R1与iPSC G1期约占整个周期的比例的17%,而pre-iPSCs 中,G1期占整个细胞周期的比例明显较大,其中pre-iPSC1约为35%,pre-iPSC2约为31%(图 5a,图 5b)。因此,pre-iPSC与iPSC细胞周期状态分布有明显差异,前者G1期较长。
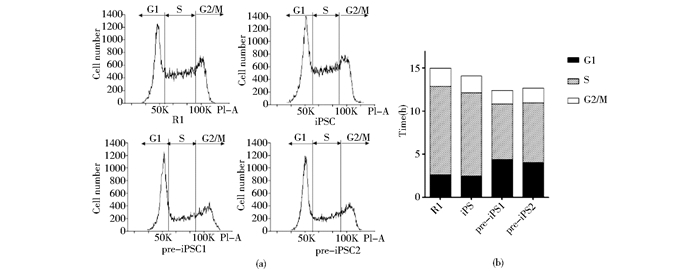
|
| 图 5 pre-iPSC与iPSC增殖速度相近,但G1期所占比例较大 Fig. 5 The pre-iPSC and iPSC have the similar proliferation rate, but the former has a large proportion of G1 phase (a) The pre-iPSCs have greater proportion of G1 phase than R1 and iPSC (b) The proportion of G1 phase of the cell cycle is about 17% for R1 and iPSC, while the proportion are 35% and 31% for pre-iPSC1 and pre-iPSC2 respectively |
我们运用逆转录病毒感染体系调节DNMT1在MEF中的表达,观察其对细胞周期的调控作用。用shDNMT1、DNMT1病毒感染MEF细胞,第三天消化计数计算MEF细胞的倍增时间,并用乙醇固定过夜,流式细胞仪分析。比较DNMT1、shDNMT1对照组细胞周期长度和各时期分布状态,发现DNMT1加速细胞周期倍增时间由56h缩短为47h,shDNMT1抑制细胞周期,倍增时间为62h。shDNMT1使G1期所占比例由48.3%上升至56.7%。因此,shDNMT1抑制细胞周期并使G1期占细胞周期的比例增大(图 6a,图 6b)。
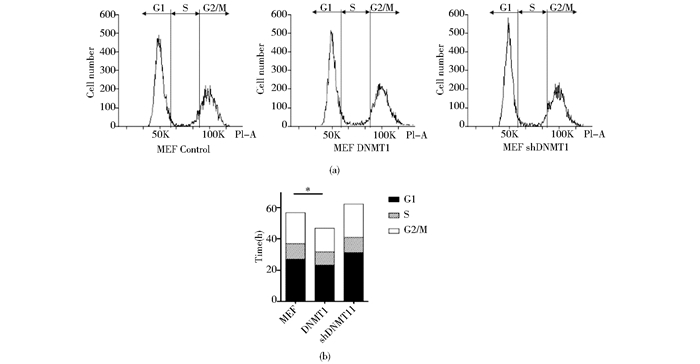
|
| 图 6 shDNMT1抑制MEF细胞增殖,增大G1期所占的比例 Fig. 6 shDNMT1 inhibits the proliferation of MEF and increases the G1 phase proportion (a) Down-regulation of DNMT1 increase the G1 phase proportion from 48.3% to 56.7% (b) shDNMT1 prolongs the cell cycle length from 56 h to 62 h |
由以上结果可知,pre-iPSC转变为iPSC需要经历细胞周期加快,G1期缩短的过程。shDNMT1抑制细胞增殖,延长G1期,不利于pre-iPSC向iPSC转变。但是Vc可以进一步使shDNMT1对促进iPSC获得及pre-iPSC向iPSC转变。为了研究Vc在这一过程中对细胞周期的调控作用,对照组用不含Vc的MEF培养基,实验组用含Vc的MEF培养基培养ICR-MEF,观察细胞周期的变化。其中对照组细胞倍增时间为59.6h,G1期占细胞周期的比例约为45%;实验组细胞倍增时间为42h,G1期所占比例约为37%(图 7a,图 7b)。所以Vc能够促进细胞增殖,并缩短G1期。
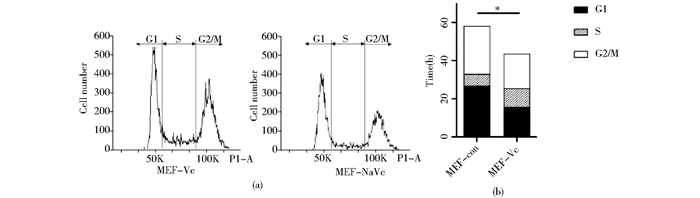
|
| 图 7 Vc加快细胞周期,使G1期比例降低 Fig. 7 Vc accelerates the prolifereation of MEF cells, decreases the proportion of G1 phase (a) G1 phase proportion of MEF cells treated with Vc decreased to 37% from 45% (b) The length of cell cycle of MEF cells is shortened to 42 h from 59.6h |
在前人研究的基础上,我们知道iPSC的产生需要经历细胞增殖加快的过程,所以本文从细胞增殖及细胞周期状态分布的角度研究Vc、shDNMT1的相互作用及其对重编程效率的影响。发现DNMT1表达量下调在一定程度上促进iPSC产生及pre-iPSC向iPSC转变,可能是由于shDNMT1使细胞甲基化水平降低造成的。但shDNMT1的促进作用较弱,所以shDNMT1可能对细胞周期有抑制作用,在一定程度上降低了对重编程的促进。pre-iPSC与iPSC细胞增殖速度相似,但G1期较长。shDNMT1使ICR-MEF细胞周期变长,G1期延长,不利于pre-iPSC转变为iPSC,但是加入Vc可以进一步增强shDNMT1对该转变过程的促进作用。所以,我们研究了Vc对细胞周期的影响,发现Vc可以使细胞增殖变快,G1期缩短,进而挽救shDNMT1对细胞增殖的抑制和G1期的延长作用,使shDNMT1进一步促进重编程。
Vc是人体必需的一种生命元素,研究表明Vc具有消除机体产生的自由基,抗氧化,延缓衰老的作用。近年来有报道称Vc可以提高诱导多能干细胞效率,使Vc在再生医学领域有了更大的潜能。而目前报道中对Vc促进Tet介导的主动去甲基化这一机制已阐述明确,对Vc的传统功能如抗氧化、促进细胞增殖等对重编程的影响机制研究却较少。本文研究发现Vc对细胞增殖有明显的促进作用,甚至可以挽救shDNMT1对细胞增殖的抑制作用从而促进重编程。但Vc与shDNMT1相互作用通过调控细胞周期促进重编程及pre-iPSC向iPSC转变的具体机制尚待进一步研究。
| [1] | Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 2006,126(4):663-676. |
| [2] | Esteban M A, Tao Wang, Baoming Qin, et al. Vitamin C enhances the generation of mouse and human induced pluripotent stem cells. Cell Stem Cell,2010, 6:71-79. |
| [3] | Chen J, He Liu, Jing Liu, et al. H3K9 methylation is a barrier during somatic cell reprogramming into iPSCs. Nat Genet,2013,45:34-42. |
| [4] | Hu X, Lei Zhang, Mao S Q, et al. Tet and TDG mediate DNA demethylation essential for mesenchymal-to-epithelial transition kin somatic cell reprogramming.Cell Stem Cell,14(4): 512-522. |
| [5] | Shinsuke Ito, Li Shen, Qing Dai, et al. Tet proteins can convert 5-methylcytosine to 5-formylcytosine and 5-carboxylcytosine.Science,2011, 333:1300-1303. |
| [6] | Chen J, Lin Guo, Lei Zhang, et al. Vitamin C modulates TET1 function during somatic cell reprogramming. Nat Genet,2013,45:1504-1510. |
| [7] | Wang T, Chen K, Xeng X M,et al. The histone demethylases Jhdm1a/1b enhance somatic cell reprogramming in a vitamin-C-dependent manner. Cell Stem Cell,2011,9:575-587. |
| [8] | Yamanaka S, Blau H M. Nuclear reprogramming to a pluripotent state by three approaches. Nature, 2010,465(7299):704-712. |
| [9] | Li E, Bestor T H, Jaenisch R. Targeted mutation of the DNA methyltransferase gene results in embryonic lethality. Cell,1992, 6(69):915-926. |
| [10] | Leonhardt H, Page A W, Weier H U, et al. A targeting sequence directs DNA methyltransferase to sites of DNA replication in mammalian nuclei. Cell,1992, 71:865-873. |
| [11] | Voo S, Skalnik D G. Identification and characterization of the DNA binding domain of CpG-binding protein. J Biol Chem,2011,276:44669-44676. |
| [12] | Pauklin1 S, Vallie L.The cell-cycle state of stem cells determines cell fate propensity. Cell,2013, 155: 135-147. |
| [13] | Asako Sakaue-Sawano, Miyawaki A. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression.cell,2007,12(033):487-498. |
| [14] | Hanna J,Krishanu S, Bernardo Pando,et al. Direct cell reprogramming is a stochastic process amenable to aceleration.Nature, 2009,462(7273):595-601. |
| [15] | Ruiz S, Athanasia D. A high proliferation rate is required for cell reprogramming and maintenance of human embryonic stem cell identity.Current Biology,2011,21(1):45-52. |
| [16] | Edel M J, Izpisua J C.The cell cycle and pluripotency: Is there a direct link? Cell Cycle,2010,9(14):1694-2695. |
 2016, Vol. 36
2016, Vol. 36




