文章信息
- 刘怡萱, 边珍, 马红梅.
- LIU Yi-xuan, BIAN Zhen, MA Hong-mei.
- 癌症基因治疗技术进展与展望
- Progress and Prospect of Cancer Gene Therapy
- 中国生物工程杂志, 2016, 36(5): 106-111
- China Biotechnology, 2016, 36(5): 106-111
- http://dx.doi.org/DOI:10.13523/j.cb.20160515
-
文章历史
- 收稿日期: 2015-12-21
- 修回日期: 2016-01-25
2. 复旦大学生命科学学院 上海 200433
2. School of Life Science,Fudan University,Shanghai 200433,China
癌症严重危害人类健康,据美国癌症协会(American Cancer Society,ACS)估计,2015年美国新发癌症病例约168.5万,死亡病例58.9万[1]。据著名医学期刊《柳叶刀》(The Lancet)报道,至2030年癌症新发病例将达到200万人,其中胰腺癌5年生存率只有4%,随之而来的是抗癌药物支出每年增长15%[2]。随着发病率和死亡率的不断上升,癌症已在全世界范围内成为导致死亡的首要原因。目前,以手术、化学疗法(化疗)及放射疗法(放疗)为代表的各种常规的癌症治疗手段已步入一个平台期,难以取得更令人满意的疗效。此外,以直接杀伤为机制的传统放疗、化疗手段所引发的毒副作用,如消化道反应、脱发及骨髓抑制等,也严重限制着其在临床上的广泛应用。而20世纪60年代发展起来的肿瘤免疫治疗虽然是一种有效的无创治疗方法,由于精确性及持久性还有待进一步提升[3],治疗效果亦不理想。传统的基因治疗通常采用增强宿主抗癌免疫、拮抗癌基因、表达自杀基因或基因修饰配合大剂量化疗的方法,在取得一定疗效的同时,也存在着基因载体的导入效率低、精确性较差及外源基因在体内表达的可控性差等缺点[4]。随着基因组学及基因工程研究的不断深入,近期靶向基因-病毒治疗、RNAi技术、microRNA,以及利用CRISPR系统筛选癌症药物靶向目标等新技术也为癌症的精确治疗提供了新的依据,本文将对这几种新的癌症基因治疗方法做详细探讨。
1 癌症的分子基础正常处于发育期或成熟期的细胞,通过自我调控机制确保细胞分裂、分化和死亡过程的正确协调进行,而癌症发生的过程与细胞增殖失控或不适当存活有关,当正常细胞的遗传物质受到损伤后,会影响细胞分裂速率,使细胞分裂加快,进入癌变的过程。癌变后的细胞还可以局部侵入周遭的正常组织,或经循环系统、淋巴系统转移到身体的其他部分。从分子水平来说,肿瘤病变是一个复杂的过程,涉及多种因素,包括多种基因的非正常表达而导致的功能异常,并且这些基因通过网络调控的方式相互作用。在该网络调控过程中,一些决定细胞生长、分裂和增殖的信号通路被不恰当上调,而与细胞凋亡等相关的信号通路则受到阻滞,最终导致了癌症的发生和发展 [5]。随着对于癌症的研究越来越深入,各种原癌基因或抑癌基因被陆续发现,这些基因通常和细胞信号传递异常密切相关,它们与癌症诱发因素的相互作用被证实是决定癌症形成的分子基础[6]。此外,一些DNA调控因子及蛋白质也在癌症形成中起着重要作用。
2 基因治疗的原理与传统的治疗方法相比,基因治疗的原理是针对不同癌症发生的分子生物学特点,利用基因转移技术,把特异性的外源目的基因片段导入肿瘤细胞中并使其表达,以纠正或补偿缺陷的基因,从而起到对肿瘤细胞的抑制和杀伤作用,达到治疗癌症的目的[7]。在基因治疗中,目的基因的表达是治疗的关键之一,为达到预期疗效,导入的目的基因必须能够在细胞中进行稳定、高效的表达。为避免基因治疗的风险,在进入临床研究阶段以前,还必须保证转移-表达系统的安全性,即目的基因在宿主细胞内表达后,不能危害细胞和宿主自身,不能激活原癌基因或引起抑癌基因的失活等。
3 新型癌症基因治疗方法 3.1 靶向基因-病毒治疗策略2001年我国刘新垣院士提出了靶向基因-病毒治疗(cancer targeting gene-viro-therapy,CTGVT)策略,在溶瘤病毒(oncolytic virus,OV)的载体中插入抗癌基因[8],结合基因治疗与病毒治疗各自的优势,一方面要求病毒载体本身能特异性地在肿瘤细胞中复制,靶向地杀死肿瘤细胞;另一方面它所携带的外源基因的表达量可以随载体病毒的复制和增殖而大大提高,可克服传统癌症基因治疗中转染效率低、靶向性差、抗癌基因表达量低、杀伤力不够等缺点。加拿大生物治疗公司Jennerex研究团队在重组牛痘病毒(OncoPax)基础上开发出的JX-594通过激活表皮生长因子受体(EGFR)/ras及有丝分裂原活性蛋白激酶(MAPK)通路杀死肿瘤细胞,同时通过抑制肿瘤细胞表面的酪氨酸激酶功能区受体(KDR)刺激肿瘤血管闭合,促进肿瘤细胞溶解[9]。目前,JX-594对肝癌治疗己通过Ⅱ期临床验证阶段,正式进入Ⅲ期扩大临床验证。中国科学院上海生命科学研究院生物化学与细胞生物学研究所刘新垣院士领导的研究小组,在靶向基因-病毒治疗方法的基础上,开发出“靶向双基因-双病毒”的治疗方法[10],利用癌症特异性启动子调控其特异性抑制基因的联合作用,使病毒载体只能在肿瘤细胞中复制,不会或很少伤害其它正常细胞,在动物肿瘤模型实验中达到了彻底清除移植性肿瘤的抗癌效果。
靶向基因治疗以过度表达的肿瘤特异性基因为靶点,抑制肿瘤细胞的增殖和转移,因此具有良好的特异性,对正常细胞损伤较小。然而目的基因的表达效率及载体病毒的质量控制及安全性评价仍是癌症靶向治疗的瓶颈,有待在未来的研究中进一步突破。
3.2 RNAi在肿瘤治疗中的应用RNA干扰(RNA interference,RNAi)是一种双链RNA(dsRNA)分子在mRNA水平关闭相应基因的表达或使其沉默的过程,是一种序列特异性的转录后基因沉默(post-transcriptional gene silencing,PTGS)的过程。目前RNAi技术越来越多地应用到癌症相关的研究领域。RNAi的作用机制大致可以分为起始阶段、效应阶段及扩增阶段[11],外源或内源的dsRNA在Dicer等RNaseIII的作用下被均匀剪切成21~25nt大小的siRNA(small interfering RNA)后,在ATP的参与下被RNA解旋酶解旋成单链,其中的反义链进入RNA介导的沉默复合体(RNA-induced silencing complex,RISC),活化后与mRNA靶向结合,对mRNA进行切割,从而干扰基因的表达,而siRNA在与mRNA结合后,还可以作为引物,以靶mRNA为模板,在RNA依赖的RNA聚合酶作用下合成新的dsRNA进入新一轮RNAi的起始阶段。
在肿瘤治疗方面,RNAi技术可以对非正常上调的癌症相关基因进行特异性表达抑制,使其处于沉默或休眠状态,进而达到抑制肿瘤细胞生长的目的[12]。目前RNAi在癌症的基因治疗研究中,主要涉及肿瘤信号转导通路、癌细胞侵袭、浸润和转移、血管形成、细胞凋亡及肿瘤细胞耐药性等方面。有研究显示,在胰腺癌BxPC-3和PANC-1细胞中,当利用RNAi技术下调转录因子NF-kappa B的表达水平,可以引起Bax蛋白表达上调,而Bcl-2和procaspase-3蛋白表达下调,伴随着细胞凋亡率的增加[13]。血管内皮生长因子(VEGF)特异性siRNA能够抑制VEGF的表达水平,阻断肿瘤血管生成[14-15]。Calando公司用于治疗实体肿瘤的CALAA01是一种包被在纳米颗粒中的siRNA产品,该siRNA可以靶向作用于肿瘤细胞的核糖核苷酸还原酶M2亚基,通过下调其表达水平抑制肿瘤的生长[16],其作为首个用于癌症的基因治疗药物于2008年获批进入I期临床研究阶段。Alaylam公司研制的包裹在脂质体中作用于纺锤体驱动蛋白(KSP)及VEGF的特异性siRNA (ALN-VSP02),具有阻滞细胞周期的作用,并能抑制肿瘤血管生成,已完成治疗肝癌的I期临床试验①(①Alnylam Pharmaceuticals. Does Escalation trial to evaluate the safety,tolerability,pharmacokinetics and pharmacodynamics of intravenous ALN-VSPO2 in patients with advanced solid tumaors with liver involvement. In Patients With Advanced Solid Tumors With Liver Involvement.[2015-12-12].First Received on April 15,2009. https://www.clinicaltrials.gov/ct2/show/NCT00882180?term=NCT00882180&rank=1.。)
虽然目前siRNA用于基因治疗仍存在药物投递方式、脱靶效应、干扰素效应及药物安全性等问题[12],限制了RNAi技术在临床治疗中的应用,但是RNAi技术可以针对特异性基因起作用,其快速、简便、高效的特点仍受到科学家们的极大关注,成为基因治疗极具发展潜力的工具。
3.3 从分子标记到基因治疗的miRNA微小RNA(miRNA)是真核生物及某些大型病毒中长度为20~24个核苷酸的一类内源性的具有调控功能的非编码单链小分子RNA。最新研究表明,人类可能存在超过1 000种miRNA,约占人类基因组的1%。miRNA可以通过抑制靶mRNA转录、翻译或剪切靶mRNA并促进其降解,在转录后水平上参与分化、细胞增殖和凋亡、器官形成及癌症发生等生理活动,表现出广泛的生物学功能[17]。miRNA通常在细胞核内由RNA聚合酶II转录,转录产物为具有茎环结构的miRNA前体(pri-miRNA)。pri-miRNA的茎环在RNase III酶Drosha和辅助因子DGCR8的共同作用下被特异性切除,形成由70个核苷酸组成的pre-miRNA,在RAN-GTP和exportin 5的作用下由细胞核被运送到细胞质中。随后在另一个核酸酶Dicer的作用下,pre-miRNA再被剪切成具有22个核苷酸的双链miRNA∶miRNA*,其中一条单链miRNA进入RNA介导的沉默复合体(RISC),在Ago蛋白的介导下与靶mRNA的3′端非翻译区(3′-UTR)互补结合,抑制mRNA翻译的延伸或中止,或降解核糖体新生成的肽链[17-18](图 1)。
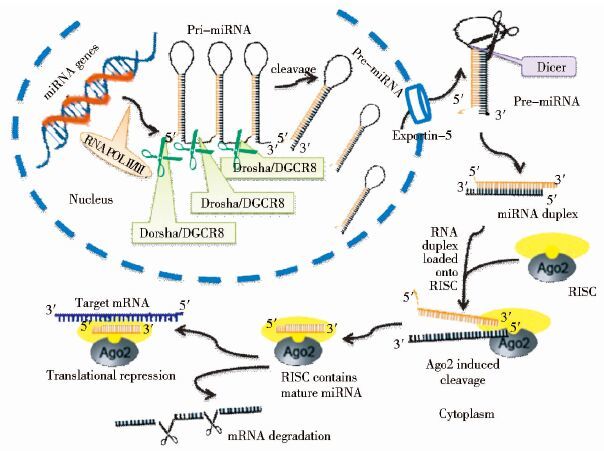
|
| 图 1 miRNA的合成及作用机制 Figure 1 The synthesis and mechanism of miRNA |
miRNA的异常表达及生物合成紊乱是许多癌细胞的重要特征,现有研究证明,miRNA可以与原癌基因相互作用发挥致癌或抑癌功能(表 1)。例如,miR-15a和miR-16-1的缺失或下调可以导致抗凋亡基因bcl2表达的升高,引起白血病和淋巴瘤的发生[20];miR-143可以抑制结肠癌相关转移基因1(MACC1)的转录和翻译,抑制结直肠癌细胞的生长和侵袭能力[21]。另外,miRNA也是一些抑癌基因的潜在作用靶点,表现出原癌基因的功能。例如,肿瘤抑制基因STARD13(DLC2)可以通过选择性激活Rho4和CDC42来抑制肿瘤细胞的生长,miR-125b可以增强乳腺癌细胞的侵袭和转移能力[22]。目前,已有约186种miRNA基因被定位于肿瘤相关的染色体重排区[17],另外,还在一些癌症特有染色体脆性位点中观察到特殊miRNA表达水平的改变[23],引起正常细胞向肿瘤细胞的转化。因此,miRNA的异常表达和调控机制不仅可以作为癌症检测的分子标记[24],简化患者分层和治疗方案选择的步骤,并且可以为新型的癌症治疗方法提供理论基础。有报道显示,已有210个miRNA药物处于不同的研发阶段。其中,Mirna Therapeutics公司用于治疗血液癌症及肝癌的MYC表达抑制剂——脂质体miRNA(MRX-34)①(①Mima Therapeutics. A multicenter Phase I study of MRX34,MicroRNA miR-RX34 liposomal injection. [2015-12-12]. https://www.clinicaltrials.gov/ct2/show/results/NCT01829971.)以及EnGeneIC公司治疗胸科癌症的TargomiRs[25]均已进入I期临床阶段,并取得了良好的疗效。
miRNA介导的癌症基因治疗尽管取得了一些进展,但其与癌症之间的分子作用机制仍没有完全清楚,因此保证miRNA对靶基因的特异性,避免发生意外的基因改造,以及通过寻找更多的靶基因位点,增加靶基因数目,以提高治疗效率仍是未来研究中需要解决的问题。
3.4 利用CRISPR/Cas9技术筛选癌症药物靶向目标CRISPR(cluster regularly interspaced short palindromic repeat)系统是细菌在噬菌体长期选择压力下进化出来的一种抵御外源DNA入侵的有效的获得性免疫机制。CRISPR簇是一个广泛存在于细菌基因组中的DNA重复序列家族,由一个前导区(leader)、多个正向重复序列区(repeats)和多个间隔区(spacer)组成,在间隔区内含有俘获的外源DNA,通过类似免疫记忆的机制,对含有相同序列的外源DNA进行识别和剪切[26],起到保护细菌自身安全的目的。Cas基因(CRISPR-associated gene,Cas gene)是位于CRISPR簇附近并与之共同发生作用的多态性基因家族,编码的蛋白质含有核酸酶、解旋酶、聚合酶等活性[27]。CRISPR与Cas基因共同构成一个高度保守的系统,其中CRISPR/Cas9系统由单链的指导基因(single guide RNA,sgRNA)和具有核酸内切核酸酶活性的Cas9蛋白构成,通过sgRNA上携带的靶序列识别特定的DNA序列,可以对基因突变位点进行修复或实现重要基因的功能缺失[28]。目前,CRISPR/Cas9系统风靡全球,在癌症研究与治疗方面的应用更是开展的如火如荼。有研究表明,应用可以被doxycycline诱导表达的CRISPR/Cas9系统对MCL-1基因进行体外敲除,淋巴瘤细胞出现了明显的死亡,体内实验也证实CRISPR/Cas9系统在小鼠肿瘤模型中永久性矫正致病突变,成功缓解疾病症状[29]。
CRISPR/Cas9技术可以快速、简单地实现对基因组的精确编辑,在此基础上,Broad研究所张锋领导的研究小组发现了一种Cpf1蛋白,与Cas9相比更容易进入组织和细胞,并且具有目标位置选择灵活、剪切位置远离识别位点、剪切后形成黏性末端等优势[30]。虽然目前用CRISPR/Cas9靶标癌症基因进行临床治疗还为时过早,但这类基因疗法的前景还是非常激动人心的。研究者们可以在这样的平台上快速找到基因型特异性弱点和协同致死的互作。另外,用这种个性化平台模拟患者接受的治疗,还可以快速揭示抗性机制,帮助人们找到有效的应对措施。
4 前景与展望癌症基因治疗的两大关键因素是基因的特异靶向性和安全性,尽管不断有基因治疗药物及技术进入临床阶段研究,由于对癌症分子机制的研究仍有不清楚的地方,并且新的研究成果不断出现,现有基因治疗的各种方法在转染效率、表达稳定性、靶向性及远期安全性等方面仍有待进一步深入研究。随着大数据时代的到来以及精准医疗概念的提出,基因治疗作为一种新的癌症治疗手段,必将为以患者个体基因组为信息基础,结合患者的蛋白质组、代谢组等内环境信息,为不同患者量身定制的个性化最佳治疗方案提供新的思路和新的方法,在人类与癌症的战斗中发挥重要的作用。
| [1] | Siegel R L, Miller K D, Jemal A. Cancer statistics 2015. CA Cancer J Clic,2015, 65 (1) : 5 –29. |
| [2] | Coleman M P. Cancer survival: global surveillance will stimulate health policy and improve equity. Lancet,2014, 383 (9916) : 564 –573. |
| [3] | Emens L A. Chemoimmunotherapy. Cancer J,2010, 16 (4) : 295 –303. |
| [4] | Rosenberg S A. The development of new cancer therapies based on the molecular identification of cancer regression antigens. Sci Am,1995, 1 (2) : 90 –100. |
| [5] | Bishop J M. Molecular themes in oncogenesis. Cell,1991, 64 (2) : 235 –248. |
| [6] | Sen B, Mahadevan B, DeMarini D M. Transcriptional responses to complex mixtures-A review. Mutat Res-Rev Mutat,2007, 636 (1) : 144 –177. |
| [7] | O'Connor T P, Crystal R G. Genetic medicines: treatment strategies for hereditary disorders. Nat Rev Genet,2006, 7 (4) : 261 –276. |
| [8] | Zhang Z L, Zou W G, Luo C X, et al. An aimed oncolytic adenovirus system, ZD55-gene, demonstrating potent antitumoral efficacy. Cell Res,2003, 13 (6) : 481 –489. |
| [9] | Heo J, Reid T, Ruo L, et al. Randomized dose-finding clinical trial of oncolytic immunotherapeutic vaccinia JX-594 in liver cancer. Nat Med,2013, 19 (3) : 329 –336. |
| [10] | Liu X Y. Cancer targeting gene-viro-therapy: An evolving anti-cancer strategy. Chin J Cnacer Biother,2015, 22 (2) : 159 –165. |
| [11] | 吴元明, 陈苏民. RNA干涉的最新研究进展. 中国生物化学与分子生物学报,2003, 19 (4) : 411 –417. Wu Y M, Chen S M. Recent advances in RNA interference. Chin J Biochem,2003, 19 (4) : 411 –417. |
| [12] | Masiero M, Nardo G, Indraccolo S, et al. RNA interference: Implications for cancer treatment. Mol Aspects Med,2007, 28 (1) : 143 –166. |
| [13] | Kong R, Sun B, Wang S J, et al. An experiment 1 study of gemcitabine inducing pancreatic cancer cell apoptosis potentiated by nuclear factor-kappa B P65 siRNA. Chin J Surg,2010, 48 (2) : 128 –133. |
| [14] | Tang X, Zhang Q, Nishitani J, et al. Overexpression of human papilloma virus type 16 on coproteins enhance shypwda-inducible factor 1 alpha protein accumulation and vascular ren dothelial growth factor expression in human cervical. Clin Cancer Res,2007, 13 (9) : 2568 –2576. |
| [15] | Zhang G X, Hou X L, Li B L, et al. Vascular endothelial growth factor receptor targeted RNA interference inhibits growth of human lung adenocarcinoma cells. Acad J Sec Mil Med Univ,2008, 29 (10) : 1153 –1156. |
| [16] | Castanotto D, Rossi J J. The promises and pitfalls of RNA interference-based therapeutics. Nature,2009, 457 (7228) : 426 –433. |
| [17] | Zhang L, Huang J, Yang N, et al. MicroRNAs exhibit high frequency genomic alterations in human cancer. Proc Natl Acad Sci USA,2006, 103 (24) : 9136 –9141. |
| [18] | Chan S P, Slack F J. MicroRNA-mediated silencing inside P-bodies. RNA Biol,2006, 3 (3) : 97 –100. |
| [19] | 王椋, 赵春华. miRNA与癌症发生. 癌症进展,2011, 9 (2) : 124 –127. Wang L, Zhao C H. miRNA and carcinogenesis. Oncol Prog,2011, 9 (2) : 124 –127. |
| [20] | Cimmino A, Calin G A, Fabbri M, et al. miR-15 and miR-16 induce apoptosis by targeting bcl-2. Proc Natl Acad Sci USA,2005, 102 (39) : 13944 –13949. |
| [21] | Zhang Y, Wang Z, Chen M, et al. MicroRNA-143 targets MACC1 to inhibit cell invasion and migration in colorectal cancer. Mol Cancer,2012, 11 (1) : 23 –32. |
| [22] | Tang F, Zhang R, He Y, et al. MicroRNA-125b induces metastasis by targeting STARD13 in MCF-7 and MDA-MB-231 breast cancer cells. PLoS One,2012, 7 (5) : e35435 . |
| [23] | Calin G A, Sevignani C, Dumitru C D, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers. Proc Natl Acad Sci USA,2004, 101 (29) : 2999 –3004. |
| [24] | Volinia S, Calin G A, Liu C G, et al. A microRNA expression signature of human solid tumors de fines cancer gene targets. Proc Natl Acad Sci USA,2006, 103 (7) : 2257 –2261. |
| [25] | Kao S C, Fulham M, Wong K, et al. A significant metabolic and radiological response after a novel targeted microRNA-based treatment approach in malignant pleural mesothelioma. Am J Respir Crit Care Med,2015, 191 (12) : 1467 –1469. |
| [26] | Barrangou R, Fremaux C, Deveau H, et al. CRISPR provides acquired resistance against viruses in prokaryotes. Science,2007, 315 (5819) : 1709 –1712. |
| [27] | Markarova K S, Haft D H, Barrangou R, et al. Evolution and classification of the CRISPR-Cas systems. Nat Rev Microbiol,2011, 9 (6) : 467 –477. |
| [28] | Barrangou R. RNA-mediated programmable DNA cleavage. Nature Biotechnology,2012, 30 (9) : 836 –838. |
| [29] | Aubrey B J, Kelly G L, Kueh A J, et al. An inducible lentiviral guide RNA platform enables the identification of tumor-essential genes and tumor-promoting mutations in vivo. Cell Rep,2015, 10 (8) : 1422 –1432. |
| [30] | Zetsche B, Gootenberg J S, Abudayyeh O O, et al. Cpf1 is a single RNA-guided endonuclease of class 2 CRISPR-Cas system. Cell,2015, 163 (3) : 759 –771. |
 2016, Vol. 36
2016, Vol. 36




