文章信息
- 李帅, 单洪瑜, 董晓雨, 郭长虹, 郭东林
- LI Shuai, SHAN Hong-yu, DONG Xiao-yu, GUO Chang-hong, GUO Dong-lin
- 磷酸肌醇磷脂酶C在DREB2表达调控中的作用
- The Role of Phosphoinositide Phospholipase C in Expression Regulation of DREB2
- 中国生物工程杂志, 2016, 36(4): 110-115
- China Biotechnology, 2016, 36(4): 110-115
- http://dx.doi.org/10.13523/j.cb.20160416
-
文章历史
- 收稿日期: 2015-12-24
- 修回日期: 2016-01-12
非生物胁迫如低温、干旱、盐碱等对植物的生长发育有不利的影响。植物中有许多基因与抗非生物胁迫相关,例如编码抗逆相关蛋白的结构基因以及与信号传递相关的转录因子。DREB(dehydraton-responsive element-binding)是植物特有的抗非生物胁迫相关的转录因子,主要参与低温、干旱等胁迫应答[1]。植物受到胁迫时,复杂的信号转导激活DREB2转录因子,其AP2保守结构域与抗性相关基因启动子中的CRT/DRE基序(c-repeat/Drought Responsive Elements)结合,从而上调许多逆境诱导基因的表达,在整体上提高植物的抗逆性[2]。
响应于各种胁迫激活的磷酸肌醇磷脂酶C(PI-PLC)是植物磷脂信号系统的重要组分。当植物受到胁迫时,PI-PLC介导的信号途径在非生物胁迫耐受中发挥重要的作用。本文阐述了DREB2转录因子和PI-PLC的研究进展、在生物工程上的应用以及PI-PLC对DREB2的表达调控机理。
1 DREB2转录因子DREB家族分为6个亚家族( A1~ A6),DREB2转录因子属于A2亚家族。继拟南芥之后,现已从多种植物中分离得到DREB2基因。研究发现DREB2基因能够响应胁迫的诱导,能够提高植物的耐脱水性、耐热性和耐盐性、抗旱性等胁迫抗性。
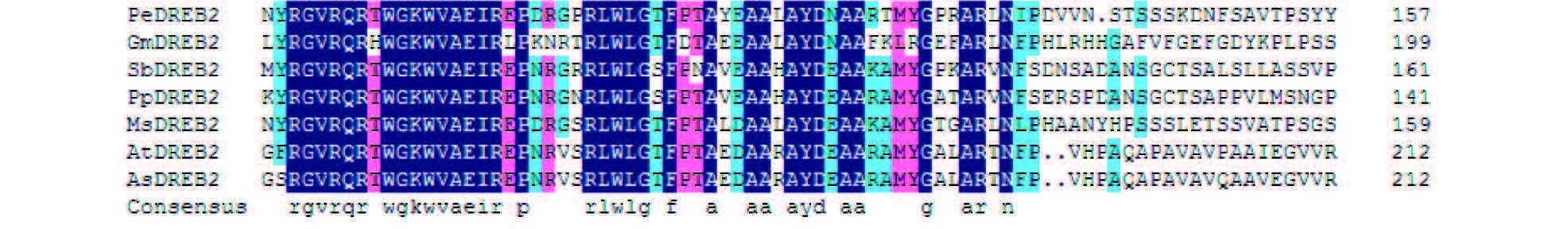
1.1 DREB2转录因子的结构DREB2转录因子的N-末端是富含碱性氨基酸的核定位信号区,含有一段高度保守的CMIV-1基序,中间是由58个氨基酸残基组成的一个保守的AP2结构域,其中位于14位的缬氨酸和19位的谷氨酸在其与顺式元件的结合中起重要作用(图 1)[3],C-末端是酸性转录激活区。
|
| 图 1 DREB蛋白AP2/EREBP结构域的氨基酸序列比对 Fig. 1 Amino acid sequence alignment of conserved AP2/EREBP domain of DREB proteins |
1998年,Liu等[3]根据已确立的DRE元件,利用酵母单杂交的方法,从低温处理的拟南芥cDNA文库中分离得到了DREB2A、DREB2B。Sakuma等[4]经序列同源性比较后,从拟南芥中克隆了6个DREB2同源基因,命名为DREB2C-DREB2H,并进行了功能的研究 。
随着第一个DREB2被发现,目前已从多种植物中分离得到DREB2。例如,2003年,Dubouzet等[5]得到了水稻OsDREB2,2007年,Qin等[6]报道了玉米ZmDREB2A基因。除此之外,2009年,Chen等[7]从胡杨中分离出PeDREB2基因。2010年,Parinita等[8]报道了来自于御谷的强转录因子PgDREB2A。2011年,Bihani等[9]从海蓬子中分离得到SbDREB2A。2013年,Zhao等[10]和Mizoi等[11]分别获得海棠苹果的MsDREB2C基因和大豆GmDREB2A。2014年,Kudo等[12]从蔬菜莴苣中分离出LsDREB2A,2014年,Ayan等[13]得到豇豆VuDREB2A,同年,Li等[14]获得准格尔无叶豆EsDREB2B。
根据氨基酸序列差异,DREB2同源基因进一步划分为3个亚型[15]。大部分参与非生物胁迫应答的DREB2属于亚型1,包括拟南芥AtDREB2A、AtDREB2B和水稻OsDREB2A、OsDREB2B;亚型2包括AtDREB2D、AtDREB2G和OsDREB2C;亚型3仅含AtDREB2F和OsDREB2E。亚型2和亚型3不响应或轻度响应胁迫的诱导。
1.2.2 DREB2基因对非生物胁迫的响应DREB2基因主要参与干旱、高盐和高温胁迫应答,也响应低温和脱落酸(abscisic acid,ABA),且不同的DREB2基因在植物的不同位置对非生物胁迫的诱导反应不一样,例如在拟南芥的8个DREB2基因中,AtDREB2A和AtDREB2B受干旱、氯化钠或热的诱导高表达,而对低温或ABA的响应较小。AtDREB2C、AtDREB2D和AtDREB2F在叶中受热和高盐的诱导微量表达。AtDREB2E在根中受ABA的诱导微量表达[16]。水稻中仅OsDREB2A和OsDREB2B响应非生物胁迫的诱导[17]。玉米ZmDREB2A、大豆GmDREB2A[18]和海蓬子SbDREB2A[19]受高温胁迫的诱导。
1.2.3 DREB2的功能研究拟南芥过表达DREB2A基因,其胁迫耐受性没有增强,用拟南芥原生质体进行分析显示,DREB2A的AP2/ERF DNA结构域旁有负调节结构域(NRD),去除NRD使DREB2A转变成组成型活性形式(DREB2A CA)。拟南芥过表达DREB2A CA基因表现出耐旱性和耐热性的提高[20]。有研究者等[7]证实在拟南芥中过表达OsDREB2类基因时,只有OsDREB2B能激活靶基因的表达。拟南芥过表达大豆ZmDREB2A和胡杨PeDREB2,分别提高了耐脱水性、耐热性和耐盐性、抗旱性。莴苣LsDREB2A以及豇豆VuDREB2A分别提高了转基因拟南芥的耐盐性和抗旱性,GmDREB2A在拟南芥中的异源表达增强其高温的耐受性。海棠苹果MsDREB2C在拟南芥中过表达增加了其根和叶的生长以及脯氨酸水平,并且减少了水分的流失以及气孔的开度。
1.2.4 DREB2的应用前景随着越来越多的DREB2成功获得,DREB2功能上的研究也取得了很多有意义的进展,由于其能提高植物的非生物胁迫耐受性,已广泛地应用于生物工程领域。2008年,Fuminori等[21]将DREB2的同系物Wdreb2转入烟草中,提高了烟草的抗冻性和渗透胁迫的耐受性。准格尔无叶豆的EsDREB2B在烟草中异源表达可提高其非生物胁迫耐受性。PgDREB2A提高了烟草的耐盐性和耐渗透性。将海蓬子SbDREB2A转入水稻,提高了其产量以及抗旱能力。由此可见,不同来源的DREB2基因转入不同的植物中,能提高不同植物 的胁迫耐受性。上述分离获得的DREB2基因可以作为抗非生物胁迫的候选基因,在生物技术领域发挥重要的功能。
2 PI-PLC磷脂既是植物细胞膜的重要组成成分又在信号转导中起作用。根据降解磷酯键位置的不同,磷脂酶分为磷脂酶A1﹑磷脂酶A2﹑磷脂酶C和磷脂酶D[22]。其中,磷脂酶C水解甘油磷脂分子中的第3位磷酯键。植物磷脂酶C(PLC)根据水解底物的不同又分为三类:水解磷脂酰肌醇的PI-PLC、水解磷脂酰胆碱和其他磷脂的PC-PLC和水解糖基化磷脂酰肌醇锚蛋白的GPI-PLC[23]。
2.1 PI-PLC的研究进展 2.1.1 PI-PLC的调控途径PI-PLC受到外界激素、胁迫等刺激时被激活,水解磷脂酰肌醇-4,5-二磷酸(PIP2),产生双信使分子肌醇1,4,5-三磷酸(IP3)[24]和二酰基甘油(DAG)[25],其中水溶性的IP3由质膜扩散进入胞质溶胶促进释放Ca2+,在细胞中起传送和扩大信号的作用[26]。留在质膜上的DAG,被DAG激酶(DGK)磷酸化成PA[27],来传递信号,PA作为植物中重要的第二信使,参与调节非生物胁迫[28],通过与效应蛋白的直接互作进行细胞调控。其中PI-PLC/DGK途径既响应非生物胁迫[29]也能在未受刺激的植物中起积极作用。
植物PLC的激活与G蛋白有关,当信号分子识别并同受体结合后,激活G蛋白α亚基激活PI-PLC,由于G蛋白可刺激IP3的产生和钙离子释放,说明G蛋白对PLC有调节作用,且可能在PLC上游发挥调控作用[30]。目前已有证据表明,G蛋白α亚基可能参与PI-PLC产生IP3介导DNA合成的过程[31]。
2.1.2 PI-PLC参与生长调节研究表明植物的PI-PLC参与多种信号转导过程,在生长调节中起多方面的作用。Franklin-Tong等用PLC抑制剂新霉素证明花粉管存在着PLC活性。马力耕等[32]用PLC抑制剂U-73122发现蛇莓和百合花粉的萌发受到抑制。由此可见,PLC可能参与花粉管萌发的生理过程。
ABA是植物激素之一,调控植物的许多防御反应[33]。在植物中,PI-PLC积极参与ABA依赖性信号转导。ABA在气孔调节中引起保卫细胞的钙振荡从而影响到气孔的最终开度。Staxén等[34]发现PLC抑制剂U-73122也抑制ABA引起的钙振荡及气孔关闭,证实PLC参与ABA调节气孔的过程。
2.1.3 PI-PLC参与胁迫反应Munnik等[35]研究表明PI-PLC参与渗透胁迫诱导的细胞信号传导过程。不同的盐和渗透胁迫诱导剂处理下可快速提高IP3水平,但U-73122可以抑制IP3水平的升高。说明渗透胁迫诱导使PI-PLC活性增强造成IP3增加,表明PI-PLC参与渗透胁迫反应。高温胁迫下,豌豆细胞膜中的PI-PLC活性增加且在40分钟时达到最大[36]。与热胁迫处理的植物中PI-PLC蛋白的积累相一致[37]。热胁迫下,拟南芥IP3快速且大量的积累[38]。冷胁迫诱导的信号转导也涉及到PI-PLC途径。冬小麦组织,拟南芥悬浮细胞[39]和油菜叶受冷胁迫时IP3快速且瞬时积累。冷胁迫使得细胞膜刚性化,使得PI-PLC依赖的钙进入细胞,从而激活PI-PLC[40]。
3 PI-PLC调控DREB2基因的表达 3.1 PI-PLC对DREB2基因的负调控脂质信号发生在非生物胁迫中,也发生在未应激的细胞中,从而参与基底信号转导。所谓的未应激细胞不是没有细胞信号发生的细胞,而是通过基底信号活性来调控其稳态的细胞[41]。
目前,一般都是采用药理学方法研究脂质信号,尤其是PI-PLC参与的基因表达的基底调节。拟南芥细胞悬浮培养是一种用于研究特定的信号机制的简化模型。PI-PLC调控拟南芥中许多DREB基因的表达,例如DREB1A、DREB1C、DREB2。但是PI-PLC对DREB1A、DREB1C的诱导要比DREB2弱[42]。
PI-PLC调控DREB2的研究是通过分析DREB2对PI-PLC抑制剂的响应来进行的。新霉素和U73122是两种常用的PI-PLC的抑制剂,被广泛地用来抑制PI-PLC。已经证明新霉素能够在体外条件下抑制PI-PLC ,由于新霉素的溶血烷基磷脂酰胆碱结构抑制磷酸胞苷酰转移酶,可能会影响膜的结构[43],产生副作用。U73122是一种氨基甾体,典型的PI-PLC活性抑制剂,能够在植物体外抑制PI-PLC[44]。它们对PI-PLC具有类似的抑制作用且会导致DREB2基因上调表达。
Nabila等使用新霉素/U73122处理植物,发现新霉素/U73122使拟南芥中的DREB2基因上调表达,这些改变可能受PI-PLC产生的PA的调控,抑制PI-PLC产生的PA会促进AtDREB2s与CRT/DRE的结合,使AtDREB2基因上调表达。RT-PCR分析了拟南芥所有DREB2基因对抑制剂的响应,除了DREB2D的表达不受调控且没有检测到DREB2F和DREB2G的转录水平外,其他所有的DREB2基因都被依地福新或U73122诱导。说明DREB2的表达受到PI-PLC途径产生的PA的抑制[6]。Perera等也证实PI-PLC负调控DREB2的表达,且PI-PLC产生的脂质和可溶性介质都参与负调控DREB2的表达。除此之外,PA也可以由PI-PLD分解PC而直接产生[45]。
3.2 PI-PLC对DREB2基因表达的正调控DREB2的表达调控不仅发生在基底条件下也发生在胁迫响应中。胁迫会造成Ca2+内流且细胞内IP3水平增加。IP3可以促使植物细胞内的Ca2+库释放Ca2+,使得细胞内Ca2+浓度上升,细胞内部发生一系列磷酸化级联反应,从而激活转录因子的表达。DREB2转录因子被激活后,其上的AP2结构域与下游功能基因启动子上的CRT/DRE顺式作用元件相结合,从而激活其表达,提高植物的抗逆性。基底PI-PLC抑制DREB2的表达,但活化的PI-PLC激发DREB2的表达,这两个过程主要的差别是PI-PLC底物和产物的含量不同。当胁迫激活PI-PLC,磷酸肌醇含量降低,PA含量增加[46],会影响PA与靶肽的相互作用。在基底条件下,PA与高亲和性的靶基因作用。胁迫条件下,高浓度的PA与较低亲和性的靶基因相互作用,这些靶基因与高亲和性的靶基因不同,可能会产生相反的作用,正调控DREB2的表达。由此可见,PI-PLC既在基底条件下也在胁迫条件下对DREB2的表达起调控作用[6]。
4 展 望DREB转录因子在信号转导中发挥重要作用,应用在生物工程上可以提高植物的非生物胁迫耐受性,磷脂酶可以调控DREB转录因子在植物中的表达,PI-PLC在基底条件下负调控DREB2的表达,但在胁迫条件下,PI-PLC可以上调DREB2的表达,从而提高植物的综合抗逆性,使植物在不同且极具变化的环境条件下,迅速做出反应适应胁迫,减少损害。但是,目前通过利用PI-PLC来调控DREB2在生物工程领域方面的应用非常少,今后应加强这方面的研究。为DREB2转录因子的利用,提高植物对胁迫环境的适应性提供基础。
| [1] | 高刚, 邓家彬, 苟学梅, 等. 14个赖草属植物DREB2基因的克隆与SNP分析. 植物研究, 2015, 35(1) : 47-51. Gao G, Deng J B, Gou X M, et al. Clone and SNP analysis of DREB2 gene in fourteen Leymus species. Bulletin of Botaanical Research, 2015, 35(1) : 47-51. |
| [2] | Sakuma Y, Liu Q, Dubouzet J G, et al. Functional role of DREB and ERF transcription factors:regulating stress-responsive network in plants.Acta Physiologiae Plantarum, 2015, 37(9): 178. |
| [3] | Liu Q, Kasuga M, Sakuma Y, et al. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought and low-temperature-responsive gene express ion, respectively, in Arabidopsis. The Plant Cell, 1998, 10(8): 1391-1406. |
| [4] | Sakuma Y, Maruyama K, Osakabe Y, et al. Functional analysis of an Arabidopsis transcription factor, DREB2A, involved in drought responsive gene expression. Plant Cell, 2006, 18(5): 1292-1309. |
| [5] | Dubouzet J G, Sakuma Y, Ito Y, et al. OsDREB genes in rice, Oryza sativa L., encode transcription activators that function in drought-, high-salt- and cold-responsive gene expression.The Plant Journal, 2003, 33(4): 751-763. |
| [6] | Qin F, Kakimoto M, Sakuma Y, et al. Regulation and functional analysis of ZmDREB2A in response to drought and heat stresses in Zea mays L. The Plant Journal, 2007, 50(1): 54-69. |
| [7] | Chen J, Xia X, Yin W. Expression profiling and functional characterization of a DREB2-type gene from Populus euphratica. Biochemical and Biophysical Research Communications, 2009, 378(3): 483-487. |
| [8] | Parinita A, Pradeep K A, Arvind J J, et al. Overexpression of PgDREB2A transcription factor enhances abiotic stress tolerance and activates downstream stress-responsive genes. Molecular Biology Reports, 2010, 37(2): 1125-1135. |
| [9] | Bihani P, Char B, Bhargava S. Transgenic expression of sorghum DREB2 in rice improves tolerance and yield under water limitation. The Journal of Agricultural Science, 2011, 149(1): 95-101. |
| [10] | Zhao K, Xinjie S, Huazhao Y, et al. Isolation and characterization of dehydration-responsive element-binding factor 2C (MsDREB2C) from Malus sieversii Roem. Plant & Cell Physiology, 2013, 54(9): 1415-1430. |
| [11] | Mizoi J, Shinozaki K, Yamaguchi-Shinozaki K. AP2/ERF family transcription factors in plant abiotic stress responses. Biochim Biophys Acta, 2012, 1819(2): 86-96. |
| [12] | Kudo K, Oi T, Uno Y. Functional characterization and expression profiling of a DREB2-type gene from lettuce (Lactuca sativa L.). Plant Cell Tissue Organ Culture, 2014, 116(1): 97-109. |
| [13] | Ayan S, Yasufumi K, Yuriko K. et al. VuDREB2A, a novel DREB2-type transcription factor in the drought-tolerant legume cowpea, mediates DRE-dependent expression of stress-responsive genes and confers enhanced drought resistance in transgenic Arabidopsis. Planta, 2014, 240(3): 645-664. |
| [14] | Li X S, Daoyuan Z H, Haiyan L, et al. EsDREB2B, a novel truncated DREB2-type transcription factor in the desert legume Eremosparton songoricum, enhances tolerance to multiple abiotic stresses in yeast and transgenic tobacco. BMC Plant Biology, 2014, 14(1): 44. |
| [15] | Mizoi J, Shinozaki K, Yamaguchi-Shinozaki K. AP2/ERF family transcription factors in plant abiotic stress responses. Biochimica et Biophysica Acta, 2012, 1819(2): 86-96. |
| [16] | Djafi N, Vergnolle C, Cantrel C, et al. The Arabidopsis DREB2 genetic pathway is constitutively repressed by basal phosphoinositide- dependent phospholipase C coupled to diacylglycerol kinase. Frontiers in Plant Science, 2013, 4: 1-14. |
| [17] | Matsukura S, Mizoi J, Yoshida T, et al. Comprehensive analysis of rice DREB2-type genes that encode transcription factors involved in the expression of abiotic stress-responsive genes. Molecular Genetics and Genomics, 2010, 283(2): 185-196. |
| [18] | Mizoi J, Ohori T, Kidokoro S, et al. GmDREB2A; 2, a canonical dehydration-responsive element-binding protein2-Type Transcription Factor in soybean, is post transnationally regulated and mediates dehydration-responsive element-dependent gene express. Plant Physiology, 2013, 161(1): 346-361. |
| [19] | Gupta K, Agarwal P K, Reddy M K, et al. SbDREB2A, an A-2 type DREB transcription factor from extreme halophte Salicornia brachiata confers abiotic stress tolerace in Escherichia coli. Plant Cell Reports, 2010, 29(10): 1131-1137. |
| [20] | Sakuma Y, Maruyama K, Qin F, et al. Dual function of an Arabidopsis transcription factor DREB2A in water-stress-responsive and heat-stressresponsive gene expression. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(49): 18822-18827. |
| [21] | Fuminori K, Machiko I, Shigeo T. Transcriptional activation of Cor/Lea genes and increase in abiotic stress tolerance through expression of a wheat DREB2 homolog in transgenic tobacco. Transgenic Research, 2008, 17(5): 755-767. |
| [22] | Geliang W, Stephen R, Xuemin W. Plant phospholipases: An overview. Lipases and Phospholipases, 2012, 861: 123-137. |
| [23] | 孙建, 裴慧娟, 路小铎, 等. 拟南芥非特异性磷脂酶C4基因表达模式的研究. 生物技术通报, 2008, (6): 83-96. Sun J, Pei H J, Lu X D, et al. Expression pattern of Arabidopsis nonspecific phospholipase C4 gene. Biotechnology Bulletin, 2008, (6): 83-96. |
| [24] | Jill S P, Brian Q P. Inositol polyphosphates and kinases. Lipid Signaling in Plants, 2009, 16: 161-174. |
| [25] | Pokotylo I, Kolesnikov Y, Kravets V, et al. Plant phosphoinositide-dependent phospholipases C: variations around a canonical theme. Biochimie, 2014, 96: 144-157. |
| [26] | Berridge M J. Inositol trisphosphate and calicum signalling. Nature, 1993, 361(6410): 315-325. |
| [27] | Ahmed A H, Harold J G, Wladimir I L, et al. Defense activation triggers differential expression of phospholipase-C (PLC) genes and elevated temperature induces phosphatidic acid (PA) accumulation in tomato. Plant Signaling & Behavior, 2012, 7(9): 1073-1078. |
| [28] | Arisz S A, Testerink C, Munnik T. Plant PA signaling via diacylglycerol kinase. Biochimica et Biophysica Acta, 2009, 1791(9): 869-875. |
| [29] | Eric R, Nabila D, Alain Z. The phosphoinositide dependent-phospholipase C pathway differentially controls the basal expression of DREB1 and DREB2 genes. Plant Signaling & Behavior, 2013, 9(1): e26895-e26893. |
| [30] | Reggiani R, laoreti P. Evidence for the involvement of phospholipase C in the anaerobic signal transduction. Plant and Cell Physiology, 2000, 41(12): 1392-1396. |
| [31] | Apone F, Alyeshmerni N, Wiens K, et al. The G-protein- coupled receptor GCR1 regulates DNA synthesis through activation of phosphatidylinositol-specific phospholipase C. Plant Physiology, 2003, 133(2): 571-579. |
| [32] | 马力耕,徐小冬,崔素娟,等. 肌醇磷脂信号途径参与胞外钙调素启动花粉萌发和花粉管伸长. 植物生理学报, 1998, 24(2): 196-200. Ma L G, Xu X D, Cui S J, et al. The involvement of phosphoinosiitde signaling pathway in the iultiatory effects of extracellular calmodulin on pollen germination and tube groth. Acta Phytophysiologica Sinica, 1998, 24(2): 196-200. |
| [33] | Fujita Y, Fujita M, Shinozaki K, et al. ABA-mediated transcriptional regulation in response to osmotic stress in plants. Journal of Plant Research, 2011, 124(4): 509-525. |
| [34] | Staxen I, Pical C, Montgomery L T, et al. Abscisic acid induces oscillations in guard-cell cytosolic free calcium that involve phosphoinositide-specific phospholipase C. Proceedings of the National Academy of Sciences, 1999, 96(4): 177-1784. |
| [35] | Munnik T, Vermeer J E. Osmotic stress-induced phosphoinositide and inositol phosphate signalling in plants. Plant Cell Environ, 2010, 33(4): 655-669. |
| [36] | Ruelland E, Zachowski A. How plants sense temperature. Environmental and Experimental Botany, 2010, 69(3): 225-232. |
| [37] | Hong T L, Wei D H, Qiu H P, et al. Contributions of PIP2-specific-phospholipase C and free salicylic acid to heat acclimation-induced thermotolerance in pea leaves. Journal of Plant Physiology, 2006, 163(4):405-416. |
| [38] | Hong T L, Gao F, Shu J C, et al. Primary evidence for involvement of IP3 in heat-shock signal transduction in Arabidopsis. Cell Research, 2006, 16(4): 394-400. |
| [39] | Ruelland E, Cantrel C, Gawer M, et al. Activation of phospholipases C and D is an early response to a cold exposure in Arabidopsis suspension cells. Plant Physiology, 2002, 130(2): 999-1007. |
| [40] | Marie Noëlle V, Catherine C, Chantal V, et al. Desaturase mutants reveal that membrane rigidification acts as a cold perception mechanism upstream of the diacylglycerol kinase pathway in Arabidopsis cells. FEBS Letters, 2006, 580(17):4218-4223. |
| [41] | Boss W F, Sederoff H W, Ju I Y, et al. Basal signaling regulates plant growth and development. Plant Physiology, 2010, 154(2): 439-443. |
| [42] | Ruelland E, Dja N, Zachowski A. The phosphoinositide dependent-phospholipase C pathway differentially. Plant Signaling & Behavior, 2013, 9:1. |
| [43] | Eric R, Igor P, Nabila D, et al. Salicylic acid modulates levels of phosphoinositide dependent-phospholipase C substrates and products to remodel the Arabidopsis suspension cell transcriptome. Frontiers in Plant Science, 2014, 5: 1-19. |
| [44] | Wilsher N E, Court W J, Ruddle R, et al. The phosphoinositide-specific phospholipase C inhibitor U73122 (1-6-(17β-3-Methoxyestra-1 3, 5-trien-17-yl) amino)hexyl)-1H-pyrrole-2, 5-dione) spontaneously forms conjugates with common components of cell culture medium. Drug Metabolism and Disposition, 2007, 35(7): 1017-1022. |
| [45] | Dominique R, Lydie H, Elise D, et al. Acyl chains of phospholipase D transphosphatidylation products in Arabidopsis cells: a study using multiple reaction monitoring mass spectrometry. PLos One, 2012, 7(7): e41985. |
| [46] | Baker S S, Wilhelm K S, Thomashow M F. The 5’-region of Arabidopsis thaliana cor15a has cis-acting elements that confer cold-, drought- and ABA- regulated gene expression. Plant Molecular Biology, 1994, 24(5): 701-713. |
 2016, Vol. 36
2016, Vol. 36




