文章信息
- 左志宇, 辛灵彪, 杨洁, 王鑫廷
- ZUO Zhi-yu, XIN Ling-biao, YANG Jie, WANG Xin-ting
- SND1转基因小鼠的构建
- Construction of SND1 Transgenic Mice
- 中国生物工程杂志, 2016, 36(4): 97-103
- China Biotechnology, 2016, 36(4): 97-103
- http://dx.doi.org/10.13523/j.cb.20160414
-
文章历史
- 收稿日期: 2015-10-30
- 修回日期: 2015-12-13
2. 天津医科大学基础医学院医学分子生物学系 天津 300070
2. Basic Medical College of Tianjin Medical University, Department of Biochemistry and Molecular Biology, Tianjin 300070, China
SND1(staphylococcal nuclease domain containing 1)蛋白,又称p100蛋白,Tudor-SN (tudor staphylococcal nuclease),首次作为EBNA2 (Epstein-Barr virus nuclear protein 2,EB病毒细胞核抗原2)的转录调控激活因子被发现[1]。细胞水平与分子水平的研究发现,SND1蛋白广泛表达于人[1]、牛[2]、小鼠[3]、大鼠[4]及拟南芥[5]等物种中,可参与基因转录、剪接体加工、细胞增殖、细胞应激、RNA干扰、病毒感染等多种重要的细胞生物学事件[6, 7, 8, 9],还与哮喘、过敏、结肠癌、肺癌、肾癌、乳腺癌等多种人类疾病相关,肿瘤组织中SND1表达均有不同程度上升[10, 11, 12, 13, 14, 15, 16]。小鼠SND1基因定位于染色体6A3.3,本实验针对小鼠SND1基因构建基因过表达小鼠模型,为深入研究该基因生物学功能提供体内研究模型。
1 材料与方法 1.1 材 料 1.1.1 实验动物野生型C57BL/6小鼠购自军事医学科学院。
1.1.2 试剂与仪器小鼠SND1基因转录本(BC007126.1)购自复能基因公司。限制性内切酶BglⅡ,SalⅠ,BamHⅠ,XhoⅠ,NheⅠ,EcoRI,T4 DNA连接酶购自Thermo Scientific公司,2×Taq PCR Master Mix 试剂盒购于TaKaRa公司,trans1-T1感受态细胞、Trans2K Plus DNA Marker 购自全式金生物技术公司,质粒提取试剂盒购自BIOMIGA公司,PCR产物纯化试剂盒购于QIAGEN公司,胶回收试剂盒购于QIAGEN公司,蛋白酶K购于TaKaRa公司,Trizol 购于Invitrogen公司,逆转试剂盒购于Thermo Scientific公司,FastStar Universal SYAR Green Master(Rox)购于Roche Diagnostics公司。电泳槽、电泳仪购自Bio-Rad公司,StepOnePlus Real-Time PCR 系统购于Applied Biosystems公司。
1.2 方 法 1.2.1 过表达SND1质粒的设计及片段的获得对SND1基因转录本进行酶切位点分析,以EcoRI为分界点将ORF分为SND1-A和SND1-B两个片段。重组SND1过表达质粒设计原则为:(1)质粒中带有3×FLAG标签;(2)含有驱动SND1在哺乳动物载体的高水平表达的组合启动子CAG;(3)引入隔离子(Insulator)以减少插入位点对转基因表达的影响。
SND1-A片段获得:以小鼠SND1基因转录本为模板,上游引物F: 5′-AATAAT AGATCT ATGGCCTCCTCC GCGCAGA-3′ ,下游引物R:5′-AATAAT GTCGAC GCG GCCGC CTCGAG AAA GAATTCAGCTTCACAACAATGG-3′ 。PCR法扩增SND1-A片段。设计引物时在上游加入BglⅡ酶切位点,下游依次加入XhoⅠ、NotⅠ和SalⅠ酶切位点,PCR条件为95℃ 5 min,95℃ 30 s,58℃ 30s,72℃ 60 s,30个循环,72℃ 10min。PCR产物胶回收,纯化试剂盒纯化线性SND1基因A片段。SND1-B片段的获得:以小鼠SND1基因转录本为模板,上游引物F: 5′ CCA GCT CCA CAC ATGGCCTCCT-3′ ,下游引物R:5′-TTAGCGACTGTAGCCAAACTCA-3′,PCR法扩增SND1-B片段。其中设计引物时在上游含有内源性酶切位点,下游加入SalⅠ酶切位点。PCR条件为95℃ 5 min,95℃ 30 s,58℃ 30s,72℃ 60 s,30个循环,72℃ 10min。PCR产物胶回收,纯化线性SND1基因B片段。
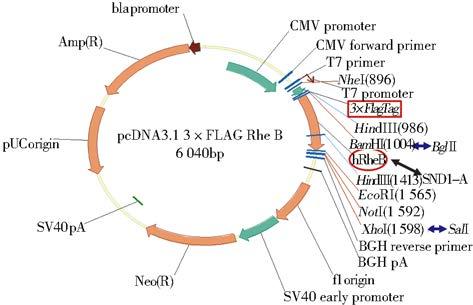
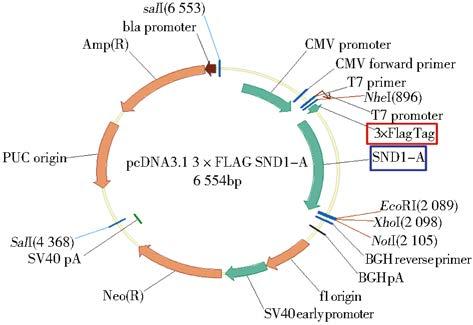
1.2.2 SND1基因N端追加3×FLAG标签(1)SND1-A片段双酶切处理:SND1基因A片段进行BglⅡ和SalⅠ双酶切处理,体系为:1μg DNA片段,1μl BglⅡ,1μl SalⅠ,2μl Buffer,超纯水至20μl。(2)3×FLAG标签的线性载体:以BamHI和XhoⅠ酶切pcDNA3.1 3×FLAG RheB质粒,获含3×FLAG标签的线性载体。体系:1μg 质粒,1μl BamHI,1μl XhoⅠ,2μl Buffer,超纯水至20μl。(3)SND1基因A片段与3×FLAG标签的线性载体连接。体系:载体与片段比例为1∶3,T4连接酶16℃过夜连接,次日转化、鉴定、测序、纯化,构建pcDNA3.1 3×FLAG SND1-A载体。因BamHⅡ与BglⅡ、XhoⅠ与SalⅠ均系同尾酶。所以人工修改了pcDNA3.1 3×FLAG上的酶切顺序,并且破坏BamHI和SalⅠ酶切位点,以便后面的载体构建。
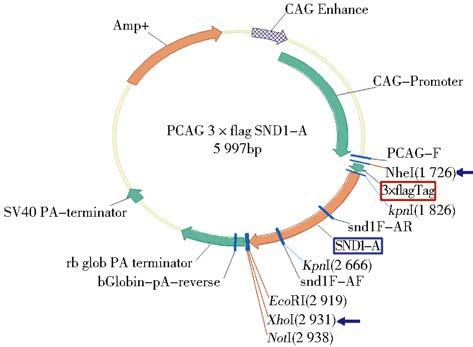
1.2.3 pCAG 3×FLAG SND1质粒构建(1)载体线性化:以酶切pCAG-MS2载体,切胶回收。体系:1μg pCAG-MS2载体,1μl NheⅠ,1μl FastAP,2μl 10×Fast Digest Buffer,超纯水至20μl,37摄氏度60min。(2)获得线性化片段:以内切酶XhoⅠ酶切pcDNA3.1 3×FLAG SND1-A载体获得带有3×FLAG 的SND1-A基因片段,切胶回收。体系:1μg 质粒,1μl XhoⅠ,2μl Buffer,超纯水至20μl(3)T4连接酶连接16℃过夜连接,次日转化、鉴定、测序、纯化,构建pCAG 3×FLAG SND1-A载体。(4)pCAG 3×FLAG SND1-A质粒线性化:以EcoRI和XhoⅠ酶切pCAG 3×FLAG SND1-A质粒,切胶回收。体系为:1μg 质粒,1μl EcoRI,1μl XhoⅠ,2μl Buffer,超纯水至20μl,37℃,60min。(5)SND1-B片段的线性化:EcoRI和SalⅠ双酶切处理,电泳分离、纯化线性SND1-B基因片段。体系:1μg DNA片段,1μl EcoRI,1μl SalⅠ,2μl Buffer,超纯水至20μl,37℃,60min。(6)T4连接酶连接:线性pCAG 3×FLAG SND1-A载体与线性SND1-B基因片段T4连接酶连接16℃过夜连接,并转化、鉴定、测序、纯化,构建pCAG 3×FLAG SND1载体。
1.2.4 pInsulator CAG 3×FLAG SND1质粒构建(1)pInsulator empty载体的线性化:以SalⅠ酶切pInsulator empty载体,电泳分离切胶回收。体系:1μg质粒,1μl SalⅠ,2μl Buffer,超纯水至20μl。(2)pCAG 3×FLAG SND1载体线性化:以BamHI酶切 pCAG 3×FLAG SND1载体,获得带有3×FLAG和CAG元件的SND1基因片段。体系:1μg质粒,1μl SalⅠ,2μl Buffer,超纯水至20μl。(3)T4连接酶连接。体系:载体与片段比例为1∶3,T4连接酶16℃过夜连接,次日转化、鉴定、测序、纯化,构建pInsulator CAG 3×FLAG SND1载体。针对pInsulator CAG 3×FLAG SND1转基因载体设计引物,进行测序分析,鉴定是否存在点突变。根据图谱以I Ceu Ⅰ酶切此转基因载体,进行琼脂糖电泳鉴定。
1.2.5 转基因载体原核显微注射取3周龄C57BL6母鼠置于明暗交替环境中饲养左右超排卵供体母鼠,5天后腹腔注射孕马血清 10 IU(0.1ml),48h后注射hCG与单笼饲养的6周以上公鼠C57按1∶1比例合笼。同时取6周龄外阴潮红的发情期母鼠作为受体鼠,受体鼠与经结扎的公鼠合笼。次日清晨检查供体鼠与受体鼠是否有阴道栓,取可见阴道栓小鼠进行实验,断颈处死供体鼠,取出输卵管,置于M2培养液中,于解剖显微镜将形态完整,透明带清晰,原核清晰可见的受精卵分离,将外源线性 pInsulator CAG 3×FLAG SND1转基因载体注入小鼠受精卵雄性原核中,再将注射后存活的卵植入受体鼠输卵管中,移植后做好标记,每天观察出生幼鼠存活情况。
1.2.6 Founder转基因鼠的鉴定幼仔出生15天左右进行编号剪脚趾,样本加含蛋白酶K的裂解液进行裂解,次日抽提小鼠基因组DNA,并以此为模板进行PCR扩增鉴定。采用引物F:5′ GCAACGTGCTGGTTATTGT G;R:CTGGGTTGTTGGCTCTCAT。PCR条件为94℃ 5 min,94℃ 30 s,55℃ 30s,72℃ 60 s,30个循环,72℃ 10min,产物4℃保存,PCR产物大小为594bp。
1.2.7 转基因鼠RT-PCR鉴定取12周SND1过表达小鼠与WT小鼠各3只,开腹取肝脏,加1ml Trizol与7颗研磨珠,于组织匀浆器中匀浆3 min,离心取上清,Trizol法提取组织RNA,5μg 体系逆转为cDNA,采用引物F: CATTGCTGACAGGATGCAGAAGG R:TGCTGGAA GGTGGACAGTGAGGSND1 扩增Actb为内参,采用 F: TGTGCCACTGTCACCATTGGAG;R: CAGCTCATCGTAG TGTGAAGACC扩增SND1,以SYBR Green 20μl体系进行RT-PCR实验,-△△Ct法分析结果。
2 结 果 2.1 重组质粒pInsulator CAG 3×FLAG SND1的构建和鉴定SND1基因转录本酶切位点分析(图 1)表明,小鼠SND1基因ORF片段较长且含有EcoRI和NheⅠ酶切位点,故根据后续载体特点,以EcoRI为分界点将ORF分为SND1-A和SND1-B两个片段。设计引物为SND1-A加入酶切位点(图 2),PCR扩增并获得纯化线性SND1基因A片段,经双酶切处理与酶切线性后再与含3×FLAG标签的线性载体相连(图 3),获得pcDNA3.1 3×FLAG SND1-A载体(图 4)。该载体进行双酶切获得纯化线性带有3×FLAG 的SND1-A基因片段,将其与、纯化线性pCAG-MS2载体相连获得pCAG 3×FLAG SND1-A载体(图 5)。经引物设计扩增的含SalⅠ酶切位点SND1-B片段与pCAG 3×FLAG SND1-A载体经双酶切分别获得纯化线性片段,经T4连接酶连接以后最终获得pCAG 3×FLAG SND1载体(图 6)。将带有3×FLAG和CAG元件的SND1基因片段与双酶切后的pInsulator empty载体(图 7)相连,并转化、鉴定、测序、纯化,最终获得pInsulator CAG 3×FLAG SND1载体(图 8)。
 |
| 图 1 小鼠SND1基因ORF重要酶切位点 Fig. 1 Important restriction enzyme cutting site in mice SND1 ORF |
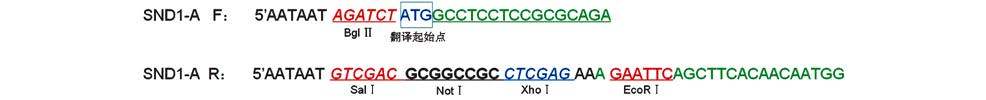 |
| 图 2 小鼠SND1基因A片段引物设计 Fig. 2 Primer design of the mice SND1 A gene segment |
 |
| 图 3 pcDNA3.1 3×FLAG RheB质粒酶切及与SND1-A片段连接图谱 Fig. 3 The schematic diagram of pcDNA3.1 3×FLAG RheB vector and link with SND1 A gene segment |
 |
| 图 4 pcDNA3.1 3×FLAG SND1-A质粒图谱 Fig. 4 The schematic diagram of pcDNA3.1 3×FLAG SND1-A vector |
 |
| 图 5 pCAG 3×FLAG SND1-A质粒图谱 Fig. 5 The schematic diagram of of pCAG 3×FLAG SND1-A vector |
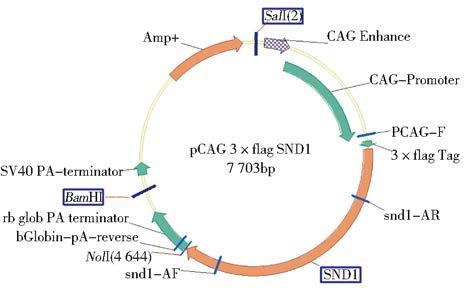 |
| 图 6 pCAG 3×FLAG SND1质粒图谱 Fig. 6 The schematic diagram of of pCAG 3×FLAG SND1 vector |
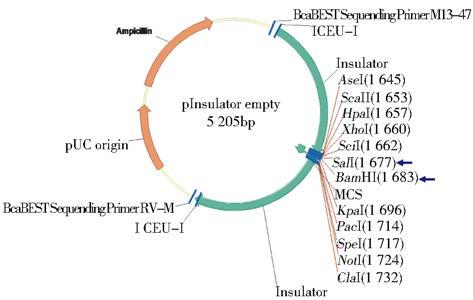 |
| 图 7 pInsulator empty载体图谱 Fig. 7 The schematic diagram of pInsulator empty vector |
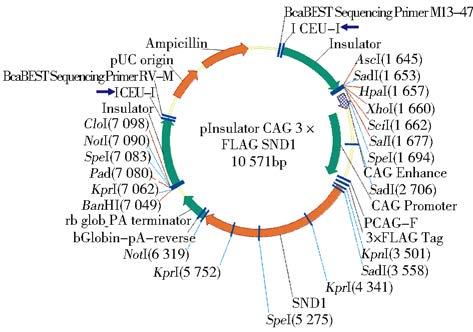 |
| 图 8 pInsulator CAG 3×FLAG SND1质粒 Fig. 8 Map of pInsulator CAG 3×FLAG SND1 transgenic vector |
对重组质粒pInsulator CAG 3×FLAG SND1转基因载体进行序列分析,根据图谱以I CeuI酶切此转基因载体,然后进行琼脂糖电泳鉴定(图 9A),可观察到M,N两条线性条带。针对M条带进行胶回收纯化处理,电泳鉴定在7 861bp左右得到较单一条带(图 9B),与预期条带相符。
 |
| 图 9 pInsulator CAG 3×FLAG SND1质粒的I Ceu I酶切鉴定及线性转基因载体纯化 Fig. 9 Cut by I CEU-I and purified by agarose gel before injection(a) I CEU-I cut(b) After purified |
对90只小鼠进行剪趾提取基因组DNA,PCR鉴定结果显示(图 10):#2、#30、#39、#40、#43、#46、#56、#61、#64、#66、#73为阳性鼠。(备注:43#死亡)
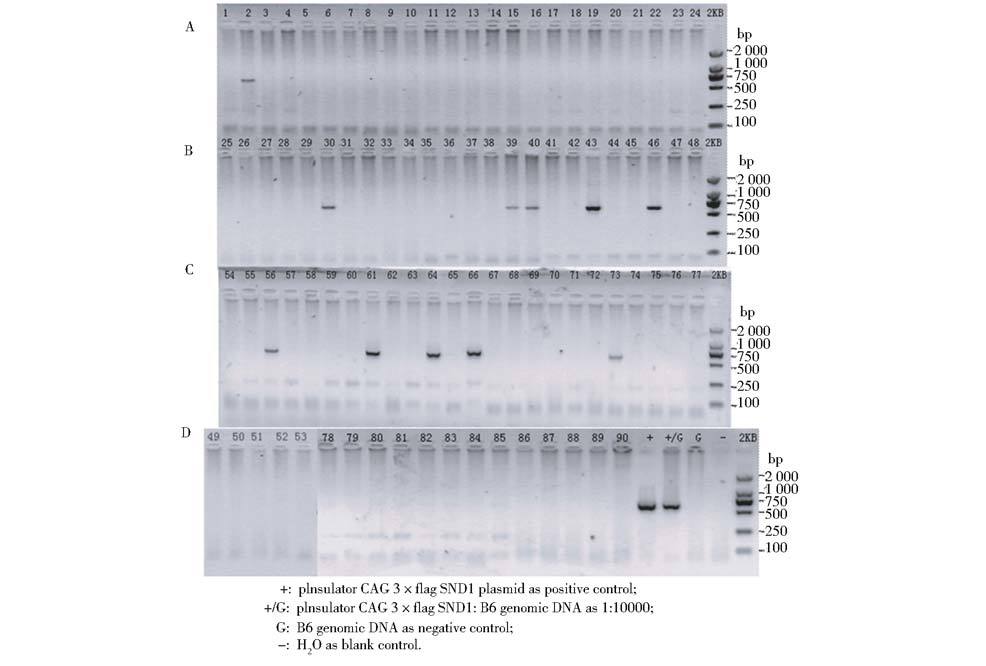 |
| 图 10 SND1转基因小鼠首次剪趾PCR鉴定 Fig. 10 Result of the first identification of SND1 transgenic mice by PCR |
对于首次鉴定呈阳性的小鼠进行剪尾、抽取小鼠基因组DNA,并以其为模板,进行PCR鉴定,方法同上。鉴定结果(图 11)显示:#2、#30、#39、#46、#56、#61、#64、#66、#73为阳性鼠。
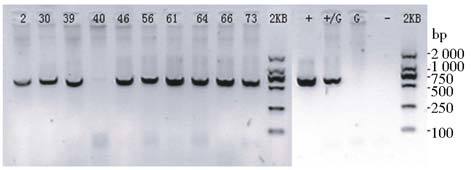 |
| 图 11 SND1转基因小鼠二次剪尾PCR鉴定 Fig. 11 Result of the second identification of SND1 transgenic mice by PCRPositive mice:2#、30#、39#、46#、56#、61#、64#、66#、73#. +: pInsulator CAG 3×flag SND1 plasmid as positive control;+/G: pInsulator CAG 3×flag snd1: B6 genomic DNA as 1∶10000;G: B6 genomic DNA as negative control;- H2O as blank control |
经PCR鉴定的小鼠提取肝脏组织mRNA,经逆转与RT-PCR实验验证SND1表达情况。鉴定结果(图 12)显示SND1转基因小鼠,其肝脏组织SND1表达量相对于野生型小鼠上升100倍以上,至此,SND1转基因小鼠模型构建成功。
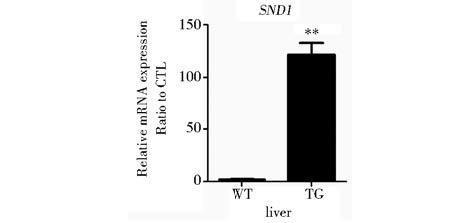 |
| 图 12 SND1转基因小鼠RT-PCR鉴定 Fig. 12 Result of the first identification of SND1 transgenic mice by PCRThe expression of SND1 in liver ,the quantitative analysis was normalized using Actb,n=3,** P<0.05 |
SND1蛋白作为一种多功能蛋白,广泛表达于动物体内,首先被证实具有转录共激活作用。早期研究发现SND1参与细胞应激、细胞周期以及细胞增殖等过程,近期研究证实该蛋白与肿瘤侵袭迁移[17]以及脂肪细胞形成[18]相关。文献报道SND1参与前脂肪细胞的分化,Tudor-SN全身敲除小鼠MEF细胞不可以分化为成熟脂肪细胞,提示SND1对于哺乳动物的脂肪形成过程具有影响。本研究拟通过建立SND1过表达小鼠模型,基于该模型研究SND1在动物体内的生理学作用。
本研究利用SND1基因转录本,经过对酶切位点分析后采用PCR法获得SND1片段,经过酶切及连接在SND1基因的N段追加3×FLAG标签。载体构建过程中将SND1A,B两片段采用同一个内源性EcoRI,故避免了蛋白翻译的框移突变问题。而后通过构建pCAG 3×FLAG SND1质粒将CAG元件引入质粒中,将人工构建的组合启动子与载体相连,使其可以驱动SND1基因在哺乳动物载体高水平表达。最终使用隔离子来减少插入位点对转基因表达的影响,构建pInsulator CAG 3×FLAG SND1质粒。PCR及测序对质粒进行鉴定表明质粒构建成功。通过显微注射将纯化和线性化后的质粒注入受精卵,经胚胎移植最终构建SND1转基因小鼠。通过两次取组织PCR鉴定最终证实成功构建SND1过表达动物模型,小鼠顺利成活,无明显畸形及早衰现象。
研究表明,在细胞模型中SND1过表达将引起脂肪细胞的分化增加,而SND1不足的情况将导致脂肪分化减少。SND1蛋白能够结合到 PPARγ 靶基因的 PPRE 区,作为转录共激活因子激活下游基因的转录[18]。因此,构建SND1转基因小鼠模型,可以在体内环境下探讨SND1蛋白的作用及其机制,可以进一步通过引入小鼠高脂饮食探讨SND1在脂肪组织形成中的作用,为探讨脂肪细胞形成、脂肪组织代谢提供研究材料。
| [1] | Tong X, Drapkin R, Yalamanchili R, et al.The Epstein-Barr virus nuclear protein 2 acidic domain forms a complex with a novel cellular coactivator that can interact with TFllE Mol Cell Biol,1995,15(9):4735-4744. |
| [2] | Broadhurst M K, Lee R S, Hawkins S, et al. The p100 EBNA-2 coactivator: a highly conserved protein found in a range of exocrine and endocrine cells and tissues in cattle. Biochim Biophys Acta, 2005, 1681(2-3): 126-133. |
| [3] | Broadhurst M K, Wheeler T T. The p100 coactivator is present in the nuclei of mammary epithelial cells and its abundance is increased in response to prolactin in culture and in mammary tissue during lactation. J Endocrinol,2001, 171(2): 329-337. |
| [4] | Palacios L, Ochoa B, Gomez-Lechon M J, et al. Overexpression of SND p102, a rat homologue of p100 coactivator, promotes the secretion of lipoprotein phospholipids in primary hepatocytes. Biochim Biophys Acta, 2006, 1761(7):698-708. |
| [5] | Abe S, Sakai M, Yagi K, et al. A Tudor protein with multiple SNc domains from pea seedlings: cellular localization, partial characterization, sequence analysis, and phylogenetic relationships. J Exp Bot, 2003, 54(384): 971-983. |
| [6] | Callebaut Ⅰ, Mornon J P. The human EBNA-2 coactivator p100:multidomain organization and relationship to the staphylococcal nuclease fold and to the tudor protein involved in Drosophila melanogaster development.Biochem J, 1997, 321 (Pt 1):125-132. |
| [7] | Stone S J, Levin M C, Zhou P, et al. The endoplasmic reticulum enzyme DGAT2 is found in mitochondria associated membranes and has a mitochondrial targeting signal that promotes its association with mitochondria. J Biol Chem,2009, 284(8): 5352-5361. |
| [8] | Gao X, Ge L, Shao J, et al. Tudor-SN interacts with and co-localizes with G3BP in stress granules under stress conditions. FEBS Lett, 2010, 584(16):3525-3532. |
| [9] | Dash A B, Orrico F C, Ness S A. The EVES motif mediates both intermolecular and intramolecular regulation of c-Myb. Genes Dev, 1996,10(15): 1858-1869. |
| [10] | Yang J, Aittomaki S, Pesu M, et al. Identification of p100 as a coactivator for STAT6 that bridges STAT6 with RNA polymerase Ⅱ. EMBO J, 2002, 21(18):4950-4958. |
| [11] | Tsuchiya N,Ochiai M,Nakashima K,et al. SND1,a component of RNA-induced silencing complex,is up-regulated in human colon cancers and implicated in early stage colon carcinogenesis. Cancer Res, 2007,67(19):9568-9576. |
| [12] | Chiosea S,Jelezcova E, Chandran U, et al. Overexpression of Dicer in precursor lesions of lung adenocarcinoma. Cancer Res, 2007, 67(5):2345-2350. |
| [13] | Brito G C,Fachel A A, Vettore A L,et al. Identification of protein-coding and intronic noncoding RNAs down-regulated in clear cell renal carcinoma.Mol Carcinog,2008,47(10):757-767. |
| [14] | Kuruma H,Kamata Y, Takahashi H, et al. Staphylococcal nuclease domain containing protein 1 as a potential tissue marker for prostate cancer.Am J Pathol,2009,174(6):2044-2050. |
| [15] | Ho J,Kong J W, Choong L Y,et al. Novel breast cancer metastasis-associated proteins. J Proteome Res, 2009,8(2):583-594. |
| [16] | Blanco M A, Aleckovic M, Hua Y,et al. Identification of Staphylococcal nuclease domain-containing 1 (SND1) as a metadherin-interacting protein with metastasis promoting functions. J Biol Chem, 2011,286(22):19982-19992. |
| [17] | Lin Y, Xin L, Kang C, et al. SND1 acts downstream of TGFβ1 and upstream of Smurf1 to promote breast cancer metastasis. Cancer Res,2015, 75(7):1275-1286. |
| [18] | Duan Z, Zhao X, Fu X, et al. Tudor-SN, a novel coactivator of peroxisome proliferator-activated receptor gamma protein, is essential for adipogenesis. J Biol Chem, 2014, 289(12): 8364-8374. |
 2016, Vol. 36
2016, Vol. 36




