文章信息
- 刘盼娆, 周雪晨, 朱雪蛟, 白娟, 王先炜, 姜平
- LIU Pan-rao, ZHOU Xue-chen, ZHU Xue-jiao, BAI Juan, WANG Xian-wei, JIANG Ping
- 猪圆环病毒2型Cap蛋白在大肠杆菌中的可溶性表达及在小鼠体内免疫特性研究
- The Soluble Expression of Porcine Circovirus Type 2 Cap Gene in Escherichia coli and Its Immunogenicity in Mice
- 中国生物工程杂志, 2016, 36(4): 50-56
- China Biotechnology, 2016, 36(4): 50-56
- http://dx.doi.org/10.13523/j.cb.20160408
-
文章历史
- 收稿日期: 2015-10-12
- 修回日期: 2015-12-12
猪圆环病毒2型(PCV2)是断奶仔猪多系统衰竭综合征(PMWS)的重要病原体,它的存在和流行给世界养猪业造成了巨大损失[1, 2, 3]。PCV2属于圆环病毒科圆环病毒属,为无囊膜单股环状DNA病毒,是目前发现的最小的动物病毒。PCV2基因组全长为1 767 bp或1 768 bp,含有11个开放阅读框(ORF)[4, 5],其中ORF1编码Rep和Rep′蛋白,ORF2编码衣壳(Cap)蛋白。Cap蛋白具有病毒的主要抗原表位,是PCV2基因工程疫苗的重要靶抗原[6]。
大肠杆菌表达系统已经广泛应用于外源基因的表达[7],但该系统表达Cap基因效力不高,并且多以包涵体形式表达。Trundova等[8]通过删除核定位序列(NLS)提高了该基因在大肠杆菌中的表达效率,有报道[9, 10]指出采用添加融合谷胱甘肽-S-转移酶或麦芽糖结合蛋白基因序列也达到了类似效果。Bucarey等[11]将ORF2基因密码子改造为酿酒酵母偏爱的密码子,获得的Cap蛋白不仅产量提高,而且还能够自我组装形成病毒样颗粒。
细胞穿膜肽(cell-penetrating peptides,CPPs)是一类能携带大分子物质进入细胞的短肽,其穿膜效果较好且不会产生细胞膜永久性损伤,毒性也较低。MPG是CPPs中的一种,1997年首次由Morris等[12]人工设计并合成的细胞穿膜肽,含27个氨基酸。其序列是G-A-L-F-L-G-F-L-G-A-A-G-S-T-M-G-A-W-S-Q-P-K-K-K-R-K-V,其中1~17个氨基酸残基来自人免疫缺陷病毒(HIV) gp41蛋白的融合蛋白结构域,W-S-Q-P为连接结构,21~27个氨基酸残基来自于SV40 T抗原的NLS区域。其碱基序列为GGTGCTCTGTTCCTGGGCTTCCTGGGTGCAGCGGGTTCCACGATGGGTGCCTGGTCGCAGCCGAAAAAGAAACGCAAAGTT。可有效提高包括质粒DNA、寡核苷酸、短干扰RNA(siRNA)、多肽核苷酸(PNA)、蛋白和多肽在内的生物分子的细胞间转移[13, 14, 15]。朱琳等[16]将 MPG的NLS 区域中一个氨基酸进行突变,命名为MPG△NLS,并设计了促黄体激素释放激素(LHRH )和 MPG△NLS的融合多肽,有利于其携带的 siRNA定位于细胞质中大量释放。
本研究将ORF2基因密码子改造为大肠杆菌偏爱的密码子作为目的基因,或将MPG与ORF2基因5′端序列融合,利用大肠杆菌表达系统获得可溶性表达,并证明其具有较好免疫保护作用,为PCV2亚单位疫苗研制奠定了基础。
1 材料与方法 1.1 试剂与材料pET28a载体、大肠杆菌DH5α、大肠杆菌BL21(DE3)均由本实验室保存;PCV2 SH株由本实验室分离鉴定并保存;PCV2单克隆抗体3E5由本实验室制备;限制性内切酶、T4 DNA 连接酶购自诺唯赞生物公司;异丙基硫代-β-D-半乳糖苷(IPTG)购于大连宝生物工程有限公司;羊抗小鼠IgG-HRP购自武汉博士德生物工程公司;佐剂ISA206、ISA15A和GEL01由法国SEPPIC公司生产提供;其他常规试剂均为国产或进口分析纯。
1.2 目的基因的扩增与克隆根据PCV2 SH毒株(GenBank: AY686763.1)的序列,采用在线的生物分析软件Codon Adaptation Tool(http://www.jcat.de/),将Cap基因密码子优化为大肠杆菌偏爱的密码子,同时编码氨基酸不变,优化后的基因由南京金斯瑞生物科技有限公司合成,构建成重组质粒p-mCap。密码子优化前后的碱基序列如图 1所示。根据mCap基因序列,运用Primer Premier 5.0软件设计引物(表 1)。

|
| 图 1 ORF2密码子优化前后序列比对 Fig. 1 Alignment of optimized sequence and the original sequence |
| Target gene | Primer sequence(5′-3′) | Size(bp) |
| mCap | ATAGGATCCATGACCTACCC (BamH I) | 717bp |
| ATACTCGAGTTTCGGATTCAGCGGCGGATCTTTC(XhoI) | ||
| MPG-Cap△10 | F1:5′-GCCTGGTCGCAGCCGAAAAAGAAACGCAAAGTTCGAAGACACCGCCCCCGCAGCCA -3′ | |
| F2:5′-CCTGGGTGCAGCGGGTTCCACGATGGGTGCCTGGTCGCAGCCGAAAAAGAAACGCA-3′ | 753bp | |
| F3:5′-ATAGGATCCGGTGCTCTGTTCCTGGGCTTCCTGGGTGCAGCGGGTTCCACGATGGGT-3′(BamH I) | ||
| R: 5′-ATCCTCGAGTCACTTAGGGTTAAGTGGGG-3′(XhoI) |
采用PCR方法扩增目的基因片段mCap和MPG-Cap△10。PCR反应体系25 μl,含p-mCap模板1 μl,上、下游引物各1 μl,PCR Mix Buffer 12.5 μl。扩增目的mCap时,以p-mCap为模板,PCR反应条件为:94℃ 5 min; 94℃ 30 s; 54℃ 30 s; 72℃ 45 s; 35个循环;72℃ 10 min。MPG-Cap△10融合蛋白基因构建方法是:分三次PCR方法将MPG基因融合至Cap基因N端,最终获得含有全长MPG的Cap序列。三次PCR采用的引物依次为F1和R,F2和R,F3和R,第一次PCR以PCV2 DNA为模板,之后每一次PCR扩增产物经切胶纯化后作为下一次PCR的模板。PCR反应条件为:94℃ 5 min; 94℃ 30 s; 57℃ 30 s; 72℃ 45 s; 35个循环;72℃ 10 min。
PCR产物于1%琼脂糖凝胶电泳鉴定,克隆至表达载体pET28a的BamH I和Xho I位点,获得的重组质粒经酶切鉴定后送金斯瑞生物科技有限公司测序。将所构建成功的重组质粒分别命名为pET28a-mCap和pET28a-MrCap。
1.3 目的基因的表达与纯化将鉴定正确的重组质粒pET28a-mCap、pET28a-MrCap分别转化至大肠杆菌BL21(DE3),待菌液OD600达到0.8~1.0左右时,加入终浓度为1.0 mmol/L的IPTG,前者37℃继续振摇培养6 h,后者28℃振摇培养过夜(优化获得的表达条件)。离心收集菌体,PBS溶解后,超声裂解至菌液澄清,离心收集上清。采用饱和硫酸铵方法纯化。并进行SDS-PAGE和Western blot分析,其中一抗采用PCV2单克隆抗体3E5,二抗为HRP标记的山羊抗小鼠IgG。
1.4 疫苗的制备分别将饱和硫酸铵方法纯化后的28a-mCap和MrCap重组蛋白分别作为抗原,按照一定的体积比例配制不同的疫苗:(1)ISA206佐剂:抗原=1∶1;(2)GEL01佐剂:抗原=3∶10;(3)ISA15A佐剂:抗原=3∶10。终浓度均为0.5 mg/ml,共6种待测候选疫苗,即28a-mCap+ISA206、28a-mCap+15A、28a-mCap+GEL、MrCap+ISA206、MrCap+15A和MrCap+GEL。
1.5 小鼠免疫保护试验取70只6~8周龄雌性清洁级ICR小鼠(购自上海实验动物中心),随机分为7组,每组10只。其中第1~6组分别免疫上述制备的6种疫苗,背部皮下多点注射0.2 ml/只,第7组为空白对照,注射等量PBS。首次免疫后21 d每组取5只小鼠尾尖采血,测定其ELISA抗体水平;并进行二次免疫,每只皮下注射各疫苗0.2 ml,二免后21 d小鼠眼球采血,测量ELISA抗体和中和抗体水平,并无菌取脾分离脾淋巴细胞进行淋巴细胞转化试验。同时将每组剩余的5只小鼠腹腔接种PCV2-SH株病毒液(105.0 TCID50/ml)0.5 ml。攻毒后21 d,将每组的5只小鼠眼球采血,分离血清,同时无菌摘取小鼠脾脏,用荧光定量PCR方法测定 PCV2含量。
1.5.1 ELISA抗体检测按参考文献[17]的方法测定各组免疫鼠血清的抗体水平。检测孔与阴性对照孔OD450值比率大于或等于2.1的最高稀释度的倒数为该血清的抗体效价。
1.5.2 中和抗体检测将不同稀释度的已灭活血清与200 TCID50/0.1ml PCV2等体积混合,37℃温箱作用1 h。接种含PK-15细胞单层的96孔板中,100 μl/孔,每个稀释度设置3个重复,同时设置阴性血清对照、病毒PCV2阳性对照和正常细胞空白对照。37℃ 5% CO2温箱培养3 d后用间接免疫荧光法(IFA)测定血清中和效价,以能够减少50%荧光的血清最大稀释度作为待检血清的中和效价。
1.5.3 淋巴细胞增殖试验无菌取小鼠脾脏,分离淋巴细胞,将细胞浓度调整为5×106 /ml,铺96孔细胞板,100 μl/孔,每只动物12孔,分别为以PCV2病毒作为刺激抗原的试验组,以ConA作为刺激抗原的阳性对照组(终浓度为10 μg/ml),和不处理细胞组,每组设4个重复;37℃温箱培养66 h,每孔加入20 μl MTT(浓度为5 mg/ml),37℃温箱继续培养6 h;弃掉96孔中的营养液,加入DMSO(100 μl/孔),振荡融解紫色结晶,测定OD570的值,计算刺激指数(SI=刺激孔的OD值/未刺激孔的OD值)。
1.5.4 Real-time PCR 定量检测 PCV2取0.2 g脾脏,使用Viral DNA Kit(OMEGA公司)提取病毒DNA,具体操作按照说明书进行。实时PCR引物参照冯志新等[18]的方法,序列如下,F:5′-CCAGGAGGGCGTTCTGACT-3′,R:5′-CGTTACCGCTGGAGAAGGAA-3′,TaqMan-probe: 5′FAM-AATGGCATCTTCAACACCCGCCTC -TARAM 3′。反应体系为25 μl:DNA 1 μl,10×TaqMan Universal PCR Master Mix 2.5 μl,引物 F/R 浓度均为400 nmol/L,探针浓度为100 nmol/L。置ABI7300荧光定量 PCR 仪上进行,反应条件为:50℃ 2 min;95℃ 10 min;95℃ 15 s,60℃ 1 min;40 个循环。同时设定不加 DNA的阴性对照。首先以包含PCV2基因组的质粒pT-SH作为模板,10倍比稀释后用于PCR,制作标准曲线。然后以提取的样品DNA进行PCR,得到对应的Ct值后,根据标准曲线方程计算出样品中的PCV2核酸拷贝数。
1.6 数据统计分析应用 GraphPad PRISM(V5.02,www.graphpad.com)软件,对数据统计分析,比较各组差异,P<0.05 表示差异显著。(*表示P<0.05)
2 结 果 2.1 目的基因克隆、表达与目的蛋白纯化构建重组质粒pET28a-mCap和pET28a-MrCap,目的基因测序结果正确。将构建的重组质粒转入BL21(DE3)中,通过IPTG诱导表达后,经SDS-PAGE分析,表达的重组蛋白以包涵体和上清两种形式存在,并且在上清中含量较高。采用硫酸铵方法对重组菌的裂解物上清进行纯化,结果显示两种重组蛋白纯度均有一定提高。Western blot结果显示,两种重组蛋白均可以和PCV2单克隆抗体反应,有清晰的特异性条带出现,表现出良好的抗原反应性(图 2)。
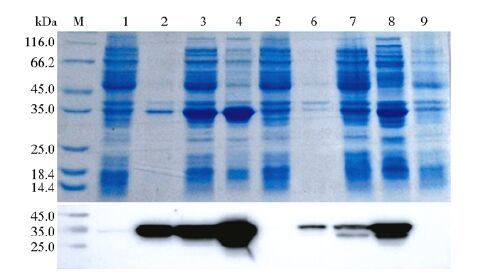
|
| 图 2 表达的重组蛋白SDS-PAGE及Western blot分析 Fig. 2 Analyses of the recombinant protein by SDS-PAGE and Western blot M:Protein Marker;1:BL21/pET28a-mCap without induction;2~3:Lysate of BL21/pET28a-mCap induced,inclusion body and supernatant,respectively;4:Purified BL21-pET28a-mCap;5:BL21/ pET28a-MrCap without induction;6~7:Lysate of BL21/ pET28a-MrCap induced,inclusion body and supernatant,respectively;8:Purified MrCap;9:Lysate of BL21/pET28a induced |
取首次免疫后21 d和42 d小鼠血清进行PCV2间接ELISA抗体检测,结果见图 3,首次免疫后21 d,各免疫组均可产生不同程度的ELISA抗体,且以MrCap+GEL组抗体效价最高,显著高于28a-mCap+15A组和MrCap+15A组(P<0.05),抗体效价为1∶1 200。加强免疫后各免疫组抗体水平持续升高,其中以含GEL的免疫组抗体效价最高,15A组较低。阴性对照组未检测到 PCV2 特异性抗体。
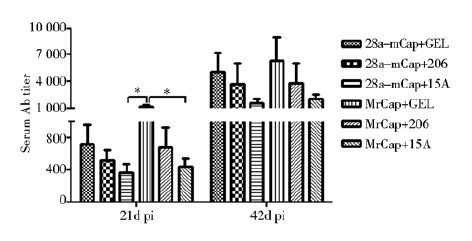
|
| 图 3 免疫后小鼠ELISA抗体效价 Fig. 3 The ELISA antibody titers in vaccinated mice * P<0.05 |
加强免疫后21 d的血清中和抗体效价如图 4所示,与对照组相比,各免疫组均可产生特异性中和抗体,其中GEL组抗体效价较高,在1∶20~1∶30之间,但与其他组差异不显著(P>0.05)。
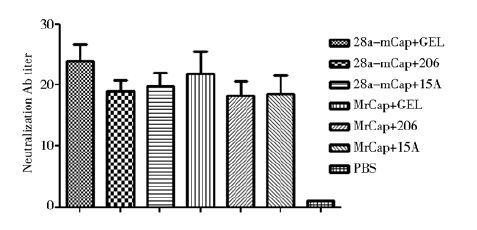
|
| 图 4 二次免疫后小鼠中和抗体效价 Fig. 4 The anti-PCV2 neutralization antibody titers in vaccinated mice |
淋巴细胞转化试验的结果见图 5,与阴性对照组相比,各试验组小鼠均可以检测到较为明显的淋巴细胞增殖反应,其中MrCap+15A组较高,各组之间差异不显著(P>0.05)。
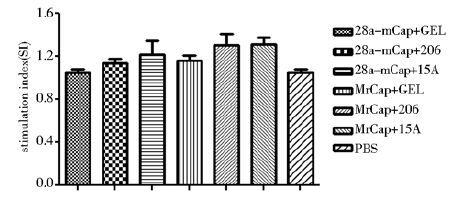
|
| 图 5 小鼠免疫后淋巴细胞增殖反应 Fig. 5 Lymphocyte proliferative responses in vaccinated mice |
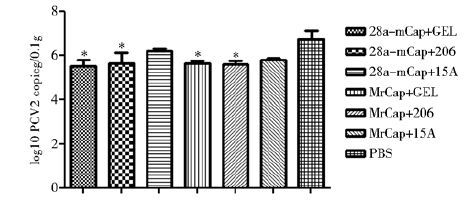
攻毒后21 d检测小鼠脾脏中的 PCV2核酸含量,结果见图 6,除两种重组蛋白与15A混合疫苗组外,其他各免疫组PCV2 含量都显著低于非免疫对照组(P<0.05),表明两种重组蛋白与佐剂GEL和206制成的疫苗可诱导产生良好的免疫保护效力。
|
| 图 6 定量 PCR 检测脾脏PCV2含量 Fig. 6 Detection of virus titers in mice spleen by Quantitative Real-time PCR * P<0.05 |
疫苗免疫是PMWS的主要防控措施。近年来,国内外研究的PCV2疫苗包括弱毒疫苗、灭活疫苗、亚单位疫苗、活载体疫苗和DNA疫苗等,其中,亚单位疫苗具有不含病毒核酸,能够避免病原扩散和有利于制备基因工程重组疫苗等优点。目前,基于杆状病毒表达Cap蛋白的亚单位疫苗注册上市[19],因为该蛋白可实现蛋白的体外表达及正确折叠,并能自我组装形成VLP,具有较好的免疫效果,但杆状病毒表达系统成本比较昂贵。
大肠杆菌表达系统具有操作简单,表达周期较短,成本低廉等优点,但Cap蛋白 N端含有较多的碱性氨基酸和大肠杆菌稀有密码子,很大程度上限制了其在大肠杆菌中的表达。每种生物对同义密码子的选择都有自己的偏好性。ORF2 NLS中所含丰富的精氨酸,在转运过程中需要大量编码此氨基酸的tRNA,从而限制了Cap蛋白的合成速度,甚至导致蛋白合成的早期终止。研究者们通过对ORF2基因序列进行密码子优化[11],截短NLS[8],插入融合标签[9, 10]等方法,可以实现Cap蛋白的高效、可溶性表达。本研究采用将ORF2基因密码子改造为大肠杆菌偏爱的密码子、或将MPG与Cap蛋白序列融合,构建大肠杆菌重组表达质粒,均成功诱导表达出可溶性且抗原性良好的Cap蛋白,且前者表达量略高于后者,说明密码子的偏好性是影响大肠杆菌表达Cap蛋白的重要因素。
免疫佐剂是影响亚单位疫苗免疫效果的重要因素之一。本研究将纯化后的两种重组蛋白分别与3种商品化佐剂混合,配制6种疫苗,进行小鼠免疫试验,结果显示,各免疫组均能产生特异性的ELISA抗体和中和抗体,其中以GEL01为佐剂的两免疫组抗体水平最高,说明该佐剂比其他两种佐剂能更好地诱发机体的体液免疫应答,但同种佐剂不同抗原之间并无明显差异。攻毒后21 d检测脾脏中的PCV2含量,结果显示,除ISA15A组外,其他各免疫组脾脏中 PCV2含量都显著低于非免疫对照组,表明两种重组蛋白与佐剂GEL01和ISA206制成的疫苗可诱导产生一定程度的免疫保护效力。上述三种佐剂均为商品化佐剂,对不同蛋白免疫佐剂效果存在差异,本研究目的主要是为了获得免疫原性高的可溶性重组Cap蛋白,小鼠实验时没有设定重组蛋白对照组,但并不影响本研究的结果和意义。
综上所述,我们分别采用将Cap基因密码子优化方法和MPG-Cap基因融合的方法,成功构建了大肠杆菌表达质粒,获得了可溶性且抗原性良好的Cap蛋白,为PCV2亚单位疫苗研制奠定了重要基础。
| [1] | Ellis J, Hassard L, Clark E, et al. Isolation of circovirus from lesions of pigs with postweaning multisystemic wasting syndrome. Can Vet J, 1998, 39(1): 44-51. |
| [2] | Opriessnig T, Meng X J, Halbur P G. Porcine circovirus type 2 associated disease: update on current terminology, clinical manifestations, pathogenesis, diagnosis, and intervention strategies. J Vet Diagn Invest, 2007, 19(6): 591-615. |
| [3] | Baekbo P, Kristensen C S, Larsen L E. Porcine circovirus diseases: a review of PMWS.Transbound Emerg Dis,2012, 59 (Suppl. 1):60-67. |
| [4] | Hamel A L, Lin L L, Nayar G P. Nucleotide sequence of porcine circovirus associated with postweaning multisystemic wasting syndrome in pigs. J Virol, 1998, 72(6): 5262-5267. |
| [5] | Lv Q Z, Guo K K, Han X, et al. Identification of putative ORF5 protein of porcine circovirus type 2 and functional analysis of GFP-fused ORF5 protein. PLoS One,2015, 10(6): e0127859. |
| [6] | Zhang H W, Qian P, Liu L F, et al. Virus-like particles of chimeric recombinant porcine circovirus type 2 as antigen vehicle carrying foreign epitopes. Viruses-Basel, 2014, 6(12): 4839-4855. |
| [7] | 解庭波. 大肠杆菌表达系统的研究进展. 长江大学学报, 2008,5(3):77-82 Xie T B. The research progress of E.coli expression system . Journal of Yangze University(Natural Science Edition), 2008,5(3):77-82. |
| [8] | Trundova M, Celer V. Expression of porcine circovirus 2 ORF2 gene requires codon optimized E. coli cells. Virus Genes, 2007, 34(2):199-204. |
| [9] | Wu P C, Lin W L, Wu C M, et al. Characterization of porcine circovirus type 2 (PCV2) capsid particle assembly and its application to virus-like particle vaccine development. Appl Microbiol Biotechnol, 2012, 95(6): 1501-1507. |
| [10] | Liu Q, Willson P, Attoh-Poku S, et al. Bacterial expression of an immunologically reactive PCV2 ORF2 fusion protein. Protein Expression and Purification, 2001, 21(1): 115-120. |
| [11] | Bucarey S A, Noriega J, Reyes P, et al. The optimized capsid gene of porcine circovirus type 2 expressed in yeast forms virus-like particles and elicits antibody responses in mice fed with recombinant yeast extracts. Vaccine, 2009, 27(42): 5781-5790. |
| [12] | Morris M C, Vidal P, Chaloin L, et al. A new peptide vector for efficient delivery of oligonucleotides into mammalian cells. Nucleic Acids Research, 1997,25(14): 2730-2736. |
| [13] | Jä rver P, Langel U. The use of cell-penetrating peptides as a tool for gene regulation. Drug Discov Today, 2004,9(9):395-402. |
| [14] | Moschos S A, Jones S W, Perry M M, et al. Lung delivery studies using siRNA conjugated to TAT(48-60) and penetratin reveal peptide induced reduction in gene expression and induction of innate immunity. Bioconjugate Chemistry, 2007, 18(5): 1450-1459. |
| [15] | Joliot A. Transduction peptides within naturally occurring proteins. Sci Stke, 2005, 2005(313):54. |
| [16] | 朱琳,刘兰霞,宋丽萍,等. LHRH-MPG△NLS/siRNA纳米复合物的制备及稳定性观察. 生物医学工程与临床,2012,16(3): 283-285. Zhu L, Liu L X, Song L P, et.al. Study on the method for preparing stable LHRH-MPG△NLS/siRNA nanoparticles. Biomedical Engineering and Clinical Medicine,2012,16(3): 283-285. |
| [17] | 吕慧,王先炜,李文良,等. 猪圆环病毒2型重组Cap蛋白间接ELISA抗体检测方法的建立. 畜牧与兽医,2009,41(11): 6-11. Lv H, Wang X W, Li W L, et.al. Development of an indirect ELISA for detecting antibody to porcine circovirus 2 using recombinant Cap protein. Animal Husbandry & Veterinary Medicine, 2009,41(11):6-11. |
| [18] | 冯志新,姜平,王先炜,等.猪圆环病毒 2 型 TaqMan 实时 PCR 检测方法的建立. 中国病毒学,2006, 1(4): 371-374. Feng Z X, Jiang P, Wang X W, et al. Development of a real-time PCR method for detection of type 2 porcine circovirus. Virology Sinica, 2006,21(4):371-374. |
| [19] | Beach N M, Meng X J. Efficacy and future prospects of commercially available and experimental vaccines against porcine circovirus type 2 (PCV2). Virus Res, 2012, 164(1-2): 33-42. |
 2016, Vol. 36
2016, Vol. 36




