文章信息
- 施慧琳, 孙靖淳, 张荣凯, 高大启, 王泽建, 郭美锦, 周礼勤, 庄英萍
- SHI Hui-lin, SUN Jing-chun, ZHANG Rong-kai, GAO Da-qi, WANG Ze-jian, GUO Mei-jin, ZHOU Li-qin, ZHUANG Ying-ping
- 电子嗅在线反馈控制毕赤酵母糖化酶发酵过程中甲醇浓度新方法的应用
- Application of the Electronic Nose on the Online Feedback Control of Methanol Concentration during Glucoamylase Fermentation Optimization by Pichia pastoris
- 中国生物工程杂志, 2016, 36(3): 68-76
- China Biotechnology, 2016, 36(3): 68-76
- http://dx.doi.org/DOI:10.13523/j.cb.20160310
-
文章历史
- 收稿日期: 2015-10-26
- 修回日期: 2016-01-08
2. 广西科学院生物研究所 南宁 530007
2. Biology Institute, Guang Xi Academy of Sciences, Nanning 530007, China
糖化酶广泛应用于食品、纺织、药品和生物发酵等行业,淀粉糖、乙醇生产、食品加工等加工行业,是我国市场占有量较大的酶制剂产品,现在主要是利用黑曲霉、米曲霉等丝状真菌进行发酵生产。随着发酵废菌渣处理难、底物葡萄糖消耗成本较高等一系列问题的出现,使得利用黑曲霉进行糖化酶发酵的生产成本较高。利用菌体可作为饲料蛋白质的毕赤酵母进行糖化酶合成酶基因的高效表达、利用化工副产物甲醇作为底物的糖化酶发酵,将逐渐成为工业糖化酶发酵生产的重要途径。
毕赤酵母表达系统是近十年发展起来的真核表达体系[1],在表达产物的加工、外分秘、翻译后修饰及糖基化修饰等方面有明显的优势,目前已广泛用于外源蛋白的表达[2]。其表达的蛋白质包括各种抗原、膜蛋白、抗体、调节蛋白和酶制剂等,尤其是在工业酶制剂糖化酶的表达和研究中的应用[3],近年来成为研究的热点。通过RNA提取和RT-PCR技术从黑曲霉生产菌种提取糖化酶合成基因,然后与表达载体连接后转化到巴斯德毕赤酵母中,通过甲醇为底物进行诱导表达。毕赤酵母基因工程菌株用于发酵来生产目的代谢物的过程往往分为两个阶段:第一阶段为利用甘油或葡萄糖为碳源的菌体快速生长繁殖阶段,该阶段往往将底物的浓度或底物补加速率的控制与比生长速率及生理代谢参数相结合进行设计,保证充足的供氧,或通过底物补加速率控制保证一定的溶氧水平来抑制各种有机酸等小分子代谢物的积累;第二阶段为在碳源限制的情况下,开始以甲醇作为碳源和能量来源用于菌体的生长和诱导醇氧化酶(AOX)启动子启动进行目的蛋白的表达合成。AOX基因的启动子具有强诱导性和强启动性[4],是调控机制最严格的启动子之一,用甲醇可严格调控源蛋白的表达;甲醇浓度过低,细胞处于饥饿状态,没有足够的能量用于菌体的生长代谢及合成,目标产物合成量较低;但过高浓度的甲醇抑制细胞的生长和产物的表达,因此通过合适的策略控制甲醇的流加量是提高外源蛋白表达量的关键。毕赤酵母表达外源蛋白期间,甲醇一方面作为碳源,构成细胞骨架用于细胞生长;另一方面作为能源物质用于菌体的生长、维持代谢及外源蛋白的表达[5]。由于菌体生长需要大量能量,与产物表达竞争能量,导致用于产物表达的能量不足,使产量偏低。提高能量供应的最简单方法是根据培养过程设备的供氧能力和菌体的生理代谢参数合理控制甲醇浓度[6]。尤其是为了更有效地提高产物表达量,往往采用酵母的高密度发酵培养,在这种情况下更需要通过一定的甲醇补加速率来维持菌体的氧消耗速率以提供足够的能量,同时还要维持一定的甲醇浓度来有效促进启动子的启动表达。不同目的蛋白表达基因工程毕赤酵母菌株的构建模式不同往往对甲醇的消耗速率和维持浓度的要求也大不相同。发酵过程中甲醇的浓度常用气象色谱离线检测,然后根据测定值进行补加速率的调整,该方法耗时较长,同时不能对动态的发酵过程进行实时监控。有报道利用在线溶氧浓度(DO)来控制甲醇补加速率,在一定程度上促进了合成表达的效率,但溶氧的维持往往反映了底物甲醇供给量的限制或者是甲醇浓度过高对菌体的生长产生一定的抑制作用,在高密度的快速率甲醇补加模式下,往往会造成甲醇补加操作的误判。
毕赤酵母诱导表达发酵过程中,甲醇浓度的变化是菌体消耗速率和甲醇补加速率共同作用的结果,该过程是一个动态变化过程,供氧条件、营养条件等的变化都会影响发酵液中甲醇浓度的动态平衡,因此培养过程中选择一个快速准确的检测方法,对提升毕赤酵母表达过程工艺条件控制有着重要的作用[3]。本研究建立了利用电子嗅传感仪进行毕赤酵母发酵表达糖化酶过程中甲醇浓度的在线浓度测定方法,并用于指导发酵过程中甲醇补加速率的在线控制。
1 材料与方法 1.1 材 料 1.1.1 菌株产糖化酶的毕赤酵母工程构建菌株(Pichia pastoris GX2)由广西科学院生物研究所保藏,具有Mut+表型。
1.1.2 培养基K2SO4 9.1g/L、CaSO4 0.46g/L、MgSO4·7H2O 7.5g/L、(NH4)2SO4 7g/L、PTM1 12ml/L、0.2mol/L K2HPO4/KH2PO4缓冲液(缓冲液pH 5.5)。
PTM1: CuSO4·5H2O 6g/L、KI 0.08g/L、MnSO4·H2O 3g/L、Na2MoO4·2H2O 0.2g/L、H3BO3 0.02g/L、ZnSO4·7H2O 20g/L、FeSO4·7H2O 65g/L、CoCl2·6H2O 0.5g/L、生物素 0.2g/L、H2SO4 5ml/L。
补料分批培养基: K2SO4 18.2g/L、CaSO4 0.93g/L、MgSO4·7H2O 14.9g/L、85% H3PO4 26.8ml/L、KOH 4.13g/L、甘油 40g/L,灭菌后用25% NH3·H2O调至所需的pH。
1.2 实验方法 1.2.1 种子培养一级种子培养:挑取单菌落接到装有25ml种子培养基的250ml摇瓶中,30℃、220r/min条件下摇床培养过夜。二级种子培养:取5ml一级种子加入装有50ml的BMGY培养基的500ml摇瓶,29℃、220r/min条件下培养到菌体浓度OD600约为20左右。
1.2.2 50L罐发酵培养按5%接种量将二级种子接种到发酵罐中,温度29℃,通气量1.8vvm,用25%的氨水调节pH。随着发酵过程的进行,溶氧逐渐下降,调节空气流量和搅拌转速,维持溶氧水平(DO)不低于30%。当初始培养基中甘油耗尽之后,溶氧回升即可进入甘油补料分批培养阶段,流加50%的甘油来控制溶氧浓度不低于5%,直到达到所需要的菌体密度。甘油分批培养阶段结束后进入碳饥饿3~5h即可进入甲醇诱导阶段,初始甲醇补加速率控制在2g/(L·h)的低速率,启动并进行甲醇消耗代谢,后期根据情况甲醇的电子嗅测量值进行甲醇补加速率控制。尾气测定:发酵过程尾气组分含量氧气和二氧化碳浓度利用过程质谱仪(MAX300-LG,Extrel,USA)进行测定,发酵过程中的摄氧率(OUR)利用软件Biostar计算得到[7]。
1.2.3 分析方法糖化酶酶活力的测定:酶活力使用淀粉葡萄糖苷酶(AGI)表示。一个AGI单位定义为在pH 4.3和温度60℃条件下每分钟从可溶性淀粉水解生成1μmol葡萄糖所需的酶量。50mg标品糖化酶的活力大约2 500AGI。糖化酶酶活量测量:230μl p-硝基苯基- a-D-吡喃葡萄糖苷(AGIsub)试剂(37℃预热5min)与20μl发酵液上清混合,37℃反应20min后加100μl AGIsub试剂,在405nm下测量混合液体吸光度来定量糖化酶活力[8]。
1.2.4 菌体浓度的测定细胞光密度:发酵液经过适当的稀释后,以清水作为对照,在600nm处检测光密度(OD600),OD600=OD读数×稀释倍数
细胞干重:测得OD后,在8 000r/min转速下取5ml发酵液离心10min,弃去上清液后用0.85%生理盐水洗涤3次,离心弃去上清液,于干燥箱内90℃烘箱中烘至恒重得到菌体干重。经过最小二乘法拟合后得到菌体干重和OD600的关系式为:DCW=0.429OD600+0.492。
1.2.5 气象色谱发酵液中甲醇残留量的测定 [9 ]选用N2作为载气,H2作为检测器的燃气,空气为助燃气,N2流量为15ml/min,H2和空气的流量分别为30ml/min和300ml/min (1∶10),色谱柱温度为180℃,气化室氢火焰温度为100℃,氢火焰温度为180℃。
1.2.6 甘油检测采用甘油三酯酶试剂盒检测[8]。
1.2.7 电子嗅甲醇检测原理电子嗅(华东理工大学研制)的敏感膜材料为金属氧化物半导体SnO2。在接触气体时,涂在陶瓷表面上的SnO2敏感膜电阻随着气体种类和浓度的变化而变化。我们选用了TGS8xx为代表的烧结型气敏传感器和以TGS2xxx的厚膜型气敏传感器共计16组(图 1)。当气敏传感器只与空气接触时,敏感膜中处于游离状态的负电子与空气中的氧分子靠电子亲和力结合在一起,形成一个势垒,导致气敏传感器电阻增加。当气敏传感器与被测气体接触时,在工作电源电压保持不变的前提下,与气敏传感器串联的负载电阻两端的电压就相应地发生变化,这就是所谓的气敏传感器对气味的响应,直接以0~10V电压信号输出[10]。
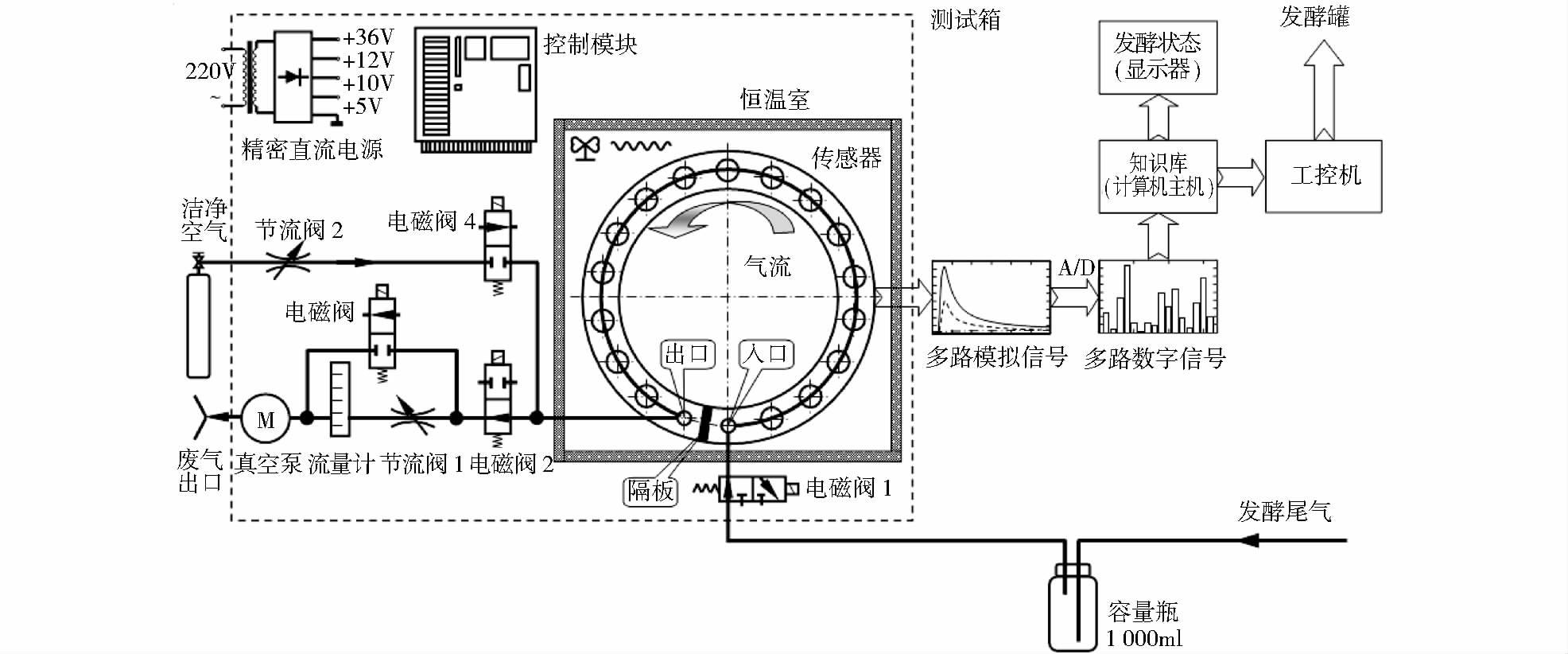 |
| 图 1 发酵过程在线检测与分析的电子嗅工作原理框图 Fig. 1 The working principle of electronic nose on the on-line detection and analysis of metabolites during fermentation process |
首先我们通过发酵罐中甲醇溶液尾气对电子嗅的响应强度变化,选择了与溶液浓度有较好对应关系的感应电极,然后考察不同操作条件对测量精度的影响,在此基础上建立溶液中甲醇浓度与电子嗅响应值之间的关系曲线,用于发酵过程中甲醇底物浓度的快速在线检测,指导甲醇底物的在线补加速率。
2 结果与讨论 2.1 电子嗅传感器工作原理图在毕赤酵母甲醇诱导表达系统研究中,大部分研究都是利用离线取样后采用气相色谱的方法进行发酵液中甲醇浓度的离线测定,根据测得的甲醇浓度来调节甲醇补加量或补加速率,这种方法间隔周期较长,而且存在样品处理过行程中甲醇的挥发等损失,造成测量误差较大。较长的样品检测时间间隔往往会影响对发酵过程残留甲醇浓度的实时控制,尤其是在供氧条件改变、补加的营养物质发生变化、操作条件发生变化等的情况下菌体的甲醇代谢活力的变化往往在短时间内会引起甲醇的耗竭与过量积累,从而影响菌体的比生长速率和目的产物的合成表达。还有学者利用渗透膜将发酵清液透出,然后通过甲醇测定传感器进行测定,这种方法与气象色谱离线测定相比有很大的优越性,实现了过程中的实时测定并起到了积极的作用,然而由于该方法对传感膜片造成的污染性较大,同时由于发酵罐中流场的混合造成的浓度梯度场差异,以及补加甲醇的密度小于发酵液等,使得在其取样点测得的数据往往存在较大波动,不能对反应发酵液中总体的甲醇浓度进行全面系统的评估。我们建立了利用电子嗅传感仪进行培养液中甲醇浓度在线测定和控制的新方法。
为了能够系统并直接进行发酵液中甲醇浓度的在线测定,我们在发酵罐中配制不同浓度的甲醇标准溶液,在模拟正常发酵搅拌、通气等的情况下,将尾气直接进行甲醇含量的测定,测得的甲醇浓度用于反馈控制甲醇补料泵的流加速率,来调节发酵液中甲醇的残留浓度。操作示意图见图 2(a)。在发酵罐通气比为1vvm、转速为350r/min、温度为35℃、发酵液中甲醇浓度为150r/min的情况下,进行电子嗅16个传感膜元件对发酵尾气的响应值的变化分析,将16个传感膜的响应值利用Matlab平面等高环形分布统计,得到16个传感器响应值对应的统计雷达曲线图如图 2(b)所示,从图谱中可以看出,部分传感膜片对甲醇浓度有较敏感的响应。
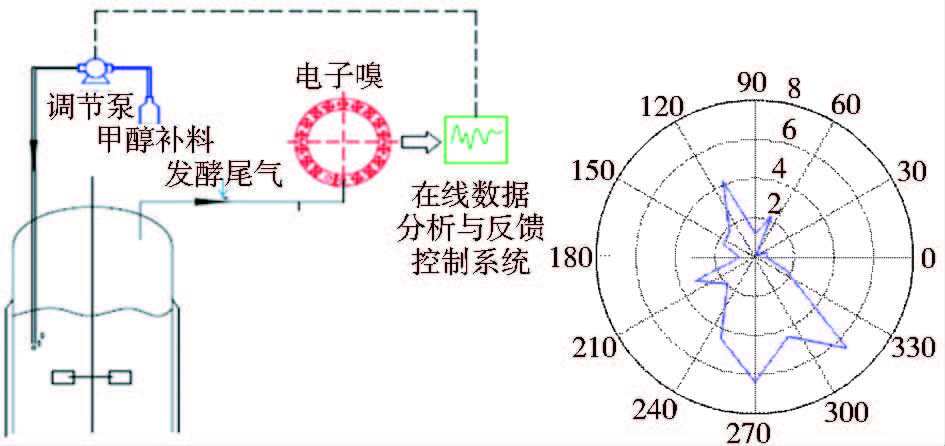 |
| 图 2 发酵过程电子嗅在线甲醇监控示意图与甲醇的响应雷达图 Fig. 2 The sketch map of electronic nose for online methanol feedback control and the radar map of methanol on the electronic nose |
首先通过发酵罐中不同甲醇溶液对应的电子嗅尾气测定数据(图 3),选择在正常发酵过程甲醇残留浓度范围内有较好相应关系的敏感膜传感器型号。通道14号传感膜在1 000ppm甲醇溶液浓度范围内有很好的响应关系,但甲醇溶液的可测量浓度范围较窄。综合分析通道13和15对应的传感膜元件TGS2602和TGS813对甲醇的响应较为敏感,响应值范围较大,测量范围较宽,对3 000ppm以内的甲醇水溶液浓度有较好的响应关系。
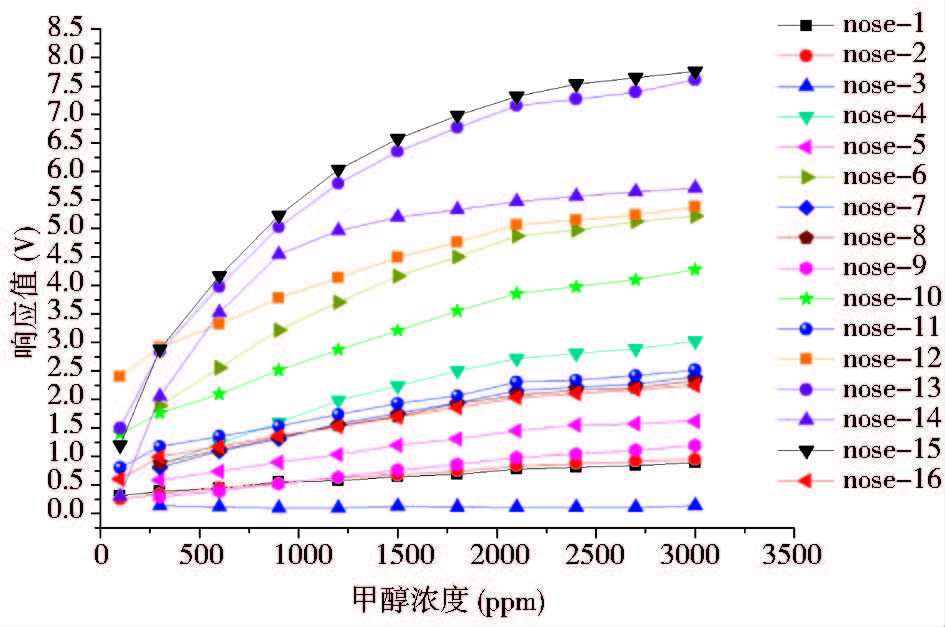 |
| 图 3 电子嗅各传感膜敏感元件在不同甲醇溶液浓度下的响应变化曲线 Fig. 3 The response of various electronic nose sensors under different n-propanol concentrations |
| 传感膜 | 拟合曲线 | 相关性R2 | 响应值范围(V) | 精确范围(ppm) |
| 1 | 响应不敏感 | — | — | — |
| 2 | 响应不敏感 | — | — | — |
| 3 | 响应不敏感 | — | — | — |
| 4 | y=-2E-07x2+0.001 6x+0.375 2 | 0.998 4 | 0.8~3.0 | 300~2 000 |
| 5 | y=-8E-08x2+0.000 7x+0.367 2 | 0.995 8 | 0.6~1.6 | 300~1 200 |
| 6 | y=-4E-07x2+0.002 7x+1.119 1 | 0.999 3 | 2.0~5.0 | 300~1 500 |
| 7 | y=-1E-07x2+0.001 1x+0.492 2 | 0.997 2 | 0.8~2.3 | 300~1 800 |
| 8 | y=-1E-07x2+0.001x+0.585 3 | 0.997 4 | 0.9~2.2 | 300~2 100 |
| 9 | 响应不敏感 | — | — | — |
| 10 | y=-2E-07x2+0.001 7x+1.227 5 | 0.998 | 1.5~4.2 | 100~2 100 |
| 11 | y=-1E-07x2+0.001x+0.791 8 | 0.991 7 | 1.0~2.5 | 100~2 100 |
| 12 | y=-3E-07x2+0.001 9x+2.271 3 | 0.998 1 | 2.5~5.5 | 100~2 100 |
| 13 | y=-9E-07x2+0.004 7x+1.362 | 0.992 6 | 1.5~7.5 | 100~3 000 |
| 14 | y=-1E-06x2+0.004 8x+0.552 6 | 0.944 1 | 2.0~5.5 | 300~1 500 |
| 15 | y=-1E-06x2+0.005 1x+1.185 7 | 0.987 1 | 1.0~8.0 | 100~3 000 |
| 16 | Y=-1E-07x2+0.000 9x+0.614 8 | 0.990 1 | 0.5~2.2 | 300~2 400 |
结合拟合曲线分析,选择在正常发酵过程甲醇残留浓度范围内有较好相应关系的敏感膜传感器型号,要求具有较高的拟合相关性、合适的响应值变化区间,以及较宽的测量范围。从结果来看,通道6、10和12对应的传感膜元件在2 000ppm的甲醇范围内有较好的线性关系,但响应值的区间较小,在应用过程中容易出现较大的误差。而通道13、14、15对应的传感膜元件响应值变化区间比较合适,对100~3 000ppm浓度的甲醇最高响应值可以达到5以上,比起其他通道具有相对较大的响应值变化区间,带来的误差较小。从相关性角度考虑,14号传感膜的R2相对较低,只有0.944 1,主要是由于对14号传感膜来说,甲醇可测浓度范围较窄。对于1 500ppm以上的甲醇浓度,响应值与甲醇浓度相关性较差。综合分析选择13号传感膜(TGS2602)、15号传感膜(TGS813),其对甲醇响应非常敏感,在正常发酵过程甲醇残留浓度范围内有较好对应关系。由于毕赤酵母诱导表达过程中除了甲醇以外,氨水也是对测定影响较大的因素,在进一步的氨水影响测试试验中,发现传感膜元件TGS813在一定程度上受氨水的影响较大,而传感膜元件TGS2602则基本不受氨水的影响,因此本实验采用13号传感膜元件TGS2602进行进一步的稳定性考察实验。
2.3 不同工艺条件对传感膜响应变化的影响在电子嗅发酵过程特定底物或产物的浓度检测过程中,确定最佳的测定范围、响应变化曲线,同时还要考察不同工艺控制条件可能对响应标准曲线的影响,以便进行响应回归计算,得到更加准确的气液含量稳定性关系,提高测量的准确性。由亨利定律[式(1)]得在一定外界条件下气体分压与溶液浓度成正比[11]。
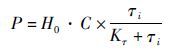 (1)
(1)我们分别研究了发酵操作条件通气量、搅拌转速、压力和温度等条件的改变对传感膜元件TGS2602响应值的影响,测试结果见图 4。通气比为0.5~6vvm时对电子嗅的响应值变化显示当通气比达到5vvm前对电子嗅测定的响应值几乎没有影响,说明在5vvm条件下发酵液中甲醇向气泡中的扩散膜传递速率远远大于传递速率常数,尾气中的饱和甲醇分压几乎不受影响。当达到6vvm时测量偏差为3.7%。转速对响应值的影响曲线[图 4(b)]显示随着转速的增加,电子嗅的响应值略有增加,800r/min情况下的响应值与100r/min时相比仅仅高出了2.8%,说明甲醇的气液相膜的传递速率很大,可以认为转速对响应值的影响可以忽略。温度对甲醇饱和分压的影响较大,尤其是当温度超过40℃以上的情况下亨利常数显著增加,气相中的饱和甲醇分压增加,测定的结果有较大偏差,但低于40℃的情况下,检测的响应值几乎没有变化。本实验还分别向甲醇的水溶液中添加培养基、无甲醇的发酵液、氨水等进行干扰测试,结果表明[图 4(d)],这些因素对测量值的影响非常小,说明利用该传感膜元件能够很好地进行发酵液中甲醇浓度的定性和定量检测。
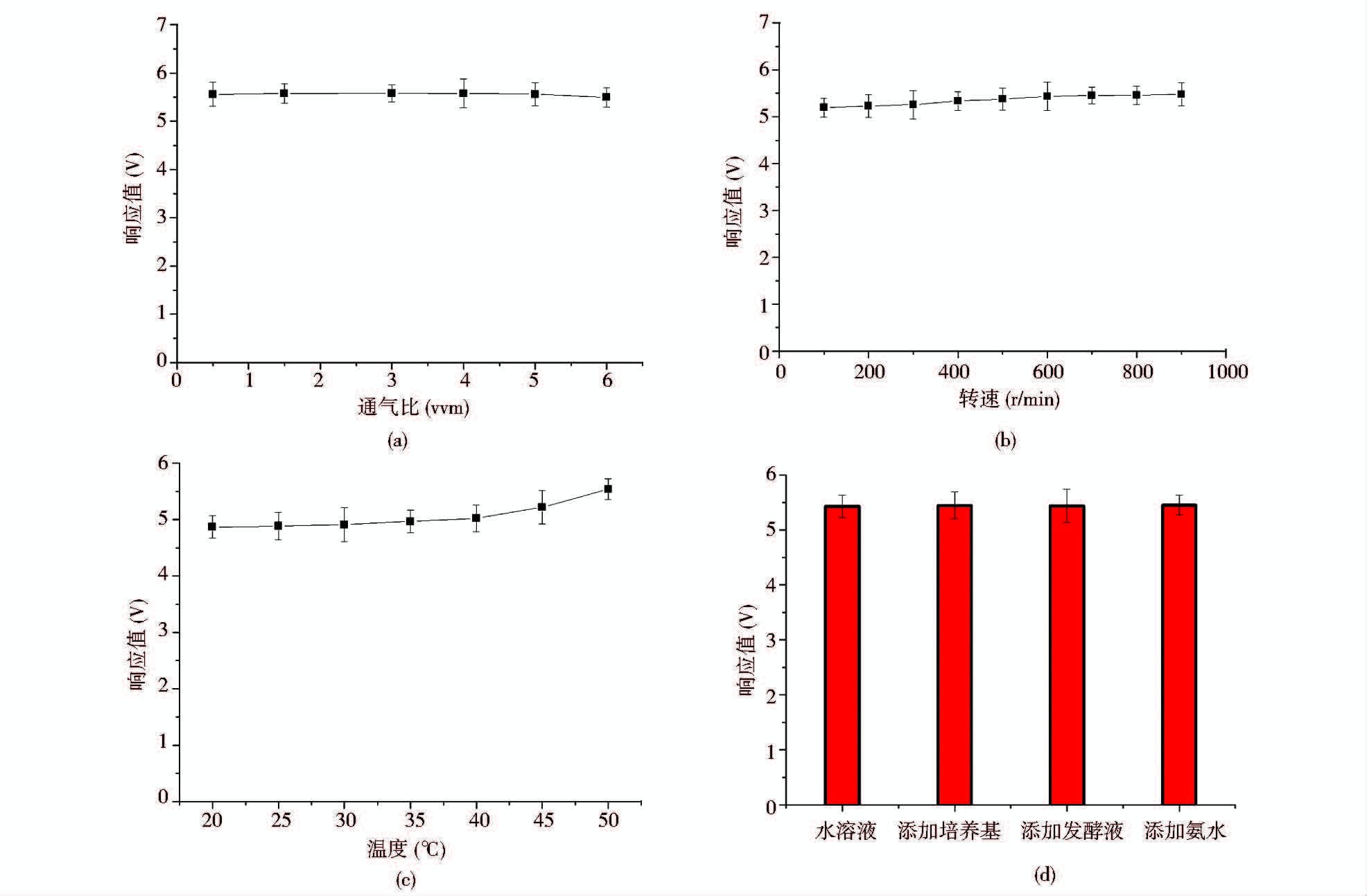 |
| 图 4 不同操作条件对甲醇溶液响应值测量的影响 Fig. 4 The effects of operation conditions on the response of electronic nose with n-propanol concentrations |
在各种响应因素研究的基础上,在发酵罐中温度为32℃、转速为600r/min、通气量为3vvm的条件下,我们建立了溶液中甲醇浓度和电子嗅测量值之间的响应变化曲线,甲醇浓度与电子嗅的响应值之间可以用一元二次方程(Eq. 2)进行表征,相关系数R2达到了0.993 3。该方程可用于甲醇溶液浓度含量的在线检测。
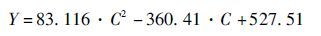 (2)
(2)将发酵过程中的尾气进行电子嗅定点检测甲醇残留浓度,并与该测样点样品的气相色谱测定结果进行对比分析,结果显示(图 5),电子嗅测定方法检测得到的甲醇残留浓度与气相色谱检测的值基本一致,误差在4%以内,可见电子嗅可以用于利用尾气进行毕赤酵母培养过程中甲醇残留浓度快速及准确的在线检测,该检测值可用于甲醇补加速率的在线控制。
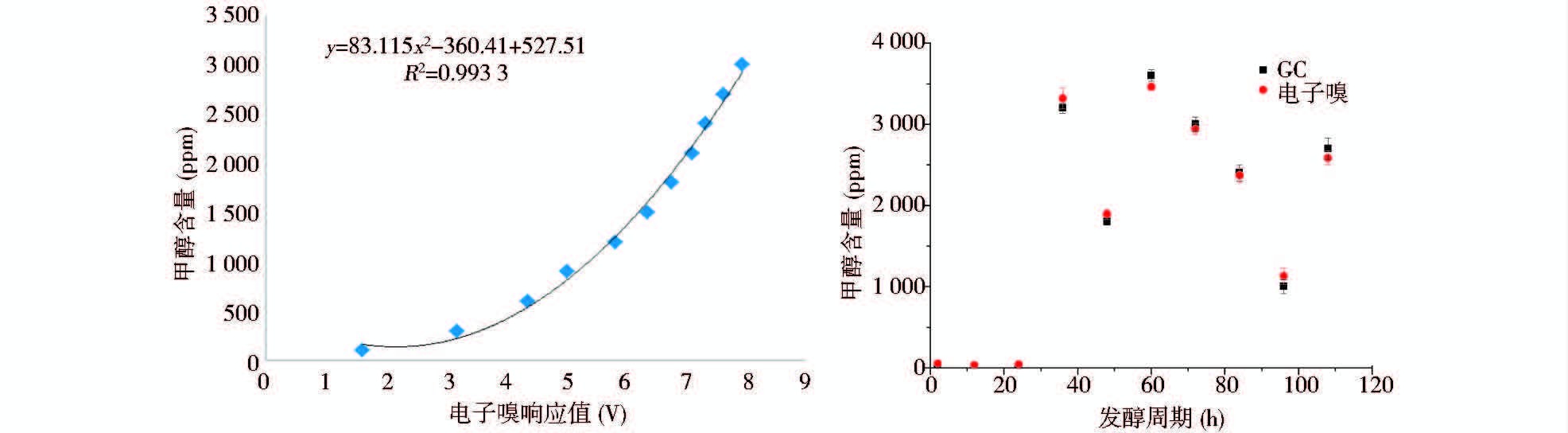 |
| 图 5 电子嗅检测甲醇溶液浓度标准曲线及与气相色谱检测的对比分析 Fig. 5 The establishment of polynomial fitting of the response of electronic nose with n-propanol concentrations and the the detection compared with gas chromatography |
甲醇营养型毕赤酵母表达系统是近年飞快发展的一个优秀的真核表达系统。利用甲醇营养型毕赤酵母发酵合成糖化酶是以甲醇为底物的,但高浓度的甲醇会对细胞的生长造成抑制,低浓度的甲醇会导致发酵过程中前体的供应不足造成产量的降低,因此甲醇补料控制策略的研究在发酵生产糖化酶过程中有十分重要的意义[12]。但由于离线气相色谱法检测的滞后性,很难精确控制甲醇的流加,导致甲醇浓度的波动较大。通过溶氧控制甲醇的补加工艺不能有效地防止甲醇流加过量。通过气相色谱离线检测控制甲醇浓度的波动较大,往往会影响毕赤酵母工程菌株产物的表达[13]。
甲醇在工程毕赤酵母菌表达系统中起着重要的作用,作为碳骨架参与菌体的生长,作为能量促进菌体生长和合成所需能量的维持,用于合成表达的目的产物。因此合理的甲醇分配流量控制对提升目的产物表达量至关重要。氧消耗速率是影响菌体生长和产物合成的主要因素,氧消耗速率的变化对应着不同的甲醇消耗速率,因此将氧消耗速率与甲醇的补加控制相结合是提升目的蛋白表达量的关键[14]。
在毕赤酵母糖化酶发酵诱导表达过程中,通过电子嗅来反馈调节甲醇补加速率[图 6(a)],控制发酵液中甲醇残留浓度分别为890ppm(RUN-A)和350ppm (RUN-B),从图 6(b)中可以看出利用电子嗅可将甲醇残留量稳定地控制在设定范围。通过甲醇的补加控制可供氧的调整,在发酵过程中维持了RUN-A和RUN-B相同的生理代谢参数氧消耗速率OUR和呼吸商RQ值[图 6(c)],同时维持了相同的溶解氧水平[图 6(d)]。两种不同甲醇浓度控制模式得到的菌体量变化趋势一致,但产物的合成在RUN-A控制模式下显著高于RUN-B控制模式[图 6(e)]。从图 6(e)中可以看出,在两个不同的甲醇控制模式下发酵培养到37h菌体浓度达到(85±4)g/L时停止甘油补加,当残留甘油耗尽,溶氧回升时开始补加甲醇进行诱导表达,将氧的消耗速率OUR几乎都控制在230mmol/(L·h)。在培养70h前甲醇残留浓度都控制在50~70ppm,菌体量呈逐渐增长趋势,但都没有产物糖化酶的合成,消耗的甲醇主要用于菌体蛋白的合成和能量维持代谢。70h后随着电子嗅的利用将甲醇浓度自动反馈控制在(890±35)ppm (RUN-A)和(350±26)ppm(RUN-B),产物糖化酶开始大量合成。从曲线图中可以看出甲醇的残留浓度稳定控制在(890±35)ppm水平下,发酵诱导培养到128h酶活达到了8 153U/ml,与甲醇浓度控制在(350±26)ppm时的发酵水平(5 048U/ml)相比提升了48.8%。尽管在两个不同的甲醇浓度控制模式考察中,保持了相同的溶氧水平和生理代谢参数(OUR及RQ值),但产物的表达量却大不相同。因此在毕赤酵母工程菌甲醇诱导表达目的蛋白的过程中,补加的甲醇量不仅要满足菌体的生长和维持呼吸代谢,同时还要保证合理的甲醇供给量用于产物目的蛋白的诱导和表达,采用合理的甲醇反馈补加控制模式对目的产物的合成非常关键。
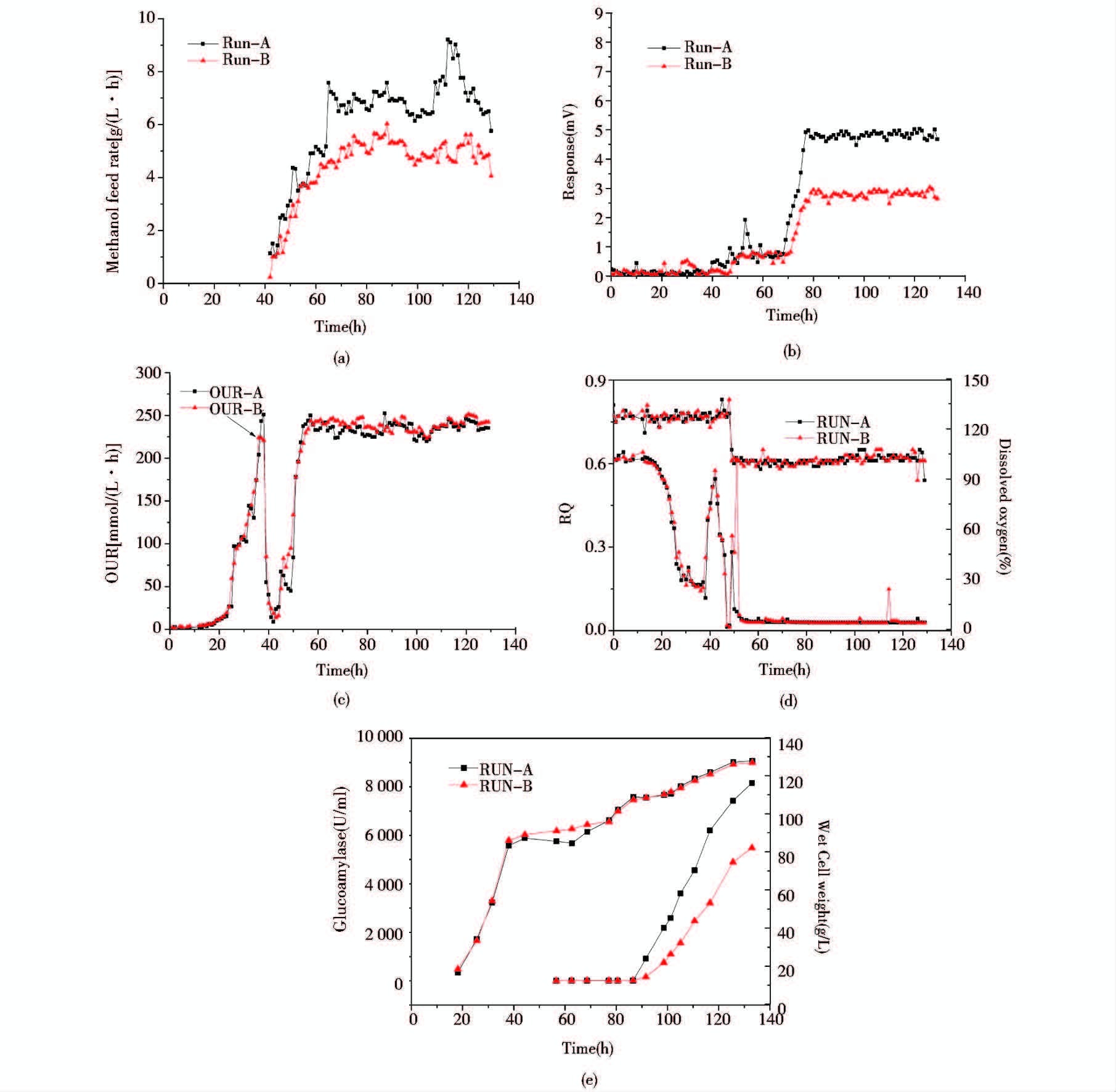 |
| 图 6 电子嗅在线控制甲醇补加的发酵过程参数曲线 Fig. 6 Time courses of physiological parameters under methanol feedback control with electronic nose The concentration of the methanol in the biosynthesis stage was controlled at RUN-A (890 ± 35)ppm and RUN-B (350 ± 26)ppm |
实验结果可以看出,在毕赤酵母的发酵过程中,利用电子嗅直接采用尾气检测甲醇残留浓度,能够做到在线及时反馈控制,并结合发酵过程中氧消耗速率和菌体的生长情况,能够很好地平衡菌体生长、维持和产物合成之间的关系,促进目标产物的快速表达,实现毕赤酵母表达调控的甲醇补加的自动化控制。
3 结 论甲醇营养型毕赤酵母表达系统在发酵过程中往往可以利用甲醇作为唯一碳源,然而在适宜浓度的情况下,提高甲醇浓度可以提高细胞的生长、代谢速率及目标蛋白的产量;在较高浓度下则会导致细胞死亡、产物失活等。同时甲醇的消耗是菌体生长、能量维持和产物表达共同作用的结果,本研究考察了电子嗅对甲醇测定的敏感性,论证了敏感膜元件TGS2602在发酵液中甲醇残留量的精确测定模型,实现了毕赤酵母糖化酶表达发酵过程中根据甲醇残留量反馈控制甲醇补加速率,当甲醇残留浓度精确控制在(890±35)ppm时,能显著促进糖化酶的合成表达。该方法弥补了离线检测方法存在的滞后性,利用发酵尾气进行直接测定不仅快速、高效而且无需复杂的前处理,对甲醇营养型毕赤酵母发酵过程合成表达控制有着非常重要的指导作用。
| [1] | Vanz A L, Lunsdorf H, Adnan A, et al. Physiological response of Pichia pastoris GS115 to methanol-induced high level production of the Hepatitis B surface antigen: catabolic adaptation, stress responses, and autophagic processes. Microb Cell Fact, 2012, 11: 103. |
| [2] | Sinha J, Plantz B A, Zhang W,et al. Improved production of recombinant ovine interferon-tau by mut(+) strain of Pichia pastoris using an optimized methanol feed profile. Biotechnol Prog, 2003, 19(3): 794-802. |
| [3] | Trinh L B, Phue J N, Shiloach J. Effect of methanol feeding strategies on production and yield of recombinant mouse endostatin from Pichia pastoris. Biotechnol Bioeng, 2003, 82(4): 438-444. |
| [4] | Schroer K, Luef K P, Stefan F, et al. Engineering the Pichia pastoris methanol oxidation pathway for improved NADH regeneration during whole-cell biotransformation. Metab Eng, 2010, 12(1): 8-17. |
| [5] | Zhou X S, Fan W M, Zhang Y X. Fermentation behaviors of recombinant Pichia pastoris under inhibited methanol concentration. Sheng Wu Gong Cheng Xue Bao, 2003, 19(5): 618-622. |
| [6] | Jorda J, Suarez C, Carnicer M, et al. Glucose-methanol co-utilization in Pichia pastoris studied by metabolomics and instationary (1)(3)C flux analysis. BMC Syst Biol, 2013, 7: 17. |
| [7] | Galbraith J C, Smith J E. Sporulation of Aspergillus niger in submerged liquid culture. Journal of General Microbiology, 1969, 59(1): 31-45. |
| [8] | Benassi V M, Pasin T M, Facchini F D, et al. A novel glucoamylase activated by manganese and calcium produced in submerged fermentation by Aspergillus phoenicis. J Basic Microbiol, 2014, 54(5): 333-339. |
| [9] | 赵玉萍, 张灏. 溶菌酶测定方法的改进. 食品科学, 2002, 23(3): 116-119. Zhao Y P, Zhang H. Improvement of lysozyme determination method. Food Science, 2002, 23(3): 116-119. |
| [10] | Fujioka K, Tomizawa Y, Shimizu N, et al. Improving the performance of an electronic nose by wine aroma training to distinguish between drip coffee and canned coffee. Sensors (Basel), 2015, 15(1): 1354-1364. |
| [11] | Ko W, Jung N, Lee M, et al. Electronic nose based on multipatterns of ZnO nanorods on a quartz resonator with remote electrodes. ACS Nano, 2013, 7(8): 6685-6690. |
| [12] | Khatri N K, Hoffmann F. Impact of methanol concentration on secreted protein production in oxygen-limited cultures of recombinant Pichia pastoris. Biotechnol Bioeng, 2006, 93(5): 871-879. |
| [13] | Lim H K, Choi S J, Kim K Y, et al. Dissolved-oxygen-stat controlling two variables for methanol induction of r-Guamerin in Pichia pastoris and its application to repeated fed-batch. Appl Microbiol Biotechnol, 2003, 62(4): 342-348. |
| [14] | Sola A, Paula J, Hannu M, et al. Metabolic flux profiling of Pichia pastoris grown on glycerol/methanol mixtures in chemostat cultures at low and high dilution rates. Microbiology, 2007, 153(Pt 1): 281-290. |
 2016, Vol. 36
2016, Vol. 36




