文章信息
- 吴胜, 霍光华, 韩启灿, 龙昊知
- WU Sheng, HUO Guang-hua, HAN Qi-can, LONG Hao-zhi
- 一株祼脚菇属菌株产抗菌活性物的基础液体培养碳、氮源等优化及其对柑橘青绿霉菌的作用
- Optimization of Carbon and Nitrogen Source of Basic Liquid Culture of Gymnopus sp. Producing Anti-fungal Activity Substance and Its Effect on Green and Blue Mold of Citrus
- 中国生物工程杂志, 2016, 36(2): 51-61
- China Biotechnology, 2016, 36(2): 51-61
- http://dx.doi.org/10.13523/j.cb.20160208
-
文章历史
- 收稿日期: 2015-11-20
- 修回日期: 2015-11-26
青霉病和绿霉病是柑橘类水果采后的最主要病害,造成的损失通常占整个柑橘贮藏期病害损失的90%以上[1]。至今,国内外大多数研究认为,引起柑桔采后腐烂的青霉菌主要为意大利青霉(Penicillium italicum)与指状青霉(Penicillium digitatum)两种[2]。柑橘绿霉病菌分布广泛,可以在多种有机质上腐生,并产生大量的分生孢子,通过气流传播,经各种伤口侵入[3]。目前,果蔬保鲜的方法主要有物理方法和化学方法,物理方法的缺点是需要特殊设备,操作复杂,成本高,普遍应用有困难,单独使用保鲜效果也不理想[4],而化学方法大多有毒性和残留,长期使用化学杀菌剂,容易使病原菌对其产生抗药性,降低了防病效果,污染环境;另外,果实表面的化学残留对消费者健康和安全造成危害[5]。然而,目前柑橘采后病害的主要防治方法是使用化学杀菌剂。随着人们环保意识和安全知识的不断增强,为了保证果实产品的卫生和安全,选择对人畜毒性低、环境污染小的非化学的、非选择性的生物防腐剂控制果实采后病害以及病虫草不易产生抗性的生物农药已成为国内外研究的热点[6]。以大型真菌为出发菌株进行医药、食品防腐剂、饲料添加剂等项目的开发,意义重大[7]。很多大型真菌的子实体从来不被昆虫所侵袭[8],而且受伤后的子实体能产生大量具有杀虫、抗细菌和抗真菌等活性的次生代谢产物[9]。因此,大型真菌可成为继植物源农药之后的生物农药及农药先导的又一热门研究课题。
本实验室从江西梅岭林区木材上采集到一株似野生冬菇的菌株[10],经分离获得其纯培养物,并发现其具有分泌胞外拮抗青绿霉等病菌的活性化合物。菌株经分子鉴定属于祼脚菇属菌株Gymnopus sp.。裸脚菇属(Gymnopus sp.)隶属于担子菌门(Basidiomycota)伞菌纲(Agaricomycetes)伞菌目(Agricales)小皮伞科(Marasmiaceae)[11],主要包括一些清淡可口到半肉质的蕈菌,常生长于热带到温带地区腐烂的树叶与木材上。裸脚菇属真菌最初发现于北美洲[12]和欧洲[13]的一些国家。Antonin等[14]公开了一株采自于匈牙利的新型双孢担子菌类,经研究鉴定为Gymnopus inusitatus var. Cystidiatus,后来,国外其他地区也相继发现并报道了该属菌种。Mata等[15]首次报道了采自于哥斯达黎加和巴拿马的加勒比海低地的几个裸脚菇属菌种,分别是Gymnopus luxurians、G. Subpruinosus、G. Neotropicus和G.omphalodes,进一步研究表明Gymnopus hondurensis为哥斯达黎加新纪录种;Miyamoto等[16]报道了采集于日本北海道的一株裸脚菇属新种Gymnopus piceipes;Banares等[17]公开了一株采集于加那利群岛蒙特维多森林的裸脚菇属新种Gymnopus beltraniae。我国关于祼脚属菌也有零星记载,迄今对该属菌种仅限于对其生物多样性的认识[18],所产活性物质少见报道,且对该属菌的营养需求,生长发育条件,以及产活性物质的代谢缺乏资料。本文就该菌株鉴定、液体培养产活性物质所需的营养和条件优化,以及此活性物质对青、绿霉病菌的拮抗作用作一论述。
1 材料与方法 1.1 菌 株供试菌:裸脚菇属野生大型真菌0612-9,保藏于南昌市生物资源保护与利用重点实验室菌种库;指示菌:指状青霉、意大利青霉,由江西省果蔬保鲜与无损检测重点实验室提供。
1.2 培养基马铃薯葡萄糖琼脂培养基(PDA),牛肉膏蛋白胨固体培养基,液体种子培养基:葡萄糖2%,蛋白胨2%,KH2PO4 0.3%,MgSO4·7H2O 0.15%,用于制备大型真菌液体种子液;碳源筛选基础培养基(g/L):各种碳源20、麸皮10、KH2PO4 3、MgSO4·7H2O 1.5、 维生素B1 0.1,pH 自然;氮源筛选基础培养基(g/L):蔗糖20、各种氮源10、KH2PO4 3、MgSO4·7H2O 1.5、维生素B1 0.1,pH 自然。
1.3 ITS-5.8S rDNA法菌种鉴定通过测定功能菌株ITS-5.8S rDNA 区段的DNA序列,并与互联网上的生物信息资源进行同源性比对,比对结果通过MEGA5.0软件构建系统发育树,初步鉴定菌种。测序由上海生物工程股份有限公司完成。
1.4 对病原菌的活性评价 1.4.1 发酵液粗提物对意大利青霉和指状青霉的活性测定[19]含药培养基的配置:发酵液离心,取其上清液经乙酸乙酯萃取至无色,乙酸乙酯相减压浓缩成浸膏,配制成2.5mg/ml的母液,过滤(0.22μm)除菌,保存备用。将PDA培养基冷却到50℃,取母液与PDA混合制成系列浓度(125μg/ml、62.5μg/ml、31.25μg/ml、15.63 μg/ml、7.82μg/ml和3.91μg/ml)的含药平板。
毒力方程的制作:采用菌丝生长速率法,将活化的供试病原菌菌饼(d=5mm)接种至系列浓度的含药平板中央,以不含药的培养基作为对照,每皿接一个菌块,处理组和对照组各重复三次。将培养皿置于26℃恒温箱中培养,待对照组菌丝即将长满培养皿时,采用十字交叉法测量菌落直径(mm),用下式计算抑制率:抑菌率(%)=(空白菌落直径-含药菌落直径)/(空白菌落直径-接入菌块直径)×100。
用DPS 7.0.5 软件统计分析,以浓度对数值为变量x,对各病原菌的抑制率的几率值为变量y,求得毒力回归方程y=ax+b,相关系数r和有效抑制中浓度(EC50)。
1.4.2 体外柑橘采后主要病害青绿霉菌的活性粗活性物质对孢子萌发的影响[20]:无菌条件下,用血球计数板将意大利青霉孢子和指状青霉孢子分别配制成浓度为106cfu/ml的菌悬液。将不同浓度的乙酸乙酯粗提物和等量的孢子悬液(106cfu/ml)加入到96孔板中,对照组加入等量的无菌水,每个处理重复 3 次。置于 28℃培养12h后显微镜下观察孢子萌发形态,统计100~200个孢子,计算孢子萌发率和抑制率:萌发率(%)=100×(萌发孢子数/总孢子数);抑制率(%)=100×(对照组萌发率-处理组萌发率)/对照组萌发率。
最小抑菌浓度(MIC)和最小杀菌浓度(MFC)的测定[20]:无菌条件下,将不同浓度的乙酸乙酯粗提物和等量的孢子悬液(106cfu/ml)加入到96孔板中,对照组加入等量的无菌水,每个处理重复3次,将其置于28℃的培养箱中培养2d。通过双目显微镜观察,以无孢子萌发生长的最低含药浓度为其最小抑菌浓度(MIC)。将上述培养2d无孢子萌发生长的菌悬液均匀涂布到PDA培养基中7d后观察,以无菌落生长的培养皿的最低含药浓度为其最小杀菌浓度(MFC)。
不同浓度的活性物质对病原菌丝形态的影响[21]:将供试的意大利青霉的孢子悬液(107cfu/ml)接种于液体PD培养基中,180r/min、28℃培养24h,长成均匀的菌丝悬浮液,加入发酵液粗提物使其浓度为EC50、MIC和MFC,同时500μg /ml的抑霉唑作为阳性对照。于处理后12h、24h、36h和48h取样,挑取少量菌丝在洁净载玻片中央于显微镜下观察菌丝形态的变化。
1.5 产抗菌物质的液体培养基优化单因子法优选碳氮源:等量的常用碳氮源(碳源:蔗糖、葡萄糖、玉米粉、可溶性淀粉、甘露糖;氮源:麸皮、蛋白胨、酵母粉、硝酸铵、尿素)分别替换,不加氮源为空白对照,发酵培养后,分别测定浓缩5倍发酵液的抑菌活性。响应面设计:以碳、氮源的优化为基础,采用N =12的Plackett-Burman试验筛选主因素,然后最陡爬坡试验逼近最大响应区域,最终Box-Behnken试验设计及响应面分析进一步优化主因素。
1.6 验证试验采用优化所得的最佳发酵工艺发酵培养活性菌株,所得发酵液进行抑制意大利青霉试验,并以优化之前的初始发酵条件下所得发酵液的抑菌活性作为对照。
1.7 统计分析采用Design Expert 8.0.6 和DPS7.0.5软件进行试验设计和统计。
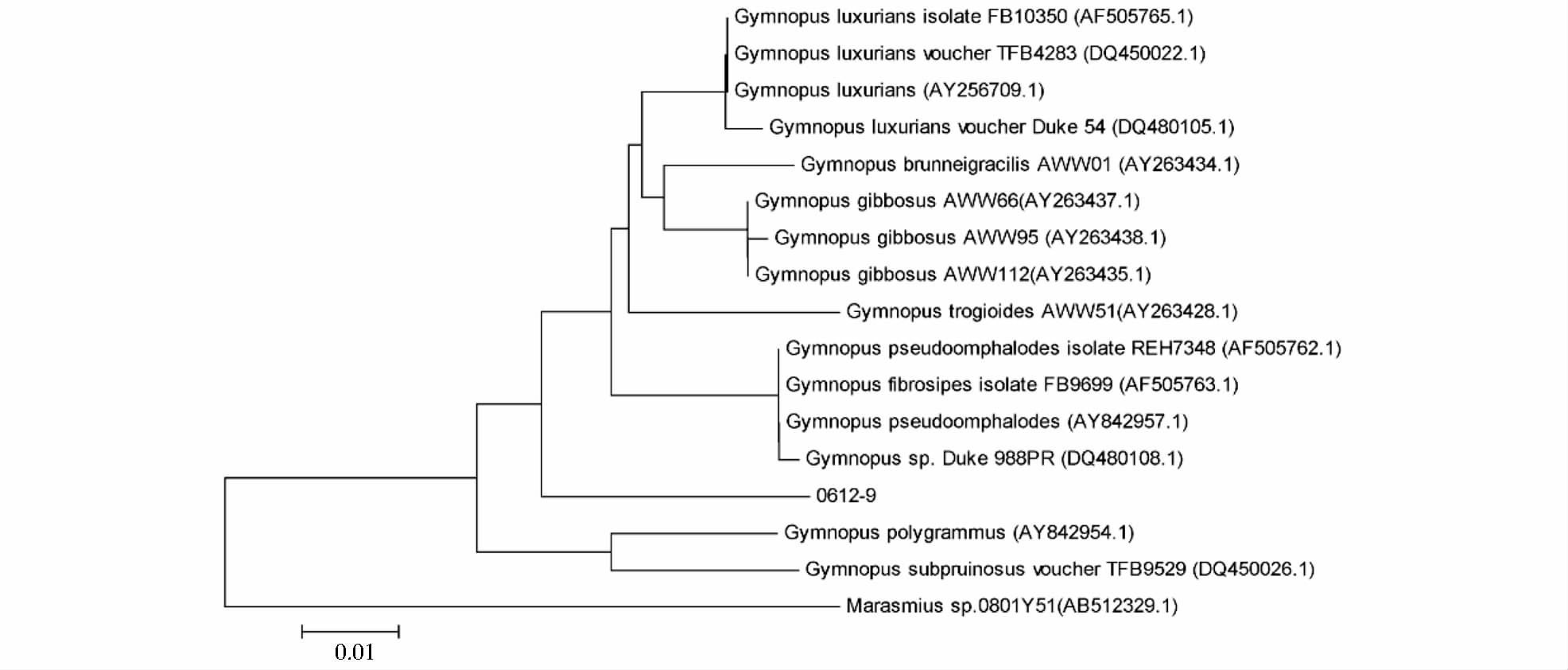
2 结果与分析 2.1 分子系统树的建立及分类地位的确定功能菌株0612-9的测序结果提交GenBank(No.KP697996)进行BLAST比对,比对结果构建系统进化树(图 1)。
|
| 图 1 以ITS序列同源性为基础的系统发育树 Fig. 1 Phylogenetic tree based on the homology of ITS sequences |
分析系统进化树(图 1)发现0612-9与裸脚菇属的亲缘关系最近,ITS序列与Gymnopus luxurians、Gymnopus trogioides AWW51和Gymnopus luxurians isolate FB10350的同源性为92%,因此,0612-9菌株归属于祼脚菇属一种Gymnopus sp.。
2.2 Gymnopus sp.菌株产抗菌活性物质的优化培养基 2.2.1 发酵培养基最佳碳、氮源由表 1可见,以葡萄糖、麸皮汁分别作为发酵培养基的碳、氮源时,所得发酵液对意大利青霉抑菌的抑菌率分别为46.78%和33.07%,抑菌活性显著高于其他待选碳、氮源,因此,Gymnopus sp.菌株发酵生产抗菌物质的最佳碳、氮源分别为葡萄糖与麸皮汁。
| Carbon source Nitrogen source | Dry weight of mycelium (μg /ml) | Inhibitory ration(%) Penicillium italicum |
| Glucose | 1.8 | 46.78±1.25a |
| Sucrose | 0.8 | 27.08±0.38c |
| Corn | 1.6 | 35.67±0.92b |
| Soluble starch | 0.7 | 17.89±1.06d |
| Mannose | 0.5 | 12.69±1.55e |
| CK(without the addition of carbon source) | 0.9 | 0 |
| Bran | 2.5 | 33.07±1.18a |
| Peptone | 3.4 | 7.91±0.38d |
| Yeast extract powder | 1.0 | 16.30±1.35b |
| NH4NO3 | 0.2 | 0 |
| Urea | 0.0 | 0 |
| CK(without the addition of nitrogen source) | 0.1 | 10.82±0.37c |
| Note:All values are expressed as mean±standard deviation from at least three independent experiments. Data with the different letters in column are significant difference at 5% level by Duncan’s multiple range test,same as below | ||
碳氮源筛选结果显示葡萄糖与麸皮分别为Gymnopus sp.菌株发酵培养基的最适碳氮源,在此基础上采用Plackett-Burman试验研究发酵培养过程可能对产抗菌活性物质存在影响的10个主要因素(X1马铃薯、X2葡萄糖、X3麸皮、X4 KH2PO4、X5 MgSO4·7H2O、X6接种量、X7摇速、X8发酵周期、X9温度、X10装液量),并设一个空白项(D1)作为误差分析,试验设计及结果分析见表 2,利用Design Expert 8.0.6 软件对PB实验结果进行多元回归分析和方差拟合见表 3,获得抑菌率IR(Y)与自变量的多元一次回归模型为:Y=32.18+7.13X1+0.30X2+3.58X3+0.37X4-4.89X5-0.38X6+ 2.16X7+ 0.75X8- 0.48X9 + 2.12X10。该模型拟合性评价表明,其决定系数R2为0.99,拟合性非常好。
| Run | X1 | X2 | X3 | X4 | X5 | X6 | X7 | X8 | X9 | X10 | D1a | IR(%) |
| 1 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 32.74±1.94 |
| 2 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 35.87±0.90 |
| 3 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | 18.13±1.55 |
| 4 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 31.02±0.93 |
| 5 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | 35.57±1.53 |
| 6 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | 21.71±1.99 |
| 7 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | 22.88±1.10 |
| 8 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 35.95±0.98 |
| 9 | 1 | 1 | 1 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 51.34±1.45 |
| 10 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | -1 | -1 | 48.93±2.18 |
| 11 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | -1 | 23.11±0.68 |
| 12 | -1 | -1 | -1 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | 28.91±1.06 |
| IR:Inhibitory ration(%),same as below; a:Representing a fictitious variable,used to estimate the error | ||||||||||||
PB实验各因素所代表的参数、水平及因素效应评价见表 3,由表 3可知,对抑菌率(IR)有显著影响(Pr>F)的因素有马铃薯、麸皮和MgSO4·7H2O,且效应大小顺序依次为马铃薯>MgSO4·7H2O>麸皮。马铃薯和麸皮CE值分别为7.13和0.58大于0,呈现出正效应;MgSO4·7H2O的CE值为-4.89,呈现出负效应。要提高抑制率,后续试验中应适当提高马铃薯和麸皮的的量,同时要适当减小MgSO4·7H2O的量,因此选择马铃薯、麸皮和MgSO4·7H2O三因素进一步试验优化。
| Factors | Levels | CE | F-value | P r > F | Significantly | ||
| Code | Factors | Low(-) | High(+) | ||||
| X1 | Potato(g /L) | 160 | 240 | 7.13 | 1359.45 | 0.0173 | 1* |
| X2 | Glucose(g /L) | 20 | 30 | 0.3 | 2.43 | 0.3628 | 10 |
| X3 | Bran(g /L) | 3 | 6 | 3.58 | 343.21 | 0.0343 | 3* |
| X4 | KH2PO4(g /L) | 1 | 2 | 0.37 | 3.66 | 0.3065 | 9 |
| X5 | MgSO4·7H2O(g /L) | 0.6 | 1.2 | -4.89 | 639.31 | 0.0252 | 2* |
| X6 | Inoculation(%) | 5 | 10 | -0.38 | 3.86 | 0.2996 | 8 |
| X7 | SP(r/min) | 160 | 180 | 2.16 | 125.21 | 0.0567 | 4 |
| X8 | Time(d) | 8 | 10 | 0.75 | 14.92 | 0.1613 | 6 |
| X9 | Temperature(℃) | 26 | 28 | -0.48 | 6.25 | 0.2422 | 7 |
| X10 | Volume(ml) | 80 | 100 | 2.12 | 120.62 | 0.0578 | 5 |
| * Significant(P<0.05) | |||||||
根据Plackett-Burman试验结果确定下一步试验的最佳最陡爬坡路径,对Gymnopus sp.菌株发酵液抑菌活性影响显著的因素有马铃薯、麸皮和MgSO4·7H2O,前两个为正效应,最后一个为负效应。根据这三个因素效应的大小比例设定他们的变化方向以及步长,最陡爬坡试验设计及结果见表 4。从表 4可以看出,最佳因素的浓度条件处于第2组和第3组之间,故以第3组条件(马铃薯280g/L、麸皮8g/L、MgSO4·7H2O 0.4g/L)为后续试验的中心点进行响应面分析。
| Run | Significant factors | IR(%) | ||
| X 1: Potato(g/L) | X 3: Bran(g/L) | X 5:MgSO 4· 7H 2O(g/L) | ||
| 1 | 240 | 6 | 0.6 | 42.36±0.78 |
| 2 | 260 | 7 | 0.5 | 52.64±2.54 |
| 3 | 280 | 8 | 0.4 | 55.48±1.35 |
| 4 | 300 | 9 | 0.3 | 51.19±2.69 |
| 5 | 320 | 10 | 0.2 | 47.72±1.72 |
以PB试验所得的显著影响因素,即马铃薯、麸皮和MgSO4·7H2O为自变量,以最陡爬坡试验表 4所确定的发酵液活性最大响应区的近似最优组合第3组为中心点,Box-Behnken响应面设计用来考查3个因子的相互作用和最佳水平。对3个显著因子进行重新编码,各因素水平及编码见表 5。
| Run | X 1 | X 3 | X 5 | IR(%) |
| X
1:
Potato(g/L) |
X
3:
Bran(g/L) |
X
5:MgSO
4·
7H 2O(g/L) |
||
| 1 | 290 | 8 | 0.5 | 48.97±1.25 |
| 2 | 280 | 9 | 0.3 | 47.05±1.29 |
| 3 | 280 | 8 | 0.4 | 52.62±0.98 |
| 4 | 280 | 8 | 0.4 | 51.19±1.35 |
| 5 | 280 | 7 | 0.5 | 45.11±2.16 |
| 6 | 280 | 8 | 0.4 | 54.36±2.11 |
| 7 | 290 | 8 | 0.3 | 45.42±0.65 |
| 8 | 280 | 7 | 0.3 | 43.91±1.07 |
| 9 | 270 | 9 | 0.4 | 46.01±2.84 |
| 10 | 290 | 7 | 0.4 | 47.29±1.95 |
| 11 | 270 | 7 | 0.4 | 44.12±1.68 |
| 12 | 290 | 9 | 0.4 | 51.28±1.22 |
| 13 | 280 | 8 | 0.4 | 55.26±1.44 |
| 14 | 280 | 8 | 0.4 | 53.12±2.31 |
| 15 | 270 | 8 | 0.3 | 46.17±0.92 |
| 16 | 280 | 9 | 0.5 | 48.95±1.35 |
| 17 | 270 | 8 | 0.5 | 45.95±0.64 |
试验数据使用Design Expert 8.0.6 软件进行二次回归分析,结果见表 6。二次回归拟合后,得到回归方程: Y=61.30+1.34X1+1.59X3+0.81X5+0.51X1X3+0.92X1X5+0.16X3X5-2.89X12-3.26X32-3.8X52,其中Y为抑菌率。
| Source | Sum of Squares | D.F. | Mean Square | F-value | Pr > F | Significantly |
| Model | 201.12 | 9 | 22.35 | 10.86 | 0.0024 | Significant |
| X1 | 14.34 | 1 | 14.34 | 6.97 | 0.0334 | * |
| X3 | 20.22 | 1 | 20.22 | 9.83 | 0.0165 | * |
| X5 | 5.2 | 1 | 5.2 | 2.53 | 0.1559 | |
| X1X3 | 1.03 | 1 | 1.03 | 0.5 | 0.5021 | |
| X1X5 | 3.42 | 1 | 3.42 | 1.66 | 0.2381 | |
| X3X5 | 0.11 | 1 | 0.11 | 0.051 | 0.8272 | |
| X12 | 35.14 | 1 | 35.14 | 17.08 | 0.0044 | * |
| X32 | 44.65 | 1 | 44.65 | 21.7 | 0.0023 | * |
| X52 | 60.77 | 1 | 60.77 | 29.53 | 0.001 | * |
| Residual | 14.4 | 7 | 2.06 | |||
| Lack of Fit | 4.72 | 3 | 1.57 | 0.65 | 0.6229 | not significant |
| Pure Error | 9.68 | 4 | 2.42 | |||
| Cor Total | 215.53 | 16 |
由表 6方差分析结果可以看出,模型在A=0.05水平上回归显著;失拟项反映的是实验数据与模型不相符的情况,P=0.6229>0.05,失拟不显著,因此模型选择正确。一次项X1和X3与二次项对发酵液抗菌活性均有显著影响(P<0.05),交互项影响均不显著,说明三因素之间交互作用相对较小。模型可信度分析表见表 7,其中复相关系数的平方R2=0.9332,说明模型可解释93.32%实验所得抑菌率的变化,表面方程拟合较好。CV(Y的变异系数)表示实验的精确度,CV值越高,实验的可靠性越低,本实验的CV=2.95%较低,说明实验操作可信。这些说明回归方程给Gymnopus sp.产活性抗菌物质提供了一个合适的模型。
| Term | Std. Dev. | Mean | C.V. % | R2 | Adj R2 | Adeq Precision |
| Value | 1.43 | 48.62 | 2.95 | 0.9332 | 0.8472 | 8.443 |
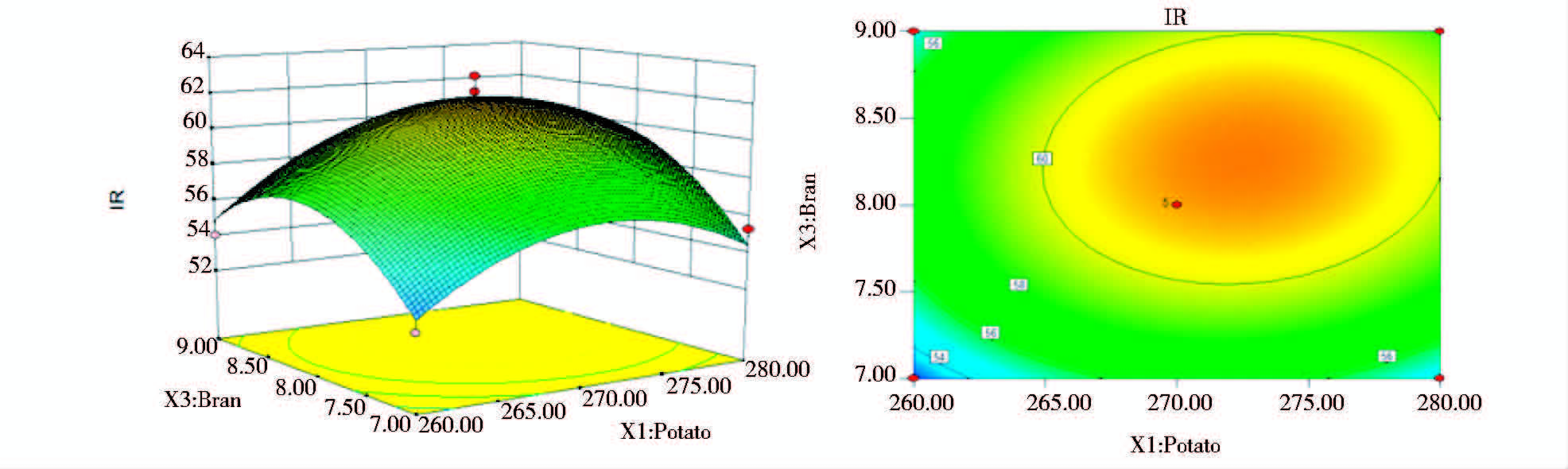
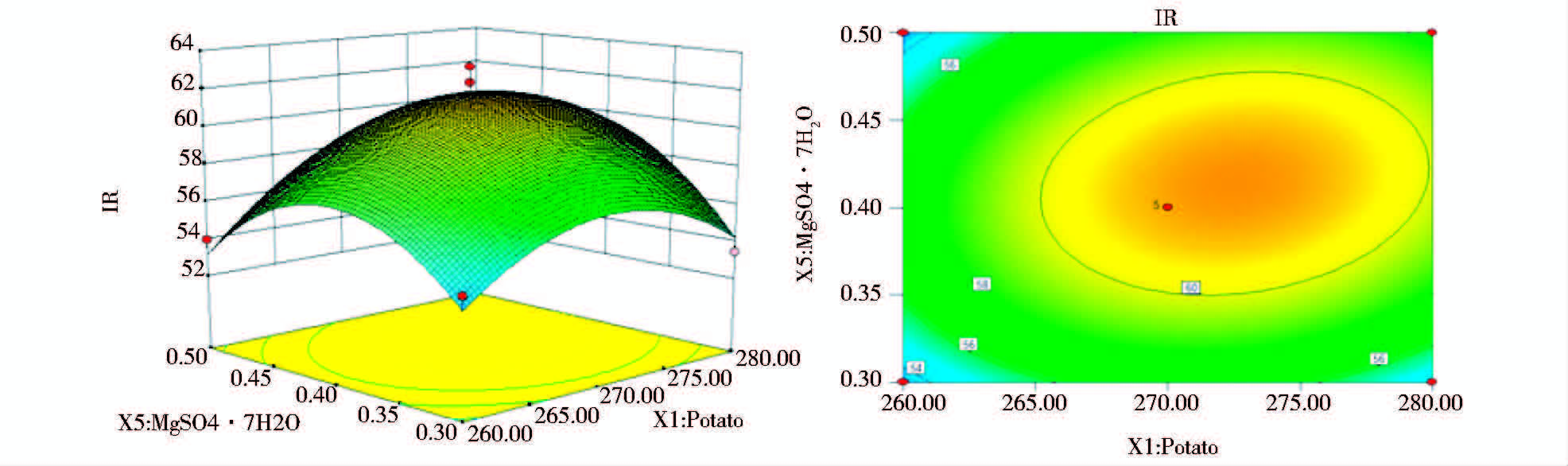
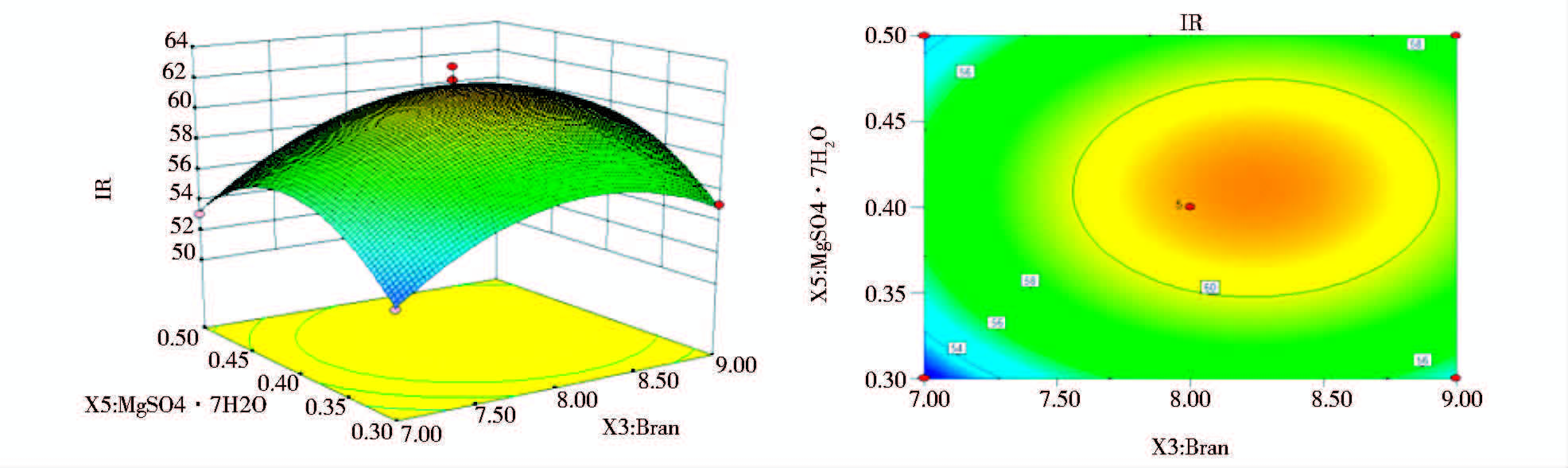
为了进一步研究相关变量之间的交互作用以及确定最优点,通过Design Expert软件绘制响面曲线图来进行分析,图 2、图 3和图 4,分别显示了三组以抑菌率会响应值的趋势图,每个响应面分别代表两个独立因素之间的相互作用,此时第三个变量保持在中心水平。
|
| 图 2 Y=f(X1,X3)立体分析图和相应等高线图 Fig. 2 Response surface plot and counter plot of the function Y=f(X1,X3) |
|
| 图 3 Y=f(X1,X5)立体分析图和相应等高线图 Fig. 3 Response surface plot and counter plot of the function Y=f(X1,X5) |
|
| 图 4 Y=f(X3,X5)立体分析图和相应等高线图 Fig. 4 Response surface plot and counter plot of the function Y=f(X3,X5) |
由图 2、图 3和图 4响应面立体图可以看出,响应值存在最大值,进一步通过软件分析计算,得到抑菌率预测值最大时的组分:马铃薯279.94g/L、麸皮8.87g/L和 MgSO4·7H2O 0.47g/L,最大响应值为58.42%。
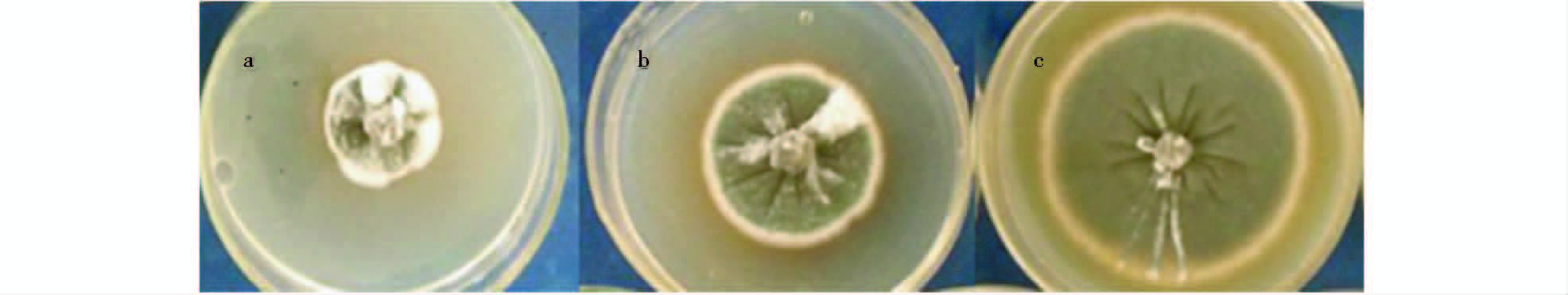
2.2.6 最佳优化条件的验证试验为验证模型的可靠性,以P-B试验优化的结果,并结合Box-Behnken试验结果,配制优化的Gymnopus sp.菌株发酵生产抗菌物质的最佳摇瓶工艺为:马铃薯279.94g/L,葡萄糖30 g/L,麸皮8.87g/L,MgSO4·7H2O 0.47g/L,KH2PO4 2 g/L,发酵周期10 d,接种量5ml/100ml,转速180 r/min,摇床温度26 ℃,装液量100 ml/250 ml。测得上述培养工艺发酵液的抑菌活性(图 5)55.77%稍低于预测值58.42%,比初始培养工艺的抑菌率42.46%提高了31.35%,极大地肯定了该优化的结果,为菌株Gymnopus sp.发酵产活性物质的放大培养提供了基础。
|
| 图 5 活性物质对意大利青霉菌的抑制效果 Fig. 5 Inhibitory effect of active substances on Penicillium italicum a:After optimization;b:Before optimization;c:CK |
实验结果表明乙酸乙酯粗提物对病原菌均有一定的抑制活性,EC50值能有效反应杀菌剂对病原菌抑制活性的大小,EC50值越小,说明乙酸乙酯提取物对病原菌抑制活性越强。本实验中,对意大利青霉的EC50为69.25μg /ml,毒力方程为y=1.48x+2.28;对指状青霉的EC50为56.70μg /ml,毒力方程为y=1.49x+2.39。病原菌的毒力方程斜率各不相同,说明乙酸乙酯浸提物对病原菌的毒力效应存在明显差异。
2.3.2 活性物质对青绿霉孢子萌发率的活性测定不同浓度的提取物对意大利青霉及指状青霉孢子萌发的抑制效果不同,随着浓度的增大,孢子的萌发数量均不断减小,抑制效果增强。在最大供试浓度125μg /ml时,意大利青霉和指状青霉孢子的萌发抑制率分别为73.67%和78.25%,其EC50值分别为54.21μg /ml和42.39μg /ml,均低于菌丝生长的半数抑制浓度69.25μg/ml和56.70μg /ml,说明粗提物对孢子的作用效果更佳,在一定范围内对孢子萌发具有显著的抑制效果。
2.3.3 对意大利青霉和指状青霉的MIC和MFC的测定本实验通过96孔板法测定了粗提物对意大利青霉以及指状青霉的最小抑制浓度(MIC)和最小杀菌浓度(MFC)。粗提物对两种青霉的MIC以及MFC的浓度一致,且MIC 200μg/ml与MFC 250μg/ml相差不大;而阳性对照抑霉唑对次两种微生物的MIC只有80 μg/ml,MFC则达到了500μg/ml,相差较大。实验结果表明,粗提物的杀菌效果优于抑霉唑,而在低浓度的药物情况下,抑霉唑对两种病原菌的抑制效果更好。
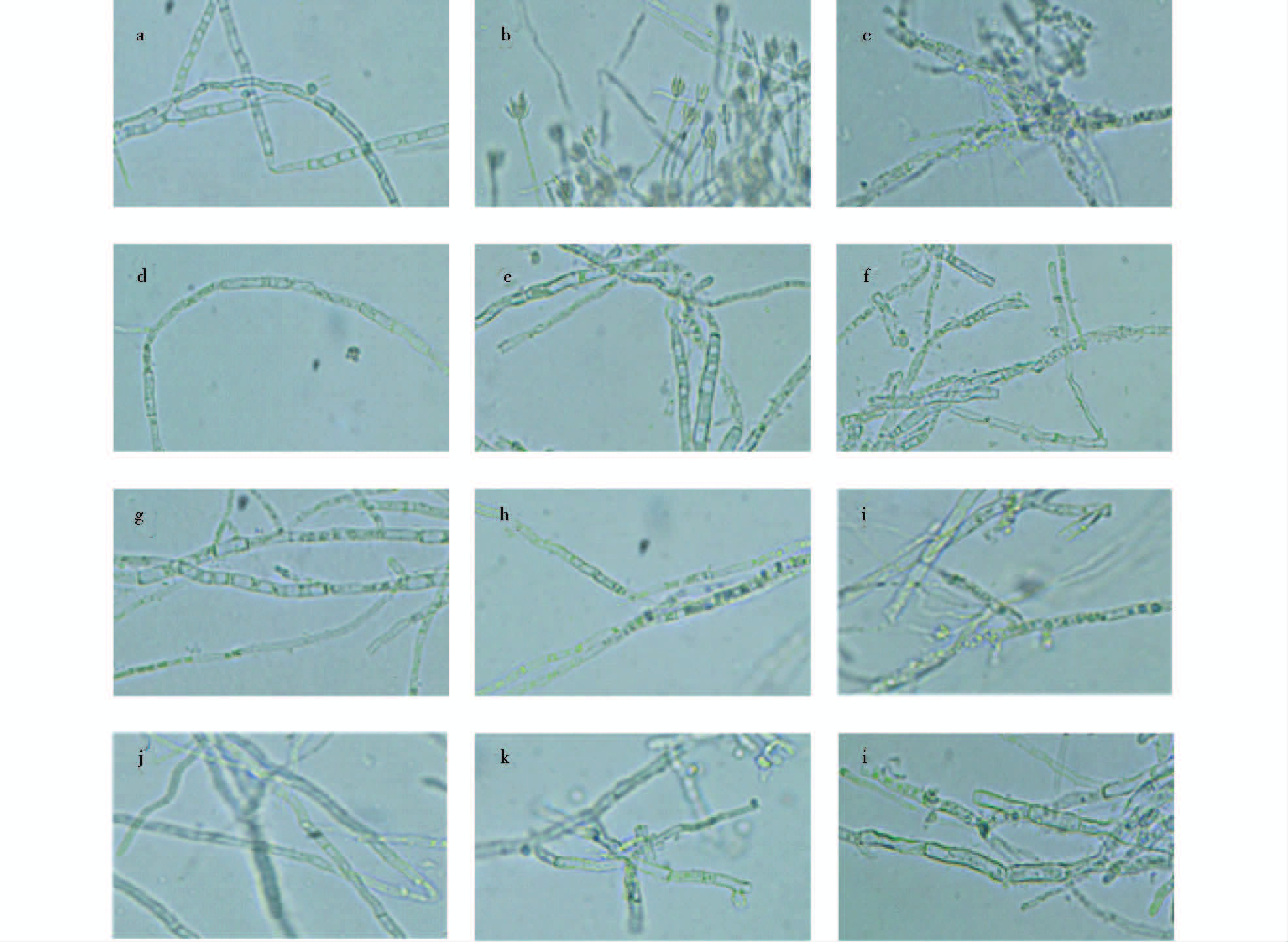
2.3.4 发酵液活性物质对意大利青霉菌丝形态的影响菌株Gymnopus sp.发酵液活性物质作用于意大利青霉菌后,其菌丝形态有了较为明显的变化,如图 6所示。空白对照组(a)菌丝边缘清晰,隔膜明显,菌丝粗细均匀,外壁光滑正常。在空白生长24h后(b),可以明显见到孢子子囊托盘,此时菌丝进入产孢阶段,孢子开始大量繁殖。在抑霉唑500μg/ml处理36h后(c),菌丝细胞壁已模糊不清,菌丝体开始断裂,内容物释放,菌丝体互相粘连扭曲,发生自溶。在MFC、MIC和EC50浓度处理下,菌丝体均出现不同程度的损伤,随着培养时间的推移,菌体的受损程度逐渐加深。粗提物的浓度越大,培养时间越长,菌丝体的受损程度越严重,细胞壁破裂更彻底。大多数菌丝出现断裂、消融,菌丝体细胞壁破坏严重,胞内原生质大量外泄,空腔变多,细胞质变得浓稠,颜色变深。
|
| 图 6 粗提物对意大利青霉菌丝形态的影响(10×40) Fig. 6 Effect of crude extracts on the morphology of Penicillium italicum(10×40) a:0h CK,b:24hCK,c:36h treatment of Imazalil; d,e and f were treatments of 12h MFC,24h MFC and 36h MFC; g,h and i were treatments of 12h MIC,24h MIC and 36h MIC; j,k and l were treatments of 24h EC50,36h EC50 and 48h EC50 |
本文初步确定了祼脚菇属菌株0612-9产拮抗柑橘青、绿菌活性物质的液体(摇瓶)培养基组成:马铃薯279.94g/L,葡萄糖30g/L,麸皮8.87g/L,MgSO4·7H2O 0.47g/L,KH2PO4 2g/L,以及培养条件:发酵周期10d,接种量5ml/100ml,转速180r/min,摇床温度26℃,装液量100ml/250ml。这将为该菌进一步放大发酵和调控生产其活性产物奠定基础。
柑橘采后青、绿霉病是较难防治的一种病,导致柑橘采后甚至采前严重的经济损失。化学杀菌剂的使用可引起病原抗药性和食品安全等问题,因此,促使人们寻求生物源(植物和微生物)的活性物质来防控此类病害。Sholbery等[22]发现,从日本柏树中提取的日柏醇对防治桃和草莓果实的采后病害有较好效果,14~40μg/ml的日柏醇就能有效地控制灰霉菌、褐腐病和青霉病菌孢子的萌发。席钦芳等[23]用大蒜汁和洋葱汁控制柑橘果实的青绿霉菌,取得了较好效果,达到甚至超过了多菌灵的效果。Wilson等[24]报道,一些植物油对B.cinerea和P.expansum病菌的生长有抑制作用。曾志恒等[25]研究发现,凤尾菇发酵液的乙酸乙酯萃取物对枇杷炭疽病菌的孢子萌发、菌丝生长的抑制作用较强。本实验用乙酸乙酯粗提物作用于青绿霉的菌丝,发现对意大利青霉和指状青霉的最小杀菌浓度为250μg/ml,低于抑霉唑的500μg/ml,同时药物能够影响病原菌丝的细胞壁,引起菌丝的断裂,菌丝内容物的释放,细胞质变得浓稠,与易磊等[19]在研究木荷皂甙对稻瘟病菌细胞形态影响的发现相一致,以EC50和EC90浓度的该粗提物对稻瘟病菌丝处理24h后,可导致菌素断裂、细胞肿胀,会引起病原菌丝细胞内含物大量释放。裸脚菇属菌株0612-9分泌到胞外的活性产物对柑橘采后主要病原菌的菌丝生长和孢子萌发均具较强抑制活性,可与现行生产上使用的抑霉唑相比,可望开发为新生物源的柑橘采后保鲜剂。
| [1] | 马俊莲,张子德. 我国果蔬贮藏保鲜业现状与发展对策. 保鲜与加工,2001,01:28-30. Ma J L,Zhang Z D.Status and developing strategies for fruit and vegetables storage in China. Storage & Process,2001,01:28-30. |
| [2] | 盛爱武,乔爱民,高飞,等. 富贵竹切口保鲜及贮运研究. 中国农学通报,2005,09:329-331. Sheng A W,Qiao A M,Gao F,et al.Studies on cutting surface preservative and storage and transport of Dracaena sanderiana. Chinese Agricultural Science Bulletin,2005,09:329-331. |
| [3] | 田世平,范青. 控制果蔬采后病害的生物学技术. 植物学通报,2000,03:211-217. Tian S P,Fan Q. Biological technologies for the control of post-harvest diseases of fruits and vegetables.Chinese Bulletin of Botany,2000,03:211-217. |
| [4] | Zhang H Y,Zheng X D,Fu C X,et al. Post-harvest biological control of gray mold rot of pare with Cryptococcus laurentii. Biology and Technology,2005,35:79-86. |
| [5] | 习柳,田世平. 酵母拮抗菌与碳酸氢钠配合对番茄果实采后病害的防治效果研究. 中国农业科学,2005,05:950-955. Xi L,Tian S P. Control of postharvest diseases of tomato fruit by combining antagonistic yeast with sodium bicarbonate.Scientia Agricultura Sinica,2005,05:950-955. |
| [6] | 康卓. 中国生物源农药产业化进展. 农药,2001,03:4-8. Kang Z.Current industrial advances of bio-pesticide in China. Agricultural Chemical,2001,03:4-8. |
| [7] | 卯晓岚. 中国食用菌物种资源回顾与展望. 中国食用菌,2000,19(增刊):9-13. Mou X L.Review and prospect of the species resources of edible fungi in China. Edible Fungi of China, 2000,19(extra edition):9-13. |
| [8] | Mier N,Canete S,Klaebe A,et al. Insecticidal properties of mushroom and toadstool carpophores. Phytochemistry,1996,41(5):1293-1299. |
| [9] | Stadler M,Sterner O. Production of bioactive secondary metabolites in the fruit bodies of macro fungi as a response to injury. Phytochemistry,1998,49(4):1013-1019. |
| [10] | 韩启灿,霍光华,罗桂祥,等. 野生冬菇产病原拮抗物的工艺参数确定.中国预防兽医学报,2014,03:208-213. Han Q C,Huang G H,Luo G X,et al. The fermentation process of anti-pathogenic bacteria substances produced by a wild Flammulina ssp. Chinese Journal of Preventive Veterinary Medicine,2014,03:208-213. |
| [11] | 李跃进,何晓兰,李泰辉. 中国食用菌已知科属的系统排列. 食用菌学报,2010,03:78-86. Li Y J,He X L,Li T H. Systematic arrangement of the families and genera of edible fungi reported in China. Acta Edulis Fungi,2010,03:78-86. |
| [12] | Halling R E. The genus Collybia(Agaricales) in the Northeastern United States and adjacent Canada. Mycologia Memoir,Cramer Publ,1983,8:148. |
| [13] | Antonín,V,Noordeloos M E. A monograph of Marasmius,Collybia and related genera in Europe. Part 2:Collybia,Gymnopus,Rhodocollybia,Crinipellis,Chaetocalathus,and additions to Marasmiellus. Libri Botanici,1997,17:256. |
| [14] | Antonin V,Finy P,Tomsovsky M. Taxonomy of the Gymnopus inusitatus group and the new G. inusitatus var. cystidiatus from Hungary. Mycotaxon,2012,119(1):291-299. |
| [15] | Mata J L,Ovrebo C L. New reports and illustrations of Gymnopus for Costa Rica and Panama. Fungal Diversity,2009,38:125. |
| [16] | Miyamoto T,Igarashi T. Gymnopus piceipes sp. nov. from Japan. Mycoscience,2001,42(2):177-180. |
| [17] | Banares A,Antonín V,Moreno G. Gymnopus beltraniae,a new species of section Vestipedes(Agaricales) from the Canary Islands(Spain). Persoonia-Molecular Phylogeny and Evolution of Fungi,2007,19(2):255-259. |
| [18] | 李跃进,李泰辉,图力古尔.中国裸伞属已知种的分布及1个大陆新记录种.菌物研究,2012,01:8-12. Li Y J,Li T H,Tu L G L.Distribution of known species of Gymnopilus from China and a new record to the Chinese mainland.Journal of Fungal Research,2012,01:8-12. |
| [19] | 易磊,霍光华,韩启灿,等. 木荷皂甙对稻瘟病菌细胞形态及生理生化指标的影响. 植物保护学报,2013,05:450-456. Yi L,Huo G H,Han Q C.Effects of saponins from Schima superba on cell morphology,physiological and biochemical indices of Magnaporthe oryzae. Acta Phytophylacica Sinica,2013,05:450-456. |
| [20] | 吴振宇,王燕,艾启俊.鹿蹄草素对桃褐腐病菌的抑制作用及其抑菌机理.中国农业科学,2009,08:2784-2792. Wu Z Y,Wang Y,Ai Q J. Inhibitory effect and antimicrobial mechanism of pyrolin on Monilinia fructicola in peach.Scientia Agricultural Sinica,2009,08:2784-2792. |
| [21] | Yang S,Peng L,Cheng Y,et al. Control of citrus green and blue molds by Chinese propolis. Food Science and Biotechnology,2010,19(5):1303-1308. |
| [22] | Sholberg P L,Shimizu B N. Use of natural plant product,hinokitiol,to extend shelf-life of peaches. Can Inst Food Sci Technol,1991(2):273-276. |
| [23] | 席钦芳,瞿传清,郑永华. 植物杀菌素抑制柑桔青绿霉菌的研究(简报). 浙江农业大学学报,1994,02:169-170. Xi Q F,Zhai C Q,Zheng Y H.Studies on the inhibitory effects of phytotoxins on Penicillium italicum Wehmer and P. Digitatum Sacc. Journal of Zhejiang Agricultural University,1994,02:169-170. |
| [24] | Wilson C L,Franklin J D,Otto B E. Fruit volatiles inhibitory to Monitinia fructicola and Botrytis cinerea. Plant Dis,1987,71:316. |
| [25] | 曾志恒,郑怡,刘艳如,等. 凤尾菇深层发酵液抗细菌抗真菌活性的研究. 福建师范大学学报(自然科学版),2010,03:72-77. Zeng Z H,Zheng Y,Liu Y R,et al.Study on antibacterial and antifungal activities of liquid from submerged fermentation of Pleurotus sajor-caju. Natural Science Journal of Fujian Normal University,2010,03:72-77. |
 2016, Vol. 36
2016, Vol. 36




