文章信息
- 许力, 熊炜, 杨江科
- XU Li, XIONG Wei, YANG Jiang-Ke
- 四种类型启动子控制下空肠弯曲杆菌血红蛋白对大肠杆菌生长速度的影响
- Four Types of Promoter Controlled Campylobacter jejuni Single Hemoglobin Improved the Growth of Escherichia coli
- 中国生物工程杂志, 2016, 36(2): 43-50
- China Biotechnology, 2016, 36(2): 43-50
- http://dx.doi.org/10.13523/j.cb.20160207
-
文章历史
- 收稿日期: 2015-09-09
- 修回日期: 2015-09-29
氧是好氧微生物进行能量和物质代谢的重要物质。氧参与微生物的新陈代谢,可使细胞能最高水平地利用底物产生能量。同时,它在细胞内通过改变特定蛋白的功能和影响细胞内转录子进而影响蛋白质的生物合成来参与多种细胞功能的调节[1]。由于气(氧气)/液(水相)传质阻力,氧的水溶解度非常低。各种微生物和培养的细胞对氧气的需求很高,尤其是在大规模和高细胞密度的生产工艺中。在工程领域中,通过改进发酵工艺参数和生物反应器的构型来满足和缓解细胞对氧的高需求,例如改进气/液混合率,改用高效率的分散系统与介质[2]等。但通过改变发酵参数和反应器等条件只能在有限范围内适用,所以生产菌对氧的需求量与发酵设备供氧仍是目前在微生物发酵工业中普遍存在的矛盾。
在生物体内,血红蛋白(hemoglobin)是与氧的利用率最密切相关的蛋白质分子。无论是在功能还是在分子结构上,它是最具有典型特征的氧结合蛋白质。透明颤菌血红蛋白(Vitreoscilla hemoglobin,VHb)是最早发现的细菌血红蛋白。1966年,Webster等[3]发现透明颤菌(Vitreoscilla)中存在一类氧结合蛋白,即VHb [3],后来被证明是血红蛋白[4, 5]。根据其结构不同,细菌血红蛋白主要分为三类:单结构域血红蛋白(single domain Hemoglobin,sdHb),只有一个结合氧的结构域;黄素血红蛋白(flavohemoglobins,flavoHb),比sdHb多一个还原酶结构域;截断血红蛋白(truncated Hemoglobin,trHb)。
在低氧的环境下,血红蛋白可将氧气传递给终端呼吸氧化酶,增强细胞的呼吸作用,从而提高ATP的产量[6]。1988年,Khosla和Bailey发现vgb基因的表达可有效提高大肠杆菌的生长水平[7]。随后,VHb广泛应用于众多宿主细胞中,既包括原核细胞,也包括真核的宿主细胞,如人细胞和烟草细胞。目前研究最成熟的是透明颤菌血红蛋白(VHb)。VHb在氧限量的条件下在多种异源宿主中表达,并已证明可以促进细胞生长和提高生产力。
本研究本着以开发新的细菌血红蛋白系统为目的,选取属于单结构域血红蛋白的空肠弯曲杆菌血红蛋白基因(Campylobacter jejuni hemoglobin,chb)为研究对象,构建含四种不同类型启动子的血红蛋白工程菌。比较分析了四种工程菌在摇瓶、蓝盖瓶以及发酵罐中对大肠杆菌生长的影响。并分析四种不同工程菌的生长情况、chb基因的表达量以及血红蛋白CO特征峰间的相互关系,并探索出获得适于发酵工业的新型重组大肠杆菌细胞株的新方式。
1 材料与方法 1.1 材 料本实验采用的宿主菌为大肠杆菌(Escherichia coli)DH5α和BL21,所用引物片段由上海生工公司合成。载体pMD-19T为宝生物工程公司产品。载体pET-28a为本实验室所保存。
质粒构建与操作采用《分子克隆手册》中的方法,限制酶和T4连接酶等为宝生物公司产品,其余为国产试剂。
1.2 方 法 1.2.1 全基因合成根据chb基因的序列设计15对引物片段,用二步法合成chb基因[8]。将这15对引物分成上游和下游两个部分,先用Assembly PCR得到chb基因的上游片段F1和下游片段F2,再用Overlap extention PCR将上下游片段连接,得到全长chb基因。再将chb与pMD-19T连接得到质粒pMD-19T-chb。同样的方法可合成低氧诱导型启动子Pvgh基因片段。
1.2.2 构建重组质粒根据NCBI上序列设计P2和PspoI-II引物,分别从大肠杆菌和芽孢杆菌SPO1基因组,通过PCR扩增获得组成型rRNA启动子P2和组成型强启动子PspoI-II,全基因合成得到低氧诱导启动子Pvgh,而IPTG诱导型启动子PT7为载体pET-28a所有。构建了两种类型四组不同重组质粒如图 1,将血红蛋白基因chb通过酶切位点插入pET-28a得到重组质粒pET-28a-chb(图 1A),将Pvgh与血红蛋白基因chb通过PCR拼接得到基因片段Pvgh-chb,基因片段Pvgh-chb通过酶切位点插入pMD-19T得到重组质粒pMD-19T-Pvgh-chb(图 1B),参照构建重组质粒pMD-19T-Pvgh-chb的方法,获得重组质粒pMD-19T-P2-chb(图 1C)和重组质粒pMD-19T-PspoI-II-chb(图 1D)。将重组质粒pET-28a-chb导入至E.coli BL21(DE3)中得到工程菌PT7-CHb,将重组子质粒pMD-19T-Pvgh-chb、pMD-19T-P2-chb、pMD-19T-PspoI-II-chb分别转化至DH5α得到工程菌Pvgh-CHb、P2-CHb、PspoI-II-CHb。
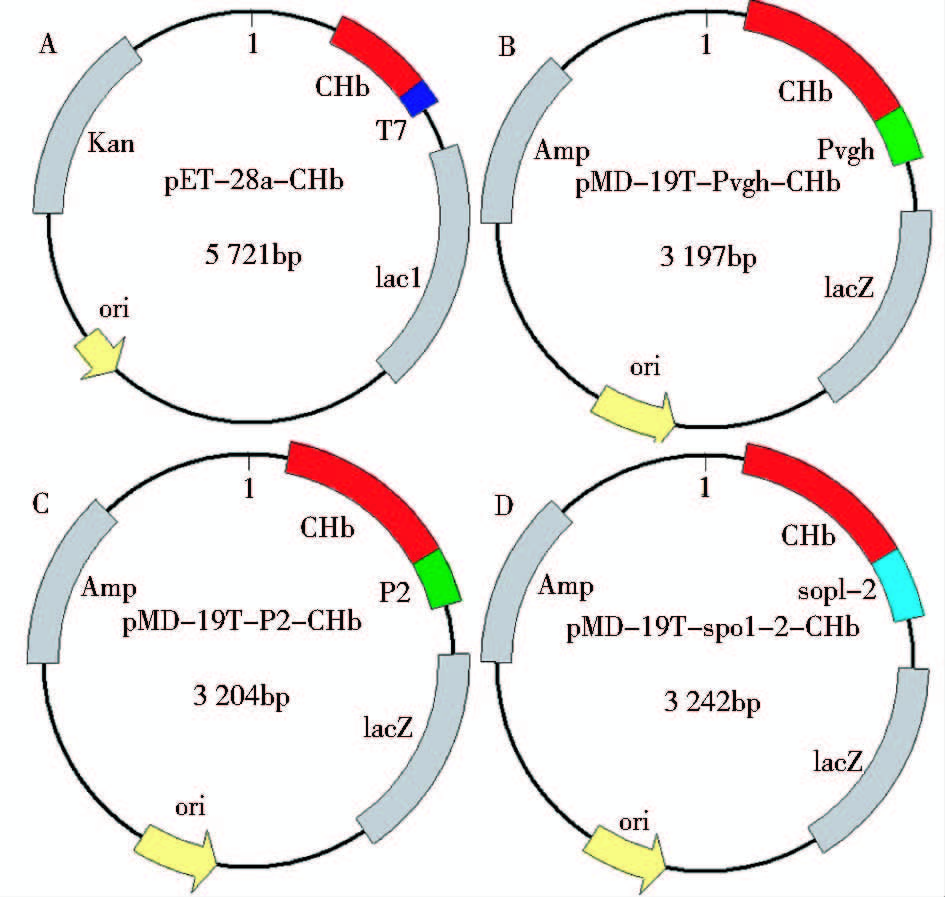
|
| 图 1 四种重组质粒图 Fig. 1 Four types of recombinant plasmids A: recombinant pET-28a-chb; B: recombinant pMD-19T-Pvgh-chb; C: recombinant pMD-19T-P2-chb; D: recombinant pMD-19T-PspoI-II-chb. Amp and Kan are coding sequences of resistance,ori is origin of plasmid, lacI and lacZ are coding sequences of lacI and lacZ |
将工程菌Pvgh-CHb、P2-CHb、PspoI-II-CHb接种至LB培养基(100 μg/ml Amp) 中37℃培养8 h后转接至新鲜的LB培养基(100 μg/ml Amp),37℃培养6 h,收集菌体。而工程菌PT7-CHb除将培养基换了LB (50 μg/ml Kan)外,还需在转接后加IPTG诱导方可收集菌体。
将收集的菌体用Protein Buffer(Tris-HCl 20 mm,NaCl 150 mm,DTT 20 μm,NP-40 0.1%)悬浮后,用低温高压破碎仪破碎,12 000 r/min,4℃,20 min离心收集上清即粗蛋白液。用15%的SDS-PAGE检测表达的蛋白大小是否正确。
1.2.4 四种工程菌在有氧水平下的发酵情况将工程菌PT7-CHb及对照pET-28a,Pvgh-CHb、P2-CHb、PspoI-II-CHb及对照pMD-19T活化后,以1/50比例接种至含相应抗生素的LB液体培养基中,37℃培养,培养用的摇瓶为棉塞摇瓶,通气性良好。取接种前培养基为参比,接种后每2 h取样测两组空白对照菌及四组工程菌的OD600值。
1.2.5 四种工程菌在低氧水平下的发酵情况将工程菌PT7-CHb及对照pET-28a,Pvgh-CHb、P2-CHb、PspoI-II-CHb及对照pMD-19T活化后,以1/50比例接种至含相应抗生素的LB液体培养基中,37℃培养,培养用的摇瓶为蓝盖瓶,接种前除气且密封性良好。取接种前培养基为参比,接种后每2 h取样测两组对照菌及四组工程菌的OD600值。
1.2.6 四种工程菌在发酵罐中的应用将工程菌PT7-CHb及对照pET-28a,Pvgh-CHb、P2-CHb、PspoI-II-CHb及对照pMD-19T活化后,以1/100比例接种含相应抗生素及LB液体培养基的发酵罐中,37℃培养。取接种前培养基为参比,接种后每2 h取样测两组对照菌及四组工程菌的OD600值和称量50 ml培养基离心后所得的细胞鲜重,并记录当时的发酵条件即温度、转速、溶氧。在细胞生长至稳定期后收集菌体进行CO差式光谱检测,估测其活性蛋白表达量。
1.2.7 CO差式光谱检测活性血红蛋白血红蛋白的CO络合态及还原态均在419 nm左右具有特征吸收峰,而CO差光谱是指血红蛋白的CO络合态与还原态吸光值之差。如果工程菌的CO差光谱检测存在差值则证明血红蛋白是有活性的。
用上述提到的方法参见1.2.3 节,得到对照菌和工程菌的粗蛋白液,向粗蛋白液中加入连二亚硫酸钠至终浓度为50 mg/ml,混匀后冰浴20 min,将每一份对照菌和工程菌的粗蛋白液分成相同两份,其中一份通入CO 10 min再暗处理10 min形成血红蛋白的CO络合态,另一份用空气代替CO做通气处理,形成血红蛋白的CO还原态,作为对照。样品处理完毕后,12 000 r/min,4℃,离心20 min,取上清,用全波长分光光度计(DU640-Backman)在400 nm至600 nm扫描样品。
2 结 果 2.1 血红蛋白基因在大肠杆菌中的表达用1.2.3 的方法得到对照菌和工程菌的粗蛋白液,用柱层析进行纯化,其蛋白液表观特征如图 2A所示,蛋白液颜色呈红色,蛋白浓度越高红色越深,与血红蛋白的表观特征一致。取蛋白液用SDS-PAGE检测。四种工程菌纯化蛋白的浓度有差异,但目的条带大小均在20.1-14.3 kDa(图 2B)。根据计算,血红蛋白基因chb表达的蛋白大小应为17.4 kDa,实际得到的目的条带大小与预计相符,初步确定表达的CHb蛋白大小正确。
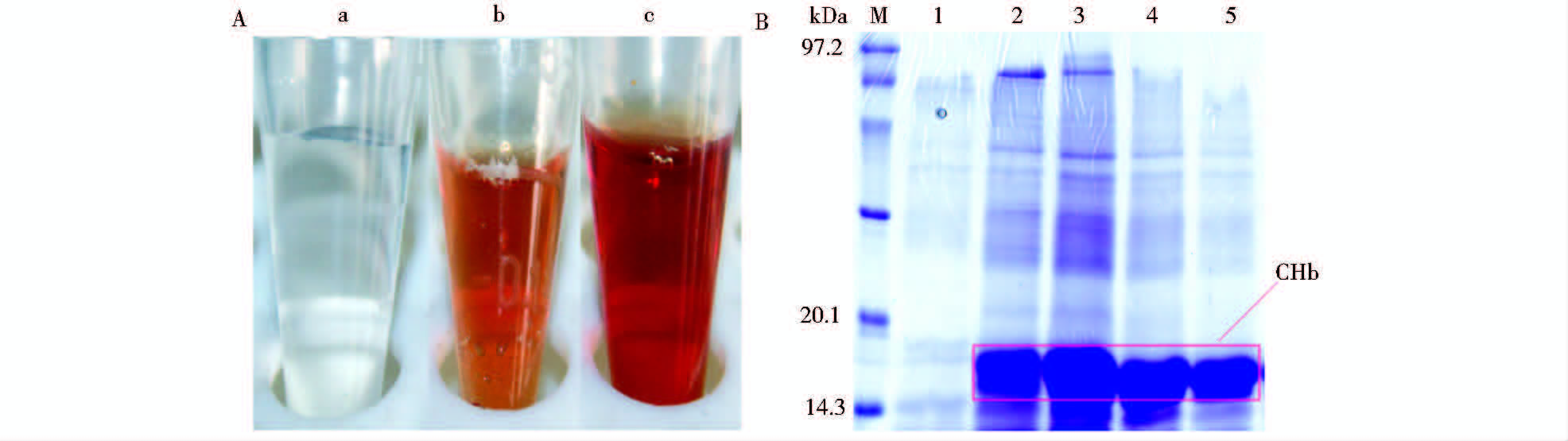
|
| 图 2 SDS-PAGE检测chb基因的表达 Fig. 2 The analysis of chb by SDS-PAGE a:The protein of the control;b:The pure CHb, 4 mg/ml;c: The pure CHb, 8 mg/ml; M:Protein Molecular Weight Marker (Low); 1: Protein expressed by control; 2: Protein expressed by PT7-CHb;3: Protein expressed by Pvgh-CHb; 4: Protein expressed by P2-CHb; 5: Protein expressed by PspoI-II-CHb |
在有氧条件下发酵,接种后每2 h测工程菌菌液的OD600值。结果如图 3所示,工程菌PT7-CHb在诱导后生长优于其对照pET-28a,在对数生长期菌密度OD最高达到2.2,比对照高22%;Pvgh启动子的工程菌Pvgh-CHb在有氧条件下的生长趋势与对照相当,可能是由于Pvgh是低氧诱导启动子,在低氧的情况下才表达有功能的CHb;工程菌P2-CHb由于出现自溶现象,达到对数期的时间比对照晚7.5 h。工程菌PspoI-II-CHb从对数初期到稳定期就一直优于对照菌,在24 h是达到最高点OD600为2.18,比对照高21.1%。综上所述,在 T7启动子和PspoI-II控制下,chb成功表达,提高了有氧条件下大肠杆菌的生长速度。
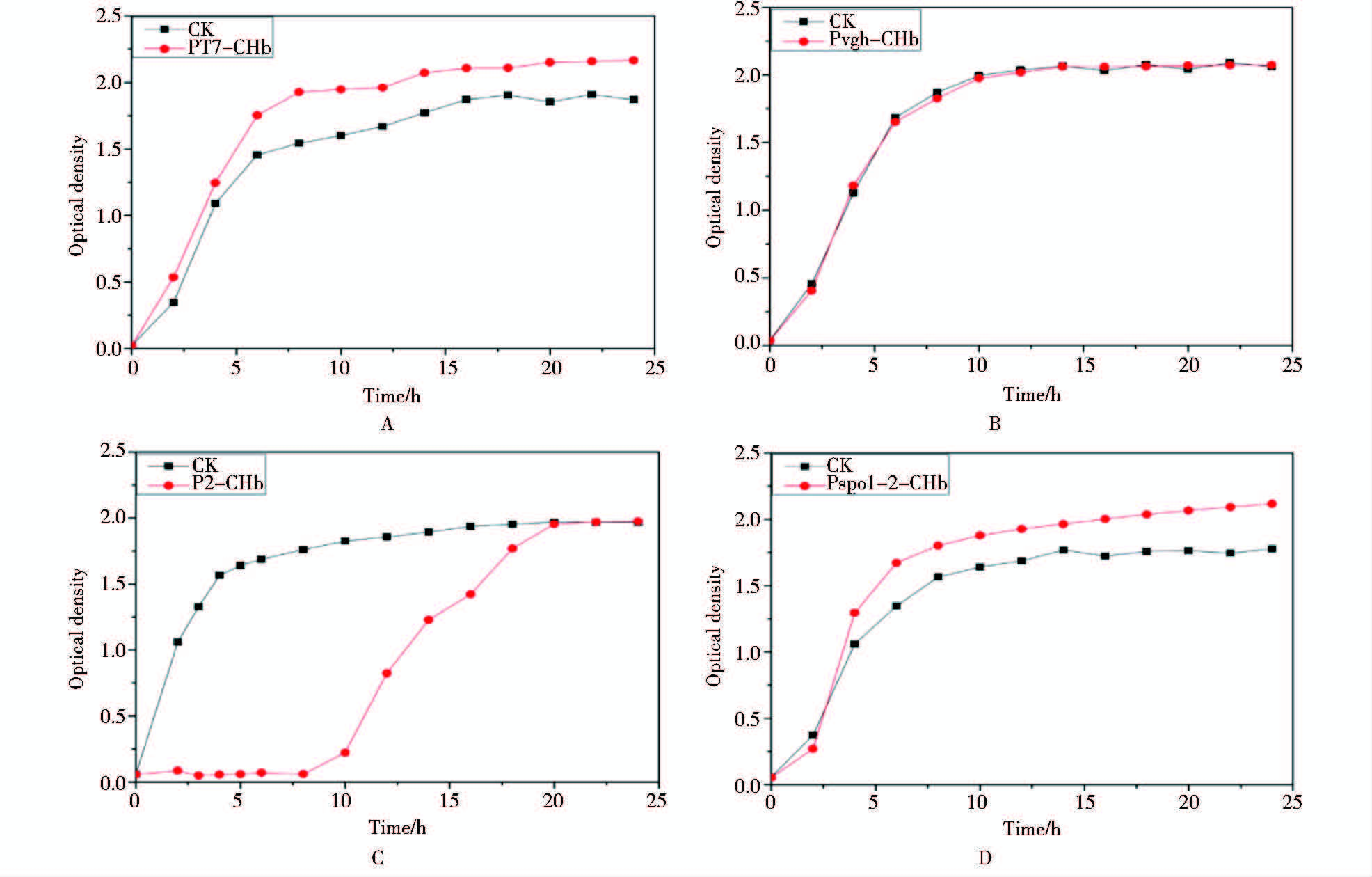
|
| 图 3 四种工程菌在有氧条件下的生长曲线 A: 含IPTG诱导型T7启动子的工程菌PT7-CHb有氧条件下的生长曲线;B:含低氧诱导型启动子Pvgh的工程菌Pvgh-CHb有氧条件下的生长曲线;C:含组成型rRNA启动子P2的工程菌P2-CHb有氧条件下的生长曲线;D:含组成型强启动子PspoI-II的工程菌PspoI-II-CHb有氧条件下的生长曲线 Fig. 3 Growth curves of the recombinants PT7-CHb (A), Pvgh-CHb(B), P2-CHb (C), PspoI-II-CHb(D) and the controls in flask culture |
在低氧条件下发酵,接种后每2 h测工程菌菌液的OD600值。结果如图 4所示,工程菌PT7-CHb在诱导后生长曲线呈峰型,比对照pET-28a达到稳定期晚,在对数生长末期菌密度OD600最高达到1.4,对照只有0.65;在低氧条件下,工程菌Pvgh-CHb从2 h开始生长速度就高于对照,最高时比对照高45.8%,充分体现了Pvgh启动子低氧诱导的特性;工程菌P2-CHb在接种后再次由于自溶现象,12 h才达到对数期;含工程菌PspoI-II-CHb在14 h时OD600达到最高点为1.6,比对照高45.5%。综上所述,在 T7启动子、Pvgh启动子、 PspoI-II启动子控制下,chb成功表达。说明在低氧水平下,空肠弯曲杆菌血红蛋白CHb的表达可以提高细菌的生长能力,提高的程度与启动子有密切联系,诱导性启动子在相应的诱导条件下才会诱导表达血红蛋白进而提高细菌的生长。P2启动子由于在两种条件下均发生自溶,而无法判断是否启动了血红蛋白在大肠杆菌中的表达。
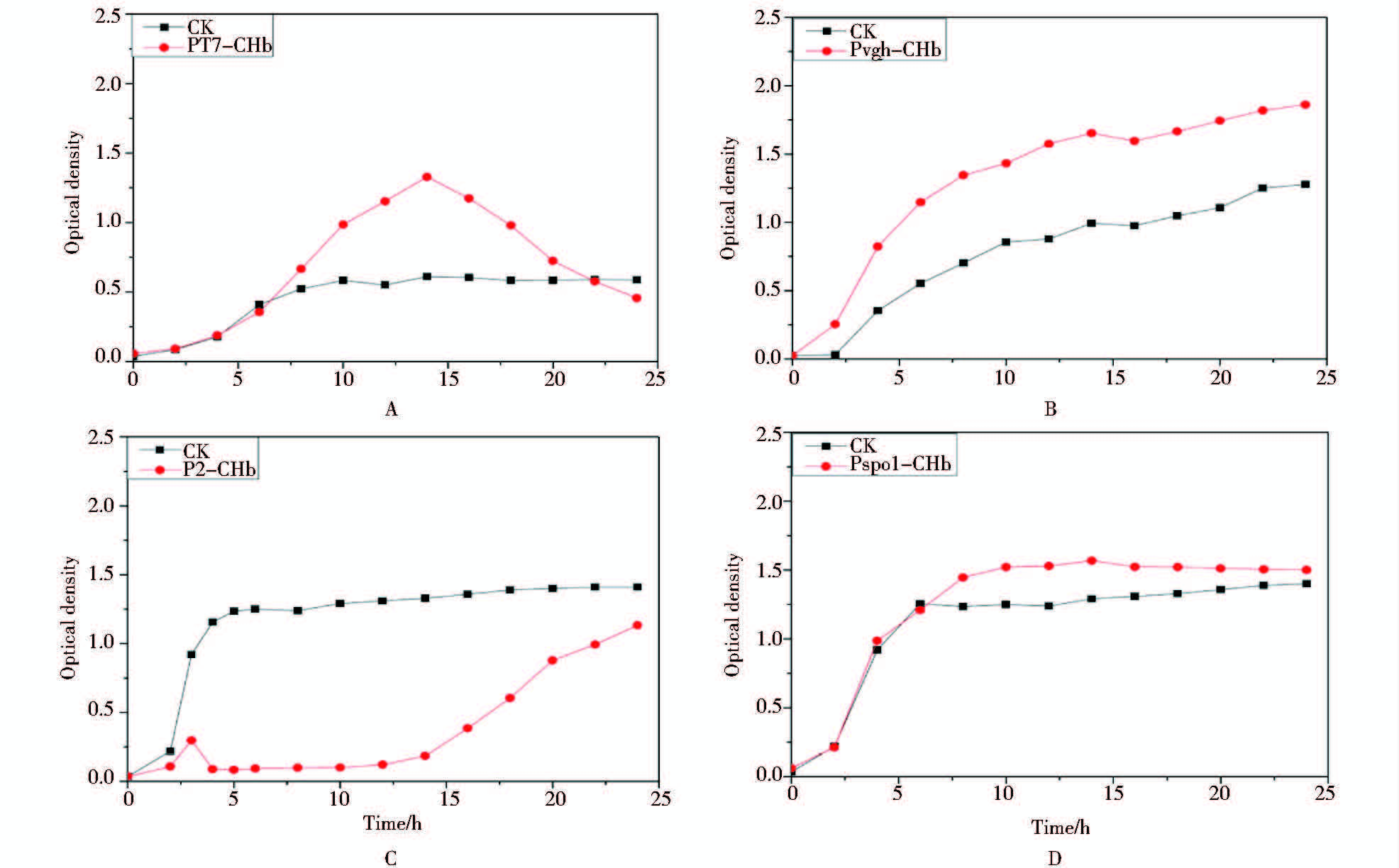
|
| 图 4 四种工程菌在低氧条件下的生长曲线 A: 含IPTG诱导型T7启动子的工程菌PT7-CHb低氧条件下的生长曲线;B:含低氧诱导型启动子Pvgh的工程菌Pvgh-CHb低氧条件下的生长曲线;C:含组成型rRNA启动子P2的工程菌P2-CHb低氧条件下的生长曲线;D:含组成型强启动子PspoI-II的工程菌PspoI-II-CHb低氧条件下的生长曲线 Fig. 4 Growth curves of the recombinants PT7-CHb (A), Pvgh-CHb (B), P2-CHb (C), PspoI-II-CHb (D) and the controls in anaerobic capped bottles |
为了检验空肠弯曲杆菌血红蛋白基因chb是否能促进发酵罐中细胞的生长,本研究用5 L发酵罐代替摇瓶作为发酵容器,每2 h取样测菌密度OD600、称量50 ml培养基离心后所得的细胞鲜重,并记录当时的发酵条件即温度、转速、溶氧。菌密度、细胞鲜重以及发酵条件如图 5所示。由于温度、pH等条件可以控制,工程菌在发酵罐中的生长状态比摇瓶好,对照菌pET-28a在发酵罐中菌密度OD600可以达到2.2,细胞鲜重可以达到14 g/L。工程菌PT7-CHb在发酵10 h 时菌密度最高为2.5,细胞鲜重为17.5 g/L,菌密度比对照高16.3%,鲜重比对照高25%。对照菌pMD-19T在发酵罐中菌密度OD600可以达到2.15,菌体湿重量可以达到14 g/L。工程菌Pvgh-CHb在发酵过程中菌密度最高为2.4,鲜重为18 g/L,菌密度比对照高14.3%,湿重比对照高28.6%。工程菌P2-CHb在发酵10 h时菌密度最高为3.3,湿重为46 g/L,在14 h时湿重降到12 g/L。工程菌PspoI-II-CHb在发酵过程中菌密度最高为2.25,湿重为15.5 g/L,菌密度比对照高9.5%,湿重比对照高12.8%。综上所述,四种工程菌,无论是菌密度还是细胞鲜重都明显高于对照,提高了细菌的生长能力。
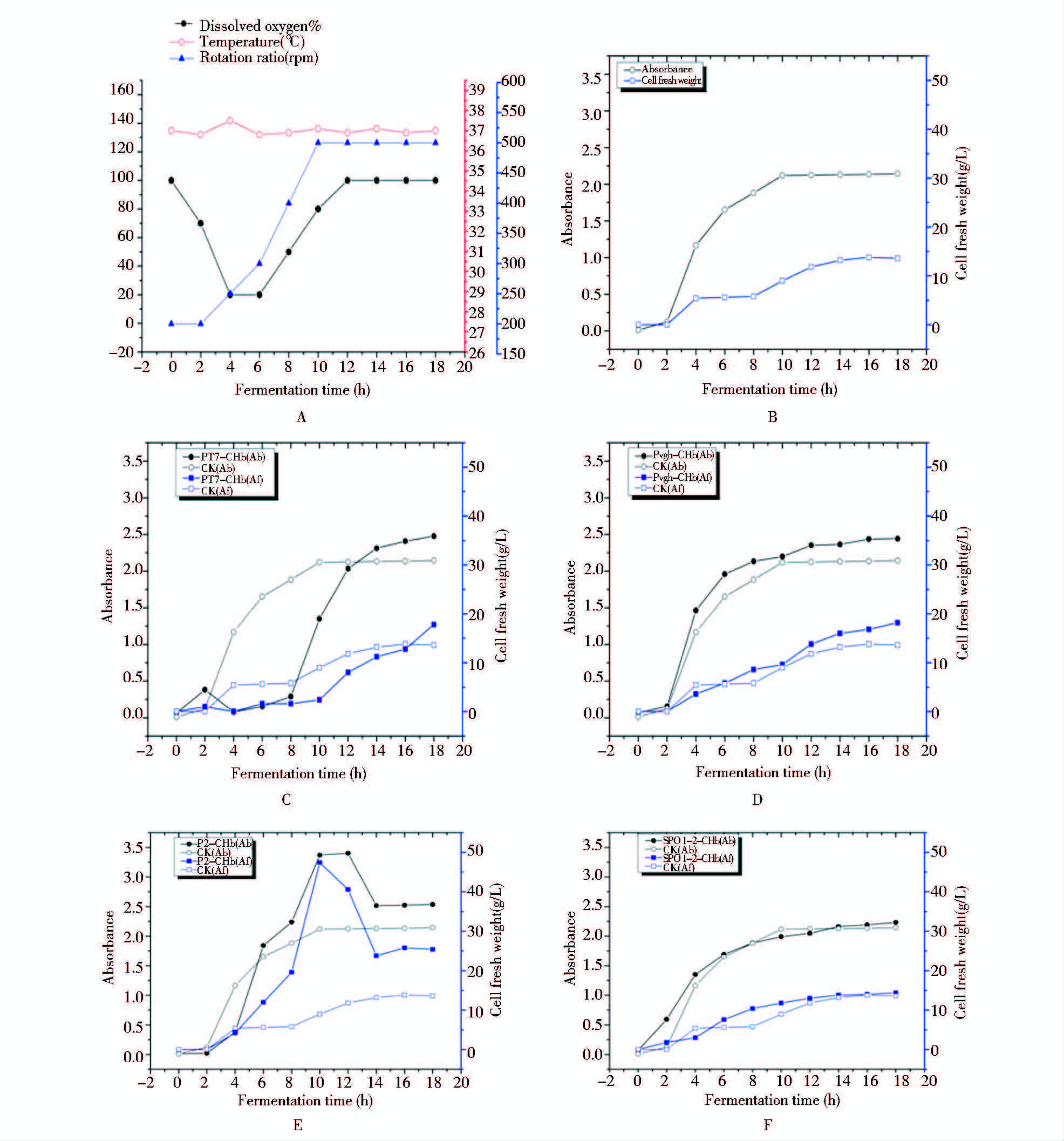
|
| 图 5 四种工程菌在发酵罐中的生长情况 Fig. 5 Cultivation parameters and growth conditions of the recombinant cells in the 5-L bioreactor A: The cultivation parameters; B: The density and wet cell weight change of the control cells carrying the empty vector; C: The density and wet cell weight change of the recombinant PT7-CHb; D: The density and wet cell weight change of the recombinant Pvgh-CHb; E: The density and wet cell weight change of the recombinant P2-CHb; F: The density and wet cell weight change of the recombinant PspoI-II-CHb |
通过SDS-PAGE检测得到chb基因在大肠杆菌中表达的血红蛋白CHb大小正确,为了验证血红蛋白是否正确折叠,是否具有血红蛋白的特性,我们用CO差式法检测四种处理过的工程菌粗蛋白液在400 nm~430 nm是否出现特征峰。如图 6所示,四种工程菌均出现CO特征吸收峰,主特征峰出现在414 nm处,透明颤菌血红蛋白VHb的CO特征吸收峰出现在419 nm[9],说明CHb是不同于VHb的另一种血红蛋白,并且在大肠杆菌中成功表达出了有活性的血红蛋白。四种工程菌的CO特征峰出现在同一位置,但峰高因启动子启动程度不同而不同,在诱导性启动子中,T7启动子比Pvgh启动子的启动chb表达的活性蛋白量高,在组成型启动子中,P2启动子启动chb表达的活性蛋白量高于PspoI-II启动子。
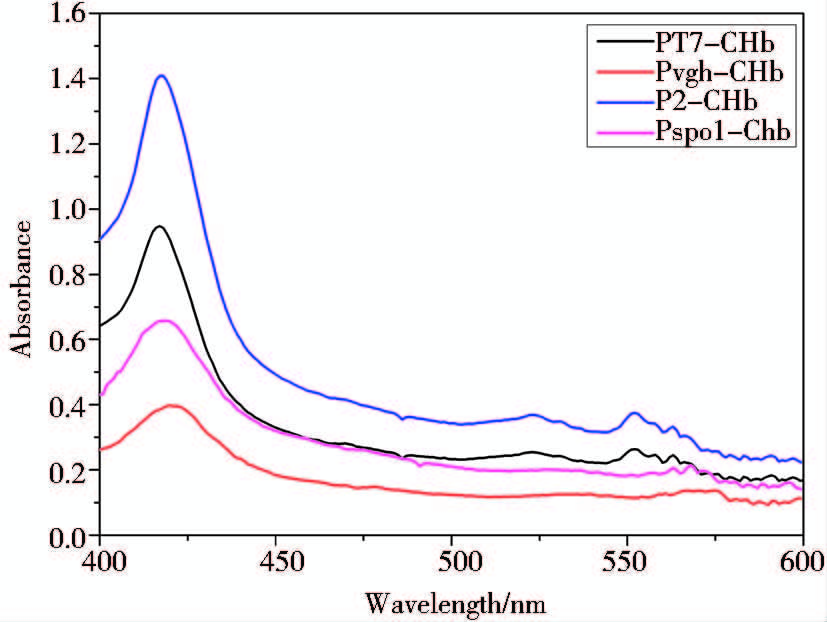
|
| 图 6 CO差试检测发酵罐中四种工程菌 中CHb的特征峰 Fig. 6 CO differential spectrum assays of the CHb in four recombinant cultures in the bioreactor |
目前,在细菌中共发现单结构域血红蛋白、黄素血红蛋白和截断血红蛋白等三类血红蛋白。尽管血红蛋白广泛分布于细菌中,但目前研究最为透彻,在生物工程领域应用最多的仅有来自透明颤菌的单结构域的血红蛋白(VHb),而其他血红蛋白的研究较少。本研究本着以开发新的细菌血红蛋白系统为目的,选取属于单结构域血红蛋白的空肠弯曲杆菌血红蛋白基因为研究对象,构建含四种不同启动子的血红蛋白工程菌。实验中,四种重组菌不仅在微氧条件比对照菌生长更快,而且在氧气充足的条件下,也能促进细胞生长,说明在正常溶氧时,细胞生长并未达到最佳生长状态,细胞生长潜力仍有待挖掘。四种不同的启动子在启动chb基因表达血红蛋白CHb时,不仅都成功启动了表达,而且在表达蛋白过程中体现了各自的特点。Pvgh是低氧诱导启动子,在溶氧值较低时,Pvgh才被诱导启动[10],如图 3B和图 4B,可以得知,在有氧条件下,Pvgh是不启动血红蛋白的表达,只有在低氧条件时才启动,Pvgh这种“经济节约”特性能使工程菌既能在氧气充足时无负担生长,又能在氧气缺乏时及时提高其氧结合能力,维持正常生长。同时有研究证明Pvgh可以增强vhb基因在透明颤菌和大肠杆菌中的表达[11, 12, 13, 14],如图 5D和图 6,在发酵罐中,工程菌Pvgh-CHb的菌密度和菌体量都比对照高,同时CO差试检测出了有活性血红蛋白,虽活性蛋白量不大,但促进了CHb的表达,且契合Pvgh “经济节约”的特性。
工程菌PT7-CHb的启动子是诱导型的T7启动子,需加IPTG进行诱导,且在37℃时,短时间内即被消耗殆尽[15, 16],如图 3A和4A,可以得知,在对数初期加入IPTG后,工程菌PT7-CHb的菌体量较对照都有明显的增加,且在低氧时尤为突出。在有氧条件下,工程菌和对照菌的生长较同步,同时抵达对数期和稳定期,但工程菌每个时期的菌体量都比对照高;而在低氧条件下,对照菌由于缺少氧气生长受到抑制,工程菌的生长却不受影响,与在有氧条件下不同的是,工程菌在稳定期出现自溶,可能是因为对数期大量繁殖消耗了氧气,而所剩氧气不能维持稳定期大量细胞的生长。如图 5C,在发酵罐中,2 h时,加入IPTG,抑制了菌体的生长,8 h时工程菌才开始进入对数期,并最终在菌密度和菌体量超过对照,而在图 6中,其活性蛋白表达量仅次于工程菌P2-CHb,可见,加入诱导物后,T7启动子会启动蛋白大量表达。
P2是大肠杆菌组成型强启动子[17],如图 3C和图 4C,在实验中,工程菌P2-CHb的生长在摇瓶中出现自溶,可能是因为发酵容器容量有限,细菌容纳量不足,限制了细菌的大量繁殖,导致大量增长的细菌瞬间死亡,而在稳定期后期才逐渐生长。在发酵罐中呈现峰状如图 5E,菌体在稳定期出现自溶,可能是营养耗尽,所有的生物量都在对数末期积累,高于与其他几种工程菌的最高生物量,且在图 6中,其活性蛋白表达量最高。
PspoI-II是芽胞杆菌SPO1的组成型启动子[18],如图 3D和图 4D,虽然在大肠杆菌中也同样能启动CHb的表达,两种条件下,都是在对数中后期,才在菌密度上超过对照,如图 5F,由于宿主差异,工程菌在发酵罐中表现平平,且活性蛋白表达量仅比工程菌Pvgh-CHb略高(图 6)。
综上所述,在生物反应器,空肠弯曲杆菌的单域血红蛋白CHb可以增加细胞密度和生物量,提高对氧气的利用能力,促进细胞生长和产物合成,而chb基因可以在启动子PT7、 Pvgh、 P2和PspoI-II控制下有效表达。本研究中开发的系统可以用来克服生物反应器无法提供足够的氧气满足细菌的需求的困难。因此我们下一步工作的重心将转向在酵母中发酵。期望利用分子克隆技术解决酵母发酵过程中的氧气供求矛盾、目的产物的产量和收率及实现高密度发酵,降低氧气及能量的消耗,减少附加的设备投资,从而大大降低发酵成本。
致谢 感谢武汉轻工大学2013研究生创新基金(2013CX019)对本研究的支持。
| [1] | Frey A D, Kallio P T. Bacterial hemoglobins and flavohemoglobins:versatile proteins and their impact on microbiology and biotechnology. FEMS Microbiol Rev, 2003, 27(4):525-545. |
| [2] | Konz J O, King J, Cooney C L. Effects of oxygen on recombinant protein expression. Biotechnol Prog, 1998, 14(3):393-409. |
| [3] | Webster D A, Hackett D P. The purification and properties of cytochrome o from Vitreoscilla. J Biol Chem, 1966, 241(14):3308-3315. |
| [4] | DeMaio R A, Webster D A, Chance B. Spectral evidence for the existence of a second cytochrome o in whole cells of Vitreoscilla. J Biol Chem, 1983, 258(22):13768-13771. |
| [5] | Wakabayashi S, Matsubara H, Webster D A. Primary sequence of a dimeric bacterial haemoglobin from Vitreoscilla. Nature, 1986, 322(6078):481-483. |
| [6] | Khosla C, Bailey J E. Heterologous expression of a bacterial hemoglobin improves the growth properties of recombinant Escherichia coli. Nature, 1988, 331(6157):633-635. |
| [7] | Ramandeep, Hwang K W, Raje M, et al. Vitreoscilla hemoglobin:intracellular localization and binding to membranes. J Biol Chem, 2001, 276(27):24781-24789. |
| [8] | Yang J K, Chen F Y, Yan X X, et al. A simple and accurate two-step long DNA sequences synthesis strategy to improve heterologous gene expression in Pichia. PLoS One 2012,7(5):e36607. |
| [9] | Khosla C, Bailey J E. The Vitreoscilla hemoglobin gene:molecular cloning, nucleotide sequence and genetic expression in Escherichia coli. Mol Gen Genet,1988, 214(1):158-161. |
| [10] | Khosla C, Bailey J E. Characterization of the oxygen-dependent promoter of the Vitreoscilla hemoglobin gene in Escherichia coli. J Bacteriol, 1989,171(11):5995-6004. |
| [11] | Dikshit K L, Spaulding D, Braun A, et al. Oxygen inhibition of globin gene transcription and bacterial hemoglobin synthesis in Vitreoscilla. J Gen Microbiol, 1989, 135(10):2601-2609. |
| [12] | Joshi M, Dikshit K L. Oxygen dependent regulation of Vitreoscilla globin gene:evidence for positive regulation by FNR. Biochem Biophys Res Commun, 1994, 202(1):535-542. |
| [13] | Tsai P S, Kallio P T, Bailey J E. Fnr, a global transcriptional regulator of Escherichia coli, activates the Vitreoscilla hemoglobin(vhb promoter) and intracellular VHb expression increases cytochrome d promoter activity. Biotechnol Prog, 1995, 11(3):288-293. |
| [14] | Unden G, Schirawski J. The oxygen-responsive transcriptional regulator FNR of Escherichia coli:the search for signals and reactions. Mol Microbiol, 1997, 25(2):205-210. |
| [15] | Rehm B H, Qi Q, Beermann B B, et al. Matrix-assisted in vitro refolding of Pseudomonas aeruginosa class Ⅱ polyhydroxyalkanoate synthase from inclusion bodies produced in recombinant Escherichia coli. Biochem J, 2001, 358(Pt 1):263-268. |
| [16] | Tabor S, Richardson C C. A bacteriophage T7 RNA polymerase/promoter system for controlled exclusive expression of specific genes. Proc Natl Acad Sci U S A, 1985,82(4):1074-1078. |
| [17] | Liang S, Bipatnath M, Xu Y, et al. Activities of constitutive promoters in Escherichia coli. J Mol Biol, 1999, 292(1):19-37. |
| [18] | Osburne M S, Craig R J. Activity of two strong promoters cloned into Bacillus subtilis. J General Microbiol, 1986, 132(2):565-568. |
 2016, Vol. 36
2016, Vol. 36




