文章信息
- 段建平, 李莹, 阚云超, 姚伦广, 夏庆友
- DUAN Jian-ping, LI Ying, KAN Yun-chao, YAO Lun-guang, XIA Qing-you
- 家蚕雄dsxM3异位表达对下游靶基因表达的影响
- Ectopical Expression of Silkworm Male-specific dsxM3 and Its Effect on Downstream Targets
- 中国生物工程杂志, 2016, 36(2): 38-42
- China Biotechnology, 2016, 36(2): 38-42
- http://dx.doi.org/10.13523/j.cb.20160206
-
文章历史
- 收稿日期: 2015-09-01
- 修回日期: 2015-09-21
2. 南阳师范学院河南省伏牛山昆虫生物学重点实验室 南阳 473061
2. Henan Provincial Key Laboratory of Funiu Mountain Insect Biology, Nanyang Normal University, Nanyang 473061, China
家蚕(Bombyx mori)作为一种具有重要经济价值的绢丝昆虫,其性别调控分子机制研究将有助于雄蚕单养和鳞翅目害虫生物防治。同果蝇类似,家蚕也遵循“初始信号→关键基因→双性基因”的性别决定信息传递基本模式。家蚕性别决定初始信号研究最近取得重大进展,其雌雄发育受W染色体上的Fem piRNA控制[1],但家蚕性别决定关键基因研究一直未取得突破,现有研究表明果蝇性别决定关键基因(sex-lethal,sxl)在家蚕中的同源体sxl很可能不是家蚕性别决定关键基因[2]。家蚕双性基因(B. mori doublesex,Bmdsx)作为调控雌雄差异发育的关键节点,通过选择性剪接产生性别特异功能蛋白Dsx,调控下游靶基因的雌雄差异表达,影响雌雄发育。
有报道Bmdsx具有两个雌特异剪接体(BmdsxF1和BmdsxF2)和一个雄特异剪接体(BmdsxM1),其异位表达可引起3个下游靶基因(SP1、Vg和PBP)的表达水平发生变化[3, 4, 5]。为寻找家蚕性别发育调控机制的突破口,据参考文献[6]报道:黄勇平教授课题组曾对Bmdsx的雌特异外显子进行过特异敲除分析,本课题组段建平(Duan J P)等[7, 8]曾对Bmdsx的剪接方式和表达形式进行过深入系统分析,并对Bmdsx控制雌雄差异发育的分子机制进行过初步探讨[9],取得了很大进展,但离完全揭示还有很大距离。在发现的新剪接体中,BmdsxM3可编码一种不同于BmDsxM1的新蛋白BmdsxM3,BmDsxM1参与家蚕体细胞性别发育调控[4, 9],但BmDsxM3是否参与家蚕体细胞性别发育调控,还不清楚。为探讨BmDsxM3的功能,本文利用转基因在雌蚕中异位表达雄DsxM3蛋白,通过检测下游靶基因SP1、Vg和PBP的表达水平是否发生变化,分析BmDsxM3是否参与家蚕体细胞性别发育。
1 材料与方法 1.1 材 料供试家蚕品种大造(P50),质粒pHA4PIG、1180A4SV40、T-dsxM3和pBac[3xp3EGFPafm],均由本实验室保存或构建。超纯质粒抽提试剂盒QIAGEN Plasmid Mini Kit购于QIAGEN公司,胶回收试剂盒购于TRANSGEN公司,限制性内切酶AscI购于NEG公司,其它限制性内切酶、DNA连接酶及反转录试剂购于TaKaRa公司。
1.2 方 法 1.2.1 转基因载体的构建用BamH I和Not I双酶切T-dsxM3,回收dsxM3片段,与经同样双酶切处理的1180A4SV40连接,获得1180A4dsxM3SV40;用AscI单酶切1180A4dsxM3SV40,回收A4dsxM3SV40片段,与经同样酶切处理的pBac[3xp3EGFPafm]连接,获得pBac[3xp3EGFP,A4dsxM3]转基因载体。
1.2.2 显微注射与荧光检测提超纯转基因质粒,与pHA4PIG按摩尔比1∶1比例混合后注射到解除滞育的家蚕早期胚胎。孵化的G0代幼虫正常饲养至成虫后回交制种,在G1代胚胎期筛选转基因阳性个体。
1.2.3 反向PCR、Southern blot、W染色体特异PCR抽提G1代转基因阳性个体蛾子的基因组,用于反向PCR、Southern blot、及W染色体特异PCR分析,相关方法均按参考文献[7]进行。
1.2.4 转基因表达分析及定量PCR分析抽提G2代五龄三天雌蚕幼虫脂肪体和蛾期雌蚕触角RNA,反转录为cDNA。转基因表达分析和定量PCR分析,均按参考文献[7]进行。
2 结果与分析 2.1 转基因家蚕的获得本课题组曾对Bmdsx的表达形式进行深入分析,发现新剪接体BmdsxM3主要在雄蚕的头、脂肪体、马氏管、气管、精巢等5个组织中表达,其余组织中表达量很低,而在雌蚕中不表达[8]。结构特征也显示BmdsxM3与BmdsxM1一样,都不含雌特异外显子(图 1a)。因此,BmdsxM3是一种新的雄特异剪接体。由于新外显子2n在第1、2外显子之间的插入,导致BmDsxM3较BmDsxM1多27aa(图 1b)。有报道BmDsxM1参与家蚕性别发育调控[4],但BmDsxM3是否具有类似的功能,未见报道。为探讨BmDsxM3的生物学功能,首先构建由A4启动子驱动BmdsxM3表达的转基因载体pBac[3xp3EGFP,A4dsxM3]。将载体注射入家蚕早期胚胎,共注射300粒,孵化60粒(孵化率20%)。孵化后的幼虫饲育至G0代蛾后回交制种,在胚胎期筛到2个阳性蛾圈,共43个阳性个体(表 1)。再将孵化后的幼虫饲育至蛾期,置于荧光显微镜下镜检后制种(图 2)。将获得的转基因品系分别命名为T1、T2。
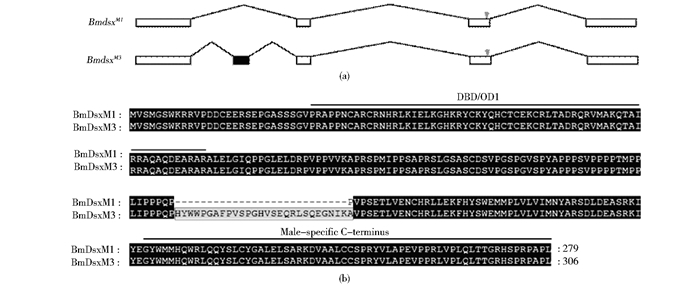
|
| 图 1 BmdsxM3剪接体及其编码的蛋白质序列 Fig. 1 The male-specific splice form BmdsxM3 and its amino acid sequence (a)Comparison of the structures of the two splice forms BmdsxM1 and BmdsxM3 Black box represents exon 2n (b) Alignment analysis of the two BmDsx proteins BmDsxM1 and BmdsxM3 |
| Silkworm strain | Number of injected embryos | Number of hatched embryos | Number of backcrosses | Number of broods with positive larvae | Number of positive G1 larvae | Number of positive G1day-1 fifth instar larvae | |
| Femal | Male | ||||||
| P50 | 300 | 60(20%) | 36 | 2(5.6%) | 43 | 19 | 24 |
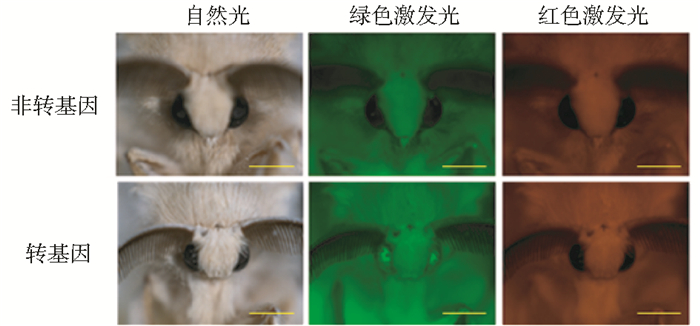
|
| 图 2 G1代转基因家蚕阳性个体的检测 Fig. 2 G1 transgenic silkworm positive for EGFP fluorescence in the eyes |
为进一步了解BmdsxM3在基因组中的插入位置信息,首先从T1、T2转基因品系中各取1份基因组DNA,分别进行反向PCR扩增,对扩增片段进行克隆、测序和染色体房侧序列分析(图 3A)。发现外源基因在两个转基因品系中都插入到基因间区,两侧都未发现与性别发育相关的重要基因;发现转基因品系T1含2个基因组插入位点,与Southern blot检测此转基因品系的插入拷贝数一致(图 3Ba);发现转基因品系T2含1个基因组插入位点,与Southern blot检测此转基因品系的插入拷贝数一致(图 3Bb)。
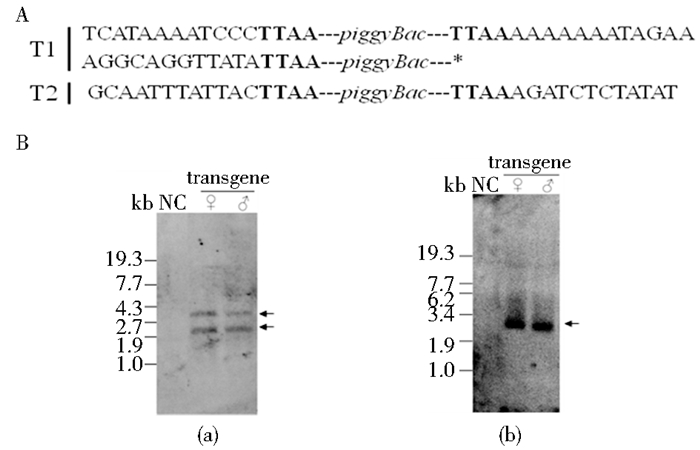
|
| 图 3 外源基因BmdsxM3在家蚕基因组中的插入分析 Fig. 3 Insertion of the exogenous gene BmdsxM3 into the chromosome of transgenic silkworm A:Genomic sequence surrounding the piggyBac insertions,with the TTAA duplicated sequence appearing at all 5′and 3′insert boundaries. Asterisk indicates the failure of determining the genomic sequence surrounding one arm of transposon. B: Genomic Southern blot analysis to verify the transgenic insertion. Genomic DNA from wildtype silkworms was used as negative control(NC) |
为验证外源基因BmdsxM3在转基因品系中是否成功表达,利用转基因特异引物对转基因和非转基因雌雄个体进行RT-PCR检测,结果只在转基因雌雄个体中扩增出特异条带,非转基因雌雄个体中未扩增出条带(图 4),表明BmdsxM3在转基因品系中确实被A4启动子驱动后成功表达。

|
| 图 4 外源基因BmdsxM3在转基因家蚕中的表达 Fig. 4 The expression of BmdsxM3 in transgenic silkworm strain |
对G1代转基因阳性个体的外部表型进行观察,并未出现发育异常。对G1代孵化的转基因阳性个体进行性别比例调查,发现雌雄个体数相差不大,大致相当,性别比例未偏离1∶1的正常性比例(表 1)。后来,在对转基因品系的继代饲养中,同样发现转基因雌雄的性比例都遵循1∶1的正常性比例。暗示在雌蚕中异位表达雄特异BmdsxM3,未引起性反转事件的发生。
进一步,利用家蚕W染色体特异引物,对43个G1代转基因阳性个体的基因组进行PCR扩增,检测是否存在染色体组型与外部表型不一致的个体。PCR结果显示,在外部表型为雌的转基因个体基因组中扩出W染色体特异条带,而在外部表型为雄的转基因个体基因组中未扩出W染色体特异条带(图 5),表明所有转基因阳性个体的染色体组型与外部表型一致,在雌蚕中表达BmdsxM3确实未引起性反转事件的发生。
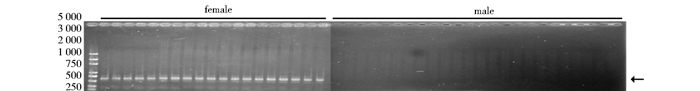
|
| 图 5 G1代转基因个体中W染色体的存在情况 Fig. 5 W chromosome in all G1 transgenic individuals using W chromosome-specific primers |
BmdsxM3的成功异位表达未引起性反转事件的发生,并不能说明该剪接体不具备调控功能。为此,我们利用定量PCR比较Bmdsx 3个下游靶基因(SP1、Vg和PBP)在转基因和非转基因个体中的表达水平。发现在转基因雌性个体中,SP1和Vg在脂肪体中的表达水平出现明显下调,而PBP在雌蛾触角中的表达水平出现明显上调,且SP1、Vg和PBP在两个转基因品系中的表达变化趋势一致(图 6)。表明BmdsxM3的异位表达虽未引起性反转事件的发生,但可以引起下游靶基因表达水平的上调或下调。
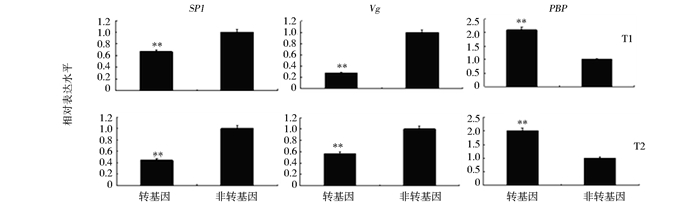
|
| 图 6 雄特异BmDsxM3在雌蚕中的异位表达对下游靶基因SP1、Vg及PBP的表达影响 Fig. 6 Effect of the ectopic expression of the male-specific BmDsxM3 in females on downstream targets SP1,Vg and PBP ** P<0.01,Student′s t-test |
同果蝇类似,家蚕也遵循“初始信号→关键基因→双性基因”的性别决定信息传递基本模式,其体细胞性别发育同样受双性基因dsx的雌雄特异选择性表达调控。本文通过转基因在雌蚕中成功异位表达dsx雄特异剪接体BmdsxM3,分析表明DsxM3的异位表达可不同程度地抑制SP1和Vg的表达,并可提高PBP的表达水平。虽然DsxM3的异位表达并未引起性反转事件的发生,但三个下游靶基因表达水平的变化,说明BmdsxM3也参与家蚕体细胞的性别发育。有研究表明DsxF1和DsxM1与下游靶基因调控区的结合位点(ACATTGT)相同[3],且前期分析发现所有Bmdsx雌雄特异Dsx蛋白与靶基因调控区结合的DNA结合结构域(DBD/OD1)完全一样[8],内源雌剪接体BmdsxFs又一直存在,外源雄剪接体BmdsxM3的异位表达无法拮抗内源雌剪接体的作用,可能是本文单一异位表达转基因雌发育表型正常的原因。
DsxM3的异位表达未引起器官发育异常,与雄DsxM1的异位表达引起生殖器官异常结果不一致[4, 9],表明不同Dsx蛋白参与家蚕体细胞性别发育的作用大小存在差异。双性基因参与体细胞性别发育都是通过其性别特异功能蛋白与下游靶基因调控区结合来完成[3, 10, 11],家蚕体内两个雄特异功能蛋白DsxM1[4, 9]和DsxM3被相继证明,从测面暗示在雄蚕体内,不同雄Dsx蛋白可能以同源或异源二聚体的形成与靶基因调控区结合,调控雄蚕体细胞雄特异发育。雌雄蚕体内存在多个Dsx功能蛋白,且这些蛋白与靶基因调控区的结合位点相同[3],因此如何结合,结合是否具有细胞或组织特异性,结合特征如何揭示,是下一步必须解决的问题。与家蚕不同,双翅目黑腹果蝇(Drosophila melanogaster)[12]、家蝇(Musca domestica)[13]、冈比亚按蚊(Anopheles gambiae)[14],以及膜翅目蜜蜂(Apis mellifera)[15]和金小峰(Nasonia vitripennis)[16]中,都只有一个雄Dsx蛋白。因此,家蚕Dsx蛋白对下游靶基因的调控很可能与上述模式昆虫不同。
| [1] | Kiuchi T,Koga H,Kawamoto M,et al. A single female-specific piRNA is the primary determiner of sex in the silkworm. Nature,2014,509(7502):633-636. |
| [2] | Niimi T,Sahara K,Oshima H,et al. Molecular cloning and chromosomal localization of the Bombyx sex-lethal gene. Genome,2006,49:263-268. |
| [3] | Suzuki M G,Funaguma S,Kanda T,et al. Analysis of the biological functions of a doublesex homologue in Bombyx mori. Dev Genes Evol,2003,213(7):345-354. |
| [4] | Suzuki M G,Funaguma S,Kanda T,et al. Role of the male BmDSX protein in the sexual differentiation of Bombyx mori. Evol Dev,2005,7(1):58-68. |
| [5] | Shukla J N,Jadhav S,Nagaraju J. Novel female-specific splice form of dsx in the silkworm,Bombyx mori. Genetica,2010,139(1):23-31. |
| [6] | Xu J,Wang Y,Li Z,et al. Transcription activator-like effector nuclease(TALEN)-mediated female-specific sterility in the silkworm,Bombyx mori. Insect Molecular Biology,2014,23(6):800-807. |
| [7] | Duan J P,Xu H F,Wang F,et al. Novel female-specific trans-spliced and alternative splice forms of dsx in the silkworm Bombyx mori. Biochem Biophys Res Commun,2013,431:630-635. |
| [8] | Duan J P,Guo H Z,O'Brochta D A,et al. New insights into the genomic organization and splicing of the doublesex gene,a terminal regulator of sexual differentiation in the silkworm Bombyx mori. Plos One,2013,8(11):e79703. |
| [9] | Duan J P,Xu H F,Ma S Y,et al. Ectopic expression of the male BmDSX affects formation of the chitin plate in female Bombyx mori. Mol Reprod Dev,2014,81(3):240-247. |
| [10] | Uma Narendra,Zhu L Y,Biaoru L,et al. Sex-specific gene regulation. The Journal of Biological Chemistry,2002,277(45):43463-43473. |
| [11] | Luo S Z,Shi G W,Bruce S B. Direct targets of the D. melanogaster DsxF protein and the evolution of sexual development. Development,2011,138:2761-2771. |
| [12] | Suzuki M G,Ohbayashi F,Mita K,et al. The mechanism of sex-specific splicing at the doublesex gene is different between Drosophila melanogaster and Bombyx mori. Insect Biochem Mol Biol,2001,31(12):1201-1211. |
| [13] | Hediger M,Burghardt G,Siegenthaler C,et al. Sex determination in Drosophila melanogaster and Musca domestica converges at the level of the terminal regulator doublesex. Dev Genes Evol,2004,214(1):29-42. |
| [14] | Scali C,Catteruccia F,Li Q,et al. Identification of sex-specific transcripts of the Anopheles gambiae doublesex gene. J Exp Biol,2005,208:3701-3709. |
| [15] | Cho S,Huang Z Y,Zhang J. Sex-specific splicing of the honeybee doublesex gene reveals 300 million years of evolution at the bottom of the insect sex determination pathway. Genetics,2007,177:1733-1741. |
| [16] | Oliveira D C,Werren J H,Verhulst E C,et al. Identification and characterization of the doublesex gene of Nasonia. Insect Mol Biol,2009,18:315-324. |
 2016, Vol. 36
2016, Vol. 36




