文章信息
- 吴云奇, 李茹莹
- WU Yun-qi, LI Ru-ying
- 污泥与餐厨垃圾发酵产氢种泥预处理方法比较
- Comparison of Seed Sludge Pretreatment Methods for Hydrogen Production from Sewage Sludge and Food Waste
- 中国生物工程杂志, 2015, 35(12): 78-83
- China Biotechnology, 2015, 35(12): 78-83
- http://dx.doi.org/10.13523/j.cb.20151212
-
文章历史
- 收稿日期: 2015-07-21
- 修回日期: 2015-08-27
生物制氢作为一种经济环保的清洁能源制备技术,近年来引起了广泛的关注。利用废水废物中的有机质制氢的生物过程可分为暗发酵制氢和光发酵制氢,暗发酵制氢相对于光发酵具有更高的产氢速率且不需光能的输入,对此已经进行了广泛的研究。暗发酵产氢菌广泛存在于自然环境中,如沉积物、土壤、污水污泥、肥料和粪便等。常用的暗发酵接种物来源包括消化污泥、厌氧颗粒污泥、剩余污泥、下水道污泥等[1]。然而这些混合菌种的接种物中还存在耗氢菌,如产甲烷菌和同型产乙酸菌会将发酵中间产物氢气和二氧化碳分别转化成甲烷和乙酸[2],使得氢气产量减小。为了提高产氢效率,获得连续稳定的产氢过程,通常需要对接种种泥进行预处理,抑制接种物中耗氢菌活性,富集产氢菌。
常用的产氢种泥预处理方法包括:热处理、酸处理、碱处理、化学抑制剂[氯仿、碘丙烷、2-乙烷磺酸钠(BESA)]、曝气、超声等[3]。各种预处理方法原理均基于产氢菌和耗氢菌的生理学差异。常见的产氢菌有两大类:梭酸菌属和肠杆菌属。梭酸菌属于革兰氏阳性菌,呈杆状,兼性细菌,能够形成生物芽孢[4],例如Clostridium butyricum[5]、C. thermolacticum[6]、C. pasteurianum[7, 8]、C. paraputrificum[9]以及C. bigermentants[10]等。肠杆菌属于革兰氏阴性菌,呈杆状,兼性细菌。而耗氢菌属于严格厌氧菌,不能形成生物芽孢[4]。故将种泥置于高温、强酸、强碱等极端条件下,耗氢菌不适应环境被淘汰,能形成芽孢的产氢菌得到富集;处于曝气环境时,严格厌氧耗氢菌被抑制,兼性产氢菌得到富集。另外,化学抑制剂BESA与产甲烷菌细胞内的甲基辅酶M结构类似,而该酶不存在于其他微生物体内,故产甲烷过程受到干扰。碘丙烷是类咕啉的拮抗物,会抑制产甲烷菌细胞内运输甲基载体的酶B12的活性。氯仿会抑制产甲烷菌细胞内类咕啉酶和M甲基辅酶的活性[11]。
但是,由于接种污泥来源、预处理条件、产氢底物种类和浓度、温度、pH值、反应器类型等不同,不同研究者得出的最佳预处理方法存在很大差异。Jia等[3]对处理猪粪的消化污泥进行酸、碱、热、干燥、曝气、超声、化学抑制剂处理后,以葡萄糖为基质进行中温厌氧发酵产氢,研究结果表明将种泥置于60℃下24h进行干燥处理是最有效的产氢种泥预处理方法。Wang等[4]的研究表明,对厌氧消化种泥进行酸、碱、热、曝气、化学抑制剂氯仿预处理后,以葡萄糖为基质进行中温发酵产氢,煮沸15min的热处理种泥氢气产量最高。而Zhu等[12]的研究表明,采用热、酸、碱、曝气、化学抑制剂BESA和碘丙烷对厌氧消化种泥预处理后,以蔗糖为基质进行中温厌氧发酵产氢,均取得较好的产氢效果。Andrea等[13]以升流式厌氧污泥床反应器中颗粒污泥为种泥,以葡萄糖为基质进行中温厌氧发酵产氢,针对连续曝气预处理方法进行研究,结果表明曝气处理3~12d均能取得较理想产氢效果,而曝气时间太短(2d)或太长(14d)处理效果则较差。另外,刘新媛[14]采用重复曝气方法,利用氧气和低pH值的双重作用抑制产甲烷菌的活性,得到的种泥用于污泥和餐厨垃圾混合厌氧发酵产氢反应器的启动,取得较好效果。
尽管针对产氢污泥的预处理方法已有大量研究,但是,已有的产氢种泥预处理方法研究主要针对易降解的葡萄糖、蔗糖等基质进行中温发酵,对于目前产量较大且造成较严重环境压力的市政污泥和餐厨垃圾的研究还较少,特别对于该两种有机废弃物混合厌氧发酵产氢的种泥预处理方式还缺乏系统研究。另外,课题组前期研究[14]结果表明高温厌氧发酵产氢比中温发酵产氢更为稳定。本研究以实验室厌氧发酵产甲烷反应器的消化污泥作为种泥,以剩余污泥和餐厨垃圾混合物作为基质进行高温厌氧发酵产氢,考察热处理、化学抑制剂BESA、酸处理、碱处理、连续曝气和重复曝气等几种常用的产氢种泥预处理方法对产氢的影响。
1 材料与方法 1.1 接种污泥与发酵底物预处理前的接种污泥来自实验室以剩余污泥和餐厨垃圾为混合底物的厌氧消化产甲烷反应器。种泥挥发性固体含量占总固体含量(VS/TS)的百分比为50.5%。
本试验研究以剩余污泥和餐厨垃圾的混合物作为发酵底物,底物VS浓度为43.5g/L,其中餐厨垃圾所占比例为54%(以VS计),该浓度和比例依据课题组前期研究结果[14]选定。其中,剩余污泥来自天津市张贵庄污水处理厂二沉池,餐厨垃圾来自天津大学学生食堂。底物的特性如表1所示。
| 参数 | 餐厨废物 | 剩余污泥 | 混合基质 |
| pH值 | 6.3 | 7.3 | 6.6 |
| VS/TS (%) | 99.5 | 58.5 | 75.2 |
| 溶解性蛋白质(mg/g-TS) | 5.6 | 0.1 | 2.9 |
| 溶解性多糖(mg/g-TS) | 289.9 | 0.0 | 146.1 |
| 总COD(mg/g-TS) | 1001.4 | 1091.3 | 1084.8 |
本研究主要考察六种厌氧产氢种泥预处理方法,包括热处理、化学抑制剂BESA、酸处理、碱处理、连续曝气、重复曝气。各预处理方法的具体操作如下:(1)热处理:煮沸30min[12];(2)化学抑制剂BESA:室温条件下,向种泥中加入10 mmol/L的BESA[12];(3)酸处理:向种泥中加入1.0 mol/L HCl调节pH为2.0,保持24h,再用1.0 mol/L NaOH调节pH为7.0[12];(4)碱处理:向种泥中加入1.0 mol/L NaOH调节pH为12.0,保持24h,再用1.0 mol/L HCl调节pH为7.0[12]。(5)连续曝气:用曝气泵对种泥进行曝气,控制溶解氧浓度为1.0~1.2 mg/L,连续曝气7d[13]。(6)重复曝气:首先在种泥中加入7.5 g/L葡萄糖和7.5 g-VS/L餐厨废物混合底物(加入餐厨废物为防止水解细菌灭活),控制溶解氧浓度为1.0~1.2 mg/L,曝气3h,然后停止曝气沉淀21h,最后将上清液排出,加入自来水定容到原来的体积,该过程重复7次[14]。曝气后种泥离心水洗3次以洗脱溶解性多糖。
预处理后种泥置于体积为300 ml的厌氧瓶中,每个厌氧瓶中加入100 ml种泥和50 ml混合基质。向厌氧瓶中充氮气吹脱空气10 min,用胶塞密封,在55℃、100 r/min的摇床中进行暗发酵产氢批式试验。未处理厌氧种泥作为接种物进行暗发酵产氢作为对照组,每种预处理条件设置两组平行样。为评估种泥本身厌氧发酵产气量,对于各种预处理方法试验组包括未处理组设置仅添加种泥不添加基质(100 ml种泥加50 ml蒸馏水)的试验组作为空白对照。为考察种泥接种后系统的持续产气能力,在批试反应结束后取出100 ml种泥重新置于厌氧瓶中,加入相同量基质 (50 ml),调节pH为7.0左右,于相同条件下反应,每种种泥预处理条件下的厌氧发酵产氢批试实验共进行三个周期。
1.3 测定方法产气量用带刻度的玻璃针筒测定。气体组分(主要包括氢气、氮气、甲烷和二氧化碳)使用装有不锈钢填充柱(TDX-01,2m)的气相色谱仪(BEIFEN 3040,北京北分瑞利)测定,使用热导检测器(TCD),高纯氩作为载气,流速为35ml/min,柱温100℃,进样口温度100℃,检测器温度130℃。
挥发性脂肪酸(VFAs)使用装有毛细管柱(HP-FFAP,0.53mm×10m×1μm)的气相色谱仪(SP6890,山东鲁南瑞虹)测定,使用火焰离子化检测器(FID),高纯氮作载气,流速为6 ml/min,分流比10∶1,进样口温度200℃,检测器温度250℃,柱室的升温程序为:以3℃/min从70℃升到79℃,79℃停留1min,以10℃/min升到180℃/min,停留3min。
pH值用台式pH计(PB-10 Sartorius Germany)测定,总固体含量和挥发性固体含量用烘干重量法[15]测定,总COD用HACH DRB200仪测定,溶解性多糖浓度用蒽酮-浓硫酸法[16]测定,溶解性蛋白质浓度用Lowery法[17]测定。
2 结 果 2.1 氢气和甲烷产量为考察预处理种泥的持续产氢能力,共进行了三个周期的批式试验。各种泥预处理条件下的氢气和甲烷累积产量如图1所示,最大氢气产率(以加入单位VS基质计)和产氢缓滞时间如表2所示。

|
| 图 1 不同种泥预处理条件下氢气(a)和甲烷(b)的累积产量 Fig. 1 Accumulative hydrogen (a) and methane (b) production under different seed sludge pretreatment methods |
| 氢气产率(ml/g-VS added) | 产氢缓滞时间(h) | ||||||
| 周期一 | 周期二 | 周期三 | 平均值 | 周期一 | 周期二 | 周期三 | |
| 未处理 | 20.1 | 10.2 | 32.2 | 20.8 | 3.9 | 3.7 | 2.9 |
| 热处理 | 45.5 | 4.9 | 30.0 | 26.8 | 63.1 | 59.1 | 3.0 |
| BESA | 49.9 | 42.0 | 63.7 | 51.9 | 2.7 | 3.3 | 2.0 |
| 酸处理 | 65.2 | 95.6 | 83.1 | 81.3 | 2.0 | 5.0 | 2.8 |
| 碱处理 | 40.6 | 8.7 | 40.7 | 30.0 | 13.1 | 2.0 | 0.5 |
| 连续曝气 | 78.6 | 74.5 | 73.2 | 75.4 | 2.0 | 5.8 | 0.2 |
| 重复曝气 | 70.3 | 114.5 | 76.0 | 86.9 | 8.0 | 3.0 | 2.6 |
由图1(a)和表2可知,抑制剂BESA处理、酸处理、连续曝气和重复曝气种泥三个周期的氢气产量均明显高于其他预处理条件种泥,其中重复曝气种泥三个周期的平均氢气产率最高,为86.9 ml-H2/g-VSadded;其次是酸处理种泥、连续曝气种泥和BESA处理种泥,平均最大氢气产率依次为81.3、75.4和51.9 ml-H2/g-VSadded。这四种产氢种泥不仅具有较高的氢气产率,且经三个周期的试验表明,持续产氢能力也较好。
而作为对照的未处理种泥三个周期的氢气产量均较低,平均氢气产率仅为重复曝气种泥的24%。预处理种泥中,热处理、碱处理种泥三个周期的氢气产量也较低,表明这两种预处理方法在预处理过程中对产氢菌也产生了一定抑制作用,产氢效果较差。
由图1(b)可知,未处理、热处理和碱处理种泥三个周期的甲烷产量均明显高于产氢效果较好的其他四种预处理种泥。另外,对照图1(a)和(b)可以看出,在各周期反应后期,未处理、热处理和碱处理种泥的累积氢气产量下降,出现吸氢反应;同时甲烷产量增加,反应途径向产甲烷方向转变,表明本试验未处理种泥中产甲烷菌活性较高,热处理和碱处理方法对产甲烷菌的抑制效果较差。
由表2可知,三个周期的批式试验中,各组均出现了不同程度的产氢缓滞现象,其中第一周期和第二周期的产氢缓滞时间相近,而第三周期的产氢缓滞时间明显小于前两个周期,可能是因为种泥中产氢菌经前两个周期的驯化和富集后,对污泥和餐厨混合基质的适应性加强。这将有利于种泥接种于连续产氢反应器,减少反应启动时间,增加产氢菌对特定基质的适应性和稳定性。
2.2 pH值和挥发性脂肪酸三个周期批式试验中,各预处理种泥体系的pH值均从中性7.0下降为酸性,第一周期降至4.26~5.91,第二周期降至4.86~5.51,第三周期降至4.78~5.45。各批式试验反应后各组挥发性脂肪酸浓度如图2所示。
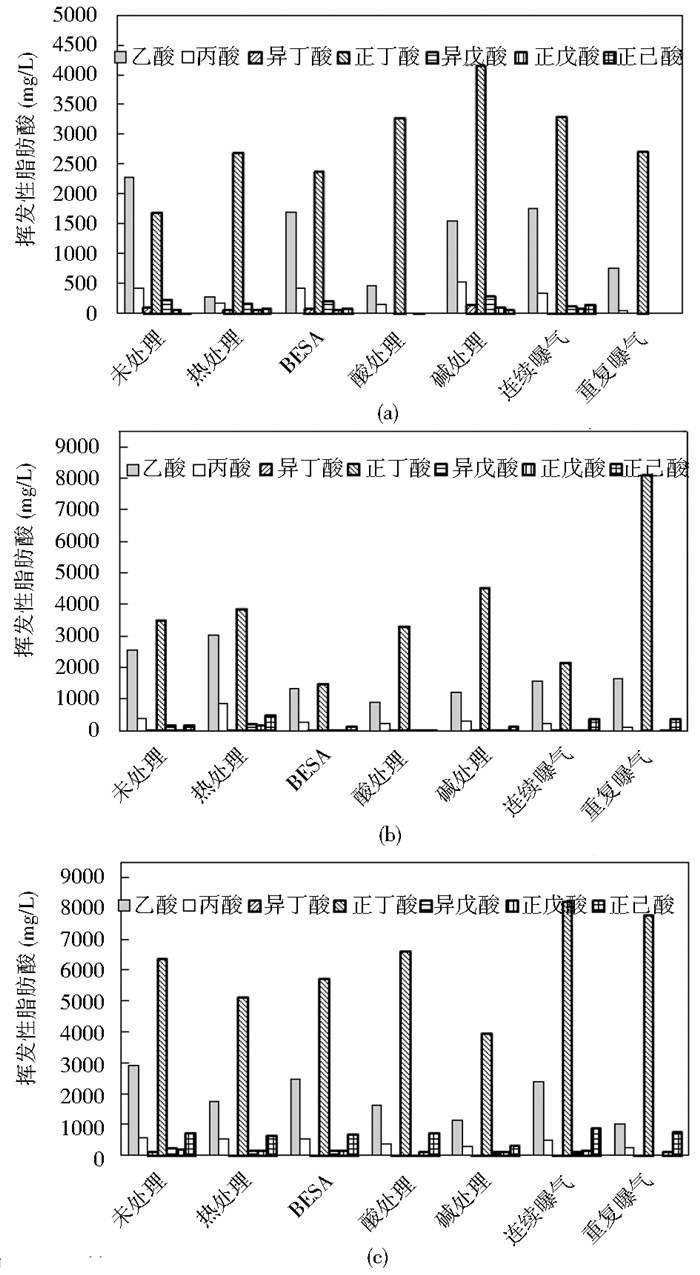
|
| 图 2 第一周期(a),第二周期(b)和第三周期(c)产氢结束后挥发性脂肪酸浓度 Fig. 2 VFA concentration at the end of the first (a),second (b) and third (c) hydrogen production cycle |
由图2可知,各周期反应产生的VFA主要组分为丁酸,其次是乙酸,其他挥发酸浓度较小。但不同预处理方法的种泥产生的丁酸和乙酸的相对含量各不相同,表明产氢反应途径有所不同。另外,各预处理种泥的VFA总浓度逐周期上升,出现挥发酸累积现象。
由图1(b)可见,未处理、热处理和碱处理种泥在三个周期的产氢反应中有明显的产甲烷现象,但甲烷产量逐周期递减,可以推测,各预处理种泥体系的酸化对产甲烷菌产生了一定的抑制作用,从而使甲烷产量逐周期减小。
2.3 挥发性固体厌氧发酵过程中,固相中部分挥发性固体最终以氢气或甲烷的形式排出反应体系,使得体系VS下降,三个周期各预处理种泥体系的VS去除率分别为24.5%~31.6%,21.0%~24.8%和23.2%~28.1%。VS去除率与氢气与甲烷产量之和呈正相关关系。各周期试验中,产氢效果较好的四种预处理种泥,甲烷产量很少甚至无甲烷产生,氢气累计产量越高的种泥VS去除率越高。
2.4 溶解性多糖和蛋白质多糖和蛋白质是厌氧微生物利用的主要能源物质。三个周期批式试验中除作为对照组的未处理种泥体系的溶解性多糖去除率稍低(73%左右),各预处理种泥体系的溶解性多糖去除率均在80%以上。三个周期的溶解性多糖的去除率分别为80.2%~83.8%,80.0%~88.6%和81.6%~87.5%。三个周期批式试验中除第一周期的热处理种泥外,各种泥体系的溶解性蛋白在厌氧发酵过程中均逐渐升高,这是因为蛋白质从固相溶出为溶解性蛋白的速率大于溶解性蛋白消耗的速率。而对于热处理种泥,可能在预处理过程中,不仅抑制了耗氢菌的活性,部分水解发酵细菌的活性也受到抑制,使得蛋白质水解速率减小,导致第一周期溶解性蛋白质浓度降低。
2.5 COD平衡三个周期批式试验中各组产氢体系反应前后TCOD(g/L),TCOD向氢气和甲烷转化的比例(%)及TCOD回收率(%)如表3所示。其中,反应前系统TCOD即底物与接种泥混合后的混合溶液的TCOD,反应后的TCOD为产生的氢气和甲烷的COD与厌氧瓶中混合液的COD之和。H2和CH4的COD由完全燃烧时需要的氧气质量估算,COD回收率为反应后系统TCOD与反应前系统TCOD之比。
| 反应前/反应后TCOD(g/L) | 产氢COD比例(%) | 产甲烷COD比例(%) | COD回收率(%) | |||||||||
| 周期一 | 周期二 | 周期三 | 周期一 | 周期二 | 周期三 | 周期一 | 周期二 | 周期三 | 周期一 | 周期二 | 周期三 | |
| 未处理 | 32.6/33.7 | 41.7/45.7 | 47.8/46.5 | 0.4 | 0.1 | 0.5 | 4.1 | 2.2 | 1.1 | 103.4 | 109.6 | 97.4 |
| 热处理 | 27.5/28.6 | 39.7/40.9 | 44.5/46.3 | 0.8 | 0.0 | 0.5 | 1.9 | 2.7 | 0.9 | 104.2 | 103.2 | 104.2 |
| BESA | 31.8/33.8 | 40.1/42.9 | 43.8/45.4 | 1.4 | 0.9 | 1.2 | 0.1 | 0.0 | 0.0 | 106.1 | 106.9 | 103.8 |
| 酸处理 | 28.0/29.0 | 39.6/45.4 | 42.0/42.0 | 2.0 | 2.1 | 1.7 | 0.1 | 0.0 | 0.0 | 103.4 | 114.7 | 100.0 |
| 碱处理 | 30.0/30.4 | 39.7/40.9 | 41.6/47.7 | 0.7 | 0.1 | 0.6 | 2.4 | 1.9 | 0.8 | 101.5 | 103.0 | 114.7 |
| 连续曝气 | 31.9/33.2 | 39.1/44.6 | 43.8/44.4 | 2.1 | 1.6 | 1.4 | 0.1 | 0.0 | 0.0 | 104.1 | 114.1 | 101.5 |
| 重复曝气 | 41.7/45.2 | 38.8/39.9 | 41.7/45.7 | 1.5 | 2.5 | 1.5 | 0.0 | 0.0 | 0.0 | 108.3 | 103.0 | 109.6 |
由表3可知,各预处理种泥产氢体系的TCOD向H2和CH4的转化率一致,氢气产率较高的BESA、酸处理、连续曝气和重复曝气种泥的反应体系TCOD向H2的转化率较高,而产氢效果较差的未处理、热处理和碱处理种泥体系的TCOD向CH4的转化率较高。各反应体系的COD回收率均在97%~115%之间,说明反应体系的COD平衡较好。
3 结 论本研究采用消化污泥作为产氢种泥,以剩余污泥和餐厨垃圾作为混合基质进行高温厌氧发酵产氢试验,比较六种常用的产氢种泥预处理方法(热处理、化学抑制剂BESA处理、酸处理、碱处理、连续曝气、重复曝气)对发酵产氢的影响。试验结果表明,未经处理的种泥氢气产率最低且伴有较多甲烷生成;BESA处理、酸处理、连续曝气和重复曝气种泥产氢效果较好,其中重复曝气预处理种泥的平均氢气产率最高;热处理和碱处理不能有效抑制产甲烷菌,氢气产量低,反应后期出现吸氢反应并明显发生产甲烷现象。产氢过程系统pH值降低会进一步抑制产甲烷菌活性。
| [1] | Prawit K, Booki M, Irini A. Biohydrogen production from xylose at extreme thermophilic temperatures(70℃) by mixed culture fermentation. Water Research, 2009, 43(5):1414. |
| [2] | Bita B, George N, Dimitre K, et al. The effect of heat pretreatment temperature on fermentative hydrogen production using mixed cultures. International Journal of Hydrogen Energy, 2008, 33(15):4064. |
| [3] | Jia X, Zhu C W, Li M X, et al. A comparison of treatment techniques to enhance fermentative hydrogen production from piggery anaerobic digested residues. International Journal of Hydrogen Energy, 2013,38:8691-8698. |
| [4] | Wang J L, Wei W. Comparison of different pretreatment methods for enriching hydrogen-producing bacteria from digested sludge. International Journal of Hydrogen Energy, 2008, 33(12):2834-2941. |
| [5] | Yokoi H, Saitsu A S, Uchida H, et al. Microbial hydrogen production from sweet potato starch residue. Journal of Bioscience and Bioenergy, 2001, 91:58-63. |
| [6] | Collet C, Adler N, Schwitzguebel J P, et al. Hydrogen production by Clostridium thermolacticum during continuous fermentation of lactose. International Journal of Hydrogen Energy, 2004, 29:1479-1485. |
| [7] | Liu G, Shen J. Effects of culture medium and medium conditions on hydrogen production from starch using anaerobic bacteria. Journal of Bioscience and Bioenergy, 2004, 98:251-256. |
| [8] | Lin C Y, Lay C H. Carbon/nitrogen ratio effect on fermentative hydrogen production by mixed microflora. International Journal of Hydrogen Energy, 2004, 29:41-45. |
| [9] | Evvyernie D, Morimoto K, Karita S, et al. Conversion of chitinous waste to hydrogen gas by Clostridium paraputrificum M-21. Journal of Bioscience and Bioenergy, 2001, 91:339-343. |
| [10] | Wang C C, Chang C W, Chu C P, et al. Producing hydrogen from wastewater sludge by Clostridum bifermentans. Journal of Biotechnology, 2003, 102:83-92. |
| [11] | Kenealy W, Zeikus J G. Influence of corrinoid antagonists on methanogen metabolism. Bacteriol, 1981,146:133-140. |
| [12] | Zhu H G, Michel B. Evaluation of alternative methods of preparing hydrogen producing seeds from digested wastewater sludge. International Journal of Hydrogen Energy, 2006,31:1980-1988. |
| [13] | Andrea G Valentina S, Maria C L, et al. Evaluation of aeration pretreatment to prepare an inoculum for the two-stage hydrogen and methane production process. Bioresource Technology, 2014,166:211-218. |
| [14] | 刘新媛.污泥和餐厨废物两相双温发酵产氢产甲烷研究.天津:天津大学,2014. Liu X Y. Hydrogen and methane production from co-digestion of sludge and food waste in a temperature-separated two-stage anaerobic fermentation process. Tianjin:Tianjin University, 2014. |
| [15] | APHA. Standard methods for the examination of water and wastewater. 21st ed. Washington DC:APHA, 2005. |
| [16] | Gaudy A F. Colorimetric determination of protein and carbohydrate. Industial Water Wastes, 1962, 7:17-22. |
| [17] | Lowery O H, Rosebrough N J, Farr A L, et al. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry, 1951, 193(1):265-275. |
 2015, Vol. 35
2015, Vol. 35




