文章信息
- 何凌冰, 李乐, 邓义熹, 蒙国基, 于玉根
- HE Ling-bing, LI Le, DENG Yi-xi, MENG Guo-ji, YU Yu-gen
- 几种Protein A亲和层析填料纯化重组单克隆抗体效果的比较
- Screening of Protein A Resins for Purifying Combinant Antibody
- 中国生物工程杂志, 2015, 35(12): 72-77
- China Biotechnology, 2015, 35(12): 72-77
- http://dx.doi.org/10.13523/j.cb.20151211
-
文章历史
- 收稿日期: 2015-09-22
- 修回日期: 2015-11-18
2. 深圳万乐药业有限公司 深圳 518029
2. Shenzhen Main Luck Pharmaceuticals Inc., Guangdong 518029, China
Protein A是金黄色葡萄球菌细胞壁上的一种蛋白[1],能够选择性地与免疫球蛋白的Fc结构域结合[2]。Protein A蛋白是由5个同源结构域和一个与细胞壁联结的结构域组成[3, 4],它通过这5个同源结构域与IgG Fc结构域结合。利用重组DNA技术,在大肠杆菌中表达不含细胞壁结合域的protein A片段。Protein A配体可以偶联到不同的基质上,例如交联琼脂糖、表面修饰的多孔玻璃、聚苯乙烯、陶瓷型外壳或者其它有机高分子材料[5, 6, 7, 8],形成不同的protein A填料。由于protein A的高选择性和稳定性,在实验室和工业生产中都将protein A亲和层析作为抗体纯化的一个标准步骤[9]。大多工艺都将protein A柱子作为纯化的第一步,从澄清的细胞培养上清液中捕获抗体[10, 11, 12]。目前抗体的表达量不断提高,有些抗体甚至达到了10 g/L。这就要求protein A介质有更高的动态载量(DBC)和传质特性。另外,工业上对protein A填料的稳定性要求很高,以获得有效的CIP清洗。因此,好的protein A填料既要保证有效的清洗,又要同时保持足够的载量。这对protein A配体是一个巨大的挑战。目前有很多protein A填料的清洗方法,然而对于大多数工艺来说NaOH是最安全、最经济的。另一方面protein A亲和层析的洗脱条件一般是在pH3~4之间,这个条件下抗体很容易聚集和沉淀[13, 14, 15]。为了降低聚集体,提高洗脱pH是可行的。目前已经有填料试图从提高洗脱的pH进行改进。因此protein A亲和层析纯化单克隆抗体时会从DBC、分辨率(纯化效果)以及清洗稳定性这三个方面进行考虑。
我们选取了6种适合大规模纯化抗体的protein A填料(4种进口和2种国产)进行纯化效果的比较,以期获得最佳纯化重组抗体的填料。通过DBC和纯化结果(样品纯度和回收率)进行比较,从中挑选出性能较好的填料进行寿命测试,最终确定适合本抗体的最佳填料。
1 材 料 1.1 填料与柱子所有试验的柱子为PP10/35(ID=10 mm,h=35 mm),柱体积为2.7 ml;层析系统为GE AKTA avant 25;纯度分析仪器为Waters HPLC-E2695,TSK gel;抗体含量分析仪器为Thermo U3000,POROS Protein A分析柱(粒径20 μm,2.1 mm×30 mm,V=0.1 ml)。填料信息如下表1所示。
| 填料名称 | 厂家 | 基质 | 颗粒大小
(μm) |
pH范围 | 推荐CIP方案 |
| MabSelect | GE | Crosslinked
agarose |
85 | 2~12 | 50mmol/L NaOH+1mol/L NaCl |
| UNOsphereSUPrA(UNO PrA) | Bio-Rad | Crosslinked polymer | 53~61 | 3~11 | 0.1mol/L NaOH |
| Prosep Ultra Plus(PUP) | Millipore | Porous glass | 60 | 1~8.5 | 150mmol/L H 3PO 4,pH1.5 |
| Eshmuno A | Millipore | Hydrophilic polymer based on polyvinylether | 50 | 1.5~13.5 | 0.1mol/L NaOH |
| iProtein A Sepharose Fast Flow(ZJ-iPrA) | 张江生物技术
有限公司 |
Crosslinked agarose | 60~160 | 2~11 | 50mmol/L NaOH+1mol/L NaCl |
| Sepromax A40 Plus | GALAK | Polystyrene-divenylbenzene | 40 | 2~14 | 0.1~0.5mol/L NaOH |
本次试验所用重组抗TNF α抗体由CHO细胞发酵而来,动态载量(Dynamic binding capacity,DBC)测试用重组抗体为精纯后样品,纯化条件筛选和填料寿命测试样品为细胞培养收获的澄清液。
2 方 法 2.1 动态载量测试用纯化后的重组抗体作为样品,保留时间为3 min,以10%背景穿透为计算终点。平衡缓冲液为10 mmol/L NaPi,pH7.2(buffer A),洗脱缓冲液为0.1 mol/L Gly-HCl,pH3.0(buffer B)。先用5 CV buffer A平衡柱子,用0.88 mg/ml重组抗TNF α抗体(缓冲液是10mmol/L NaPi,pH7.2)上样,流速为0.9 ml/min,同时用96孔板开始收集穿透,每孔0.9 ml。当流穿超过10%初始上样浓度时停止上样。
2.2 纯化条件筛选选取洗脱缓冲溶液种类和pH两个因子,考察纯化后抗体纯度(SEC-HPLC %)以及回收率(%)。pH范围为3.0~4.0,洗脱液盐种类为甘氨酸-盐酸(Glycine-HCl)、柠檬酸钠-柠檬酸(Na-Citrate)、醋酸钠-醋酸(NaAc-HAc )3种。利用GE AKTA avant 25 Design of Experiments(DoE)软件进行纯化条件筛选,软件推荐模型为全因子试验,含3次中心点重复,共包括7种洗脱条件,每种填料含9次试验。7种洗脱液分别是0.1 mol/L Glycine-HCl,pH3.5(中心点)、0.1 mol/L Glycine-HCl,pH3.0、0.1 mol/L Glycine-HCl,pH4.0、50 mmol/L NaAc-HAc,pH3.0、50 mmol/L NaAc-HAc,pH4.0、20 mmol/L Na-Citrate,pH3.0、20 mmol/L Na-Citrate,pH4.0。试验参数见表2。洗脱液收集以后进行SEC-HPLC纯度检测,通过紫外分光光度计测定收集抗体浓度进行含量计算,评估回收率。
| 工艺步骤 | 缓冲液 | 工艺体积(CV) |
| 平衡 | 10 mmol/L NaPi,pH7.2 | 5 |
| 上样 | V = 0.9 ml/min | -- |
| 淋洗 | 10 mmol/L NaPi,pH7.2 | 3 |
| 洗脱 | 7种洗脱液 | 7 |
| CIP | 填料推荐溶液 | 3 |
用澄清的细胞液作为样品,每次上样量为20 ml,按照表2 的参数用GE AKTA avant 25进行纯化,分别在使用100次、200次、300次时测定动态载量。
3 结果与讨论 3.1 动态载量动态载量受很多因素的影响,包括配体密度、基质、上样蛋白浓度、上样pH、样品离子强度、流速等。为了在相同条件下比较这6种填料的性能,我们分别装填了6根2.7 ml的PP10/35层析柱,以3 min保留时间来测定10%流穿下各填料的动态载量。柱子是过载的,收集流穿,用protein A分析柱进行抗体蛋白含量分析。6种填料在3 min保留时间下的动态载量结果如图1所示:ESHMUNO A>ZJ-iPrA>PUP>MabSelect>UNOPrA>Sepromax A40。
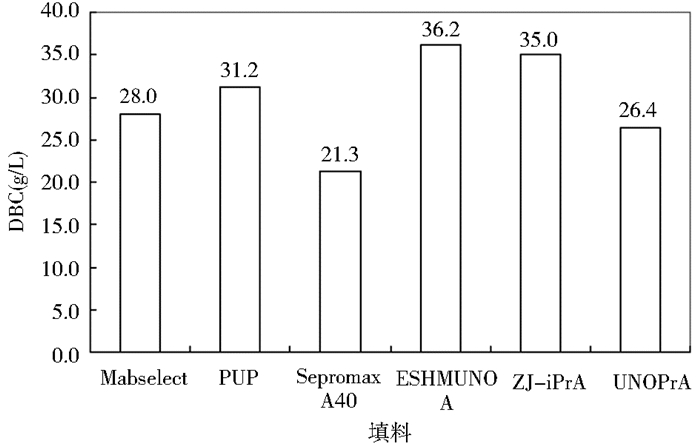
|
| 图 1 相同保留时间下抗体在不同填料上的DBC Fig. 1 DBCs at 10% breakthrough and the retention time of 3min |
Protein A亲和层析中抗体的洗脱条件一般在pH3~4之间,随着抗体种类的差异而变化。不同厂家填料的差异会导致洗脱条件的差别。利用GE AKTA avant 25 的DoE软件推荐的全因子试验进行重组抗体的纯化条件筛选。
Na-Citrate缓冲溶液洗脱时,MabSelect、ZJ-iPrA和ESHMUNOA填料的SEC纯度几乎不受其pH的影响,回收率随着pH的升高有明显降低;PUP、Sepromax A40、UNOPrA随着pH的升高,SEC纯度下降,回收率却几乎没有改变(图2a和图2b)。
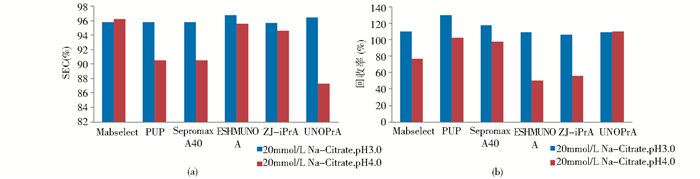
|
| 图 2 柠檬酸缓冲体系下抗体纯度和回收率 Fig. 2 SEC and recovery of eluates in NaCitrate buffer |
NaAc-HAc缓冲溶液洗脱时,这6种填料的SEC纯度受pH的影响不大,均在97%~98%之间;除了MabSelect和PUP回收率随着pH的升高而降低,其它4种填料回收率几乎不受pH的影响(图3a和3b)。
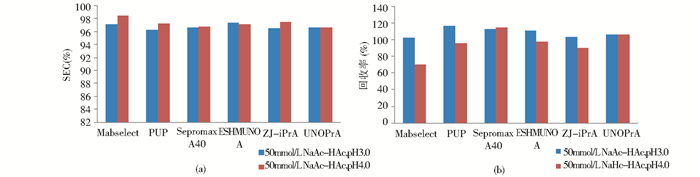
|
| 图 3 醋酸钠缓冲体系下抗体纯度和回收率 Fig. 3 SEC and recovery of eluates in NaAcHAc buffer |
Gly-HCl缓冲液洗脱时,Sepromax A40、PUP、UNOPrA 3种填料的回收率受pH影响不大,而其它3种填料随着pH升高回收率有明显下降;MabSelect、PUP、Sepromax A40随着pH升高,SEC纯度升高(图4a和4b)。
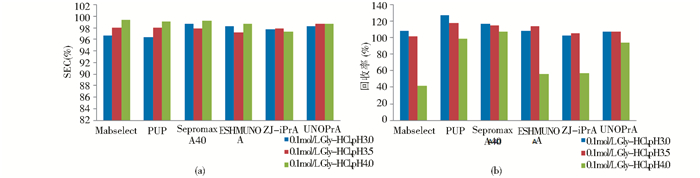
|
| 图 4 甘氨酸缓冲体系下抗体纯度和回收率 Fig. 4 SEC and recovery of eluates in GlycineHCl buffer |
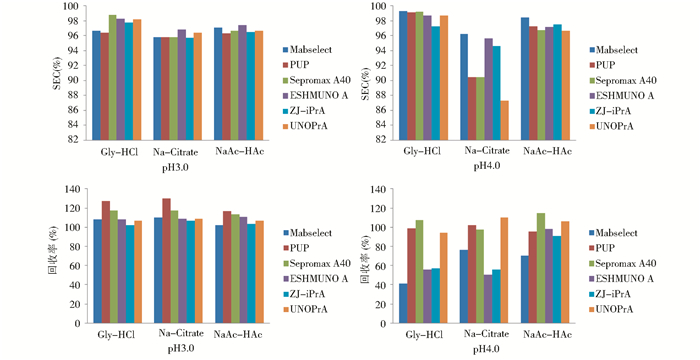
综合以上数据可以看出,在pH3.0~4.0的范围内,相同pH条件下,Na-Citrate缓冲溶液在任何一种填料的SEC纯度都低于NaAc-HAc和Gly-HCl缓冲体系(图5),这说明Na-Citrate缓冲溶液不适合作为本抗体的洗脱液。Gly-HCl溶液洗脱抗体时SEC纯度最高可以达到99%以上,而NaAc-HAc溶液洗脱时纯度最高可达97%且受pH影响不大(图5)。因此Gly-HCl缓冲体系有更大的优化空间,更适合作为本抗体的洗脱液。
|
| 图 5 相同pH时洗脱液种类对抗体纯度和回收率的影响 Fig. 5 SEC and recovery in pH3.0 compared with that in pH4.0 |
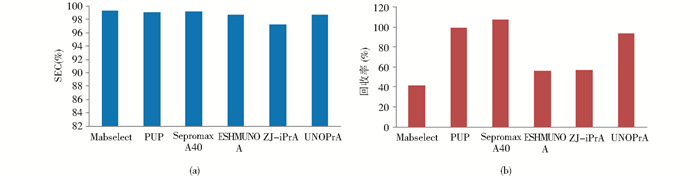
在相同的pH和洗脱液条件下,不同的填料表现出不同的性质。在0.1 mol/L Gly-HCl,pH3.0的条件下,6种填料中的回收率都可以达到100%,这说明pH3.0是一个剧烈的洗脱条件,可以将抗体从填料上全部剥离下来。而0.1 mol/L Gly-HCl,pH4.0时各填料表现出不同的性质。这6种填料的SEC纯度均在98%~99%之间,但MabSelect、ESHMUNO A 和ZJ-iPrA填料的回收率比另外3种填料低50%~60%(图6a和图6b)。这说明MabSelect、ESHMUNO A 和ZJ-iPrA 3种填料在pH4.0时,与抗体的结合作用要强于Sepromax A40、PUP、UNOPrA。Sepromax A40、PUP、UNOPrA这3种填料可以在较高的pH下洗脱并保持较高的回收率。由此可以看出同一洗脱缓冲溶液在不同填料上的洗脱作用是有差异的,这与填料的性质有关。填料颗粒大小、孔径大小、基质、偶联方式等差异,可能影响配基和抗体之间的相互作用,进而导致洗脱纯度和回收率的不同。
|
| 图 6 0.1 mol/L Gly-HCl,pH4.0洗脱时不同填料对纯度和回收率的影响 Fig. 6 SEC and recovery of eluates in GlycineHCl,pH4.0 buffer |
从整体来看,在甘氨酸缓冲液体系下Sepromax A40、Millipore PUP和Bio-Rad UNOsphereSUPrA填料的回收率和SEC纯度都能保持较高的水平。这三种填料表现出硬胶的性质,洗脱效果好,传质效应高。这种性质对工艺来说操作空间比较大,能够在较大的范围保证产品质量。而MabSelect、ESHMUNO A、ZJ-iPrA随着pH的升高,回收率会降低,需要寻找一个平衡点同时满足纯度和回收率的要求。ESHMUNO A和ZJ-iPrA在pH3~4之间SEC纯度差别较小;MabSelect填料随着pH升高,SEC纯度也提高,变化范围较大,最高可达99%,利于进行优化。因此就纯化效果来说适合本抗体的填料有MabSelect、Sepromax A40、PUP和UNOsphereSUPrA。
综合考虑载量的因素,选择动态载量较大的MabSelect和PUP填料。PUP填料的基质是可控孔玻璃珠,不耐碱清洗,需要用低pH的磷酸溶液进行清洗。药品GMP生产最基本的要求是无菌、无热源,而NaOH是最常用的除菌、除热源试剂,再者考虑到未来工艺放大后的柱清洗工艺条件对设备管路的影响,我们倾向使用碱清洗的填料,因此最终选定MabSelect作为本抗体亲和层析的填料。
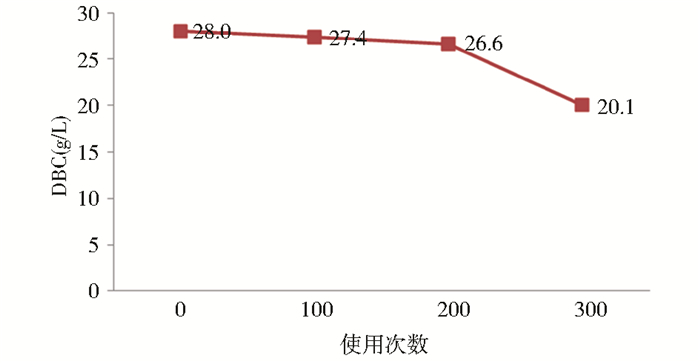
3.3 MabSelect使用寿命在药品生产过程中,为避免细菌、内毒素或病毒污染,需要对层析系统、介质进行清洗消毒,以保证产品的质量。变性的蛋白、脂质和核酸等形成的沉淀也会影响介质的性能,直接影响其寿命。而Protein A填料的寿命会直接影响到产品安全和生产成本。层析柱使用以后必须进行有效的再生,同时要保证填料性能不会因此而衰减。这对使用蛋白配体的亲和填料来说是一个巨大的挑战。填料厂商提出了protein A柱有效的清洗方法,MabSelect填料推荐的清洗条件为50 mmol/L NaOH+1 mol/L NaCl,15 min[16]。碱清洗的方法可以有效溶解来自细胞培养液沉淀在介质上的蛋白、脂类和核酸,从而可以延长填料的寿命。这种方法是一种双刃剑,由于MabSelect填料的配体是重组protein A,对NaOH比较敏感,强碱条件下容易变性或脱落,造成载量的衰减,使寿命降低。因此选用这种清洗方法需要考察载量的变化。我们通过循环纯化抗体来测试此清洗条件是否会影响MabSelect的动态载量,以动态载量的衰减程度来判定MabSelect的使用寿命。每个循环都包括平衡、上样、清洗、洗脱、剥离和CIP步骤。0次、100次、200次、300次纯化后MabSelect填料的动态载量数据如下图7所示。100个循环时,载量仅衰减了2.1%,200个循环时MabSelect的动态载量仍能保持初始载量的95%,300次时衰减了28%。这说明MabSelect填料可以在使用200次时仍然保持较高的载量,与GE推荐的200次使用寿命是吻合的。
|
| 图 7 不同使用次数MabSelect填料的动态载量 Fig. 7 DBCs tested at different life time in 10% breakthrough and the retention time of 3min |
市面上有多种针对单克隆抗体纯化的protein A填料,在选择时首先考虑填料的动态载量,其次还应考虑填料的纯化分离效果及使用寿命。在本次试验中,Millipore的两种填料PUP和ESHMUNO A以及张江生物的iPrA FF动态载量高于其它填料。洗脱液种类对抗体纯度有很大的影响,重组抗体在甘氨酸-盐酸缓冲液中纯度最高,其次是醋酸钠缓冲液,在柠檬酸缓冲液中纯度最差,因此选定甘氨酸-盐酸缓冲液作为本抗体的洗脱缓冲液。在同一洗脱缓冲液中,填料性质的差异也会影响抗体的回收率和纯度。综合载量、纯化分辨率和稳定性等的考察结果,最终选择MabSelect填料和甘氨酸-盐酸洗脱液作为本抗体的亲和层析的基础条件,再进行完整的工艺开发。这也可以为单抗药物工艺开发时protein A填料和纯化条件的筛选提供一定的参考。
| [1] | Sjoquist J, Movitz J, Johansson I B,et al. Localization of protein A in the bacteria. Eur J Biochem,1972,30:190-194. |
| [2] | Lindmark R, Thoren-Tolling K, Sjoquist J. Binding of immunoglobulin to protein A and immunoglobulin levels in mammalian sera. J Immunol Mothods,1983,62:1-13. |
| [3] | Lofdahl S, Guss B, Uhlen M,et al. Gene for staphylococcal protein A. Proc Natl Acad Sci USA,1983,80:697-701. |
| [4] | Guss B, Uhlen M, Nilsson B,et al. Region X,the cell-wall-attachment part of staphylococcal protein A. J Biochem,1984,138:413-420. |
| [5] | Horstmann B J,Chase H A. Modeling the affinity adsorption of immunoglobulin-G to protein-A immobilized to agarose matrices. Chem Eng Res Des,1989,67:243-254. |
| [6] | Hahn R, Schlegel R, Jungbauer A. Comparison of protein A affinity sorbents. Chromatography B,2003,790(1-2):35-51. |
| [7] | McCue J T,Kemp G,Low D,et al. Evaluation of protein-A chromatography media. J Chromatography A,2003,989:139-153. |
| [8] | Fahrner R L, Whitney D H, Vanderlaan M,et al. Performance comparison of protein A affinity-chromatography sorbents for purifying recombinant monoclonal antibodies. Biotechnol Appl Biochem,1999,30:121-128. |
| [9] | Boschetti E, Jungbauer A. Handbook of Bioseparations. San Diego:Academic Press,2000.535. |
| [10] | Gottschalk U. Bioseparation in antibody manufacturing:the good,the bad,and the ugly,Biotechnol Prog,2008,24:496-503. |
| [11] | Kelley B. Industrialization of mAb production technology:the bioprocessing industry at crossroads. Mabs,2009,1:443-452. |
| [12] | Liu H F,Ma J,Winter C,et al. Recovery and purification process development for monoclonal antibody production. Mabs,2010,2:1-20. |
| [13] | Shukla A A, Gupta P, Han X. Protein aggregation kinetics during chromatography:case study for an Fc fusion protein. J Chromatography A,2007,1171:22-28. |
| [14] | Gagnon P. Technology trends in antibody purification. J Chromatogr A,2012,1221:57-70. |
| [15] | Vazquez-Rey M, Lang D A. Aggregates in monoclonal antibody manufacturing processes. Biotech Bioeng,2011,108:1494-1508. |
| [16] | GE Healthcare Life Sciences.Regulatory Support File MabSelect,11-0028-20. |
 2015, Vol. 35
2015, Vol. 35




