文章信息
- 李真, 刘兆雨, 徐丹, 陈婷, 孟赞, 唐勇, 彭彦
- LI Zhen, LIU Zhao-yu, XU Dan, CHEN Ting, MENG Zan, TANG Yong, PENG Yan
- 星形胶质细胞通过CX47促进少突胶质前体细胞增殖
- Astrocyte Promotes Oligodendrocyte Precursor Cell Proliferating through Connexion CX47
- 中国生物工程杂志, 2015, 35(12): 21-29
- China Biotechnology, 2015, 35(12): 21-29
- http://dx.doi.org/10.13523/j.cb.20151204
-
文章历史
- 收稿日期: 2015-08-19
- 修回日期: 2015-09-28
2. 重庆医科大学第一附属医院 重庆 400016
2. The First Affiliated Hospital of Chongqing Medical University Chongqing 400016, China
少突胶质细胞(oligodendrocyte,OLs)作为中枢神经系统唯一的髓鞘形成细胞,对维持髓鞘结构完整性和促进信息传递发挥着极为重要的作用。众多的中枢神经系统退行性疾病都与髓鞘病理性脱失、少突胶质细胞发育不良相关 [1]。因此,研究髓鞘形成和髓鞘再生就成为一个热点问题。其中,能直接分化为OLs的是少突胶质前体细胞(OPCs)。OPCs是一类具有着高度增值特性的多潜能干细胞,特定条件下也能分化为神经元、星形胶质细胞[2],如何保证OPCs在特定条件下大量增殖及向少突胶质细胞方向分化是修复髓鞘的关键。
在中枢神经组织中,AST作为脑内的数目最多、最主要的大胶质细胞[3],涵盖着OPCs最重要的细胞外环境,近来研究表明,AST可通过分泌或直接接触,对OPCs增殖分化起到重要的调控作用。研究发现在细胞缝隙连接蛋白(connexion)CX43、CX47等基因敲除小鼠中,少突胶质细胞数量大量减少并出髓鞘空泡化的病理状态[4, 5, 6, 7, 8],AST分泌的BDNF、IGF等神经性营养因子也可促进少突胶质前体细胞增殖[8, 9]。
但是,在促进少突胶质前体细胞增殖中,缝隙连接和神经性营养因子有不同的调控方式,谁是AST对OPCs增殖分化的调控主要因素,以及调控的具体机制等等诸多问题目前并不清楚,国内外也少有报道。本实验目的就是全方位对比缝隙连接和神经性营养因子的调控,探讨AST对少突胶质前体细胞(OPC)生长分化的影响及作用机制。
1 材料与方法 1.1 材料与试剂清洁出生P3SD乳鼠,由重庆医科大学动物实验中心提供,神经母细胞瘤细胞株B104由第三军医大学惠赠;其他则为:DMEM/F12培养基(Hyclone)、胎牛血清(Gibco)、N2添加剂(Gibco)、乙二胺四乙二酸钠(EDTA)、EDU试剂盒(广州锐博生物有限公司)、兔抗PDGFαR多克隆抗体(Santa Cruz)、兔抗CX47多克隆抗体(Bioward)、兔抗GFAP多克隆抗体(碧云天公司)。
1.2 星形胶质细胞与少突胶质前体细胞原代培养 1.2.1 收集B104上清液B104常规培养直到细胞融合至80%~90%,PBS清洗去除残留血清,更换含 DMEM/F12 +1% N2-supplement的培养基,培养 4 天后收集上清,-80℃冻存[10]。
1.2.2 少突胶质前体细胞原代培养取P3SD乳鼠,分离端脑,去除脑膜,切碎后种至多聚赖氨酸预包被培养皿中,隔天换液(DMEM/F12+10%FBS+1%双抗),培养6~7d 当细胞融合至70%~80% 时,换增殖培养基(DMEM/F12+15%B104+1%N2+1%双抗),培养8~10天,获得较多OPC,细胞因子增殖联合EDTA消化机械吹打分离纯化法分离和纯化少突胶质细胞前体细胞[11]。
1.2.3 星形胶质细胞原代培养取P3SD乳鼠,分离端脑,去除脑膜,剪碎后胰酶消化,200目细胞筛过滤,离心1 200r/5min,重悬至玻璃培养皿内,孵箱内贴壁20min,吸出细胞悬液接种于多聚赖氨酸提前包被的培养皿内,隔天换液(DMEM/F12+10%FBS+1%双抗)至细胞融合,胰酶消化、离心进行传代纯化。
1.2.4 星胶与少胶前体共培养模型建立及实验分组常规OPC培养组(OPC组):纯化少突胶质前体细胞按1×107均匀接种于六孔板内,增殖培养基贴壁培养72h。
细胞因子培养组(CO-OPC组):接种纯化星形胶质细胞于细胞小室上层至完全融合,将纯化少突胶质前体细胞按1×107均匀接种于六孔板内,增殖培养基贴壁培养72h。
AST与OPC直接接触式培养组(AST-OPC组): 接种纯化星形胶质细胞于六孔板内至完全融合,将纯化少突胶质前体细胞按1×107均匀接种于星胶表面,增殖培养基贴壁培养72h。
缝隙连接空白干扰组: 接种纯化后星形胶质细胞于六孔板内至完全融合,将纯化少突胶质前体细胞按1×107均匀接种于星胶表面,贴壁培养24h后,加入转染复合物贴壁培养48h。
缝隙连接干扰组: 接种纯化后星形胶质细胞于六孔板内至完全融合,将纯化少突胶质前体细胞按1×107均匀接种于星胶表面,贴壁培养24h后,加入转染复合物(CX47 siRNA:CCGAGAAGACTGTCTTCTT)贴壁培养48h。
1.3 少突胶质前体细胞与星形胶质细胞纯度鉴定取上述培养的少突胶质前体细胞和星形胶质细胞,4%多聚甲醛固定30min,PBS洗3次(每次5min),4%山羊血清封闭1h,分别加一抗PDGFɑR(1∶200)和GFAP(1∶200)4℃过夜,PBS洗3次(每次5min),荧光二抗(1∶500)37℃孵育1h,PBS洗3次(每次5min),DAPI 37℃孵育10min,PBS清洗3次(每次5min),50%甘油封片后在激光共聚焦显微镜下检测。
1.4 流式细胞术分析细胞周期收集各组OPCs,PBS洗涤2次,采用70%冰乙醇于4℃固定过夜,在测定前先遗弃固定液,并加入碘化丙啶、RNA酶工作液,放于4℃染色30min,用300目滤网过滤之后上流式细胞仪,用计算机数据处理并分析出细胞周期中的各时相比例。
1.5 转录组测序分析差异表达缝隙连接蛋白提取样品总RNA并使用DNAase 1消化DNA后,用带有Oligo(dT)的磁珠富集mRNA,加入打断试剂在Thermomixer中适温将mRNA打断成短片段,以打断后的mRNA为模板合成第一链cDNA,然后配制二链合成反应体系合成第二链cDNA,并使用试剂盒纯化、回收、粘性末端修复、cDNA的3′末端加上碱基“A”并连接接头,然后进行片段大小选择,最后进行PCR扩增;构建好的文库用Agilent 2100 Bioanalyzer和ABI StepOnePlus RT-PCR system 质检合格后,使用Illumina HiSeqTM 2000进行测序,参照NCBI数据库的编码基因序列进行数据分析,在后续差异表达基因筛选中,设定符合Log2Ratio(A/O)>1,FDR<0.01,Pvalue<0.01的基因为显著差异表达基因。
1.6 RT-PCR验证差异表达缝隙连接蛋白(1)根据宝生物工程(大连)有限公司RNAiso Plus Total RNA说明书提取各组OPCs RNA,-80℃保存。(2) 根据M-MLV RTase cDNA试剂盒说明书逆转录合成cDNA。(3)采用CFX 96 PT-PCR系统进行检测,引物序列如下——CX47 前引物:GAGGATGAGGACGAGGAACCA;后引物:CTCCTACTCCTGCTCCTTGGT。反应条件为:95℃预变性30s;95℃变性5s,60℃退火30s,共40个循环;72℃ 延伸10min的反应条件。
1.7 Western blot 检测CX47干扰效果收集各组OPCs,PBS洗涤,蛋白裂解液裂解提取蛋白,BCA法测定细胞总蛋白浓度,样品经SDS-PAGE电泳分离,转膜,5% 脱脂奶粉封闭,CX47一抗(1∶1 000)及GAPDH一抗(1∶1 000)4℃孵育过夜,洗膜,HRP标记的二抗(1∶3000)室温孵育1h,洗膜,ECL发光。采用Quantity-One 软件来进行半定量分析,使用目的条带光密度值和β-actin条带光密度值的比值来反映目的蛋白表达的相对量,GAPDH为内参照。
1.8 EDU细胞增殖实验检测少胶前体细胞增殖能力各组OPCs培养至对数期时,加入50μmol/L EDU培养基孵育1天,次日,4%多聚甲醛固定,2mg/ml甘氨酸脱色摇床孵育5min、0.5%TritonX-100脱色摇床孵育10min,然后进行Apollo染色和DNA染色,激光共聚焦显微镜下观察和照相记录。应用ImageJ软件分别对DAPI、EDU染色阳性的细胞进行计数统计。
1.9 统计学分析采用软件SPSS16.0统计所有数据,组间均采用两两比较,并且进行单因素方差分析,使用LSD检验,以x±s方法统计所有计量资料,设定P<0.05的差异具有统计学意义。
2 结 果 2.1 星形胶质细胞与少突胶质前体细胞纯度鉴定OPC、AST特异性抗原PDGFɑR和GFAP分别标记的阳性细胞占细胞总数95%以上。少突胶质前体细胞较小,椭圆形,有2~3级突起,突起细长;AST细胞与细胞核较大,胞质丰富,突起较粗而多分枝(图 1)。
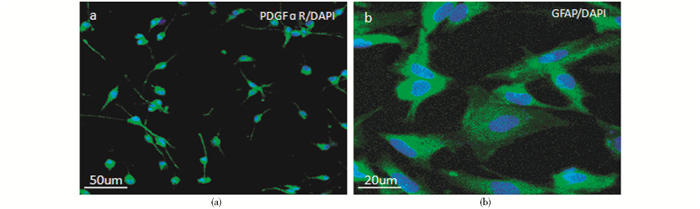
|
| 图 1 细胞纯度鉴定 Fig. 1 Identification of oligodendrocyte precursor cells and astrocytes (a) Oligodendrocyte precursor cells (b) Astrocytes |
光镜观察结果表明,星形胶质细胞可以通过分泌细胞因子或缝隙连接通讯两种方式促进少突胶质前体细胞增殖,细胞数目增多,在第2~3天明显,其中,直接接触式培养组增殖作用最为明显,在第3天细胞数目可达(265.60±3.85),明显高于单纯OPC培养组(80.20±1.92)(P<0.01,n=5)。流式细胞术对三组对数期细胞进行细胞周期检测,发现直接接触式培养组G0/G1期细胞比例为(62.51±2.39)%,低于常规OPC培养组(76.63±0.63)%,S期细胞比例为(30.69±2.14)%,高于常规OPC培养组(15.61±1.34)%,(P<0.01,n=3),提示直接接触式培养组明显通过缝隙连接促进OPC增殖(图 2、图 3、表 1)。
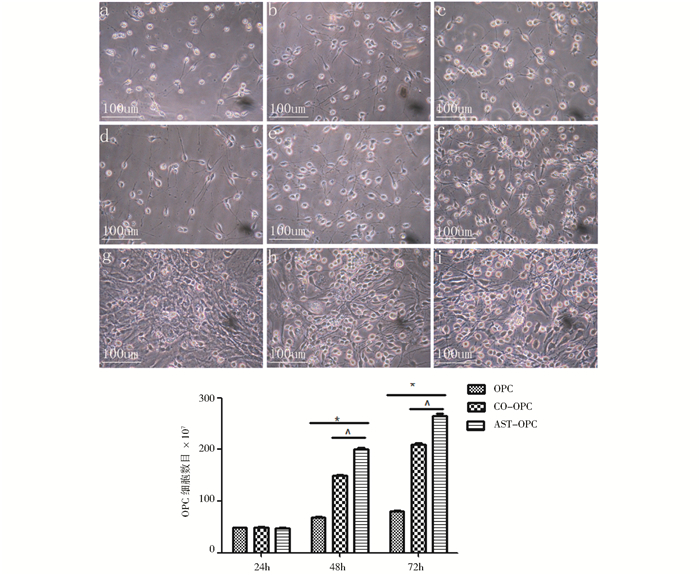
|
| 图 2 少突胶质前体细胞各个时期生长状态及数量改变 Fig. 2 Growth state and changes of cell numbers about OPCs in each period In fig.2: s, b, c, represents the growth state of OPCs under general culture at 24h,48h,72h respectively; d, e, f, represents the growth state of OPCs under co-culture in transwells at 24h,48h,72h respectively; g, h, i, represents the growth state of OPCs under directly contact co-culture in transwells at 24h,48h,72h respectively. Compared with OPC group, * P<0.01;Compared with CO-OPC group, ∧:P<0.01 |
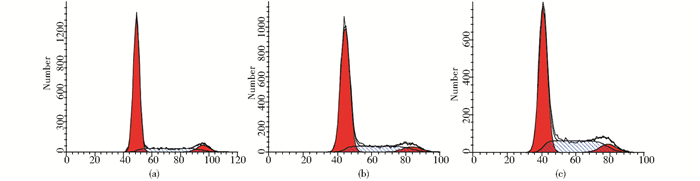
|
| 图 3 AST对OPC细胞周期的影响 Fig. 3 Effects of astrocytes on oligodendrocyte precursor cells’s cell distribution (a) OPC group (b) CO-OPC group (c) AST-OPC group |
| 组别 | G0/G1期(%) | S期(%) | G2/M期(%) |
| OPC | 76.63±0.63 | 15.61±1.34 | 7.76±0.73 |
| C0-OPC | 72.47±0.61* | 20.77±0.93** | 6.61±0.40 |
| AST-OPC | 62.51±2.39** # | 30.69±2.14** # | 6.80±0.24 |
| Compared with OPC group, * P<0.05,** P<0.01;Compared with CO-OPC group, # P<0.01 | |||
以Log2Ratio>1(差异倍数>2),FDR(错误发现率)<0.01且P<0.01的基因为显著差异表达基因。在9种缝隙连接蛋白中,CX47表达量较高,并且差异表达倍数明显。与常规OPC培养组相比,AST-OPC组CX47表达量FPKM高达(15.38±0.47),是OPC组(2.15±0.50)的7.15倍(表 2)。为验证直接接触式培养组与常规OPC培养组CX47的差异表达倍数,对差异表达基因CX47进行定量RT-PCR验证,AST-OPC组mRNA CX47的表达量是OPC组的(11.35±0.97)倍(n=3,P<0.01),与转录组测序分析结果的RNA差异表达倍数相一致(图 4)。
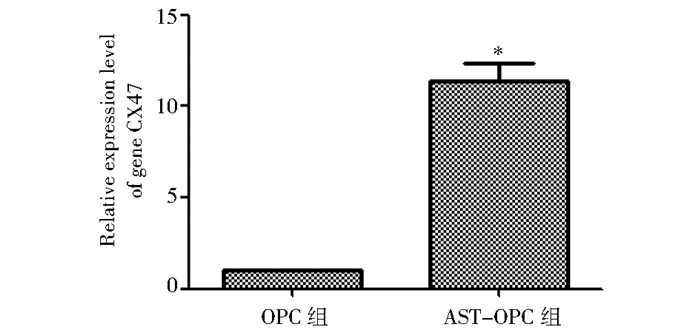
|
| 图 4 RT-PCR检测直接接触式共培养对基因CX47表达量的影响 Fig. 4 The relative expression of gene CX47 detected by RT-PCR after directly co-cultured Compared with OPC group, * P<0.01 |
| 组别 |
|
| OPC | 16.37±0.41 | 2.15±0.50 | 5.92±0.34 | 0 ±0 | 0±0 | 0.04±0.01 | 0±0 | 0±0 | 0.05±0.01 |
| CO-OPC | 13.56±0.60 | 2.51±0.31 | 4.82±0.36 | 0 ±0 | 0±0 | 0.10±0.02 | 0.08±0.01 | 0.08±0.01 | 0±0 |
| AST-OPC | 19.81±0.70 | 15.38±0.47* | 2.40±0.11 | 0.42±0.02 | 0.26±0.01 | 0.11±0.02 | 0±0 | 0±0 | 0±0 |
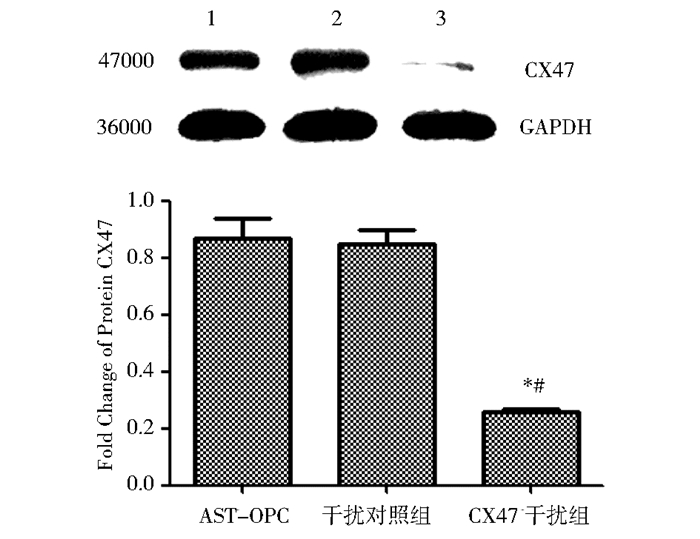
干扰RNA沉默基因CX47后其表达量(0.26±0.01)显著降低,与接触式共培养组(0.87±0.07)、CX47干扰对照组(0.85±0.05)相比,(P<0.01,n=3),具有统计学意义(图 5)。
|
| 图 5 Western blot检测少突胶质前体细胞CX47蛋白表达 Fig. 5 The expression of connexion CX47 in oligodendrocyte precursor cells Group 1 refers directly contact culture group; group 2 refers CX47 control group; group 3 refers CX47 silience group Compared with directly contact culture group, * P<0.01;Compared with CX47 control group, # P<0.01 |
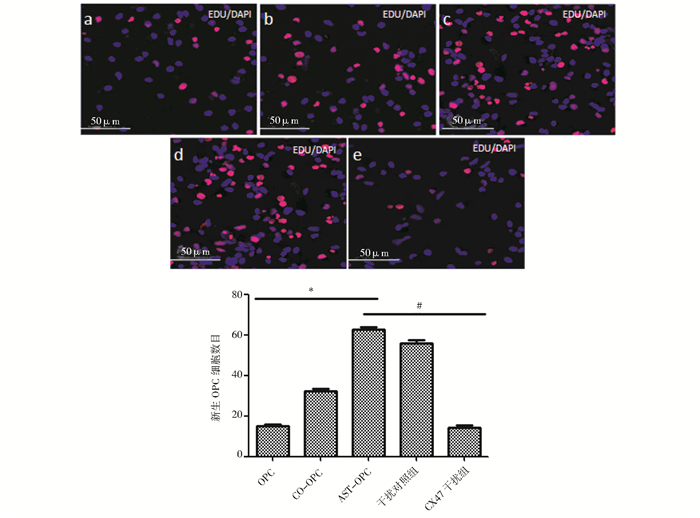
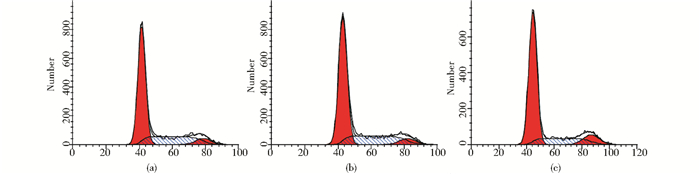
EDU染色结果表明,直接接触式共培养组OPC增殖明显,新生细胞数目为(62.60±1.14),明显高于单纯OPC培养组(15.20±0.84),(P<0.01,n=5),对CX47进行干扰后,新生细胞数目明显降低(14.20±1.10),(P<0.01,n=5);流式细胞术检测细胞周期结果表明,对差异表达缝隙连接CX47进行干扰后,G0/G1期细胞比例为(71.23±1.46)%,明显高于直接接触式培养组(66.28±1.93)%,S期细胞比例为(19.10±2.06)%,明显低于直接接触式培养组(27.40±1.62)%,(P<0.01,n=3),提示CX47敲出导致OPC细胞周期阻滞在G0/G1期,细胞增殖能力下降(图 6、图 7、表 3)。
|
| 图 6 EDU实验检测CX47干扰后OPC增殖能力 Fig. 6 The proliferation ability of OPCs after gene CX47 knockout In fig6: a refers OPC group; b refers CO-OPC group; c refers AST-OPC group;d refers CX47 control group; e refers CX47 silience group. Compared with directly contact culture group, * P<0.01;compared with CX47 control group, # P<0.01 |
|
| 图 7 CX47干扰后对OPCs细胞周期的影响 Fig. 7 Cell cycle distribution of OPCs after gene CX47 konckout (a) AST-OPC group (b) CX47 control group (c) CX47 silience group |
| 组别 | G0/G1期(%) | S期(%) | G2/M期(%) |
| AST-OPC组 | 66.28±1.93 | 27.40±1.62 | 6.32±0.50 |
| CX47 Control组 | 67.26±0.88 | 26.61±0.54 | 6.13±0.33 |
| CX47 Silience组 | 71.23±1.46* # | 19.10±2.06* ## | 9.67±0.75* ## |
| Compared with directly contact culture group, * P<0.01;compared with CX47 control group, # P<0.05, ## P<0.01 | |||
随着我国社会老龄化程度的加剧,神经系统退行性疾病如阿尔茨海默症、痴呆等神经系统退行性疾病发病率逐渐增加,严重影响了我国人口的健康水平和家庭的生活质量。而脱髓鞘是神经系统退行性疾病的最典型的共有病理表现之一,并且随着年龄增加,髓鞘再生效率下降[12]。髓鞘的再生修复主要依赖于少突胶质前体细胞(OPCs)的大量增殖及迁移到受损轴突区域并分化成熟。星形胶质细胞(AST)作为中枢神经系统数量最多、分布最广泛的一类细胞,对少突胶质前体细胞的增殖分化起着重要的调控作用。本实验探讨AST对OPCs发育分化的调控方式和机制,旨在寻找促进OPCs大量增殖的方法,为神经系统退行性疾病的脱髓鞘治疗提供理论基础。
我们发现,AST上清液培养组与直接接触式共培养组均能明显促进OPCs的增殖,随着培养时间延长,OPCs细胞数目增多明显,与对照组(80.20±1.92)相比,具有显著的统计学意义。其中,以直接接触式培养组(265.60±3.85)效果最为明显。流式检测三组OPCs对数期细胞周期也显示,直接接触式培养组细胞处于S期比例(30.69±2.14)最多,与其他两组相比,具有显著性差异。上述结果提示,AST促进OPCs增殖的机制可能和缝隙连接密切相关。
缝隙连接(gap junctions,GJs)是由相邻细胞膜上两个六聚体连接子相互锚定而成,能够直接进行物质交换和信息交流的跨膜通道[13, 14],每个连接子又由6个亚单位组成,称为连接蛋白(connexin)[15]。GJ 参与细胞间物质交换的代谢偶联和电信号传递的电联,进行细胞间信息传递(gap junction intercellular communication,GJIC),从而在神经细胞的生长、分化以及调节生理功能中发挥作用 [16]。研究表明,每个少突胶质细胞膜表面至少表达100个以上的缝隙连接蛋白[17],并且97%是与星形胶质细胞的连接蛋白相偶联[18]。星形胶质细胞连接蛋白CX43、CX30等突变或缺失,可引起少突胶质前体细胞连接蛋白表达减少,进而诱发脱髓鞘的病理改变[19, 20]。
运用转录组二代测序分析不同培养状态下OPCs所有的9种缝隙连接蛋白的表达变化。结果表明,与通常的成熟少突胶质细胞主要表达CX47、CX32、CX29[21]不同,少突胶质前体细胞主要表达CX32、CX47、CX45。其中,CX47变化最为显著,其表达量FPKM值可达(15.38±0.47),是常规OPC培养组(2.15±0.50)的7.15倍,荧光定量PCR验证与转录组测序结果相一致。所以我们推测CX47是促进接触式共培养组OPCs显著增殖的关键靶点。为此,我们采用siRNA沉默CX47进一步证明其作用。siRNA沉默基因CX47后,新生细胞数目明显减少至(14.20±1.10),与接触式共培养组(62.60±1.14)相比,具有显著差异。细胞周期G0/G1期比例由接触式共培养组的(66.28±1.93)升高为干扰后的(71.23±1.46),细胞周期明显阻滞在G0/G1期,增殖能力明显下降。结果提示,AST与OPCs间增殖代谢相关的物质交换和信息交流主要是通过表达于细胞膜表面缝隙连接蛋白CX47[22]介导的。
综上所述,星形胶质细胞与少突胶质前体细胞体外共培养后,可以明显促进少突胶质前体细胞的增殖,缝隙连接与细胞上清分泌因子均在这一过程中起作用,而CX47是促进少突胶质前体细胞增殖的主导因素。星形胶质细胞通过CX47可以明显调控少突胶质前体细胞的细胞周期和细胞增殖数量,是研究髓鞘再生的关键点,其机制值得深入研究。
致谢 本研究受到重庆医科大学青年科学基金资助,特表感谢!
| [1] | 林乐迎,李剑.少突胶质细胞的研究进展.赣南医学院学报,2010,03:500-502. Lin L Y,Li J.Research progress of oligodendrocytes.Journal of Gannan Medical University, 2010,03:500-502. |
| [2] | Barateiro A, Fernandes A. Temporal oligodendrocyte lineage progression:In vitro models of proliferation, differentiation and myelination. Biochimica et Biophysica Acta-Molecular Cell Research, 2014, 1843(9):1917-1929. |
| [3] | 沈维高,何欣,王振江.星形胶质细胞的生物学功能及其与疾病的关系研究进展.北华大学学报(自然科学版),2008,06:501-509. Shen W G,He X,Wang Z J.Research progress of biology function of astrocyte and its relationship with disease.Journal of Beihua University(Natural Science), 2008,06:501-509. |
| [4] | Sargiannidou I, Vavlitou N, Aristodemou S, et al. Connexin32 mutations cause loss of function in Schwann cells and oligodendrocytes leading to PNS and CNS myelination defects.The Journal of Neuroscience, 2009, 29(15):4736-4749. |
| [5] | Rash J E. Molecular disruptions of the panglial syncytium block potassium siphoning and axonal saltatory conduction:pertinence to neuromyelitis optica and other demyelinating diseases of the central nervous system.Neuroscience, 2010, 168(4):982-1008. |
| [6] | Kleopa K A, Orthmann-Murphy J, Sargi-annidou I. Gap junction disorders of myelinating cells. Rev Neurosci 2010,21:397-419. |
| [7] | Tress O, Maglione M, May D, et al. Panglial gap junctional communication is essential for maintenance of myelin in the CNS.The Journal of Neuroscience, 2012, 32(22):7499-7518. |
| [8] | Tsiperson V, Huang Y, Bagayogo I, et al. Brain-derived neurotrophic factor deficiency restricts proliferation of oligodendrocyte progenitors following cuprizone-induced demyelination. Asn Neuro, 2015, 7:1-11. |
| [9] | Mason J L, Xuan S, Dragatsis I, et al. Insulin-like growth factors (IGF) signaling through type 1 IGF receptor plays an important role in remyelination.The Journal of Neuroscience,2003,23:7710-7718. |
| [10] | 孟赞,徐丹,李真,等.TRPC3参与糖氧剥夺致培养的少突胶质细胞凋亡.中国生物工程杂志,2015,4:23-29. Meng Z,Xu D,Li Z,et al.Oxygen glucose deprivation-induced apoptosis in oligodendrocytes through TRPC3.China Biotechnology,2015,4:23-29. |
| [11] | Niu J, Wang L, Liu S, et al. An efficient and economical culture approach for the enrichment of purified oligodendrocyte progenitor cells. Journal of Neuroscience Methods, 2012, 209(1):241-249. |
| [12] | 方依卡,潘速跃.中枢神经系统髓鞘再生的生物学机制.临床医学工程,2010,03:154-155. Fang Y K,Pan S Y.The biological mechanism of remylination in the central nervous system. Clinical Medicine & Engineering,2010,03:154-155. |
| [13] | Söhl G, Maxeiner S, Willecke K. Expression and functions of neuronal gap junctions. Nat Rev Neurosci 2005,6:191-200. |
| [14] | Kumar N M, Gilula N B. The gap junction communication channel. Cell,1996,84:381-388. |
| [15] | 黄侠,赵明.缝隙连接蛋白和心房颤动的研究进展.心肺血管病杂志,2015,05:419-421. Huang X,Zhao M.Research progress of connexin and atrial fibrillation.Journal of Cardiovascular and Pulmonary Diseases,2015,05:419-421. |
| [16] | 韩冬. RNAi抑制Cx43基因表达对星形胶质细胞缺氧/再复氧后凋亡的影响.长春:吉林大学,2009. Han D.The effect of RNA interference against Connexin 43 on the apoptosis of astrocytes after hypoxia/reoxygen.Changchun:Ji Lin University,2009. |
| [17] | Spray D C, Dermietzel R. Gap Junctions in the Nervous System:An Introduction. Berlin Heidelberg:Springer, 1996,8:1-11. |
| [18] | Söhl G, Degen J, Teubner B, et al. The murine gap junction gene connexin36 is highly expressed in mouse retina and regulated during brain development. FEBS letters, 1998, 428(1):27-31. |
| [19] | Markoullis K,Sargiannidou I, Schiza N, et al. Oligodendrocyte gap junction loss and disconnection from reactive astrocytes in multiple sclerosis gray matter. Journal of Neuropathology Experimental Neurology, 2014, 73(9):865-879. |
| [20] | May D, Tress O, Seifert G, et al. Connexin47 protein phosphorylation and stability in oligodendrocytes depend on expression of Connexin43 protein in astrocytes. Journal of Neuroscience the Official Journal of the Society for Neuroscience, 2013, 33(18):7985-7996. |
| [21] | Orthmann-Murphy J L,Abrams C K,Scherer S S.Gap junctions couple astrocytes and oligodendrocytes. J Mol Neurosci,2008,35(1):101-116. |
| [22] | Zlomuzica A,Tress O, Binder S, et al. Changes in object recognition and anxiety-like behaviour in mice expressing a CX47 mutation that causes Pelizaeus-Merzhacher-like disease.Dey Neurosci,2012,34(2-3):277-287. |
 2015, Vol. 35
2015, Vol. 35




