文章信息
- 焦昀, 孔英俊, 高建萍, 康跻耀, 孙坤, 査圣华, 张贵锋, 王明林
- JIAO Yun, KONG Ying-jun, GAO Jian-ping, KANG Ji-yao, SUN Kun, ZHA Sheng-hua, ZHANG Gui-feng, WANG Ming-lin
- 羟基化修饰对大鼠胶原热稳定性的影响研究
- The Effect of Hydroxylation on the Thermal Stability of Rat Collagen
- 中国生物工程杂志, 2015, 35(11): 7-12
- China Biotechnology, 2015, 35(11): 7-12
- http://dx.doi.org/10.13523/j.cb.20151102
-
文章历史
- 收稿日期: 2015-03-23
- 修回日期: 2015-07-17
2. 中国科学院过程工程研究所生化工程国家重点实验室 北京 100190
2. Institute of Process Engineering, Chinese Academy of Sciences, National Key Laboratory of Biochemical Engineering, Beijing 100190, China
胶原是由动物细胞合成的一种生物高分子,具有良好的生物相容性、弱抗原性和生物可降解性等,在生物材料、组织工程与再生医学、生物医药和医疗器械领域应用十分广泛,如用于制备止血材料、组织工程支架和动物细胞培养的微载体等[1, 2]。胶原降解速率、热稳定性和力学性能等是影响其应用的关键因素,通常情况下利用胶原直接制备的生物材料存在一定局限性,采用适当方式改善胶原性能是近年来生物可降解材料研究的热点[3, 4]。
目前文献报道的提高胶原材料性能的方法主要包括化学交联/物理交联、与其它材料复合或胶原涂层等。化学交联可有效改善胶原的力学性能,并显著提高组织工程支架、组织填充材料和药物控释水凝胶等材料的机械强度,但交联剂残留及其反应产物常产生一定的细胞毒性[5, 6]。物理交联可提高胶原基材料(如胶原膜等)的拉伸强度等性能,但物理法交联度普遍较低,且表面和内部的交联度不均一[7]。在水凝胶或细胞支架制备方面,将胶原与透明质酸或壳聚糖混合可在一定程度上改善生物材料的机械性能,但降解速率、成膜性和可塑性等与胶原存在显著差异[8]。胶原涂层技术可显著提高材料的细胞黏附效果,以改变材料表面性能,但主要用于高分子聚合物、金属或陶瓷材料表面处理[9]。采用电纺丝技术可制备胶原纳米纤维并进一步制备高机械强度的细胞支架或膜材料等,但限于制备规模,该技术尚未广泛应用于生物材料制备[10]。此外,基于3D打印的生物材料制备技术对胶原的机械强度提出了更高的要求[11]。
胶原的热稳定性及力学性能主要受三条α链之间的相互作用及羟基化修饰影响。对于特定来源的特定类型胶原,羟脯氨酸(Hyp)含量是影响其力学性能的关键因素[12]。有研究表明Hyp含量随动物生长年龄会发生变化[13],利用同种动物提取的胶原其性能也存在显著差异,并进一步影响制备的生物材料的各种性能[14]。因此,研究Hyp对胶原热稳定性和力学性能的影响对进行生物材料研究十分关键。胶原的热变性过程和机械强度均涉及三条α链之间的相互作用,在临界变性温度条件下胶原的三螺旋发生解聚,理论上不同Hyp含量的胶原其稳定性和机械强度差异与临界变性温度及焓变密切相关 [15, 16]。差示扫描量热仪(DSC)可通过热诱导变化研究蛋白质结构稳定性与温度的关系,是一种研究胶原结构与稳定性的方法[17, 18]。由于Hyp对胶原三螺旋解聚的机制一直未有统一的认识,因此可以利用DSC测定胶原蛋白焓变的方法定量得到胶原蛋白焓变与Hyp含量的关系,通过建立焓变方程的方法进一步解释Hyp含量对胶原蛋白三螺旋解聚的内在机制,这对胶原蛋白材料的改性提供了理论基础,有利于胶原生物材料的广泛应用。
本研究以不同周龄大鼠的皮胶原为对象,研究Hyp含量对胶原热稳定性的影响,首先从不同周龄BN大鼠皮肤中分离胶原,测定了不同生长期鼠皮胶原中的Hyp含量,采用DSC技术和圆二色光谱(CD)测定制备胶原的临界变性温度及焓变,并考察Hyp含量对胶原热稳定性的影响。
1 材料与方法 1.1 材料与试剂雄性BN大鼠(1~10周)购自北京维通利华实验动物技术有限公司;氨基酸标准品购自中国食品药品检定研究院,2,4-二硝基氟苯(DNFB)、色谱纯乙腈均购自Sigma公司,其他试剂均为市售分析纯。
1.2 主要仪器设备高效液相色谱仪(美国.Agilent1260);VP-DSC(美国,GE)、CD光谱(日本,分光JASCO-810)。
1.3 胶原提取胶原粗品的制备过程参照文献[8]中的方法,机械法脱毛后去除鼠皮内侧脂肪,取0.5g置于离心管内,加入5ml乙酸溶液(0.01mol/L,pH3),溶胀处理0.5h后匀浆。将鼠皮匀浆在25℃条件下恒温水浴处理3h,置于离心管内,10 000r/min离心10min,取上层清液待用。胶原精制过程采用凝胶过滤色谱法,收集保留时间为10~11min的组分。
胶原精制:采用凝胶过滤色谱(SEC)分离胶原粗提品,收集保留时间为10~11min的组分。
1.4 分析方法 1.4.1 SEC蛋白分离 色谱柱TSK3000SWxl(7.5mm×300mm,5μm);流动相:0.02mol/L磷酸盐缓冲液(pH7.0);流速:0.5ml/min;检测波长:220nm检测;进样量:4μl。
1.4.2 氨基酸组成分析参考文献[19]中的方法。
1.4.3 SDS-PAGE采用SDS-PAGE法检测提取胶原纯度,分离胶浓度为10% ,浓缩胶浓度为8% ;电极缓冲液为SDS - Tris -甘氨酸,电泳电流30mA、电压200V、电泳时间4~5h。
1.4.4 DSC分析检测样品前采用脱气超纯水校正仪器3次,取样品与参比液各570μl,脱气后置于样品池进行检测;温度扫描区间为10~100℃,升温速率为1℃/min。
1.4.5 CD光谱扫描波段为190~260nm,光谱测量频率为0.2~1nm,扫描速率为500nm/min,在氮气条件下,平行扫描三次。
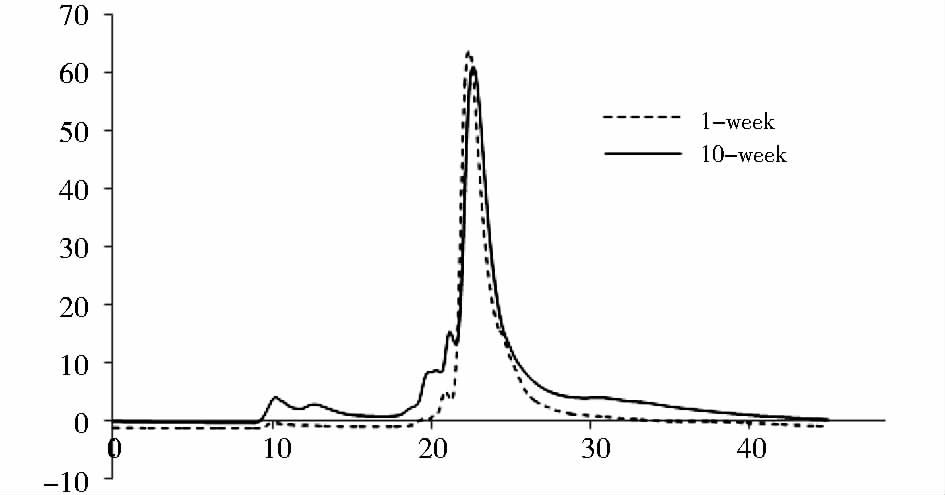
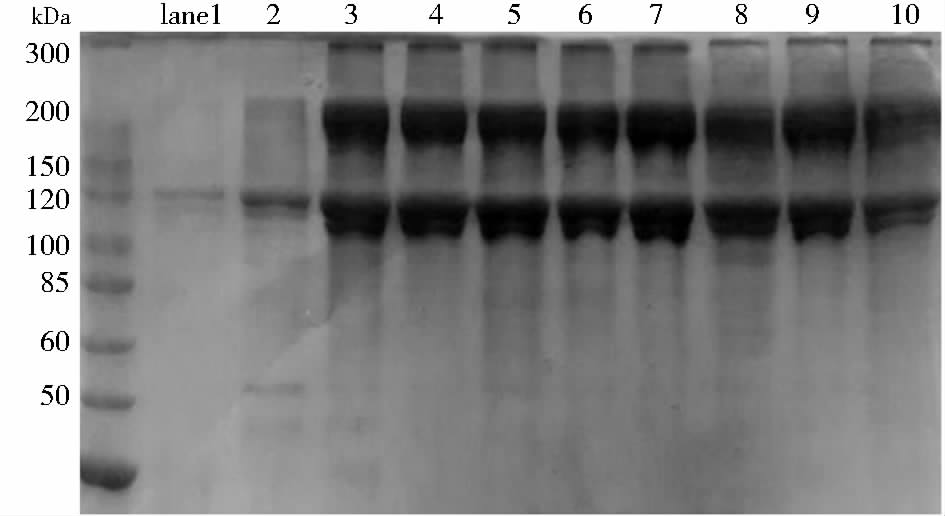
2 结果与讨论 2.1 胶原精制和SDS-Page分析胶原粗品中存在一定量的杂蛋白质,实验采用凝胶过滤色谱对提取的胶原蛋白粗品进行了进一步纯化(图 1)。胶原分子质量约为300kDa,正常条件下其直径为1.5nm,分子线性长度约为300nm。胶原具有较大的水力学半径,超过TSK3000SW凝胶色谱柱的检测上限,图 1所示存在保留时间为10min的组分,理论上会是胶原蛋白的色谱峰。胶原蛋白粗品中存在一定低分子质量的杂蛋白质或多肽,收集保留时间为10min的色谱峰可有效去除含有的杂蛋白质或多肽。实验进一步采用聚丙烯酰胺凝胶电泳方法对图 1中保留时间为10min的组分进行分子质量测定,从凝胶电泳图谱中可知(图 2),精制后的胶原电泳图中显示出三条明显的主带,其中分子质量为100kDa的条带为胶原蛋白的α链,分子质量为200kDa的条带为胶原蛋白β链,分子质量为300kDa的条带为完整胶原蛋白。胶原的理论分子质量约为300kDa,在电泳样品预处理过程中加热会导致胶原的三条链部分解离,产生分子质量为200kDa和100kDa的条带,但未发现低于100kDa的组分,表明精制后的胶原具有较高的纯度。图 2中lane1~10分别依次为精制后第1周至第10周的大鼠皮胶原,表明实验采用的鼠皮胶原提取方法具有良好的重复性。
|
| 图 1 1周、10周BN大鼠皮肤胶原SEC胶原分离谱图 Fig. 1 Separation of spectra of 1,10-week BN rat skin collagen |
|
| 图 2 SDS-聚丙烯酰胺凝胶电泳图 (不同周龄鼠皮胶原样品) Fig. 2 SDS-Page (BN rat skin collagen in different weeks) |
实验分析了制备胶原的氨基酸组成(表 1),胶原蛋白的氨基酸序列由G-X-Y重复排列组成,这种特殊的序列组成决定了胶原中Gly的含量超过1/3。大鼠I型胶原由两条α1链(UnitProt: P02454)和一条α2链(UnitProt: P02466)组成,α1链由1 056个氨基酸组成(不含信号肽和端肽),其中含有346个Gly,Pro和Hyp共计236;α2链由1 022个氨基酸组成(不含信号肽和端肽),其中含有344个Gly,Pro和Hyp共计201。理论上,大鼠I型胶原的每1 000个氨基酸中含有超过330个Gly,Pro+Hyp共计超过214个。表 1所示提取的不同周龄大鼠皮胶原中Gly的含量均超过1/3,Pro和Hyp之和接近214,与胶原的序列特征及氨基酸组成相同,表明实验制备的胶原具有较高的纯度。不同大鼠胶原中的Hyp的含量随周龄延长而逐渐增加。
| 1-week | 2-week | 4-week | 5-week | 8-week | 10-week | |
| Hyp/‰ | 33.5 | 88.9 | 99.3 | 99.6 | 99.7 | 118.1 |
| Gly/‰ | 357.7 | 372.1 | 363.8 | 359.3 | 357.6 | 350.9 |
| Pro/‰ | 63.6 | 111.7 | 116.2 | 118.0 | 117.6 | 126.1 |
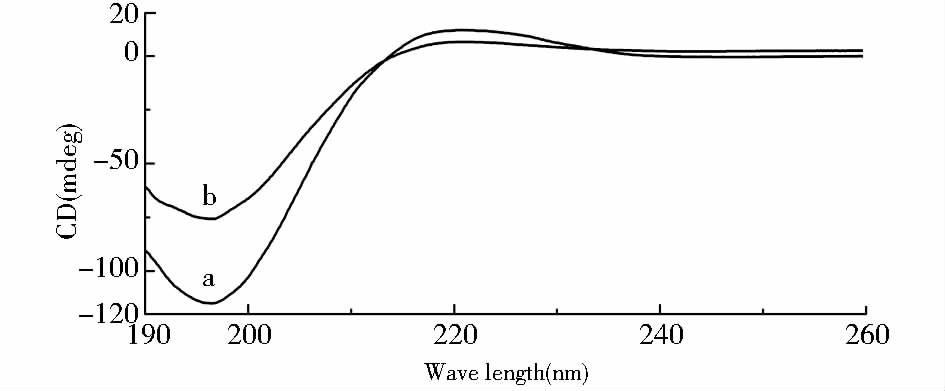
为进一步证明提取的胶原具有三螺旋结构,实验采用CD光谱测定了样品的二级结构。在可溶性胶原蛋白三螺旋结构的解旋过程中,伴随有光学活性等物理性质的变化。胶原三螺旋结构在CD光谱图中的典型特征是在220nm处出现正峰最大值,负峰值于195nm处出现。图 3中a曲线是胶原样品未经过Tm温度处理的CD光谱图,在220nm出现正吸收谱带,在196nm处出现负吸收谱带,属于典型的胶原CD光谱图,表明胶原在热变性处理前保持有完好的三螺旋结构。中性pH条件下哺乳动物胶原热变性温度为35~45℃,同时也受溶液离子种类和离子强度的影响。图 3中b曲线是将提取胶原在41.3℃恒温处理10min后的CD光谱图,在220nm和196nm处的吸收谱带均发生明显变化,表明经过热处理后胶原三螺旋结构发生了部分解聚,也进一步证明实验提取的胶原具有完好的三螺旋结构。
|
| 图 3 BN鼠皮胶原CD扫描谱图(临界变性温度处理前a,后b) Fig. 3 CD spectra of BN rat skin collagen before a and after b Tm treated |
|
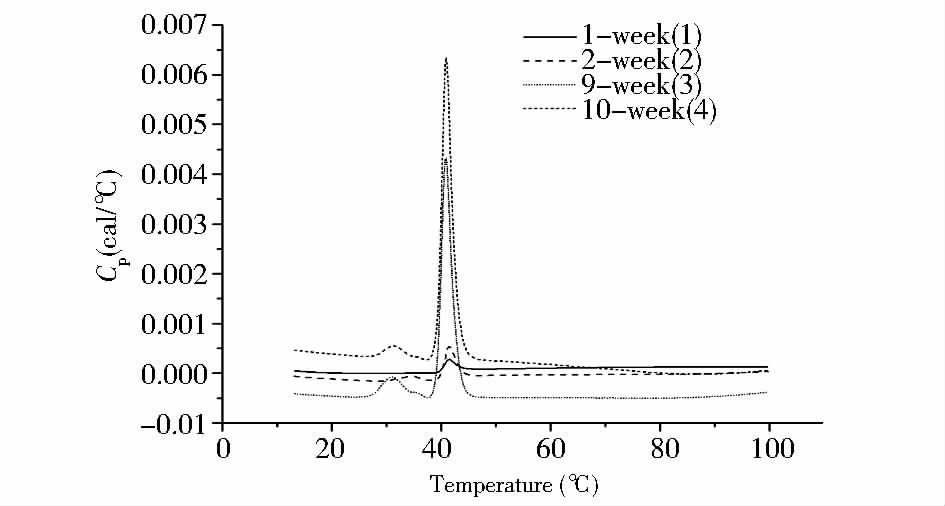
| 图 4 不同周龄BN鼠皮胶原DSC检测分析 Fig. 4 DSC Analysis of BN rat skin collagen in different weeks |
|
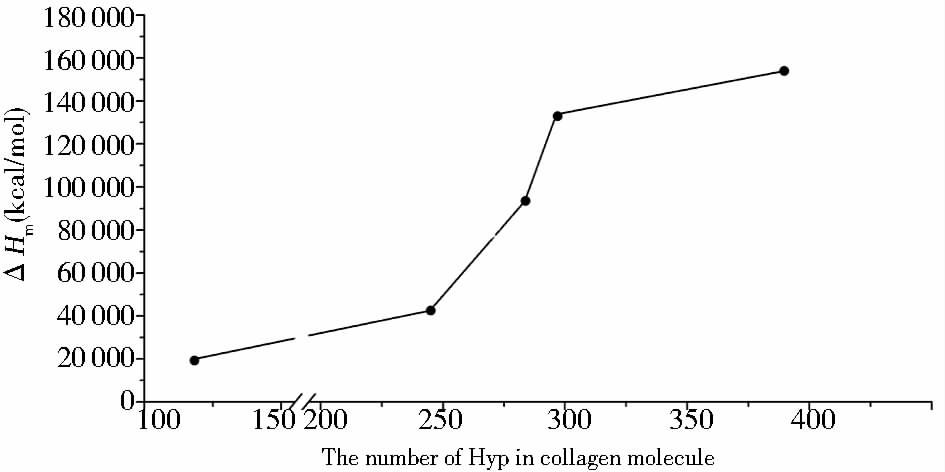
| 图 5 胶原Hyp含量与摩尔焓变关系图 Fig. 5 Molar enthalpy changes in collagen with different Hyp content |
| Week | ||||||
| 1 | 2 | 4 | 5 | 8 | 10 | |
| △Hm/104 (kcal/mol) Hyp(molecule) | 1.97 105 | 3.05 279 | 11.4 311 | 16.4 312 | 17.6 313 | 17.4 370 |
构成胶原分子的每条α链属于左手螺旋结构,三条链以右手螺旋方式缠绕成三螺旋结构。胶原热变性过程的摩尔焓变与三条α链之间的解离、α链之间的氢键断裂及α链的自身结构变化相关,因此,胶原热变性过程的摩尔焓变可由式(1)表示。
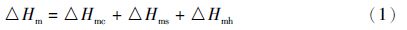
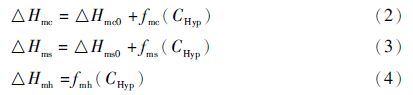
在哺乳动物皮肤中I型胶原含量约占总胶原的85%以上,在不同生长期内的大鼠皮肤中,I型胶原蛋白的相对含量会随生长期逐渐升高,SDS-聚丙烯酰胺凝胶电泳分析了精制后的胶原,与胶原理论分子质量一致。进一步采用DNFB柱前衍生化测定提取胶原中氨基酸组成,胶原中Hyp和Gly的含量与基于氨基酸序列计算的结果一致,表明制备的胶原是大鼠I型胶原。应用DSC对提取胶原Tm及摩尔焓变进行检测,其中总焓变可由胶原三螺旋结构解聚所涉及的结构变化解释,首先是胶原解离的摩尔胶原焓变,其次是自身结构变化的摩尔焓变,以及脯氨酸羟基化修饰引起氢键所需焓变。由于样品均为鼠皮胶原提取物,其多肽链结构与氨基酸成分一致,所以造成焓变差异的主要原因是由于Hyp引起的氢键的影响,通过对不同周龄BN大鼠皮中羟脯氨酸含量与临界变性温度及焓变关系的研究发现,对胶原的热变性过程进行分析,Hyp是提高胶原三螺旋结构稳定性的关键因素,这对进一步探究脯氨酸羟基化修饰位点对其稳定性的影响提供了基础研究。
本实验通过热诱导变化研究了胶原结构中Hyp含量与焓变的关系。研究结果表明,Hyp在胶原三螺旋解聚的过程中可以有效提高其稳定性,可对胶原样品进行不同程度的羟基化修饰以达到不同应用的要求,对胶原材料多元化提供了实验基础,有助于推动胶原生物材料的发展。
| [1] | Schweizer S, Bick A, Subramanian L, et al. Influences on the stability of collagen triple-helix. Fluid Phase Equilibria, 2014, 362: 113-117. |
| [2] | Lin Y K, Kuan C Y. Development of 4-hydroxyproline analysis kit and its application to collagen quantification. Food Chemistry, 2010, 119(3): 1271-1277. |
| [3] | Mu C D, Li D F, Lin W, et al. Temperature induced denaturation of collagen in acidic solution. Biopolymers, 2007, 86(4): 282-287. |
| [4] | Hofman K, Hall B, Cleaver H, et al. High-throughput quantification of hydroxyproline for determination of collagen. Analytical Biochemistry, 2011, 417(2): 289-291. |
| [5] | Marzec E, Pietrucha K. The effect of different methods of cross-linking of collagen on its dielectric properties. Biophysical Chemistry, 2008, 132(2-3): 89-96. |
| [6] | Pon-on W, Charoenphandhu N, Teerapornpuntakit J, et al. Mechanical properties, biological activity and protein controlled release by poly(vinyl alcohol)-bioglass/chitosan-collagen composite scaffolds: a bone tissue engineering applications. Materials Science and Engineering C, 2014, 38(9): 63-72. |
| [7] | Selvam S, Usha R, Kalarical J, et al. Enhancing collagen stability through nanostructures containing chromium(III)oxide. Colloids and Surfaces B: Biointerfaces, 2012, 100: 36-41. |
| [8] | Usha R, Rajaram A, Ramasami T. Stability of collagen in the presence of 3,4-dihydroxyphenylalanine (DOPA). Journal of Photochemistry and Photobiology B, Biology, 2009, 9(7): 34-39. |
| [9] | Colgrave M L, Allingham P G, Jones A. Hydroxyproline quantification for the estimation of collagen in tissue using multiple reaction monitoring mass spectrometry. Journal of Chromatography A, 2008, 1212(1-2): 150-153. |
| [10] | He L R, Mu C D, Li D F, et al. Revisit the pre-transition of type I collagen denaturation in dilute solution by ultrasensitive differential scanning calorimetry. Thermochimica Acta, 2012, 548: 1-5. |
| [11] | He C L, Tang Z H, Tian H Y, et al. Progress in the development of biomedical polymer materials fabricated by 3-dimensional printing technology. Acta Polymerica Sinica, 2013, 13(6): 722-732. |
| [12] | John A M, Naina K, Barbara B. Gly-X-Y tripetide frequencies in collagen: a context for host-guest triple-helical peptide. Structure Biology, 1998, 122(1-2): 86-91. |
| [13] | Rieppo J, Hyttinen M M, Halmesmaki E, et al. Changes in spatial collagen content and collagen network architecture in porcine articular cartilage during growth and maturation. Osteoarthritis and Cartilage, 2008, 17(4): 448-455. |
| [14] | Gu Q S, Tian K. Collagen in tissue engineering and clinical application. Shanghai Biomedical Engineering, 1999, 6: 35-38. |
| [15] | Gu Q S, Hou C L. Natural biodegradable sex research progress of biomedical materials. Shanghai Biomedical Engineering, 1999, 6: 39-40. |
| [16] | 杨太美. 胶原与创面愈合.国际骨科学杂志,1994, 2:72-76. Yang T M. Collagen and wound healing. International Journal of Orthopaedics, 1994, 2: 72-76. |
| [17] | Liu W T, Li G Y. Non-isothermal kinetic analysis of the thermal denaturation of type I collagen in solution using isoconversional and multivariate non-linear regression methods. Polymer Degradation and Stability, 2010, 95: 2233-2240. |
| [18] | Li Y, Li Y W, Du Z L, et al. Comparison of dynamic denaturation temperature of collagen with its static denaturation temperature and the configuration characteristics in collagen denaturation processes. Thermochimica Acta, 2008, 469(1-2): 71-76. |
| [19] | Wang J, Zhang X Y, Teng Y K, et al. Determination of the content of amino acid by pre-column derivatization and RP-HPLC. Journal of Shenyang Pharmaceutical University, 2003, 20(6):428-430. |
| [20] | Kandamchira A, Selvam S, Marimuthu N, et al. Influence of functionalized nanoparticles on conformational stability. Materials Science and Engineering, 2013, 33(8): 4985-4988. |
| [21] | Wu L W, Liu W T, Li G Y. Preparation and characterization of undenatured collagen from porket skin. China Leather, 2013,7(42):26-29. |
 2015, Vol. 35
2015, Vol. 35




