文章信息
- 刘晓霏, 付晶, 霍广鑫, 章博, 王智文, 陈涛
- LIU Xiao-fei, FU Jing, HUO Guang-xin, ZHANG Bo, WANG Zhi-wen, CHEN Tao
- 生物法制备平台化合物乙偶姻的最新研究进展
- Latest Advances of Microbial Production of Platform Chemical Acetoin
- 中国生物工程杂志, 2015, 35(10): 91-99
- China Biotechnology, 2015, 35(10): 91-99
- http://dx.doi.org/10.13523/j.cb.20151014
-
文章历史
- 收稿日期: 2015-04-03
- 修回日期: 2015-05-15
2. 系统生物工程教育部重点实验室 天津 300072;
3. 天津化学化工协同创新中心 天津 300072
2. Key Laboratory of Systems Bioengineering Ministry of Education, Tianjin University, Tianjin 300072, China;
3. SynBio Research Platform, Collaborative Innovation Center of Chemical Science and Engineering, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China
乙偶姻,化学名为3-羟基-2-丁酮,又名甲基乙酰甲醇,具有特殊的奶香味道,天然存在于许多食品中,是一种广泛使用的食品级香料[1],在GB2760-2011(食品安全国家标准/食品添加剂使用标准)中被列为允许使用的食品用合成香料。同时,乙偶姻作为一种重要的4碳平台化合物,被美国能源部列为30种优先开发利用的平台化合物之一[2]。特别是手性乙偶姻(D-(-)-乙偶姻和L-(+)-乙偶姻)作为高附加值化学品,可广泛应用于手性药物和化学中间体的合成[3]。
传统的化学合成乙偶姻方法主要有丁二酮部分加氢工艺、2,3-丁二醇选择性氧化工艺以及丁酮氯化水解工艺等,这些方法操作简便且技术成熟,但目标产品的得率较低,且环境污染严重。生物法制备乙偶姻具有高效、环保、可持续等特点,可以减轻资源和环境压力,从而促进我国低碳经济和循环经济的建设。通过代谢工程、合成生物学、进化工程等方法改造微生物,使其成为高效生产乙偶姻的生物炼制工厂,吸引了世界各国科学家关注的目光,并取得了丰硕的研究成果。
本文重点关注了近几年国内外学者在生物法制备乙偶姻领域的最新研究成果和热点方向,简述了发酵法生产乙偶姻的菌株概况,重点综述了以糖类物质为底物、以2,3-丁二醇或双乙酰为底物生产乙偶姻的最新策略及研究成果,介绍了乙偶姻的分离纯化工艺,并展望了今后生物法制备乙偶姻的研究趋势和方向。
1 乙偶姻生产菌株及其改造 1.1 乙偶姻生产菌株目前,已有多种微生物能够天然或通过代谢工程改造后生产乙偶姻,但其生产能力却有很大差异(表 1)。粘质沙雷氏菌(Serratia marcescens)、多粘类芽孢杆菌(PaeniBacillus polymyxa)、芽孢杆菌属(Bacillus)中的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、短小芽孢杆菌(Bacillus pumilus)、枯草芽孢杆菌(Bacillus subtilis)和地衣芽孢杆菌(Bacillus licheniformis)具有卓越的乙偶姻生产能力。通过代谢工程方法,改造大肠杆菌(Escherichia coli)、谷氨酸棒杆菌(Corynebacterium glutamicum)等非乙偶姻天然合成微生物的研究工作也获得了许多突破性进展。
目前,已有多种微生物能够天然或通过代谢工程改造后生产乙偶姻,但其生产能力却有很大差异(表 1)。粘质沙雷氏菌(Serratia marcescens)、多粘类芽孢杆菌(Paenibacillus polymyxa)、芽孢杆菌属(Bacillus)中的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、短小芽孢杆菌(Bacillus pumilus)、枯草芽孢杆菌(Bacillus subtilis)和地衣芽孢杆菌(Bacillus licheniformis)具有卓越的乙偶姻生产能力。通过代谢工程方法,改造大肠杆菌(Escherichia coli)、谷氨酸棒杆菌(Corynebacterium glutamicum)等非乙偶姻天然合成微生物的研究工作也获得了许多突破性进展。
| Strains | Substrates | Titer(g/L) | Yield(g/g) | Productivity(g/Lh) | Ref |
| Serratia marcescens H32-nox | Sucrose | 75.2 | 0.360 | 1.88 | [4] |
| Bacillus amyloliquefaciens E-11 | Glucose | 71.5 | 0.404 | 1.63 | [5] |
| Bacillus pumilus XH195 | Glucose Sucrose | 63.0 58.1 | ND ND | 1.05 0.96 | [6] |
| Serratia marcescens H32 | Sucrose | 60.5 | ND | 1.44 | [7] |
| Escherichia coli (pAC-NOX) | Glucose | 60.3 | 0.422 | 1.55 | [8] |
| Bacillus subtilis TH-49 | Glucose | 56.9 | ND | 0.89 | [9] |
| PaeniBacillus polymyxa CS107 | Glucose | 55.3 | 0.370 | 1.32 | [10] |
| Bacillus subtilis JNA-UD-6 | Glucose | 53.9 | 0.359 | 0.37 | [11] |
| Bacillus amyloliquefaciens FMME044 | Glucose | 51.2 | 0.430 | 1.42 | [12] |
| Bacillus licheniformis MEL09 | Glucose | 41.3 | 0.413 | 1.15 | [13] |
| Klebsiella pneumoniae XZF-308 | Glucose | 25.9 | ND | 0.32 | [14] |
| Enterobacter cloacae DSM01 | Glucose | 10.8 | 0.282 | 0.90 | [15] |
| Candida glabrataΔadh-Δald-Δbdh-ScPDC1-NOX | Glucose | 7.3 | 0.070 | 0.11 | [16] |
| Clostridium acetobutylicum adc∷int (180)(pSY8-alsD) | Glucose | 4.3 | ND | ND | [17] |
| ND: no data mentioned in that article | |||||
在大规模工业化生产中,使用安全的非致病性菌株(Class 1 microorganisms)可以降低人畜患病的风险。而从食品安全的角度考虑,乙偶姻被用作食用添加剂时同样要求其生产菌株是非致病性的(generally recognized as safe,GRAS)。
目前已经报道的乙偶姻高产菌株中,多粘类芽孢杆菌、解淀粉芽孢杆菌、短小芽孢杆菌、枯草芽孢杆菌和地衣芽孢杆菌因其安全性(属于Class 1微生物)更适合乙偶姻的工业化生产。这些高产菌株很多只是通过传统诱变(如物理诱变和化学诱变)或简单筛选(Voges Proskauer test,VP试验)而获得。但是,传统诱变筛选方式得到的菌株积累了很多未知的突变点,有些突变可能会影响菌株的鲁棒性和重组能力,而这些不确定性因素给进一步的理性代谢工程改造带来了困难。可以预见,通过代谢工程和合成生物学手段改造这些遗传背景清晰的、具有乙偶姻工业化生产潜力的菌株,从而提高乙偶姻的产量和生产力,会成为今后研究者关注的重点。
与此同时,通过引入乙偶姻合成途径的相关基因,改造不具备乙偶姻天然合成能力的安全模式菌株也引起了研究者的关注。作者课题组通过在全基因组测序的谷氨酸棒状杆菌(C. glutamicum ATCC 13032)中引入来自枯草芽孢杆菌Bacillus subtilis 168中乙偶姻合成途径的相关基因alsSD操纵子,使其具备乙偶姻合成能力。在优化的溶氧条件下,工程菌的乙偶姻产量达到8.3 g/L,这证明了谷氨酸棒杆菌具有良好的乙偶姻合成能力和应用潜力[18]。
2 以糖类物质为底物生产乙偶姻及其策略目前生物法制备乙偶姻的研究重点大部分集中在以糖类物质为底物的微生物发酵过程。如图 1所示,各种糖类经由糖酵解途径生成丙酮酸,两分子丙酮酸在α-乙酰乳酸合成酶(Acetolactate synthase,ALS)的催化作用下合成L-(+)-α-乙酰乳酸,再经由α-乙酰乳酸脱羧酶(acetolactate decarboxylase,ALD)的催化作用脱羧生成D-(-)-乙偶姻(也叫R-乙偶姻)。该途径广泛存在于各类乙偶姻生产菌中。在有氧条件下,L-(+)-α-乙酰乳酸可以自发地生成双乙酰(又名丁二酮),后者可在双乙酰还原酶(Diacetyl/acetoin reductase,AR)作用下还原为L-(+)-乙偶姻(又称S-乙偶姻)[19]。
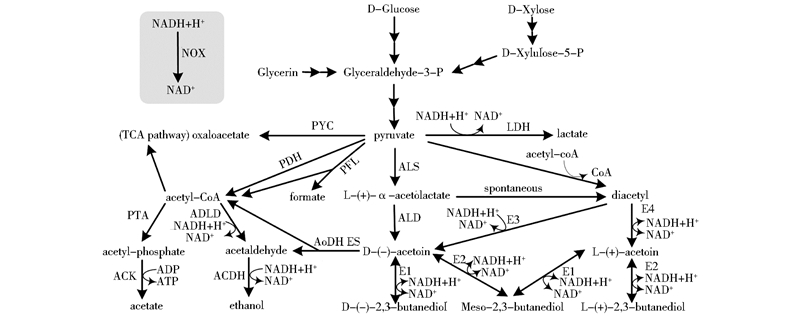
|
| 图 1 乙偶姻的生物合成途径 Fig. 1 The acetoin biosynthetic pathway ALS: Acetolactate synthase; ALD: Acetolactate decarboxylase; ACK: Acetate kinase; ADDH: Aldehyde dehydrogenase; ACDH: Alcohol dehydrogenase; LDH: Lactate dehydrogenase; NOX: NADH oxidase; PDH: Pyruvate dehydrogenase; PFL: Pyruvate formate lyase; PTA: Pta, phosphotransacetylase; PYC: Pyruvate carboxylase; E1: D-(-)-butanediol dehydrogenase (EC 1.1.1 .4 ); E2: L-(+)-butanediol dehydrogenase (EC 1.1.1.76); E3: Diacetyl reductase [(R)-acetoin forming] (EC 1.1.1.303); E4: Diacetyl reductase [(S)-acetoin forming] (EC 1.1.1.304) |
从乙偶姻的代谢途径中可以看出,提高乙偶姻生成途径代谢通量、阻断乙偶姻还原为2,3-丁二醇和其他降解产物的代谢途径,失活乙偶姻竞争代谢支路相关基因从而减少副产物合成,是构建乙偶姻高产菌株的可行策略。同时,通过辅因子工程解决菌体胞内还原力过剩的问题,通过进化工程提高工程菌对乙偶姻的耐受性,可以突破乙偶姻产量增长的瓶颈。在此基础上,提高糖类底物利用效率或使用廉价碳源,并结合发酵工程手段,可以进一步降低生物法制备乙偶姻的生产成本。
2.1 增强乙偶姻合成支路相关基因的表达丙酮酸到乙偶姻的合成支路涉及到α-乙酰乳酸合成酶和α-乙酰乳酸脱羧酶,分别由alsS和alsD基因编码。两者在某些菌株中也被称作butA和butB基因,且其常以操纵子形式存在[3]。
通过代谢工程手段引入外源alsS和alsD基因可以使非乙偶姻天然合成菌株获得其生产能力,同时,在具备乙偶姻合成能力的菌株中过表达这两个基因也可以显著提高乙偶姻的产量。对于非乙偶姻天然合成菌株,Li等[20]借助模拟计算指导,在光滑念珠菌C. glabrata中比较了不同的外源alsS和alsD基因引入对乙偶姻生产的影响,并在优选基因组合的基础上进一步对这两个基因的启动子进行优化,解决了丙酮酸积累过多的瓶颈,最终突变株C. glabrata MuA15生产了3.67 g/L乙偶姻。马红武等[18]通过在安全模式菌株C. glutamicum ATCC 13032中引入来自B. subtilis 168的alsSD操纵子,使该菌株能够生产2.1 g/L乙偶姻。Xu等[8]通过在E. coli中引入S. marcescens的butA和butB基因,使其获得了手性D-(-)-乙偶姻的生产能力,并结合其他操作使D-(-)-乙偶姻的最终产量达到60.3 g/L。对于自身可以合成乙偶姻的菌株,Liu等[17]通过在丙酮丁醇梭菌C. acetobutylicum B3中过表达其自身的alsD基因,使乙偶姻的生产能力得到显著提高。Wang等[21]通过在B. subtilis中使用组成型表达的强启动子P43过表达自身的alsS和alsD基因使其不再受alsR的调控,使ALS的酶活提高了52%,与过表达前相比乙偶姻产量提高了约7%。
值得注意的是,在很多天然具备2,3-丁二醇生产能力的菌株中,alsSD/butAB操纵子一般受到alsR/butR基因编码的LysR型转录激活子AlsR/ButR的调控[2]。例如,在B. subtilis中,适量的乙酸盐、较低的溶解氧和低pH值可以作用于AlsR从而提高alsSD操纵子的表达水平。截止目前,研究者普遍使用强启动子过表达alsSD实现乙偶姻的高产,而alsSD基因调控因子的种类和机理尚处于理论研究阶段。随着研究的深入,在代谢工程改造菌株中通过AlsR/ButR增强alsSD表达,提高ALS对丙酮酸的转化效率,进而提高乙偶姻产量的研究需要进一步开展。
2.2 阻断乙偶姻还原途径在乙偶姻还原酶(acetoin reductase,AR,EC 1. 1. 1. 5)的作用下,乙偶姻被还原为2,3-丁二醇(图 1),该酶又名2,3-丁二醇脱氢酶(2,3-butanediol dehydrogenase,BDH)。在微生物正常代谢情况下,细胞很容易积累NADH,促使AR将乙偶姻进一步还原为2,3-丁二醇。发酵条件优化可以降低代谢产物中2,3-丁二醇的比例从而提高乙偶姻产量,但2,3-丁二醇作为主要的副产物,造成了碳源的浪费,因此,在2,3-丁二醇高产菌株中失活AR是提高乙偶姻产量的适宜方法。
Gao等[22]敲除了S. marcescens中的AR编码基因budC,在批式补料实验中,使乙偶姻的产量达到47.5 g/L。但是,发酵液中同时存在9.8 g/L的2,3-丁二醇,说明该菌株仍存在AR催化乙偶姻的还原反应。Bai等[23]通过敲除S. marcescens MG1中的AR编码基因slaC,同样使D-(-)-乙偶姻大量积累。Wang等[21]通过敲除B. subtills 中AR编码基因bdhA,在批式发酵实验中将乙偶姻的产量由14.2 g/L提高到19.2 g/L。
这些研究成果证明,失活AR能够阻断2,3-丁二醇的生产,从而直接提高乙偶姻对底物的得率和最终产量。值得注意的是,部分2,3-丁二醇生产菌株有多个AR编码基因,其中可能某些基因尚未被注释或鉴定,这就需要对AR编码基因相关基础研究给予更多的支持。例如Yang等[24]发现在K. oxytoca中敲除budC并不能完全阻断2,3-丁二醇的生产,而当敲除另一个编码双乙酰/乙偶姻还原酶的dar基因后,2,3-丁二醇的产量才显著下降,最终的工程菌生产了约27 g/L乙偶姻。该研究证明在K. oxytoca中,至少存在两个主要的AR编码基因,这为进一步提高该菌株乙偶姻合成的操作提供了理论支持。
2.3 阻断乙偶姻降解途径乙偶姻在乙偶姻脱氢酶复合物(acetoin dehydrogenase enzyme system,AoDH ES)的催化作用下生成乙酰-CoA和乙醛,后者可以进一步转化为乙酸或乙醇[2]。目前相关研究尚未对这一机理给出系统阐述,一般认为在碳源耗尽后,失活AoDH ES可以降低(乙偶姻)的消耗。某些菌株在碳源耗尽后会利用发酵液中过量的2,3-丁二醇合成乙偶姻,而该方法在这一情况下十分有效。
目前对乙偶姻降解途径的研究基本停留在基础阶段,很少涉及其产业化应用。Wang等[21]通过在B. subtilis中敲除AoDH ES系统编码E1亚基的acoA基因,使乙偶姻的产量提高了约9%,证明了通过阻断乙偶姻降解从而提高其产量的可行性。
2.4 阻断乙偶姻竞争合成途径乙偶姻发酵过程中,会有丙酮、乳酸、乙酸和乙醇等代谢副产物的产生,造成碳源的浪费。通过阻断乙偶姻竞争合成途径,可以提高乙偶姻对底物的得率和生产力。例如,在C. acetobutylicum中,丙酮酸经由多个中间产物最后生成丙酮,而该途径中adc基因编码的乙酰乙酸脱羧酶可以催化乙酰乙酸生成丙酮,而丙酮作为一种副产物会同乙偶姻共同竞争前体物丙酮酸。Liu等[17]在C. acetobutylicum中敲除了adc,使乙偶姻的得率比野生型出发菌株B3提高了37.5%。值得注意的是,目前在乙偶姻的高产菌株中,很少对乙偶姻的竞争支路进行操作,而阻断其竞争途径可以提高乙偶姻合成途径的代谢通量,从而进一步提高这些菌株乙偶姻的产量和得率。
2.5 2.5 辅因子工程调节NAD+/NADH比例乙偶姻的一项重要的生理功能是通过与2,3-丁二醇相互转化调节微生物胞内的氧化还原水平,即胞内NADH/NAD+的比例。而在乙偶姻高产菌的构建过程中,降低2,3-丁二醇、乳酸、乙醇等副产物的生物合成会引起胞内NADH/NAD+比例的大幅提高,造成还原力不平衡、细胞内NAD+再生困难,从而影响细胞生长和其他生理功能。使用辅因子工程策略,利用NADH氧化酶可以催化胞内过剩的NADH与氧气反应生成水和NAD+,平衡胞内氧化还原水平,保证微生物的正常代谢功能。
近年来,使用辅因子工程结合代谢工程手段,调节胞内辅因子水平,从而提高乙偶姻生产力的方法引起了研究者的重点关注,并取得了丰硕成果。Zhang等[25]在B. subtilis中敲除了AR编码基因bdhA后筛选并过表达自身的NADH氧化酶合成基因yodC,使乙偶姻的最终产量达到56.7 g/L,提高了35.3%。Sun等[4]在S. marcescens H32中过表达来自短乳杆菌Lactobacillus brevis的NADH氧化酶编码基因,成功地在S. marcescens菌株中引入了外源的NAD+再生体系,使乙偶姻的产量增加了33%,并在批式补料实验中,使乙偶姻最终产量达到75.2g/L,生产力高达1.88g/Lh。Ji等[14]在2,3-丁二醇高产菌株K. pneumoniae中引入外源的NADH氧化酶,使胞内NADH的浓度下降了1.4倍,并使胞内NADH/NAD+的比例下降了2倍,最终在批式补料发酵中生产了25.9 g/L乙偶姻。Li等[26]通过计算模拟和氧化还原水平分析,发现NADH是限制C. glabrata乙偶姻高产的关键因素,在引入外源NADH氧化酶后,乙偶姻的最终产量得到显著提高。Xu等[27]将同样的策略应用于E. coli,除引入外源乙偶姻合成途径外,同时引入了来自Lactobacillus brevis的NADH氧化酶,解决了E. coli在生产乙偶姻过程中还原力过剩的问题。
2.6 提高菌体对乙偶姻的耐受性针对乙偶姻的还原产物2,3-丁二醇的研究成果众多[28],且在已报道的文献记录中2,3-丁二醇的最高产量已达152 g/L[29]。从表 1可以发现,目前乙偶姻的最高产量为75 g/L,且绝大部分菌株在改造过程中乙偶姻生产水平的进一步提高却遇到了瓶颈。这一现象可能与细胞对乙偶姻的耐受性或乙偶姻对细胞造成的生理影响有关。Yang等[30]首次证明在金黄色葡萄球菌中,乙偶姻的形成与细胞死亡有关。
通过进化工程手段筛选乙偶姻耐受浓度较高的菌株,是有效提高乙偶姻生产水平的重要策略。但是目前针对该方面的报道并不多见,Luo等[5]对B. amyloliquefaciens进行了乙偶姻高浓度进化实验,使进化菌株在80 g/L乙偶姻的培养基中生长速率提高了265%,并在44 h内生产了71.5 g/L乙偶姻。这一研究成果为进一步改造乙偶姻高产菌株提供了一个新的思路。
2.7 提高底物利用效率目前,用于生产乙偶姻的糖类底物大部分是葡萄糖和蔗糖,通过代谢工程和进化工程等手段提高底物的利用效率,可以降低乙偶姻生产成本。另一方面,在工业发酵过程中,使用廉价可再生碳源为底物,如纤维素水解液、木糖、阿拉伯糖或工业废弃物甘油等,也可以大幅降低乙偶姻的生产成本。
在提高葡萄糖利用效率方面,Liu等[13]通过Vp实验筛选出一株能耐受315 g/L葡萄糖和100 g/L NaCl的B. licheniformis,该菌株有很强的葡萄糖利用能力,在批式发酵实验中生产了41.26 g/L乙偶姻,达到理论最大得率的84.4%。
在其他廉价底物利用方面,本课题组进行了一系列改造B. subtilis利用木糖生产乙偶姻的相关工作。Chen等[31]通过在B. subtilis中使用P43强启动子组成型表达自身的araE基因,成功实现了菌株对木糖的利用,此外,通过引入来自大肠杆菌的xylA和xylB基因,实现了对葡萄糖和木糖的共利用。在摇瓶发酵实验中,同步利用10 g/L葡萄糖和5 g/L木糖生产了5.5 g/L乙偶姻。Zhang等[32] 利用进化工程手段筛选到一株能够有效利用木糖快速生长的B. subtilis E72,通过全基因组测序、突变点分析和逆向代谢工程突变点引入等方法,以B. subtilis 168为出发菌株构建了一株木糖高效利用菌株B. subtilis ARSRCP,在敲除acoA和bdhA基因后,乙偶姻对木糖的生产得率达到了理论得率的70%。
2.8 发酵条件优化目前,研究人员普遍选用批式补料方式在发酵罐中进行乙偶姻的生产操作,从而较为便捷地对搅拌转速、通气量、pH、温度等进行控制。通过分析已报道的研究结果发现,发酵时的溶氧、pH和培养基组分优化对乙偶姻的高产至关重要。
溶氧水平对乙偶姻和2,3-丁二醇的转化、副产物的积累以及菌体生长都有重要影响。如前所述,胞内较高的NADH/NAD+比值不利于乙偶姻的生产。而相对较高的溶氧水平有利于胞内NAD+的再生,同时可以使菌体生物量快速积累,减少副产物乳酸、乙醇等代谢副产物的生成。但是,细胞在有氧条件下高速生长会使碳通量导向三羧酸循环,从而导致碳源的浪费,影响乙偶姻对底物的得率。多数研究者选择一个相对较高的溶氧水平以维持较高的乙偶姻生产力,而对于不同的菌株,研究不同的转速和通气量的影响有利于实现乙偶姻的产量最大化[3]。同时,在通气量一定的条件下,两阶段转速控制为乙偶姻高产提供了一个新的思路。Sun等[7]在通气量保持1.25 vvm的条件下,通过分析不同转速下糖耗速率、生物量和乙偶姻产量之间的关系,发现搅拌速度在乙偶姻生产中起到了至关重要的作用。该研究发现,在发酵前8 h转速保持700 r/min可以使菌体生物量迅速积累(此时乙偶姻积累量很少),之后使转速降至600 r/min,使丙酮酸经由乙偶姻合成途径大量合成目的产物,发酵42 h后乙偶姻的产量达到60.5 g/L。<
在乙偶姻发酵实验中,大多数研究者将pH维持在5.5~7之间或选择不控制。但需要引起注意的是,Zhang等[33]通过比较之前文献报道的AR/BDH酶学研究结果发现,在乙偶姻和2,3-丁二醇的相互转化过程中,酸性条件有利于还原反应发生,而碱性条件有益于生成乙偶姻的氧化反应发生。通过对B. subtilis的AR/BDH酶进行考察,对其在乙偶姻发酵过程中进行两阶段pH控制,初期pH设定为6.5以达到使葡萄糖快速转化为乙偶姻和2,3-丁二醇的目的,后期将pH设定为8.0以便发酵液中的2,3-丁二醇快速转化为乙偶姻,最终使乙偶姻产量达到了73.6 g/L。由于敲除AR/BDH后,会造成一定程度的还原力过剩从而对细胞的代谢造成一定抑制,因此,在保留AR/BDH的情况下,在发酵后期使发酵成为弱碱性有助于2,3-丁二醇转化为乙偶姻,进而提高乙偶姻的产量和生产速率。
乙偶姻作为一种溢流代谢产物,与细胞的生长密切相关,通过优化培养基配方使菌体积累合适的生物量有助于乙偶姻生产能力的提高。目前乙偶姻的高产报道中大多使用了丰富的有机氮源促进细胞的生长,同时,较高的生物量可以提高产品生产力。然而,酵母抽提物、牛肉膏和胰蛋白胨等氮源价格较为昂贵,使用玉米水解液和大豆蛋白等廉价的氮源可以降低生产成本。此外,对于某些菌株,通过在培养基中添加乙酸盐、丙酸盐、丙酮酸盐和琥珀酸盐等物质可以提高2,3-丁二醇的产量,使用这些添加物是否可以提高乙偶姻的产量值得研究者的关注。
3 以2,3-丁二醇或双乙酰为底物生产乙偶姻及其策略2,3-丁二醇和双乙酰作为大宗工业化学品,价格与乙偶姻相比较为低廉,远低于化学试剂纯乙偶姻的价格[3]。目前,生物法制备手性2,3-丁二醇的研究取得了丰硕的成果,无手性构体的双乙酰可以由化学法大量制备,这使得有可能以相对低廉的底物生产乙偶姻(特别是手性乙偶姻)。
在目前的研究报道中,酶转化法制备乙偶姻并不具备大规模工业化生产的潜力。该方法需要大量提纯微生物菌体中特异性的乙偶姻还原酶,反应体系要求较为苛刻,并且需要额外添加价格昂贵的辅因子。因而该工艺的生产成本难以控制,与传统的化学法相比,该方法并不能体现生物法所应有的绿色、经济、环保的特点。通过降低2,3-丁二醇脱氢酶的制备成本并提高该酶的使用效率和寿命,是酶转化法制备乙偶姻产业化的关键。最近几年,研究者倾向于将有潜力的菌株作为微生物细胞炼制工厂,转化2,3-丁二醇或双乙酰制备手性乙偶姻,并取得了一定进展。
通过代谢工程改造菌株使其大量表达立体专一性高的乙偶姻脱氢酶,是催化2,3-丁二醇转化为手性乙偶姻的关键。Xiao等[34]通过在E. coli中共表达来自B. subtilis的D-2,3-BDH和L. brevis中的NADH氧化酶,催化3种手性2,3-丁二醇的混合物生产D-(-)-和L-(+)-型乙偶姻。Bao等[35]则在B. subtilis中过表达自身的D-2,3-BDH编码基因bdhA以及自身的NADH氧化酶编码基因yodC,达到了将2,3-丁二醇高效转化为乙偶姻的目的。值得关注的是,由于乙酰乳酸到L-(+)-乙偶姻的反应为非酶催化反应,而以糖类物质为底物生产L-(+)-乙偶姻的反应较为困难。Liu等[36]首先利用K. pneumoniae CICC 10011以葡萄糖为底物生产L-(+)-2,3-丁二醇和meso-2,3-丁二醇的混合物,去除K. pneumoniae菌体后将培养基中的2,3-丁二醇混合物作为底物,再利用B. subtilis 168催化meso-2,3-丁二醇为L-(+)-乙偶姻,且其产量高达56.3 g/L。该方法为以葡萄糖为底物发酵生产L-(+)-乙偶姻提供了一个新的思路。
双乙酰转化为乙偶姻需要使菌体大量表达双乙酰还原酶(E3或E4,图1)。Gao等[37]考察了E. coli对双乙酰的耐受性,并将Paenibacillus polymyxa编码双乙酰还原酶的基因引入,在批式补料实验中,通过优化葡萄糖与双乙酰的比例,利用E. coli转化双乙酰生产了39.4 g/L的L-(+)-乙偶姻,其光学纯度大于99.9%,且没有D-(-)-乙偶姻和2,3-丁二醇的生成。这里需要注意的是,双乙酰对微生物有一定的毒性,筛选耐受双乙酰的菌株,或通过流加补料的方式控制发酵液中双乙酰的浓度,可以有效提高手性乙偶姻的生产能力。
4 分离提纯工艺改进目前,对生物法制备乙偶姻的研究主要集中在中上游的菌株改造和发酵条件优化上,但是下游分离纯化工艺的研究相对较少。发酵过程中使用廉价底物如木质纤维素和复杂的氮源如大豆蛋白等可以提高乙偶姻的发酵终浓度,但由于引入了较多组分(如果胶、蛋白质)、在复杂培养基中产生了其他细胞代谢物,因而与使用简单无机盐培养基相比,前者的乙偶姻分离纯化难度提升,成本大幅提高。而这也成为了生物法制备乙偶姻产业化发展亟待解决的问题。
相比乙偶姻的还原产物2,3-丁二醇在下游分离纯化研究所取得的众多进展,对于乙偶姻分离纯化的报道却很少,且不够深入和系统。国内的修志龙课题组对盐析萃取2,3-丁二醇进行了长期的研究[38]。其结果表明,该方法用于乙偶姻也能得到高回收率,但2,3-丁二醇会随乙偶姻一起被萃取到上相,需要通过进一步的精馏操作将二者分开。2013年,Fan等[39]将亲水性溶剂和无机盐组成的新型双水相系统(ATPS)用于发酵液中乙偶姻的提取,当使用质量分数为25%的磷酸氢二钾和24%的盐析萃取体系时,乙偶姻的最大分配系数为9.68,回收率达94.6%。Wu等[40]研究了超交联树脂HD-02用于乙醇-乙偶姻-乙酸三元混合体系中乙偶姻的回收再生,其结果表明比起乙酸和乙醇,HD-02树脂对乙偶姻具有良好的吸附选择性,且使用乙醇作为解吸剂时树脂的复性率高达98%。
可以预见,随着乙偶姻生物法制备水平的不断提高,乙偶姻的分离纯化工业必将引起研究者的广泛关注,而这也是乙偶姻产业化发展的必要前提。
5 展 望展望未来,研究人员需要克服乙偶姻生产的若干瓶颈问题,并在产品安全性、附加值等方面投入更多的精力。(1)提高菌体对乙偶姻的耐受性,通过进化工程筛选对乙偶姻耐受性高的菌株有助于乙偶姻产量的进一步提高。(2)乙偶姻的一项重要用途是食用香料,而食品的安全性原则要求其生产菌株必须是安全风险最低的,使用Class I微生物会成为今后研究的主流方向。(3)通过合理的代谢工程改造使菌株生产高手性纯度的乙偶姻,可以提高乙偶姻的附加值。
| [1] | Xiao Z J, Lu J R. Generation of acetoin and its derivatives in foods. J Agric Food Chem, 2014, 62(28): 6487-6497. |
| [2] | Xiao Z J,Xu P. Acetoin metabolism in bacteria. Crit Rev Microbiol, 2007, 33(2): 127-140. |
| [3] | Xiao Z J,Lu J R. Strategies for enhancing fermentative production of acetoin: a review. Biotechnol Adv, 2014, 32(2): 492-503. |
| [4] | Sun J A, Zhang L Y, Rao B,et al. Enhanced acetoin production by Serratia marcescens H32 with expression of a water-forming NADH oxidase. Bioresource Technol, 2012, 119: 94-98. |
| [5] | Luo Q, Wu J, Wu M. Enhanced acetoin production by Bacillus amyloliquefaciens through improved acetoin tolerance. Process Biochemistry, 2014, 49(8): 1223-1230. |
| [6] | Xu P, Xiao Z, Du Y,et al. Acetoin high-yield Bacillus pumilus strain. U.S.A.8,158,402, 2012-4-17. |
| [7] | Sun J, Zhang L, Rao B,et al. Enhanced acetoin production by Serratia marcescens H32 using statistical optimization and a two-stage agitation speed control strategy. Biotechnol Bioproc E, 2012, 17(3): 598-605. |
| [8] | Xu Q, Xie L, Li Y,et al. Metabolic engineering of Escherichia coli for efficient production of (3R)-acetoin. J Chem Technol Biot, 2015, 90(1): 93-100. |
| [9] | Xu H, Jia S, Liu J. Production of acetoin by Bacillus subtilis TH-49. IEEE International Conference on Consumer Electronics, Commun, Network,2011:1524-1527. |
| [10] | Zhang L, Chen S, Xie H,et al. Efficient acetoin production by optimization of medium components and oxygen supply control using a newly isolated Paenibacillus polymyxa CS107. J Chem Technol Biot, 2012, 87(11): 1551-1557. |
| [11] | Zhang X, Zhang R, Yang T,et al. Mutation breeding of acetoin high producing Bacillus subtilis blocked in 2,3-butanediol dehydrogenase. World J Micro Biot, 2013, 29(10): 1783-1789. |
| [12] | Zhang Y, Li S, Liu L,et al. Acetoin production enhanced by manipulating carbon flux in a newly isolated Bacillus amyloliquefaciens. Bioresource Technol, 2013, 130: 256-260. |
| [13] | Liu Y, Zhang S, Yong Y C,et al. Efficient production of acetoin by the newly isolated Bacillus licheniformis strain MEL09. Process Biochem, 2011, 46(1): 390-394. |
| [14] | Ji X J, Xia Z F, Fu N H,et al. Cofactor engineering through heterologous expression of an NADH oxidase and its impact on metabolic flux redistribution in Klebsiella pneumoniae. Biotechnol Biofuels, 2013, 6(1): 7. |
| [15] | Li L X, Li K, Wang Y,et al. Metabolic engineering of Enterobacter cloacae for high-yield production of enantiopure (2R,3R)-2,3-butanediol from lignocellulose-derived sugars. Metab Eng, 2015, 28: 19-27. |
| [16] | Li S, Xu N, Liu L,et al. Engineering of carboligase activity reaction in Candida glabrata for acetoin production. Metab Eng, 2014, 22: 32-39. |
| [17] | Liu D, Chen Y, Ding F,et al. Simultaneous production of butanol and acetoin by metabolically engineered Clostridium acetobutylicum. Metab Eng, 2015, 27: 107-114. |
| [18] | 马红武,刘会娟,朱年青,等. 代谢工程方法改造谷氨酸棒状杆菌生产乙偶姻. 天津大学学报(自然科学与工程技术版), 2014, 47(11): 967-972. Ma H W, Liu H J, Zhu N Q, et al. Metabolic engineering of Corynebacterium glutamicum for acetoin production.Journal of Tianjin University, 2014, 47: 967-972. |
| [19] | Ji X J, Huang H, Ouyang P K. Microbial 2,3-butanediol production: a state-of-the-art review. Biotechnol Adv, 2011, 29(3): 351-364. |
| [20] | Li S, Gao X, Xu N,et al. Enhancement of acetoin production in Candida glabrata by in silico-aided metabolic engineering. Microb Cell Fact, 2014, 13(1): 55. |
| [21] | Wang M, Fu J, Zhang X,et al. Metabolic engineering of Bacillus subtilis for enhanced production of acetoin. Biotechnol Lett, 2012, 34(10): 1877-1885. |
| [22] | Gao S, Guo W, Shi L,et al. Characterization of acetoin production in a budC gene disrupted mutant of Serratia marcescens G12. J Ind Microbiol Biotechnol, 2014, 41(8): 1267-1274. |
| [23] | Bai F, Dai L, Fan J,et al. Engineered Serratia marcescens for efficient (3R)-acetoin and (2R,3R)-2,3-butanediol production. J Ind Microbiol Biotechnol, 2015,42(5):779-786. |
| [24] | Yang T H, Rathnasingh C, Lee H J,et al. Identification of acetoin reductases involved in 2,3-butanediol pathway in Klebsiella oxytoca. J Biotechnol, 2014, 172: 59-66. |
| [25] | Zhang X, Zhang R, Bao T,et al. The rebalanced pathway significantly enhances acetoin production by disruption of acetoin reductase gene and moderate-expression of a new water-forming NADH oxidase in Bacillus subtilis. Metab Eng, 2014, 23: 34-41. |
| [26] | Li S, Xu N, Liu L,et al. Engineering of carboligase activity reaction in Candida glabrata for acetoin production. Metab Eng, 2013, 22: 32-39. |
| [27] | Xu Q, Xie L, Li Y,et al. Metabolic engineering of Escherichia coli for efficient production of (3R)-acetoin. J Chem Technol Biot, 2015, 90(1): 93-100. |
| [28] | 付晶,王萌,刘维喜,等. 生物法制备 2, 3-丁二醇的最新进展 化学进展, 2012, 24 (11): 2268-2276. Fu J, Wang M, Liu W X, et al. Latest advances of microbial production of 2,3-butanediol. Prog Chem, 2012, 24 (11): 2268-2276. |
| [29] | Zhang L, Sun J, Hao Y, et al. Microbial production of 2,3-butanediol by a surfactant (serrawettin)-deficient mutant of Serratia marcescens H30. J Ind Microbiol Biotechnol, 2010, 37(8): 857-862. |
| [30] | Yang S J, Dunman P M, Projan S J, et al. Characterization of the Staphylococcus aureus CidR regulon: elucidation of a novel role for acetoin metabolism in cell death and lysis. Mol Microbiol, 2006, 60(2): 458-468. |
| [31] | Chen T, Liu W X, Fu J, et al. Engineering Bacillus subtilis for acetoin production from glucose and xylose mixtures. J Biotechnol, 2013, 168(4): 499-505. |
| [32] | Zhang B, Li N, Wang Z, et al. Inverse metabolic engineering of Bacillus subtilis for xylose utilization based on adaptive evolution and whole-genome sequencing. Appl Microbiol Biotechnol, 2015, 99(2): 885-896. |
| [33] | Zhang X, Bao T, Rao Z, et al. Two-stage pH control strategy based on the pH reference of acetoin reductase regulates acetoin and 2,3-butanediol distribution in Bacillus subtilis. PLoS One, 2014, 9(3): e91187. |
| [34] | Xiao Z, Lv C, Gao C, et al. A novel whole-cell biocatalyst with NAD+ regeneration for production of chiral chemicals. PloS one, 2010, 5(1): e8860. |
| [35] | Bao T, Zhang X, Rao Z, et al. Efficient whole-cell biocatalyst for acetoin production with NAD+ regeneration system through homologous co-expression of 2, 3-butanediol dehydrogenase and NADH oxidase in engineered Bacillus subtilis. PloS One, 2014, 9(7): e102951. |
| [36] | Liu Z, Qin J, Gao C, et al. Production of (2S,3S)-2,3-butanediol and (3S)-acetoin from glucose using resting cells of Klebsiella pneumonia and Bacillus subtilis. Bioresource Technol, 2011, 102(22): 10741-10744. |
| [37] | Gao J, Xu Y Y, Li F W, et al. Production of S-acetoin from diacetyl by Escherichia coli transformant cells that express the diacetyl reductase gene of Paenibacillus polymyxa ZJ-9. Lett Appl Microbiol, 2013, 57(4): 274-81. |
| [38] | 戴建英,刘春娇,孙亚琴,等. 盐析萃取生物基化学品的研究进展. 生物工程学报,2013, 29(10): 1441-1449. Dai J Y, Liu C J, Sun Y Q, et al. Research progress in salting-out extraction of bio-based chemicals.Chinese Journal of Biotechnology, 2013, 29(10): 1441-1449. |
| [39] | Fan Y, Tian Y, Zhao X, et al. Isolation of acetoin-producing Bacillus strains from japanese traditional food—natto. Prep Biochem Biotech, 2013, 43(6): 551-564. |
| [40] | Wu J, Ke X, Wang L, et al. Recovery of acetoin from the ethanol-acetoin-acetic acid ternary mixture based on adsorption methodology using a hyper-cross-linked resin. Ind Eng Chem Res, 2014, 53(31): 12411-12419. |
 2015, Vol. 35
2015, Vol. 35




