文章信息
- 李慧, 薛巍, 孙雪松
- LI Hui, XUE Wei, SUN Xue-song
- 化脓链球菌中野生型和突变体FtsB蛋白的铁色素结合特性
- Ferrichrome Binding Characteristics of Wild Type-and Mutant FtsBs in Streptococcus pyogenes
- 中国生物工程杂志, 2015, 35(10): 32-38
- China Biotechnology, 2015, 35(10): 32-38
- http://dx.doi.org/10.13523/j.cb.20151005
-
文章历史
- 收稿日期: 2015-05-04
- 修回日期: 2015-06-15
2. 暨南大学生命与健康工程研究院 广州 510632
2. Institute of Life and Health Engineering, Jinan University, Guangzhou 510632, China
化脓链球菌(Streptococcus pyogenes)是一种重要的革兰氏阳性人类致病菌,可引起咽炎、急性风湿热、风湿性心脏病、肾小球性肾炎、坏死性肌膜炎、链球菌中毒性休克综合征等多种侵袭性和非侵袭性感染[1]。
除了一些乳杆菌和螺旋杆菌,铁离子是大多数细菌生长和形成感染的必需元素[2, 3]。但是,人体中的铁离子在生理环境下形成了极度难溶的稳定的氧化铁复合物(10-18 mol/L),使得细菌从人体中获得铁离子相当困难[4]。为了克服铁元素的限制性问题,一些细菌分泌出一些位于细胞表面的铁源受体蛋白从宿主体内的含铁蛋白(如铁蛋白、转铁蛋白、乳铁蛋白和血红蛋白)中摄取铁离子,一些则分泌出小分子量的铁载体(Siderophores)从宿主环境中捕获铁离子[5]。铁离子及其复合物然后通过 ABC 转运系统转运至细胞膜内。由于这些铁摄取蛋白暴露在细胞表面,同时也是细菌在宿主体内生长所必需的,于是它们可以作为潜在的药物靶标或疫苗候选物,因此已成为现在研究抗菌药物的热点[6]。
在化脓性链球菌中,至今已报道了三种摄取铁离子的ABC系统,分别是 MtsABC、HtsABC 和 FtsABCD[6]。其中FtsABCD转运复合体包括ATP结合蛋白FtsA、脂蛋白FtsB和膜蛋白FtsCD,负责铁色素的转运[7]。脂蛋白FtsB直接捕获铁色素,但其三维结构一直未能成功解析,铁色素结合位点也更是未知。我们前期研究通过蛋白质序列同源比对和三维结构模拟,发现FtsB的Glu120、Tyr137、Trp204和 Tyr287残基通过氢键在一个疏水环境中和铁色素直接作用。之后制备野生型和突变体蛋白,通过一系列铁色素结合表征实验发现Y137A 和 W204A 突变体蛋白的铁色素亲和力、结合速率、抗酶解稳定性均明显下降[8]。
本研究通过ICP-MS、ITC、Na2S2O4还原、CD热变性、盐酸胍化学变性实验深入比较了野生型和Y137A、W204A突变体FtsB蛋白的铁色素结合特性,进一步确定了Tyr137和Trp204位点在铁色素结合中的重要作用,为研究化脓链球菌的铁转运机制奠定了一定的理论基础。
1 材料与方法 1.1 菌株及培养基化脓链球菌(Streptococcus pyogenes)5005、大肠杆菌(Escherichia coli)DH5α、BL21(DE3) star均为本实验室保存。大肠杆菌培养基为LB培养基,化脓链球菌培养基为Todd-Hewitt培养基(含0.5%酵母浸出液)。
1.2 试剂与仪器去铁铁色素(iron-free ferrichrome)、氯化铁购自Sigma公司;盐酸胍购自 Genebase公司;连二亚硫酸钠(Na2S2O4)购自百灵威公司;3 kDa微型透析管购自Merk公司;定点突变试剂盒(Quick Change mutagenesis kit)购自Stratagene公司。
电感耦合等离子体发射光谱质谱联用仪(ICP-MS)为US EP A6020A-2007公司生产,等温滴定微量热仪(ITC)为美国MicroCal公司产品,SX200圆二色谱仪为英国Applied Photophysics公司产品,Evolution 300紫外分光光度计为德国Thermo公司产品。
1.3 FtsB蛋白铁色素结合位点的预测及突变体蛋白制备选择蛋白质数据库(Protein Data Bank,PDB)中FtsB蛋白同源性最高的枯草芽孢杆菌(Bacillus subtilis)中的FhuD蛋白为模板,运用Accelrys Discovery Studio Client 2.5软件进行FtsB与铁色素的分子对接,预测铁色素的结合位点[8]。采用定点突变试剂盒构建突变体质粒,采用野生型蛋白相同的方法表达和纯化突变体蛋白,具体步骤参考文献[8]。
1.4 野生型及突变体FtsB蛋白的铁色素结合能力比较 1.4.1 ICP-MS每个去铁铁色素螯合一个铁离子,故可通过检测铁元素含量确定铁色素的含量。在野生型和突变型FtsB蛋白溶液中加入过量的铁色素,室温孵育3h,将溶液吸入1 ml的3 kDa 的透析管中,加入1 L的透析液4℃ 透析24 h,中间换三次透析液,得到铁色素饱和的蛋白。分别将铁色素饱和的野生型和突变型蛋白(10 μmol/L)进行酸消解去除有机物,在样品中加入10 mg/L 标准样品铁作为内参制成检测样品,ICP-MS检测蛋白中的铁元素含量,实验是在暨南大学分析测试中心进行的。每个样品重复读数三次。
1.4.2 ITC使用等温滴定量热仪(Microcal ITC200)分别对野生型和突变型FtsB蛋白与铁色素结合的热力学反应进行分析。所有的试剂均需要用0.22 μm的滤膜进行过滤并脱气,具体测定方法如下:样品池温度25℃,滴定溶液为300 μmol/L 铁色素,样品池中被滴定溶液为10 μmol/L的 FtsB蛋白,样品池搅拌转速为500 r/min。滴定共进行15次,每次滴定体积5 μl,滴定延迟60 s,滴定时间为4 s,间隔120 s,过滤2 s。最终的数据使用ITC仪器自带的Origin 7.0进行拟合分析。
1.4.3 Na2S2O4还原Na2S2O4是一种强还原剂,向铁色素饱和的FtsB中滴加Na2S2O4可使铁色素中的铁离子发生还原反应,从而介导铁色素的释放。FtsB 结合铁色素后在425nm处有一特征紫外吸收峰,铁离子还原后此吸收峰消失,因此可用紫外分光光度计检测整个还原反应。用铁色素饱和的野生型(120 μmol/L,20 mmol/L Tris-HCl,pH 7.4)和突变型(240 μmol//L,20 mmol/L Tris-HCl,pH 7.4)FtsB 蛋白溶液从300~600 nm 波段进行紫外扫描,之后加入10倍当量的Na2S2O4溶液,每隔30 s扫描一次直到还原反应结束。每个实验重复扫描三次。
1.5 野生型及突变体FtsB蛋白的铁色素结合稳定性比较 1.5.1 CD热变性实验前期研究显示FtsB的CD光谱在192 nm处有一正的波谱,在222 和208 nm处有两个负的肩峰波谱,为典型的α-螺旋结构[8]。故其热变性实验可通过CD光谱仪在特征波谱处进行检测。光谱仪连上一个电子控温的水浴循环系统来控制样品的温度,在样品池中插入感温探针,以1 ℃ /min 的升温速率在 20~80 ℃ 区间内分别检测野生型和突变体蛋白(3 μmol/L,20 mmol/L Tris-HCl,pH 7.4)和铁色素结合前后在222 nm处的CD光谱。数据用CD光谱仪自带的Global 3TM 软件分析得出热变性温度(Tm)。
1.5.2 盐酸胍化学变性实验盐酸胍(GuHCl)是一种常用的化学变性剂。分别将铁色素结合前后的野生型和突变型FtsB蛋白在不同浓度(0,0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0 mol/L)的盐酸胍溶液中稀释到3 μmol/L 的终浓度,放置过夜,用圆二色谱仪在222 nm处扫描,检测蛋白的变性状态。变性曲线用Origin 7.5中的Sigmoidal方程拟合。
2 结果与分析 2.1 FtsB蛋白铁色素结合位点的预测及突变体蛋白制备如参考文献[8]所描述,FtsB呈现出第Ⅲ类细菌质膜结合蛋白超家族中的经典双小叶构象,即两小叶分别由α-螺旋和β-折叠混合而成,两个独立的结构域之间由一个约20个氨基酸组成的长α-螺旋连接,中间有一个深深的口袋用于铁色素结合。如图 1所示,Glu120,Tyr137,Trp204和Tyr287 位于底物结合口袋的表面,通过氢键在一个疏水环境中和铁色素直接作用。
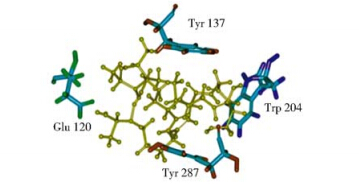
|
| 图 1 四个结合位点的氨基酸残基放大图 Fig. 1 Zoom on the four ferrichrome binding amino acid resides |
突变体蛋白的制备采用 Stratagene 公司的定点突变试剂盒构建突变体质粒,其表达和纯化按照与野生型蛋白相同的方法。图 2为野生型和突变体蛋白纯化后的 SDS-PAGE 图,可见突变体蛋白较稳定,并没有出现易降解的现象,同时蛋白的产率也和野生型蛋白接近。
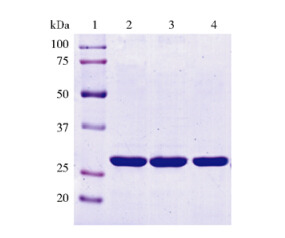
|
| 图 2 野生型和突变型FtsB蛋白的纯化 Fig. 2 Purification of WT and mutant FtsBs 1: Protein maker; 2: WT FtsB; 3: Y137A; 4: W204A |
经ICP-MS测得,样品内参铁含量为9. 957 mg/L,与加入的内参量接近,证明方法的精准性。测试结果显示(表 1),10 μmol/L野生型和Y137A、W204A突变体FtsB的铁含量分别为0.524 mg/L(9.4 μmol/L)、0.223 mg/L(3.9 μmol/L)、0.128 mg/L(2.3 μmol/L)。可见野生型FtsB蛋白和铁色素1∶1结合,Y137A、W204A突变体蛋白铁色素结合比率明显下降,约为1∶0.39和1∶0.23。
| Proteins | Fch concentration | Fch binding ratio |
| WT-FtsB(10 μmol/L) | 0.524 mg/L(9.4 μmol/L) | 1∶1 |
| Y137A(10 μmol/L) | 0.223 mg/L(3.9 μmol/L) | 1∶0.39 |
| W204A(10 μmol/L) | 0.128 mg/L(2.3 μmol/L) | 1∶0.23 |
为了更深入地了解FtsB蛋白与铁色素结合的特性,采用ITC法对其结合过程的热力学进行分析。如图 3所示,只有野生型蛋白和铁色素结合后呈现出明显的等温线,用仪器自带的Origin软件对结合等温线进行拟合分析,获得如下热力学参数:FtsB的铁色素结合等温线符合单结合位点模型,结合位点数N=0.94,结合常数k=2.06×106 /mol,焓变△H=﹣14.27 kcal/mole,熵变△S=-14.4 cal/mole/k。熵变△S为负值,反应体系混乱度减小;焓变△H为负值,表明两者的结合为焓驱动的放热反应过程,FtsB蛋白与铁色素相互作用主要为疏水作用力。Y137A和W204A突变体蛋白和铁色素的结合均没有表现出明显的结合等温曲线,无法用曲线拟合,可见突变体蛋白的铁色素结合能力明显下降。
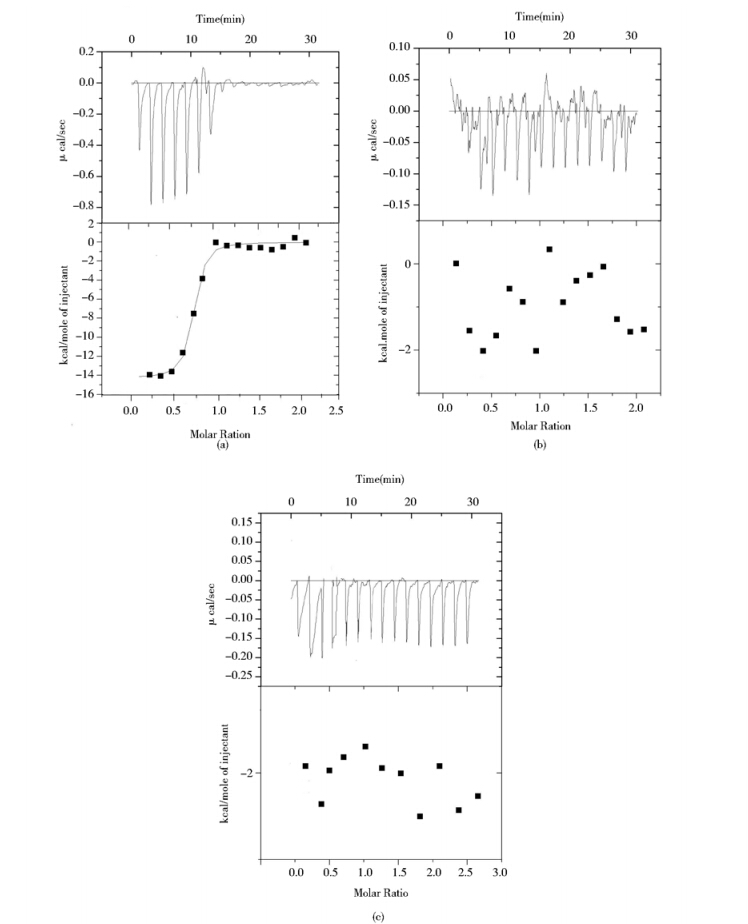
|
| 图 3 FtsB蛋白和铁色素的ITC滴定曲线 Fig. 3 ITC curves of ferrichrome binding to FtsBs (a) WT-FtsB (b) Y137A (c) W204A |
铁离子从铁载体上释放的机制之一就是还原假说。细菌内存在一些铁还原酶,可将Fe3+还原成Fe2+,降低了铁载体的热稳定性,有助于铁离子的释放[9]。Na2S2O4是一种强还原剂,可作为FtsB中的电子供体。在铁色素饱和的FtsB中滴加Na2S2O4,可见原来蛋白溶液的深黄色渐渐褪去,同时425nm 处的紫外吸收峰迅速下降(图 4a),表明铁色素中的铁离子还原成了亚铁离子。425nm 处的紫外吸收变化是时间依赖的,用一级指数方程式拟合可得出还原速率为0.83±0.10 min-1。整个还原反应至少需要 5 min。同时比较了突变体蛋白的铁色素还原速率,发现Y137A和W204A的铁色素还原速率明显上升(图 4b),分别为1.44±0.03 min-1和1.77±0.02 min-1,可见突变体蛋白和铁色素结合得更为疏松,使其还原反应更易发生。
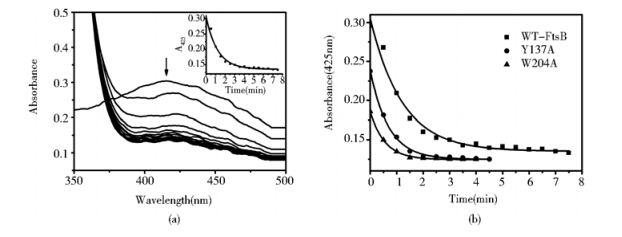
|
| 图 4 紫外光谱检测Na2S2O4还原FtsBs Fig. 4 UV-vis spectral kinetics of reduction of FtsBs by Na2S2O4 (a) WT-FtsB reduction curve (b) Time-dependent absorption change at 425 nm of WT and mutant FtsBs |
CD光谱也可用来研究FtsB和铁色素结合前后的热变性。分别将铁色素结合前后的野生型和突变型FtsB缓慢加热,用CD光谱仪检测 222 nm处的蛋白变性程度(图 5)。可见FtsB和铁色素结合前后的热变性温度(Tm)分别为55.12±0.1 ℃ 和62.00±0.09 ℃,相差6.88 ℃。FtsB未和铁色素结合时在约58 ℃时完全变性,而结合铁色素后在约64 ℃完全变性,说明铁色素可以稳定FtsB蛋白构象,增强其热稳定性。同时也比较了Y137A和W204A和铁色素结合前后的热稳定性,发现其和铁色素结合前后热变性曲线差异不大,接近于野生型FtsB蛋白未结合铁色素时的热变性曲线(各蛋白的热变性温度见表 2)。可见Y137A和W204A和铁色素结合的热稳定性较野生型蛋白均明显下降。
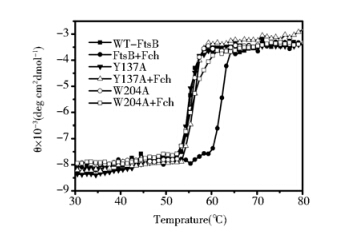
|
| 图 5 野生型和突变型FtsB蛋白的热变性曲线 Fig. 5 Thermal denaturation curves of the WT and mutant-FtsBs with and without ferrichrome monitored at 222 nm by CD spectroscopy |
| Proteins | Tm (℃) | GuHCl denaturation midpoint concentrations (mol/L) |
| WT-FtsB | 55.1±0.1 | 1.3±0.1 |
| WT-FtsB+Fch | 62.0±0.1 | 2.2±0.1 |
| Y137A | 54.8±0.1 | 1.5±0.1 |
| Y137A+Fch | 56.1±0.1 | 1.7±0.1 |
| W204A | 55.4±0.04 | 1.5±0.1 |
| W204A+Fch | 56.0±0.1 | 1.5±0.1 |
金属结合蛋白与其特异结合的金属结合后常常会变得更加稳定[10]。盐酸胍(GuanidineHCl,GuHCl)是一种常用的化学变性剂,在较高浓度下大部分蛋白都会去折叠形成类似无规则卷曲的状态[11]。用不同浓度的盐酸胍处理铁色素结合前后的FtsB蛋白,再用CD光谱仪检测222 nm处的蛋白椭圆率(图 6),如图所示在变性曲线中,野生型FtsB和铁色素结合前后的盐酸胍变性中点浓度分别为1.30±0.11 mol/L 和 2.19±0.12 mol/L,但Y137A和W204A和铁色素结合后盐酸胍变性中点浓度分别下降至1.70±0.13 mol/L和1.50±0.07 mol/L,可见突变体蛋白Y137A和W204A的铁色素结合稳定性明显低于野生型蛋白。具体数据见表 2。
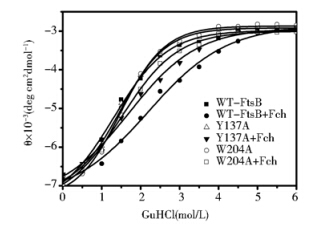
|
| 图 6 野生型和突变型FtsB蛋白的盐酸胍变性曲线 Fig. 6 GuHCl denaturation curves of the WT and mutant-FtsBs with and without ferrichrome monitored at 222 nm by CD spectroscopy |
铁载体(包括铁色素),在革兰氏阳性菌或者阴性菌中都是通过ABC转运复合体转运至细胞膜内的[12]。化脓链球菌的FtsB蛋白为FtsABCD 转运体中的脂蛋白,主要通过转运铁色素为化脓链球菌提供铁源[7],但是目前对阳性菌中的铁色素结合蛋白并没有细致深入的研究,对FtsB的铁色素结合位点也仅有本实验室的相关报道。
近年来,随着计算技术和应用软件的发展,根据蛋白质一级结构的氨基酸序列来预测蛋白质的高级结构已成为一个热门的研究课题,并得到越来越广泛的应用。同源建模依赖于一至多个结构已知的蛋白质作为建模模板,通过氨基酸序列同源性比对,使目标蛋白质的氨基酸残基与模板蛋白质的残基匹配[13]。目前对结合铁色素的质膜蛋白的结构研究并不是很多,仅有E.coli中的FhuD蛋白有结合铁色素的蛋白晶体复合体结构,并没有经典的结合铁色素的保守位点的报道,但是大肠杆菌中的FhuD和FtsB蛋白同源性很低,这就更显示了同源建模的重要性。我们前期研究发现和 FtsB 同源性最高的为枯草芽孢杆菌中的铁载体结合蛋白FhuD,同源性为37 %[8]。不过目前还没有FhuD和铁色素的结晶复合体。前期同源建模结果显示 FtsB 有两个独立的由α/β结构组成的小叶,通过一个长长的α-螺旋结构链连接,两小叶中间有一个深深的铁色素结合凹槽。预测的铁色素结合位点Glu120,Tyr137,Trp204和Tyr287就位于这个凹槽的表面,通过氢键在一个疏水的环境中与铁色素相互作用,同时我们初步证明了Tyr137 和Trp204 两个位点在FtsB与铁色素结合中的重要作用[8]。
本实验首先应用定点突变试剂盒构建了Y137A和W204A单位点突变质粒,采用和野生型蛋白相同的方法得到纯化的突变体蛋白。之后运用ICP-MS检测蛋白铁元素含量,发现Y137A和W204A的铁色素结合比率较野生型蛋白的1∶1下降至1∶0.39和1∶0.23。进一步采用ITC分析FtsB和铁色素相互作用的热力学变化,结果仅有野生型蛋白表现出明显的铁色素结合等温线,结合常数k= 2.06×106 mol-1,Y137A和W204A均未表现出和铁色素明显的相互作用,可见突变体蛋白的铁色素结合能力显著下降。有文献报道铁载体的释放是由氧化还原反应介导的[9],我们选用Na2S2O4作为还原剂,发现Y137A和W204A的铁色素还原反应速率较野生型蛋白的0.83±0.10 min-1上升至1.44±0.03 min-1和1.77±0.02 min-1,可见突变体蛋白和铁色素结合得更为疏松,使其还原反应更易发生。结合我们前期研究的荧光滴定和stop-flow结合动力学实验,Y137A和W204A与铁色素的结合常数和结合速率均小于野生型蛋白[8],可见Tyr137和Trp204在铁色素的结合中占据了重要作用,使其突变体蛋白的铁色素结合能力显著下降。
金属结合蛋白与其特异结合的金属结合后常常会发生构象变化,使其结构更加稳定[10]。前期研究显示Y137A、W204A和铁色素结合后抗酶解稳定性明显低于野生型蛋白[8]。本实验通过CD热变性和盐酸胍化学变性实验,证实了Y137A、W204A和铁色素结合的热力学稳定性和化学稳定性均小于野生型蛋白,表明Try137和Trp204氨基酸残基在S. pyogenes中FtsB蛋白的铁色素结合中具有重要作用。
本课题以化脓链球菌铁色素摄取蛋白FtsB为对象,以铁色素结合中心为切入点,深入比较了Y137A和W204A突变体蛋白和野生型蛋白铁色素结合能力和结合稳定性的差异,进一步证实了Try137和 Trp204两个位点在FtsB蛋白铁色素结合中的重要作用,为细菌中脂蛋白介导的铁色素转运机制的深入研究提供了一定的理论基础。
| [1] | Cunningham M W. Pathogenesis of group A streptococcal infections. Clin Microbiol Rev, 2000, 13(3): 470-511. |
| [2] | Ratledge C, Dover L G. Iron metabolism in pathogenic bacteria. Annu Rev Microbiol, 2000, 54(1): 881-941. |
| [3] | Archibald F. Lactobacillus plantarum, an organism not requiring iron. FEMS Microbiol Lett, 1983, 19(1): 29-32. |
| [4] | Putten J P. Iron acquisition and the pathogenesis of meningococcal and gonococcal disease. Med Microbal imuunol, 1990, 179(6): 289-295. |
| [5] | Wandersman C, Delepelaire P. Bacterial iron sources: from siderophores to hemophores. Annu Rev Microbiol, 2004, 58(1): 611-647. |
| [6] | Ge R G, Sun X S, He Q Y. Iron acquisition by Streptococcus species: An updated review. Front Biol China, 2009, 4 (4): 392-401. |
| [7] | Hanks T S, Liu M Y, McClure M J, et al. ABC transporter FtsABCD of Streptococcus pyogenes mediates uptake of ferric ferrichrome. BMC Microbiol, 2005, 5(1): 62-72. |
| [8] | Li H, Li N, Xu Q, et al. Lipoprotein FtsB in Streptococcus pyogenes binds ferrichrome in two steps with residues Tyr137 and Trp204 as critical ligands. PLoS One, 2013, 8(6): e65682. doi:10.1371/journal.pone.0065682. |
| [9] | Harrington J M, Crumbliss A L. The redox hypothesis in siderophore-mediated iron uptake. Biometals, 2009, 22(4): 679-689. |
| [10] | Loisel E, Jacquamet L, Serre L, et al. AdcAII, a new pneumococcal Zn-binding protein homologous with ABC transporters: biochemical and structural analysis. J Mol Biol, 2008, 381(3): 594-606. |
| [11] | Hedoux A, Krenzlin S, Paccou L, et al. Influence of urea and guanidine hydrochloride on lysozyme stability and thermal denaturation; a correlation between activity, protein dynamics and conformational changes. Phys Chem, 2010, 12(40): 13189-13196. |
| [12] | Braun V, Hantke K. Acquisition of iron by bacteria. Microbiol Monogr, 2007, 6(1):189-219. |
| [13] | Sherman W, Day T, Jacobson M P, et al. Novel procedure for modeling ligand/receptor induced fit effects. J Med Chem, 2006, 49 (2): 534-553. |
 2015, Vol. 35
2015, Vol. 35




