文章信息
- 宋明丽, 林雨, 罗南书, 冯全义, 黄岂平, 张晃猷, 张义国, 吴泽志
- SONG Ming-li, LIN Yu, LUO Nan-shu, FENG Quan-yi, HUANG Qi-ping, ZHANG Hwan-you, ZHANG Yi-guo, WU Ze-zhi
- PDMS微柱阵列型拓扑结构基底增强HepG2细胞TRPV1、TRPV4通道表达及功能响应性
- Enhancement of the Expression and Responsiveness of TRPV1 and TRPV4 Channels on HepG2 Cells with Micropillar Arrayed Substrate Topography
- 中国生物工程杂志, 2015, 35(10): 1-12
- China Biotechnology, 2015, 35(10): 1-12
- http://dx.doi.org/10.13523/j.cb.20151001
-
文章历史
- 收稿日期: 2015-04-10
- 修回日期: 2015-04-28
2. "国立"清华大学生命科学院医学科学系/分子医学研究所 新竹 300 台湾;
3. 吉首大学生物资源与环境科学学院 吉首 416000;
4. 西南大学生命科学学院 重庆 400715
2. Institute of Molecular Medicine and Department of Medical Science, National TsingHua University, 101Section2, Kuang-Fu Road Hsinchu 300, Taiwan, China;
3. College of Biology and Environmental Sciences, Jishou University, Jishou 416000, China;
4. School of Life Science, Southwest University, Chongqing 400715, China
基底拓扑结构是基于肝细胞的生物反应器、微系统、细胞生物传感器及药物筛选平台构建中重要的细胞微环境因素。文献表明,拓扑结构已经用于固定肝细胞三维聚集体[1]、提供细胞粘附的三维支架[2]乃至优化肝细胞生长的流体力学微环境[3]。在这些研究中,由于聚集体对肝细胞功能的改善,细胞-细胞相互作用或肝细胞聚集体的形成往往作为最重要的评价指标[1, 2, 3],而肝细胞-基底拓扑结构的直接相互作用却相应被忽略[4, 5]。我们曾经以聚二甲基硅氧烷(polydimethylsiloxane,PDMS)微柱阵列型拓扑结构基底研究HepG2细胞株与基底拓扑结构的相互作用并发现,伴随HepG2细胞在拓扑结构基底上的形态铺展和极化,肝细胞白蛋白及细胞色素酶CYP1A1和CYP1A2的表达均较平面基底相应值明显升高[6]。这一研究揭示了以基底拓扑结构构建肝细胞培养微环境和优化肝细胞功能的可行性。然而,有关肝细胞与基底拓扑结构相互作用以及肝细胞功能调节和优化的信号机制尚待更进一步的深入研究。
Curtis等[7]在上世纪90年代曾提出,细胞在拓扑结构基底上的响应可能源于细胞对基底的牵拉反应以及由此导致的形态铺展。采用适当的基底拓扑结构设计引导细胞呈铺展的形态构型无疑会引起细胞膜和细胞骨架的张力增加。从细胞流变学的角度看,这种以拓扑微结构基底促进细胞呈铺展几何形态的效应无疑可以看作一种静态细胞流变学加载过程。Bettinger等[8]进一步认为在基底拓扑结构条件下的细胞形态学响应不仅是细胞与拓扑结构表面相互作用的标志,也是进一步二级效应的基础,如细胞在拓扑结构表面的铺展和牵张反应引起细胞膜离子通道的开启、离子跨膜运动、细胞膜生物物理特性的改变等[9, 10]。在这种情况下,人们有充分的理由设想机械敏感离子通道可能在介导细胞的拓扑结构效应中发挥重要的作用。事实上,一些研究结果已经提示机械敏感离子通道的开放及细胞内钠离子、钙离子以及蛋白激酶等的变化可能是细胞在拓扑结构上功能改变的重要信号机制[11]。
如同在其他细胞一样,肝细胞膜上潜在的机械敏感离子通道属于短暂受体电位(transient receptor potential,TRP)超家族成员[12]。其中,TRPV4参与构成的通道已被认为是体内分布广泛的机械敏感离子通道[13]。使用分子及细胞生物学手段,人们发现肝细胞在基因水平表达TRPV1-4[12, 13, 14]。使用TRPV1特异性激动剂辣椒素(capsaicin)以及TRPV4特异性激动剂4α-佛波醇-12,13-二葵酸酯(4α-phorbol-12,13-didecanoate,4αPDD)的研究发现,HepG2细胞膜上存在功能性的TRPV1和TRPV4特异性钙离子跨膜转运通道[15, 16],二者均可能是细胞的机械敏感离子通道或机械敏感性的次级效应通道[14]。这些研究表明,从TRP通道功能响应性及有关离子信号角度研究肝细胞与基底拓扑结构相互作用已经成为必要。
本文以紫外光光刻和复制模塑的方法制备了4种PDMS微柱阵列型拓扑结构基底,实现了HepG2细胞在拓扑结构基底和平面基底上的复合培养,在此基础上考察了细胞的生长形态、TRPV1 和 TRPV4 在基因水平和蛋白水平的表达及功能响应性。实验结果表明,在四种拓扑结构基底上HepG2细胞TRPV1和TRPV4的mRNA表达量均显著高于平面基底上相应值。免疫印迹实验证实了TRPV1和TRPV4在蛋白水平的表达,且拓扑结构基底上TRPV1和TRPV4免疫荧光染色强度较之平面基底相应值明显增高或趋于增高。拓扑结构基底上分布的细胞较之平面基底上的细胞表现出TRPV1和TRPV4功能响应性的明显增强。结合前期研究,上述结果提示,TRPV介导的离子信号可能是基底拓扑结构优化HepG2细胞功能表型的重要信号机制。基底拓扑结构设计可能成为基于肝细胞的反应器、微系统及细胞生物传感器培养环境设计及细胞功能表型优化的重要工程化手段。
1 材料与方法 1.1 PDMS微柱阵列型拓扑结构基底的制备实验设计制备了4种微柱阵列型拓扑结构基底进行相关研究,并以PDMS平面基底为对照。圆形微柱名义直径为4 μm和10 μm,名义间距为4 μm和7 μm,名义高度为4 μm。下文中将以名义直径-名义间距(μm)表示不同尺寸拓扑结构基底,如“10-7”表示名义直径为10 μm,名义间距为7 μm的拓扑结构基底。石英铬掩模由中国科学院微电子所制版加工。主模系以P<100>硅片(电阻率7-13,北京有研)为起始材料,紫外光光刻及硅主模蚀刻由中国电子科技公司第二十四所协作完成。软光刻操作步骤参照参考文献[6]进行:将PDMS (Sylgard184,Dow Corning公司,美国)预聚体与固化剂按质量比10∶1比例混合均匀,倾倒在硅主模上,均匀平铺,抽真空至无气泡冒出,50oC固化3h,剥离、切割即得到PDMS微柱阵列型拓扑结构。平面对照用平整硅片代替主模用上述同样方法制备。上述制得的PDMS拓扑结构基底和平面基底放置于6孔板(Falcon,美国)中。5种PDMS基底经95%乙醇浸泡,并以水平摇床(200r/min)清洗1 h。以灭菌PBS清洗残留乙醇,每次5 min,共3次。制备的基底于超净工作台内紫外照射(过夜)灭菌,用完全培养基裱衬1 h后待用。
1.2 细胞培养HepG2细胞购自中国科学院细胞库(上海),培养在25 cm2细胞培养瓶(Corning公司,美国)中,置于37℃,5% CO2的孵箱中常规培养。完全培养基使用改良型RPMI-1640基础培养基(Hyclone公司,美国)添加100 U/ml 青霉素和100 μg/ml 硫酸链霉素(Sigma公司),10%胎牛血清(Gibco公司)。当细胞生长融合到90%左右时,采用0.25%胰蛋白酶(Hyclone公司)消化并机械吹打收集细胞,以完全培养基制备细胞悬浮液。拓扑结构基底和平面基底上细胞接种密度约为4 × 104/ml,常规进行培养。
1.3 扫描电子显微镜将接种细胞并常规培养3天后的拓扑结构基底及平面基底用PBS洗涤3 次,以2.5 %戊二醛(pH 7.2~7.4)在4 ℃固定过夜,用0.9%的生理盐水清洗2次,每次10 min。样本经30%、50%、70%、80%、95%和100%(每梯度2次)的乙醇进行梯度脱水,每次5 min。样本进一步依次采用50%、70%、90%、95%和100%(每梯度2次)的叔丁醇进行梯度置换,每步5 min。样本干燥后,经溅射涂膜镀金3~5次,每次20 s。扫描电镜照片拍摄采用扫描电子显微镜(Hitachi S-3400N,日本)进行,加速电压设置为15 kV。
1.4 RNA 提取及PCR反应HepG2细胞在4种拓扑结构基底及平面基底上常规培养3天后,使用Trizol法分别提取细胞总RNA。以PrimeScriptTM RT reagent kit 合成cDNA。实时荧光定量PCR (qRT-PCR)实验使用SYBR® Premix Ex Taq II 试剂盒(TaKaRa,日本)在CFX96TM(C1000TM Thermal Cycler)定量PCR仪上进行,阴性对照分别用等量的三蒸水或RNA替代cDNA,以人β-actin作为内参基因,每个样品设置3个重复。反应体系为20 μl∶1 μl cDNA添加到 10 μl 2×SYBR® Premix Ex Taq 混合物中,加入适量的上、下游引物 (Sangon公司,中国; 引物序列见表1),用三蒸水补足到20 μl。 TRPV1反应参数设置为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 10 s,共40个循环;65 ℃ 2 s,95 ℃。TRPV4反应参数设置为:95 ℃ 30 s;95 ℃ 5 s,56 ℃ 30 s,72 ℃ 10 s,共40个循环;65 ℃ 2 s,95 ℃。
| Target gene | Sequence(5′-3′) | Product length(bp) |
| TRPV1 | F: CAGGCTCTATGATCGCAGGAG R: TTTGAACTCGTTGTCTGTGAGG | 121 |
| TRPV4 | F:TGGTGGAACTGAACAAGAACTCG R:GCTGAAATGCGGCTGGACTA | 191 |
| β-actin | F:CATGTACGTTGCTATCCAGGC R:CTCCTTAATGTCACGCACGAT | 250 |
HepG2细胞于25 cm2细胞培养瓶中常规培养3天后,使用哺乳动物蛋白抽提试剂盒(Cowin Biotech公司,中国)提取全细胞蛋白质。细胞裂解液于实验前2 min添加1 mmol/L苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)(Cowin Biotech公司,中国)蛋白酶抑制剂。细胞经预冷磷酸盐缓冲液(PBS)(0.01mol/L,pH 7.2~7.3)清洗3次,每次5 min。样本再经细胞裂解液冰上裂解20 min,且每5 min晃动一次使裂解充分。全细胞裂解液于14 000×g,4 ℃,离心10 min,获取上清液。样品加入适量的上样缓冲液,混匀后于沸水中煮沸5 min使蛋白变性。样品经8% SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离目的条带,并以湿转法将目的蛋白条带转移到PVDF膜(Immobilon-P,Millipore公司)上(1.5h左右)。将印有蛋白条带的PVDF膜浸泡在预冷的5%脱脂奶粉中,室温下摇床孵育1 h。样品经一抗兔抗人/大鼠 TRPV1(BA2589,Boster公司,中国)、兔抗人/大鼠 TRPV4(BA2876-2,Boster公司,中国)、兔抗人/大鼠 β-actin(BA2305,Boster公司,中国)分别于4 ℃过夜孵育。用辣根过氧化物酶标记的二抗羊抗兔IgG-HRP(BA1054,Boster公司,中国)室温孵育2 h。免疫反应复合物用超敏ECL化学发光试剂盒检测。
1.6 TRPV1 和 TRPV4 通道蛋白免疫荧光染色HepG2细胞接种于拓扑结构基底及平面基底上常规培养3天后,参考Martin等[17]的方法进行TRPV1 和 TRPV4 通道蛋白免疫荧光染色。细胞用PBS缓冲液清洗3次后,用4%多聚甲醛固定30 min。样品经0.5% Triton X-100-PBS溶液通透5 min,并以4%山羊封闭血清室温孵育30 min。一抗采用兔抗人/大鼠 TRPV1(BA2589,Boster公司,中国) 和兔抗人/大鼠 TRPV4(BA2876-2,Boster公司,中国),于4 ℃孵育过夜。样品经PBS清洗后,用Cy3标记的山羊抗兔 IgG二抗 (1∶500,Boster公司,中国)室温孵育1.5 h。细胞核用浓度为10 μg/ml的4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染色液(碧云天生物技术研究所,江苏)室温染色15 min。样品经甘油封片后,用激光共聚焦扫描显微镜(Leica SP5,德国)观察并拍照。DAPI以405 nm的Diode激光激发,以基础长通滤片收集发射光。Cy3以 488 nm的氩激光激发,以570 nm长通滤片收集发射光。为便于免疫荧光灰度值的对比研究,所有图像均采用相同的扫描和荧光采集条件设置。激光共聚焦免疫荧光图像采用ImageJ(NIH,美国)图像处理软件进行灰度值测量。该软件的使用参考NIH图像用户手册( http://rsb.info.nih.gov/nih-image/manual/menus/analyze.html#calibrate)。打开待分析图像,以手动框取方式选取每一细胞阳性染色区域进行灰度值测量,并以此完成视野下所有细胞TRPV1和TRPV4阳性信号区域灰度值的分析。
1.7 TRPV1、TRPV4通道功能响应性的评价TRPV1、TRPV4功能响应性采用其相应特异性激动剂辣椒素(capsaicin)和4α-佛波醇-12,13-二葵酸酯(4α-PDD)刺激下细胞钙离子内流的动态响应来评价。采用细胞膜通透性钙离子荧光染料Calcium Green-1 AM (Invitrogen公司)对细胞进行荧光染色,以观察激动剂作用下胞内钙离子的动态变化。拓扑结构基底和平面基底上培养3天的HepG2细胞经HEPES缓冲盐溶液(HEPES buffered saline,HBS)清洗3次后,样品用含5 μmol/L的Calcium Green-1 AM、3%热灭活胎牛血清和0.02% Pluronic F-127(PeproTech公司,美国)的HBS在37 ℃、5% CO2的孵箱中孵育1 h。样品经HBS清洗3次后,再以适量 HBS在37 ℃、5% CO2条件下孵育30 min以完全去酯化。Calcium Green-1荧光强度变化采用激光共聚焦扫描显微镜(Leica SP5,德国)检测,物镜使用高数值孔径1.25的40×复消色差油镜。Calcium Green-1以488 nm的激发光激发,以波长为515 nm的长通滤光片采集激光共聚焦信号。采用每3秒一幅的时间扫描模式采集共聚焦图像(512×512像素),一个扫描序列总时间长度为360s。在刺激前记录基线荧光强度60 s后快速(2 s内)加入特异性激动剂(capsaicin终浓度为10 μmol/L,4α-PDD终浓度为5 μmol/L)并记录细胞Calcium Green-1荧光强度动态变化。TRPV1、TRPV4功能响应性通过测量Calcium Green-1瞬态的相对荧光强度响应幅度来评价:
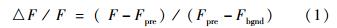
F代表加入刺激剂后最大荧光强度值,Fpre表示加入激动剂前荧光强度的平均值,Fbgnd表示不含染料的细胞浸浴液(HBS)的背景荧光值[18]。
1.8 统计学处理采用Origin75 software (Origin Lab Corporation,Northampton,美国)进行统计分析和数据作图。免疫荧光染色图像灰度值统计、TRPV1和TRPV4通道响应幅度以M±SD(算术平均值±标准偏差)表示,并采用两样本均数的t检验进行统计分析。TRPV1和TRPV4阳性响应细胞百分比以非参数双样本Mann-Whitney进行统计学检验。以P < 0.05作为统计学差异显著性的判断标准。
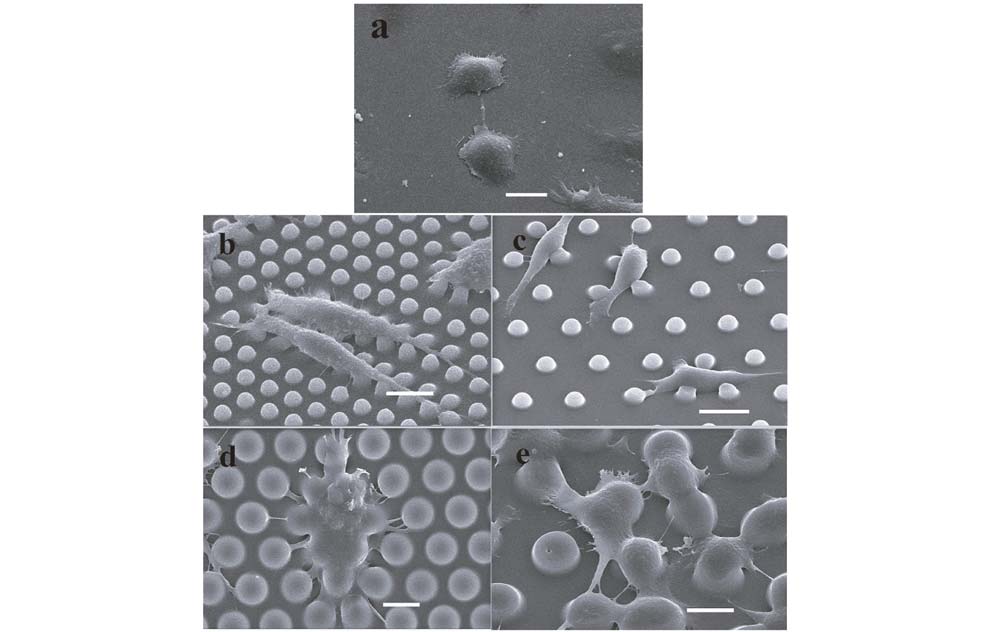
2 结 果 2.1 HepG2细胞与PDMS微柱阵列型拓扑结构基底的复合为了观察比较HepG2细胞与拓扑结构复合后的生长行为,实验将HepG2细胞分别接种于PDMS平面基底及4种拓扑结构基底(4-4 μm、4-7 μm、10-4 μm、10-7 μm),接种后常规培养3天,采用扫描电子显微镜拍照观察比较5种基底上细胞的铺展形态。如图1所示,在本实验条件下使用紫外光光刻、硅蚀刻及软光刻复制模塑技术制得的拓扑结构清晰完整,其几何尺寸符合实验设计的预期要求。图1显示,PDMS平面基底(图1a)和拓扑结构基底上HepG2细胞均能进行正常粘附生长,且细胞在不同基底上表现出不同的形态和铺展状态:在平面基底上(图1a)细胞呈正常铺展的鹅卵石形; 在4-4 μm(图1b)和4-7 μm(图1c)拓扑结构基底上细胞趋向于呈长梭型生长,极化程度较高而铺展程度较平面基底低; 在10-4 μm(图1d)和10-7 μm(图1e)拓扑结构基底上细胞呈铺展的鹅卵石形和星形生长,铺展程度较平面基底高。拓扑结构基底上,细胞位于柱子顶部或微柱间距内,可见很多伪足,而平面基底上则少有伪足出现。
|
| 图 1 HepG2细胞与微柱阵列型拓扑结构基底复合培养72h后的扫描电子显微图 Fig. 1 Interfacing of HepG2 cells with flat and micropillar arrayed PDMS substrates a: An SEM micrograph showing HepG2 cells on the flat PDMS substrate; b~e: SEM micrographs showing HepG2 cells on the 4-4 μm (b),4-7 μm (c),10-4 μm (d) and 10-7 μm (e) micropillar arrayed substrates. SEM micrographs showing the height of the 10-7 μm PDMS micropillar arrayed substrates were 3.5 μm. Images were taken 3 days after plating in growth medium. Scale bar = 10 μm |
TRPV1和TRPV4均可能是细胞的机械敏感离子通道或机械敏感性次级效应通道[13]。为了了解拓扑结构基底对HepG2细胞TRPV1和TRPV4通道蛋白在基因水平表达的影响,我们设计了特异性引物(表1),以qRT-PCR技术定量研究了拓扑结构基底和平面基底上HepG2细胞TRPV1和TRPV4的mRNA相对表达水平。HepG2细胞接种于4种拓扑结构基底和平面基底上复合培养3天后,分别提取细胞总RNA进行qRT-PCR实验。为了排除基因组DNA及环境因素的影响,采用NTC (无模板对照) 及 NRT (RNA替代cDNA作对照) 两种阴性对照。PCR结果显示,NTC及 NRT对照反应无产物生成(未显示结果)。实时荧光定量PCR样品熔解曲线分析表明,每个PCR反应只有单一产物生产(未显示结果)。
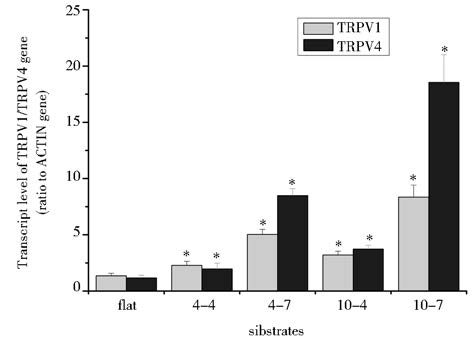
如图2所示,拓扑结构上HepG2细胞TRPV1和TRPV4的mRNA表达水平均高于平面基底上的相应值(P < 0.05)。TRPV1和TRPV4基因在4-7 μm结构上表达量均高于4-4 μm结构上的相应值(P < 0.05),10-7 μm结构上表达量高于10-4 μm结构(P < 0.05);10-4 μm结构上表达量高于4-4 μm结构(P < 0.05),10-7 μm结构上表达量高于4-7 μm结构(P < 0.05)。在五种基底上TRPV1和TRPV4基因的表达强度依次为:10-7 μm > 4-7 μm > 10-4 μm > 4-4 μm >平面基底。上述结果提示,拓扑结构基底较之平面基底上细胞TRPV1和TRPV4基因表达水平均显著增强,且相同微柱直径,较大微柱间距促进TRPV1和TRPV4基因水平表达;相同微柱间距,较大微柱直径增强TRPV1和TRPV4基因表达水平。
|
| 图 2 平面基底和4种拓扑结构基底上HepG2细胞TRPV1 和 TRPV4 mRNA表达定量分析 Fig. 2 Quantitative analysis of TRPV1 and TRPV4 mRNA expression in HepG2 cells on flat substrates and micropillar patterned substrates ACTIN gene was used as a reference. Negative controls were made by using water instead of cDNA. Data represent means and standard deviations. Statistically significant difference probability values for comparison with cells on flat substrates: * P < 0.05 |
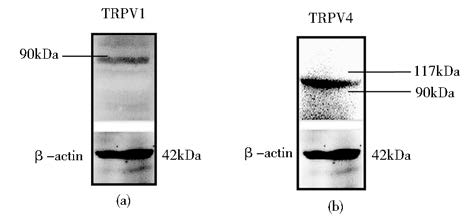
HepG2细胞在25 cm2细胞培养瓶中常规培养3天后,采用免疫印迹技术研究了HepG2全细胞蛋白提取物中TRPV1、TRPV4通道蛋白的表达。如图3所示,使用针对TRPV1的特异性抗体检测出分子量大小为85 - 90 kDa的蛋白质片段(图3a),符合TRPV1蛋白分子量预期大小[16]。使用针对TRPV4 的特异性抗体检测出分子量大小100 kDa左右的蛋白质片段(图3b),符合TRPV4蛋白分子量预期大小[17]。
|
| 图 3 HepG2细胞TRPV1和TRPV4蛋白表达的免疫印迹实验结果 Fig. 3 Western blot analysis of TRPV1 and TRPV4 channel protein expression in HepG2 cells (a)Upper panels: expression of TRPV1 (b) Expression of TRPV4 Lower panels: expression of β-actin |
为了评价基底拓扑结构对HepG2细胞TRPV1和TRPV4通道蛋白表达的影响,我们对拓扑结构基底和平面基底上培养3天的HepG2细胞进行了免疫荧光染色分析。如图4所示,分别使用针对TRPV1和TRPV4 的特异性抗体,在4种拓扑结构基底和平面基底上HepG2细胞均出现阳性免疫荧光染色反应(红色)。
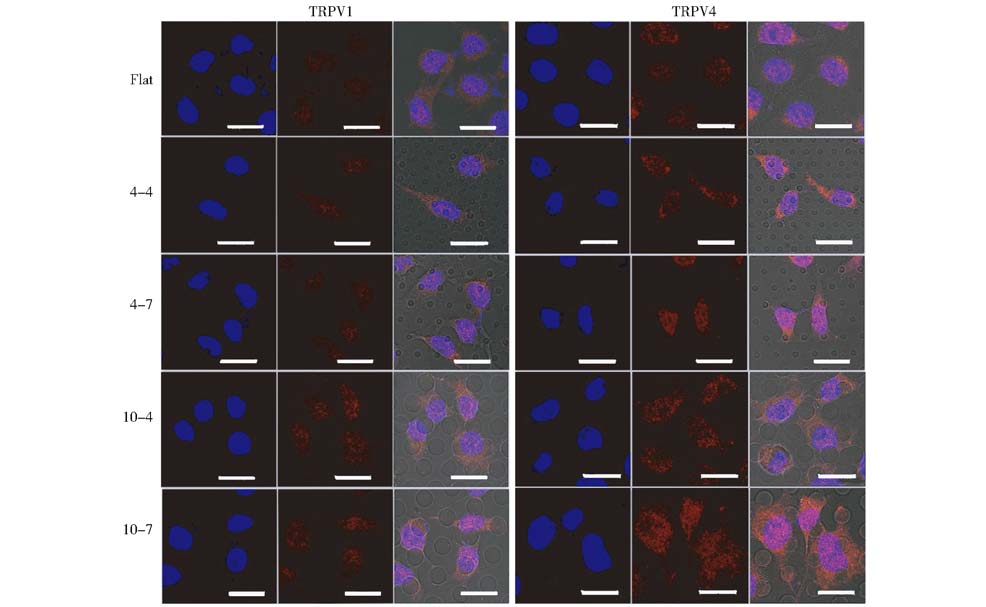
|
| 图 4 HepG2细胞在平面基底和4种拓扑结构基底上培养3天后TRPV1和TRPV4免疫荧光染色图 Fig. 4 Immunostaining for TRPV1 and TRPV4 (red) in HepG2 cells grown on flat substrates and micropillar patterned substrates for 3 days Numbers on the left side of the figure indicate the substrates represented by nominal pillar diameter - nominal spacing in micrometers. “Flat” refers to flat substrates. Scale bars=20μm |
表2为以免疫荧光图像为基础的HepG2细胞TRPV1和TRPV4免疫荧光灰度值测量结果。从表中可以发现,在4种拓扑结构基底上HepG2细胞的TRPV4免疫荧光灰度值较之平面基底均出现显著增强(P < 0.05);在不同结构尺寸微柱阵列型拓扑结构基底之间,TRPV4免疫荧光灰度值并无显著性差异(P > 0.05)。与平面基底上相应值比较,四种微柱阵列型拓扑结构基底上HepG2细胞TRPV1免疫荧光灰度值趋于增高或明显增高。其中,在4-7μm结构上TRPV1免疫荧光灰度值较之平面基底显著增强(P < 0.05),而其他拓扑结构上与平面基底相比无显著性差异(P > 0.05)。
| flat | 4-4 | 4-7 | 10-4 | 10-7 | |
| TRPV1 | 14.52±2.44 (n =124) | 15.49±2.97 (n=98) | 22.48±3.95* (n=116) | 14.81±2.05 (n =105) | 16.61±2.77 (n =87) |
| TRPV4 | 27.01±3.42 (n =133) | 31.32±4.42* (n =71) | 32.79±3.36* (n =161) | 32.49±4.16* (n =51) | 33.28±4.23* (n =92) |
| Notes: Data represent the means ± standard deviations. Measurements were based on immunofluorescence images. Statistically significant difference probability values for comparison with cells on flat substrates: * P < 0.05; n: Number of cells measured | |||||
我们以TRPV1激动剂capsaicin和TRPV4激动剂4α-PDD刺激HepG2细胞,通过激光共聚焦显微镜观察记录胞内Calcium Green-1荧光强度动态变化评价细胞TRPV1和TRPV4通道的功能响应性。如图5所示,在加入特异性激动剂前,荧光记录结果显示不同结构上细胞均表现出相对稳定的[Ca2+]i。 加入刺激剂10 μmol/L capsaicin (图5a)或5 μmol/L 4α-PDD(图5b)后,细胞表现出瞬态的胞内Calcium Green-1荧光强度或钙离子浓度变化。加入10 μmol/L capsaicin刺激剂后,细胞内Calcium Green-1荧光强度或钙离子浓度即刻迅速升高,后又迅速衰减并于刺激后25 s内回到或接近刺激前荧光强度水平。这一现象反映了TRPV1通道的快速去敏感化特性[19]。加入5 μmol/L 4α-PDD刺激剂后,细胞内Calcium Green-1荧光强度或钙离子浓度同样即刻迅速升高,但其恢复或下降过程较之于capsaicin刺激缓慢得多(5 min内)。
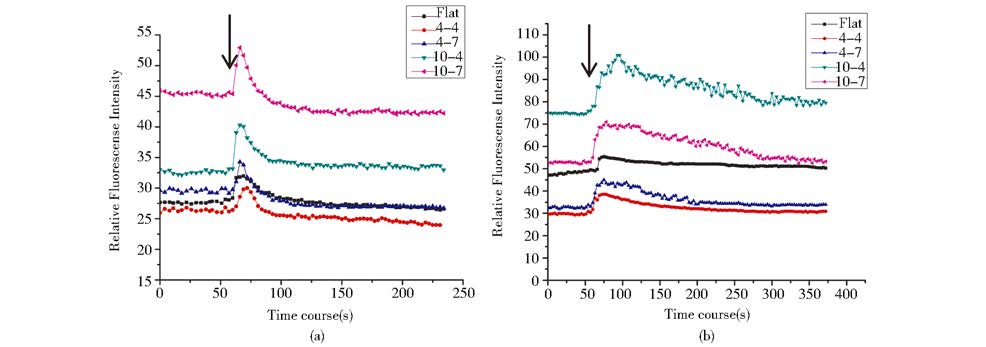
|
| 图 5 TRPV1和 TRPV4激动剂capsaicin和 4α-PDD刺激平面基底及拓扑结构基底上HepG2细胞后胞内Calcium Green-1平均荧光强度变化示意图 Fig. 5 Intracellular calcium responses to the TRPV1 and TRPV4 agonists,capsaicin and 4α-PDD,respectively,in HepG2 cells grown on PDMS flat substrates and micropillar patterned substrates Changes in [Ca2+]i of HepG2 cells were recorded using Calcium GreenTM-1 AM as Ca2+probe. Cells were bathed in recording medium containing 1.8 mmol/L Ca2+ (a )Typical recordings are shown when capsaicin (10 μmol/L) was applied (b) Typical recordings are shown when 4α-PDD (5 μmol/L) was applied. The cells in each substrate category,either responding or non-responding,were pooled and fluorescence intensities averaged to show dynamic changes in fluorescence intensities. Arrows indicate the timing of agonist introduction |
为了定量评价基底拓扑结构对HepG2细胞通道功能响应性的影响,对平面基底与拓扑结构基底上细胞TRPV1和TRPV4通道响应幅度及阳性响应细胞比例进行统计分析。本研究中定义细胞具备TRPV1和TRPV4功能响应性的判断标准为加入激动剂后细胞Calcium Green-1荧光强度较之刺激前平均荧光强度增加10%或以上[20]。如表3所示,4-4 μm、4-7 μm、10-7 μm拓扑结构基底上HepG2细胞TRPV1通道相对荧光强度响应幅度与平面基底上相应值无显著差异(P > 0.05),10-4 μm拓扑结构基底上TRPV1通道响应幅度达22.17%,显著高于其他基底(P < 0.05)。4-4 μm、4-7 μm、10-7 μm拓扑结构基底上TRPV1通道阳性响应细胞比例显著高于平面基底(P < 0.05),10-4 μm拓扑结构基底与平面基底上TRPV1通道阳性响应细胞比例无显著差异(P > 0.05)。表4为不同拓扑结构基底上HepG2细胞在4α-PDD刺激下TRPV4通道相对荧光强度响应幅度和阳性响应细胞比例。从表4中可见,4-4 μm、4-7 μm、10-4 μm 、10-7 μm四种拓扑结构基底上TRPV4通道相对荧光强度响应幅度和阳性响应细胞比例均显著高于平面基底上相应值(P < 0.05),但不同尺寸拓扑结构基底上细胞相对荧光强度响应幅度无显著差异(P > 0.05)。
| flat | 4-4 | 4-7 | 10-4 | 10-7 | |
| Percentage of responsive cells(%) | 24/44=54.54% | 41/49=83.67%* | 38/61=62.30%* | 19/35=54.29% | 29/46=63.04%* |
| Response magnitude | 0.15±0.10 | 0.15±0.05 | 0.15±0.03 | 0.22±0.06* | 0.16±0.035 |
| Notes: A cell was only considered responsive when it showed a fractional increase in Calcium Green-1 fluorescence intensity of 0.1 or higher over the pre-stimulus fluorescence intensity level. The percentage of responsive cells is expressed as: (number of responding cells) / (total number of cells measured). Response magnitude was only presented for “responsive” cells. Statistically significant difference probability values for comparison with flat substrates: * P < 0.05 | |||||
| flat | 4-4 | 4-7 | 10-4 | 10-7 | |
| Percentage of responsive cells(%) | 30/94=31.92% | 28/36=77.78%* | 37/59=62.71%* | 40/58=68.97%* | 43/68=63.24%* |
| Response magnitude | 0.16±0.06 | 0.37±0.09* | 0.39±0.09* | 0.35±0.09* | 0.35±0.07* |
| Notes: See the notes under Table3 | |||||
细胞-基底拓扑结构相互作用是生物材料学、组织工程学、生物反应器、细胞微系统以及细胞生物传感器等共同关注的跨学科研究领域。基底微拓扑结构已成功应用于体外细胞培养以实现细胞形态和运动的定向控制(即接触诱导,contact guidance[21])乃至培养细胞的功能优化。微加工技术的应用实现了培养基底上微纳米尺寸拓扑结构的制备和材料特性的精确控制,并使得细胞-基底拓扑结构相互作用的系统研究成为可能[22]。本文以紫外光光刻、硅蚀刻及软光刻复制模塑技术制得的4种不同尺寸拓扑基底结构清晰完整,其几何尺寸符合实验设计的预期要求。HepG2细胞在PDMS平面基底和拓扑结构基底上均能进行正常粘附生长,且表现出不同程度的形态铺展。前期使用同样拓扑结构基底的研究表明[6]:HepG2细胞在4种微柱阵列型拓扑结构基底上培养72h后,10-4 μm和10-7 μm拓扑结构基底较之于4-4 μm和4-7 μm基底,细胞具有较高的铺展面积;而4-4 μm和4-7 μm拓扑结构基底较之于10-4 μm和10-7 μm基底,HepG2细胞具有更高的极化程度。拓扑结构上细胞铺展面积大小依次为:10-4 μm > 10-7 μm > 4-4 μm > 4-7 μm。平面基底上HepG2细胞则具有中等程度的铺展面积。提示细胞形态及铺展与微柱阵列型拓扑结构基底上微柱直径大小有关,微柱直径为10 μm较之直径为4 μm的结构更有利于促进细胞铺展。这与本文的显微观察结果一致。
对拓扑结构基底上HepG2细胞TRPV1和TRPV4基因相对表达量的定量研究发现,拓扑结构基底上HepG2细胞TRPV1和TRPV4基因相对表达水平均显著高于平面基底。拓扑结构基底上TRPV1相对表达量是平面基底上相应值的1.68~6.17倍,TRPV4相对表达量是平面基底上相应值的1.68~15.83倍。结合细胞形态铺展的研究可以发现,在所考察的培养时间段内(细胞接种3天),不论是促进细胞铺展的较大微柱直径(10-4 μm、10-7 μm)拓扑结构,还是促进细胞形态极化的较小微柱直径(4-4 μm、4-7 μm)拓扑结构,都增强HepG2细胞TRPV1、TRPV4基因表达水平,提示细胞与基底拓扑结构这一相互作用本身促进了TRPV1和TRPV4基因表达[23]。进一步分析发现,相同微柱直径(4 μm或10 μm)、较大微柱间距(7 μm)拓扑基底上细胞较之于较小微柱间距(4 μm)具有较高的TRPV1和TRPV4基因表达水平;相同微柱间距(4 μm或7 μm)、较大微柱直径(10 μm) 拓扑基底上细胞较之于较小微柱直径(4 μm)具有更高的TRPV1和TRPV4基因表达水平。结合本实验室田青华等[6]早期的表型研究结果可以看出:相同微柱间距(4 μm、7 μm),较大微柱直径(10 μm)较之较小直径(4 μm)的基底促进细胞铺展并抑制细胞形态极化程度(圆度),同时伴随着较高的TRPV1或TRPV4基因表达水平;相同微柱直径(4 μm或10 μm),较小微柱间距(4μm)较之较大微柱间距(7 μm)的基底一定程度促进细胞铺展的同时也增加细胞形态极化(圆度),但却伴随着较低的TRPV1或TRPV4基因表达水平。上述结果提示,基底拓扑结构影响HepG2细胞TRPV1和TRPV4基因表达与细胞-基底拓扑结构相互作用本身以及由此导致的细胞形态铺展和形态极化都具有明显的相关性。有关这一现象,进一步结合细胞在基底拓扑结构上粘着斑形态分布及有关信号途径的研究可能会揭示更有意义的结果。
对4种不同尺寸微柱阵列型微拓扑结构基底上TRPV1和TRPV4通道蛋白表达的研究结果表明,拓扑结构基底上细胞TRPV1和TRPV4通道蛋白表达的变化趋势与基因表达并非完全一致。对于TRPV1蛋白表达,免疫荧光染色结果提示HepG2细胞在4-7 μm拓扑结构基底上较之平面基底免疫荧光染色强度显著增强,而在其他拓扑结构上则与平面基底相比无明显差异。在4种拓扑结构基底上HepG2细胞的TRPV4免疫荧光染色强度较之平面基底相应值均出现显著增强,但在不同结构尺寸拓扑结构基底之间,HepG2细胞TRPV4免疫荧光染色强度并无显著性差异。这一现象可能与细胞基因表达和蛋白表达过程之间复杂的相互调节作用有关[24]。
在肝细胞内,钙离子作为第二信使调控着细胞的增殖、分化、代谢及分泌等多种生理与病理过程[14]。胞内钙离子信号的最重要来源是胞外钙离子通过选择性钙离子通道跨膜内流。而这些钙离子通道绝大多数属于TRP家族阳离子通道,是一些重要肝脏疾病药物治疗的潜在靶标[25]。我们分别采用TRPV1特异性激动剂capsaicin和TRPV4特异性激动剂4α-PDD刺激HepG2细胞,通过激光共聚焦显微镜观察记录胞内钙离子的动态变化来评价TRPV1和TRPV4通道的功能响应性。实验结果表明,加入刺激剂10 μmol/L capsaicin或5 μmol/L 4α-PDD均能刺激细胞引起瞬态的胞内钙离子浓度变化。加入10 μmol/L capsaicin刺激剂后,细胞内钙离子浓度即刻迅速升高,后又迅速衰减并于刺激后25 s内回到或接近刺激前荧光强度水平,这一现象反映了TRPV1通道的快速去敏感化特性[19],且拓扑结构基底上阳性响应细胞比例或钙离子响应幅度较之平面基底相应值增高。加入5μmol/L 4α-PDD刺激剂后,细胞内钙离子浓度同样即刻迅速升高,但其恢复或下降过程较之于capsaicin刺激缓慢得多(5 min内)。与此同时,拓扑结构基底上细胞TRPV4阳性响应细胞比率和钙离子响应幅度较之平面基底均全面明显升高。上述结果不仅提示TRPV1和TRPV4介导的钙离子内流可能是基底拓扑结构调控和优化肝细胞细胞功能表型的离子信号机制,而且显示了以基底拓扑结构增强TRPV靶标响应性的潜在应用前景。
本研究PDMS平面基底及拓扑结构基底上培养的HepG2细胞在capsaicin刺激下,均表现出钙离子浓度的即刻升高后又快速衰减。Vriens等[15]和Waning等[16]以普通培养皿基底及I型胶原裱衬基底进行的HepG2细胞在capsaicin刺激下的钙离子成像研究发现,细胞在系统引入capsaicin刺激后的数十秒至数分钟开始出现缓慢持续的钙离子浓度升高,之后缓慢下降,钙响应峰宽达数分钟至十分钟以上。这与本文在capsaicin刺激即刻出现HepG2细胞钙离子浓度的迅速升高和快速恢复的动态过程明显不一致。这一差异产生的原因除了与细胞的实验条件及培养基底的不同有关外,可能还与激动剂添加的动态过程密切相关。在Vriens等[15]和Waning等[16]的实验体系中,他们采用了一种持续而低速的灌流加样方式,这使得激动剂如capsaicin的动态扩散过程以及流体剪应力成为影响实验结果的重要因素。从capsaicin刺激后的钙离子信号响应来看,本文所得到的即刻响应和快速恢复的钙离子信号无疑从时间动态过程上反映了TRPV1的快速去敏感化特性,具有更好的靶标响应质量。Vriens等[15]和Waning等[16]对经肝细胞生长因子(hepatocyte growth factor,HGF)预处理的HepG2细胞的钙离子成像和膜片钳实验研究发现,HGF处理的细胞比未经HGF处理的细胞在capsaicin作用下具有更高的TRPV1响应性。在capsaicin刺激下,HGF处理的迁移表型的HepG2细胞比HGF处理的非迁移表型的细胞和未经HGF处理的细胞表现出更高的胞内钙离子荧光信号响应。相同的研究还发现,HGF具有刺激HepG2细胞分散(形成与基底的直接相互作用),促进细胞铺展和伪足形成而表现出迁移性表型。前期[6]及本文研究发现,本实验采用的微柱阵列型拓扑结构基底具有促进细胞与基底相互作用并引导细胞铺展的效应;有研究表明拓扑结构基底促进细胞的迁移[26]。这可以解释本文采用的基底拓扑结构,与HGF类似,具有增强HepG2细胞TRPV1和TRPV4的功能响应性作用。然而对于TRPV4,HGF对激动剂4α-PDD刺激下的HepG2细胞钙信号并无明显影响而主要增强固有开放相关的TRPV4通道的响应性[15],而本文采用拓扑结构基底则全面增强HepG2细胞在4α-PDD刺激下的细胞钙信号响应性(Calcium green-1相对荧光响应幅度和阳性响应细胞比例)。微柱阵列型基底拓扑结构增强TRPV1和TRPV4通道的功能响应性,除了与通道的表达增高有关外,可能也涉及细胞钙离子内流驱动力(如膜电位极化程度)的改变[16]。有关这一机理,尚需更多的研究。
在拓扑结构与细胞的相互作用方面,迄今有关的研究大量集中在拓扑结构细胞培养基底的先进加工和细胞在基底拓扑结构上的形态响应,如细胞的粘附、铺展、取向、迁移,以及与此相关的细胞骨架和粘附结构形态分布和组成等[5, 27, 28]。而拓扑结构条件下基因表达和功能响应的机理已经引起研究者的注意。对于肝细胞,这可能涉及细胞骨架重组和细胞核变形[5, 27]、粘着斑及下游信号通路[27, 28]以及相应机械敏感离子通道的表达和开放。基底拓扑结构增强TRPV通道的功能响应性提示TRPV介导的离子信号可能是基底拓扑结构优化HepG2细胞功能表型的重要信号机制。
| [1] | Toh Y C, Lim T C, Tai D, et al, A microfluidic 3D hepatocyte chip for drug toxicity testing. Lab Chip, 2009, 9:2026-2035. |
| [2] | Lee K H, Shin S J, Kim C B, et al. Microfluidic synthesis of pure chitosan microfibers for bio-artificial liver chip. Lab Chip, 2010, 10: 1328-1334. |
| [3] | Park J, Li Y, Berthiaume F, et al. Radial flow hepatocyte bioreactor using stacked microfabricated grooved substrates. Biotechnology and Bioengineering, 2008, 99: 455-467. |
| [4] | Alvarez S D, Derfus A M, Schwartz M P, et al. The compatibility of hepatocytes with chemically modified porous silicon with reference to in vitro biosensors. Biomaterials, 2009, 30(1): 26-34. |
| [5] | Tsai W B, Lin J H. Modulation of morphology and functions of human hepatoblastoma cells by nano-grooved substrata. Acta biomaterialia, 2009, 5(5): 1442-1454. |
| [6] | 田青华,林雨,黄岂平,等. PDMS微柱阵列型拓扑结构基底对肝癌细胞HepG2形态及功能基因表达的影响.中国生物工程杂志,2013,33(10):4-13. Tian Q H,Lin Y,Huang Q P, et al. Effects of polydimethylsiloxane micropillar arrayed topographic substrates on the morphology of the HepG2 hepatoma cells and their functional gene expression. China Biotechnology,2013, 33( 10): 4-13. |
| [7] | Curtis A, Wilkinson C. New depths in cell behaviour: Reactions of cells to nanotopography. Biochemical Society Symposium, 1999, 65:15-26. |
| [8] | Bettinger C J, Langer R, Borenstein J T. Engineering substrate topography at the micro-and nanoscale to control cell function. Angewandte Chemie-international Edition, 2009, 48: 5406 -5415. |
| [9] | Khan S, Newaz G A. comprehensive review of surface modification for neural cell adhesion and patterning. Journal of Biomedical Materials Research, 2010, 93A: 1209-1224. |
| [10] | Martínez E, Engel E, Planell J A, et al. Effects of artificial micro-and nano-structured surfaces on cell behaviour. Ann Anat, 2009, 191: 126-135. |
| [11] | Kriparamanan R, Aswath P, Zhou A, et al. Nanotopography: cellular responses to nanostructured materials. J Nanosci Nanotechnol, 2006, 6: 1905-1919. |
| [12] | Rychkov G Y, Barrit G J. Expression and function of TRP channels in liver cells. In: Islam M S, eds. Transient Receptor Potential Channels, Advances in Experimental Medicine and Biology, 2011, 704: 667-686. |
| [13] | Kung C.A possible unifying principle for mechanosensation. Nature, 2005, 436: 647-654. |
| [14] | Barritt G J, Chen J, Rychkov G Y. Ca2+-permeable channels in the hepatocyte plasma membrane and their roles in hepatocyte physiology. Biochim Biophys Acta, 2008, 1783: 651-672. |
| [15] | Vriens J, Janssens A, Prenen J, et al. TRPV channels and modulation by hepatocyte growth factor/scatter factor in human hepatoblastoma (HepG2) cells. Cell Calcium, 2004, 36: 19-28. |
| [16] | Waning J, Vriens J, Owsianik G, et al. A novel function of capsaicin-sensitive TRPV1 channels: involvement in cell migration. Cell Calcium, 2007, 42:17-25. |
| [17] | Martin E, Dahan D, Cardouat G, et al. Involvement of TRPV1 and TRPV4 channels in migration of rat pulmonary arterial smooth muscle cells. Pflügers Archiv-European Journal of Physiology, 2012, 464(3): 261-272. |
| [18] | Takahashi A, Camacho P, Lechleiter J D, et al. Measurement of intracellular calcium. Physiol Rev, 1999, 79(4):1089-1125. |
| [19] | Mohapatra D P, Nau C. Regulation of Ca2+-dependent desensitization in the vanilloid receptor TRPV1 by calcineurin and cAMP-dependent protein kinase, J Biol Chem, 2005,280: 13424-13432. |
| [20] | Wu Z Z, Zhao Y P, Kisaalita W S. A packed cytodex microbead array for three-dimensional cell-based biosensing. Biosensors & Bioelectronics, 2006, 22(5):685-693. |
| [21] | Weiss P. Nerve patterns: the mechanics of nerve growth. Growth, 1941,5(suppl.):163-203. |
| [22] | 吴泽志,朱满根,KisaalitaW S,等.阵列型微拓扑结构基底的制备及其对神经细胞电生物物理特性的影响.传感技术学报,2011,4(24):467-474. Wu Z Z,Zhu M G,Kisaalita W S, et al. Fabrication of arrayed topographic substrates and their effects on the electrobiophysical properties of neuronal cell. Chinese Journal of Sensors and Actuators,2011,24(4):467-474. |
| [23] | Ben-Ze'ev A, Robinson G S, Bucher N L, et al. Cell-cell and cell-matrix interactions differentially regulate the expression of hepatic and cytoskeletal genes in primary cultures of rat hepatocytes. Proc Natl Acad Sci USA, 1988, 85(7):2161-2165. |
| [24] | Nakamura K, Kato N, Aizawa K, et al. Expression of albumin and cytochrome P450 enzymes in HepG2 cells cultured with a nanotechnology-based culture plate with micro-fabricated scaffold. The Journal of Toxicological Science,2011,36( 5) : 625-633. |
| [25] | Gregory R B, Hughes R, Barritt G J, et al. Induction of cholestasis in the perfused rat liver by 2-aminoethyl diphenylborate, an inhibitor of the hepatocyte plasma membrane Ca2+ channels. Journal of Gastroenterology and Hepatology, 2004, 19: 1128-1134. |
| [26] | Maka K Y, Lia L, Wong C M,et al. Quantitative analysis of hepatic cell morphology and migration in response to nanoporous and microgrooved surface structures. Microelectronic Engineering, 2013, 111: 396-403. |
| [27] | Ranucci C S, Moghe P V. Substrate microtopography can enhance cell adhesive and migratory responsiveness to matrix ligand density. Journal of Biomedical Materials Research,2001, 54(2): 149-161. |
| [28] | Yin C, Liao K, Mao H Q, et al. Adhesion contact dynamics of HepG2 cells on galactose-immobilized substrates. Biomaterials, 2003, 24(5): 837-850. |
 2015, Vol. 35
2015, Vol. 35




