文章信息
- 周立军, 刘文娟, 祁永浩, 李妙
- ZHOU Li-jun, LIU Wen-juan, QI Yong-hao, LI Miao
- SOCS3通过JNK和STAT3信号通路调控AKT
- SOCS3 Negatively Regulates AKT through JNK and STAT3 Signal Pathways
- 中国生物工程杂志, 2015, 35(9): 50-56
- China Biotechnology, 2015, 35(9): 50-56
- http://dx.doi.org/10.13523/j.cb.20150908
-
文章历史
- 收稿日期: 2015-05-18
- 修回日期: 2015-06-05
蛋白激酶B(AKT)是一种丝氨酸/苏氨酸(Ser/Thr)蛋白激酶,在某些细胞因子的刺激下,能够调控细胞凋亡和细胞增殖信号,与细胞存活、代谢、迁移、侵袭等密切相关。在乳腺癌中,AKT的表达随着乳腺癌恶性进展逐渐增高,并且与肿瘤的大小相关,研究表明肿瘤体积越大,AKT阳性表达率也越高[1]。越来越多的研究结果表明,AKT在多种肿瘤细胞中都存在异常活化现象,如胃癌、肺癌、子宫内膜癌及恶性黑色素癌等,AKT异常活化与肿瘤的发生、发展、治疗有着非常重要的联系[2]。AKT已成为抗肿瘤药物的靶点,目前,很多以AKT为靶点的抗肿瘤药物成为研究的热点问题。
细胞信号转导抑制因子3(suppressor of cytokine signaling 3,SOCS3)作为SOCS 家族的重要成员之一,是在细胞因子和生长相关因子信号转导通路中起负性调节的蛋白质因子。大量研究证明,SOCS3可被多种炎症因子诱导表达,并且抑制多种免疫分子的信号转导。此外,SOCS3对酪氨酸蛋白激酶-信号转导及转录激活因子(JAK-STAT)通路的信号转导起负性调节的作用,从而阻止细胞的恶性转化,促进肿瘤细胞的凋亡,SOCS3的激活和过表达对肿瘤的生长具有潜在的作用。
最近的报道显示,SOCS3的过表达能够抑制肿瘤细胞的生长,促进凋亡,并且降低AKT磷酸化水平[3],说明SOCS3能够通过抑制AKT的激活从而对细胞的生长进行调控。因此,如何利用SOCS3在AKT信号通路中的负向调控对研究癌症的发生、发展、预防及治疗具有重要的意义。
1 AKT 信号通路 1.1 AKT信号通路的组成在正常生理状态下,机体能够通过自我的动态平衡调控细胞的存活和增殖,然而肿瘤细胞则通过生长促进和凋亡抑制等途径来实现永生化。例如,肿瘤细胞通过AKT信号通路调节下游核因子NF-κB的入核,启动基因转录及调控BCL-2家族蛋白的表达,从而促进细胞的增殖和抗凋亡,使细胞逃离凋亡而保持增殖能力,这主要是通过AKT-PI3K信号通路实现调控的[4, 5, 6]。
PI3K是催化磷酸肌醇3′-OH端磷酸化的一类蛋白质,它的组成单位是一个催化亚基P110和一个调节亚基P85。P85的氨基端由一个SH3结构域和能与SH3结构域结合的脯氨酸富集区构成,其羧基端是由2个SH2结构域及1个与P110结合的区域组成。PI3K的P110亚基与蛋白激酶具有同源性,本身既具有丝氨酸/苏氨酸激酶活性,也具有磷脂酰肌醇激酶活性[7]。AKT作为PI3K信号通路中重要的下游靶分子,对调控细胞增殖与凋亡具有重要作用。目前知道AKT家族至少有3个成员:AKT1/PKBα、AKT2/PKBβ及AKT3/PKBγ。AKT羧基端是疏水区,其氨基端含有一个特异性作用于底物丝氨酸(Ser)/苏氨酸(Thr)的氨基酸残基,富含脯氨酸。AKT的PH区域在进化中高度保守,说明其可能在AKT的功能发挥方面具有重要作用。AKT由细胞质向细胞膜的移位是其激活的重要过程[8]。当PI3K被一些细胞因子等细胞表面受体激活后,在细胞质膜上产生3,4,5-三磷酸磷脂酰肌醇(PIP3),PIP3与胞内AKT的PH结构域结合从而使AKT由细胞质向细胞膜移位,继而磷脂酰激酶依赖激酶2(PDK2)与AKT结合使其C端的疏水区Ser473位点发生磷酸化,同时磷脂酰激酶依赖激酶1(PDK1)与AKT结合使其催化区的Thr308位点发生磷酸化,Thr308与Ser473位点的同时磷酸化是AKT激活的必要条件[9]。激活的AKT能够调节其下游靶蛋白,促进核基因的激活与转录,促进细胞的增殖与抗凋亡[10]。
1.2 AKT与肿瘤的研究进展Gills和Dennis[11]发现,超过50%的人类肿瘤细胞中存在AKT被激活的现象。激活的AKT/PI3K信号通路与细胞癌变及抗凋亡信号的活化有着密切的关系。AKT的Thr308/Ser473位点发生磷酸化后能够促进NF-κB的活化,活化的NF-κB进而促进抗凋亡基因的表达、阻断抑癌基因P53的激活从而使细胞存活[12, 13]。Ye等[14]研究发现,胃癌细胞中PI3K/AKT表达上升,若阻断PI3K/AKT信号通路会抑制胃癌细胞的生长,并且下调促细胞迁移相关蛋白的表达。Hovelmann等[15]也证实AKT的活化能够增加抗凋亡因子BCL-2家族中BCL-XL蛋白的表达。另外,研究发现 PI3K/AKT信号通路能够调节肿瘤细胞的自噬和凋亡,控制caspase-3和DNA修复酶的活化[16]。在人类T淋巴细胞白血病病毒Ⅰ型(HTLV-1)转化细胞中用PI3K抑制剂LY294002阻断AKT激活后,会引起P53通路依赖的细胞凋亡[17]。此外,在293T细胞中,干扰TRAF6的表达会降低AKT的磷酸化,促进细胞凋亡[18]。因此,AKT在调控肿瘤细胞凋亡过程中发挥核心作用,AKT的活化能够引起肿瘤细胞的抗凋亡作用。与此同时,如果AKT在肿瘤细胞中被干扰或抑制,依赖AKT的信号就会产生促凋亡信号,引发肿瘤细胞凋亡。
1.3 靶向AKT信号通路的抗肿瘤策略以PI3K/AKT为靶点的抗肿瘤药物的研究已经成为抗肿瘤药物研究领域的热点问题。渥曼青霉素(wortmannin)和LY49002是目前PI3K主要的抑制剂之一,体外研究均证实了它们对培养的肿瘤细胞具有抗瘤作用,并且能够增加肿瘤细胞对放疗和化疗的敏感性[19]。Kubota等[20]首先发现渥曼青霉素能够增加胶质瘤细胞的放射敏感性,虽然渥曼青霉素能够有效抑制PI3K的活性,但是由于其水溶性差和具有较大的毒副作用等缺点限制了其在临床上的应用。LY49002也能有效抑制PI3K的活性,但是其较短的半衰期使其在临床上的应用也受到了限制[21]。目前AKT抑制剂研究中进入临床二期实验的是派立福新(perifosine)和MK-2206。AKT抑制剂中派立福新是研究的最为深入的,并且具有很好的效果,但是由于其单独使用时会引起较大的胃肠道反应,因此也限制了其在临床上的应用。研究发现,MK-2206联合吉非替尼(gefinitib)能够介导胶质瘤细胞的自噬与凋亡,而且具有很好的抗瘤活性[22]。AKT可接受LPS、IGF-1等众多信号的刺激来控制下游众多底物。例如,通过调节促凋亡蛋白Bad、叉头转录因子(forkhead 转录因子)、糖原合成酶激酶-3 (GSK-3) 等的表达,并且通过激活癌基因Mdm2与核因子NF-κB等来促进蛋白的合成,从而调控肿瘤细胞周期,促进肿瘤细胞生长[23, 24],因而理论上抑制AKT的活性对于肿瘤的治疗具有非常大的优势。直接或间接靶向AKT基因能够抑制肿瘤细胞的生长,因此抑制AKT的激活在肿瘤治疗中扮演着重要角色。
2 SOCS3信号通路 2.1 SOCS3的生物学特征与功能SOCS3是SOCS家族的重要成员之一,SOCS家族包括SOCS1~7与CIS等成员。人的SOCS3基因定位于17q25.3,只有一个外显子,无内含子[25]。SOCS3由225个氨基酸组成,蛋白质分子质量为24.7kDa。SOCS3由SOCS盒、SH2结构域和N端的激酶抑制区(KIR)[26]组成。
SOCS3的SOCS盒长约40个氨基酸,可募集到Elongin B/C,进而结合蛋白酶体或通过Elongin B/C复合物招募泛素转移酶系统,促进与SOCS3结合的靶蛋白的降解,从而阻断细胞因子的信号传递。此外,SOCS盒还可以抑制SOCS蛋白发生蛋白酶体依赖的降解而维持自身蛋白质的稳定,若SOCS蛋白发生酪氨酸残基磷酸化,则会导致蛋白酶介导的SOCS3的降解[22, 27]。SOCS3的SH2结构域位于SOCS3的中央,有研究发现其可与蛋白磷酸基结合,它通过介导SOCS3分子与其他信号转导分子之间的相互作用,为SOCS3发挥负反馈调节提供了基础[26]。SOCS3的N端KIR能够直接抑制JAK1和JAK2的催化活性,研究证明KIR的结构与JAK底物的JAK激活环相似,其机制可能是KIR作为假底物与JAK产生竞争性拮抗作用从而抑制了JAK激酶活性[28]。
在正常情况下,SOCS3在细胞内的表达水平很低或没有表达,但是某些细胞因子和激素能够刺激SOCS3的产生,而SOCS3的产生又可以负反馈调节细胞因子及激素介导的JAK/STAT的信号转导[29]。研究表明,在某些因素的作用下,SOCS3的表达发生异常,导致肿瘤细胞过度生长、迁移、侵袭及血管生成等[30]。SOCS3启动子区CpG岛的异常甲基化导致其转录抑制,这一现象在肝癌、结肠癌及前列腺癌等多种肿瘤中被发现,提示SOCS3的甲基化与肿瘤的发生发展具有明显的相关性[29, 30]。另外有学者报道当肿瘤细胞中过表达SOCS3时肿瘤细胞的生长受到抑制,细胞G0/G1期比例显著增高,S期及G2/M期比例显著降低[15],提示SOCS3 可以作为癌症的诊断及预后预测的生物分子指标。
2.2 SOCS3对AKT信号通路的调节最近研究报道SOCS3的过表达能够抑制AKT的磷酸化与激活,表明AKT与SOCS3之间有着重要的联系[3]。
研究表明在细胞因子和生长因子,如白细胞介素2(IL-2)、白细胞介素3(IL-3)、干扰素γ(IFN-γ)、生长激素(GH)等的刺激下,SOCS3蛋白能够被诱导表达,并且其作为一种经典的负反馈调节机制可以直接拮抗STAT3信号通路[31]。在多种肿瘤细胞,如肺癌、胃癌、结肠癌等[3, 32, 33, 34]中都存在JAK/STAT3信号转导途径的过度激活,而SOCS3可作为STAT3/JAK信号转导途径上游的重要负反馈调节蛋白。SOCS3蛋白通过负反馈调节STAT3的酪氨酸磷酸化而抑制JAK/STAT3信号通路的激活,从而抑制了肿瘤细胞的生长[35]。
研究报道STAT3与AKT有着密切的联系,STAT3信号通路能够调控AKT的表达[35, 36]。有研究者发现,用STAT3的抑制物Sttatic处理细胞,AKT的磷酸化水平显著降低,这提示AKT的激活依赖于STAT3的功能。转染STAT3的干扰RNA发现STAT3的含量和活性都下调,同时AKT的激活受到了抑制[36]。Sharma等[37]也发现在子宫颈癌细胞中,瘦素介导的AKT与ERK2的磷酸化依赖于JAK/STAT信号通路的激活,阻断STAT信号通路可抑制细胞的增殖,同时抑制瘦素所介导的AKT及STAT3的过度磷酸化。学者发现,上调SOCS3的表达能够抑制瘦素所调控的JAK2酪氨酸的磷酸化及随后STAT3的激活,这反过来又抑制了AKT的激活[38, 39, 40]。STAT3作为激活AKT的上游,能够对AKT进行正向调控,从而促进AKT的磷酸化及激活。而SOCS3作为STAT3的负向调控因子,能够抑制STAT3的激活。因此,通过SOCS3对STAT3的调控从而调控AKT的激活及抑制肿瘤细胞的生长,对临床癌症的治疗具有重要的意义。
有研究发现,脂肪细胞因子(ddipocytokines)能够拮抗瘦素诱导的肝癌细胞HepG2与Huh7的增殖、迁移、侵袭等行为;通过实验进一步探讨这个作用机制,发现脂肪细胞因子能够抑制瘦素所诱导的STAT3与AKT的激活,同时诱导了SOCS3的表达[41]。这阐明了脂肪细胞因子抑制肝癌细胞的生长是由于促进了上游SOCS3的表达,而SOCS3又能够负向调控STAT3的表达,因STAT3活性抑制而阻碍了AKT的激活。
在肺癌细胞中表皮生长因子(EGFR)酪氨酸激酶过度活化是一种很普遍的现象,因此临床上采用酪氨酸激酶抑制物,如吉非替尼等来抑制肿瘤细胞的生长。但是由于耐药问题的存在,大多数患者最后还是出现了肿瘤复发。Wu等[36]研究发现,肺癌患者吉非替尼耐药的原因是由于STAT3所调控的AKT的激活。吉非替尼增加了EGFR与STAT3的互作,从而解除了STAT3上游抑制物SOCS3对其的抑制,由于逃离了SOCS3的抑制,STAT3反过来又会加强AKT的激活,从而导致了耐药性的产生。因此,为了逆转由于STAT3过度激活而导致的AKT激活所产生的耐药性,临床上可以采用STAT3的抑制物与酪氨酸激酶的抑制物联合用药对表皮生长因子酪氨酸激酶过度激活的肺癌患者进行联合治疗。
也有研究者发现在甲状腺癌患者体内,STAT3与AKT都处于高度激活状态,同时磷酸化的IKKα/β及其作用底 物IκB的表达在甲状腺癌细胞中都得到提高。但是SOCS1、SOCS3、SOCS5的表达却受到了显著的抑制,这也提示了SOCS家族蛋白表达的抑制解除了对STAT3的控制,从而促进了AKT的激活,最终激活NF-κB进入细胞核诱导核基因的转录,促进细胞的存活与抗凋亡。为了进一步探讨SOCS3在STAT3-AKT信号通路中的作用,研究者通过在未分化的甲状腺癌细胞中过表达SOCS3,发现SOCS3过表达能够完全抑制STAT3的表达,同时抑制AKT磷酸化及GSK3β的表达。此外,研究者还发现SOCS3是通过抑制AKT的激活从而调控BCL-2家族抗凋亡蛋白表达的。为了证明这个作用机制,研究者在未分化的甲状腺癌细胞中转染AKT激酶缺陷的突变体AKTK179M,通过免疫荧光和免疫印迹发现GSK3β磷酸化的水平在AKTK179M转染细胞中显著下降,同时BCL-XL的表达受到了显著的抑制[42]。这揭示了在未分化甲状腺癌中AKT能够调控BCL-XL家族蛋白的表达,从而也说明SOCS3可以通过抑制AKT的表达抑制抗凋亡蛋白BCL-XL的表达来促进细胞凋亡。同时研究者通过SOCS3的反义寡核苷酸干扰正常甲状腺细胞中SOCS3的表达,发现BCL-XL和BCL-2的表达水平都得到提高,再一次证明了SOCS3通过调控AKT的表达从而调控细胞的凋亡。
Yu等[3]也发现在人肺癌A549细胞中过表达SOCS3,细胞生长活力受到了抑制。为了探讨SOCS3对细胞生长抑制的潜在作用机制,他们采用免疫印迹法检测pSTAT3、pAKT及pERK1/2的水平,发现在SOCS3过表达细胞中,pAKT、pERK1/2的水平与对照组相比显著下调,说明了SOCS3能够正调控Erk1/2以及AKT的激活。
学者通过表达IL-1上游的信号分子MyD88、IL-1R激活激酶1、肿瘤坏死因子受体相关因子6(TRAF6)、TGF-β激活激酶1(TAK)发现,SOCS3能够抑制IL-1诱导的NF-κB的转录和激活,并且证明了SOCS3作用的靶标是TRAF6/TAK1;进一步发现SOCS3通过抑制TRAF6的泛素化,从而阻止了TAK1的激活,最终抑制了IL-1诱导的信号通路的转导[43]。而TRAF6作为AKT的E3泛素连接酶,也间接地说明了SOCS3与AKT之间存在一定的联系。在心脏SOCS3特异性敲除的鼠中发现,15周龄时,小鼠糖蛋白130 (gp130) 下游的靶蛋白STAT3、Erk1/2、AKT及P38的活性增加,并且大约在第25周时发展为心脏功能不全[44]。汉黄芩素能够诱导SOCS3表达的增加,有研究发现,使用PI3K的抑制物LY294002与渥曼青霉素处理人的成神经瘤细胞能够阻断汉黄芩素诱导的SOCS3的表达。用AKT抑制物处理成神经瘤细胞也能够阻断汉黄芩素诱导的SOCS3的表达且呈现剂量依赖性。而当使用汉黄芩素处理成神经瘤细胞时,细胞内磷酸化AKT的水平从12h开始增加直到第48h,但72h时又出现了下降趋势[45]。通过这个试验也揭示了汉黄芩素能够对PI3K或者从其开始的信号通路的上游产生刺激,增加神经元细胞中SOCS3的表达。汉黄芩素对SOCS3的诱导效应是由PI3K调控的MAPK信号通路(AKT、ERK1/2、P38、JNK)的激活产生的。林芳等[44]通过构建携带SOCS3的溶瘤腺病毒AdCN305-SOCS3感染人肺癌H460细胞,发现过表达SOCS3的肿瘤细胞与对照组相比出现显著的细胞凋亡,并且STAT3的磷酸化受到显著抑制。因此,SOCS3能够通过对STAT3进行调控从而负向调控AKT的激活、抑制肿瘤细胞的生长和促进肿瘤细胞的凋亡。
3 前景展望SOCS3作为JNK/STAT3信号转导途径的重要负反馈调节蛋白,可下调STAT3的酪氨酸磷酸化从而抑制JAK/STAT3信号通路的激活,抑制了肿瘤细胞的生长。SOCS3与STAT3、AKT之间的相互作用模式见图 1。临床上通过直接靶向AKT从而抑制AKT的激活来进行肿瘤治疗已经成为一种非常有效的方法。而SOCS3可通过JNK/STAT3信号通路调控AKT的磷酸化激活,将来可以采用调控SOCS3的表达靶向AKT,为临床开发新的抗肿瘤药物提供一种新的思路。
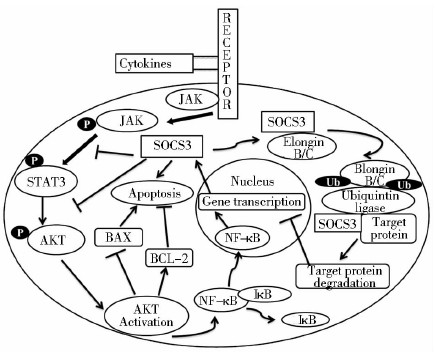
|
| 图 1 SOCS3与STAT3、AKT之间的相互作用模式图 Fig. 1 The diagram showing the interaction between STAT3 and AKT as well as the role of SOCS3 in the process |
| [1] | 王鲁建, 孙丽梅. 乳腺癌中AKT激活与耐药蛋白表达相关性. 中国组织化学与细胞化学杂志, 2012, 21(4): 401-405. Wang L J, Sun L M. AKT activation and breast cancer resistance protein expression correlated. Chinese Journal of Histochemistry and Cytochemistry, 2012, 21(4): 401-405. |
| [2] | 刘伦华, 楼丽广. 丝/苏氨酸蛋白激酶Akt及其靶向药物研究进展. 中国药理学通报, 2006, 22(1): 1-4. Liu L H, Lou L G. Advance in drug targeting serine/threonine protein kinase Akt. Chinese Phamacological Bulletin, 2006, 22(1): 1-4. |
| [3] | Yu Z B, Bai L, Qian P, et al. Restoration of SOCS3 suppresses human lung adenocarcinoma cell growth by down regulating activation of Erk1/2, Akt apart from STAT3. Cell Biol Int, 2009, 33(9): 995-1001. |
| [4] | Gardai S J, Hildeman D A, Frankel S K, et al. Phosphorylation of Bax Ser (184) by Akt regulates its activity and apoptosis in neutrophils. J Biol Chem, 2004, 279(20): 21085-21095. |
| [5] | Linseman D A, Butts B D, Precht T A, et al. Glycogen synthase kinase-3 beta phosphorylates bax and promotes its mitochondrial localziation during neuronal apoptosis. J Neurosci, 2004, 24(44): 9993-10002. |
| [6] | Zha J, Harada H, Yang E, et al. Serine phosphorylation of death agonist BAD in response to survival factor results in binding to 14-3-3 not BCL-XL. Cell, 1996, 87(4): 619-628. |
| [7] | 王维, 张琍. PI3K/Ak信号转导通路的研究进展. 现代医药卫生, 2010, 26(7): 1051-1052. Wang W, Zhang L. Progress pathway PI3K/Akt signal transduction. Modern Medicine & Health, 2010, 26(7): 1051-1052. |
| [8] | Restuccia D F, Hemmings B A. Blocking Akt-ivity. Science, 2009, 325(5944): 1083-1084. |
| [9] | 张超, 章雄文, 丁健. Akt-mTOR的互动与癌症的发生. 生命科学, 2007, 19(1): 21-26. Zhang C, Zhang X W, Ding J. Akt-mTOR interplaying and carcinogenesis. Chinese Bulletin of Life Sciences, 2007, 19(1): 21-26. |
| [10] | Kok K, Geering B, Vanhaesebroeck B. Regulation of phosphoinositide 3-kinase expression in health and disease. Trends Biochem Sci, 2009, 34(3): 115-127. |
| [11] | Gills J J, Dennis P A. The development of phosphatidylinositol ether lipid analogues as inhibitors of the serine/threonine kinase, Akt. Expert Opin Emerg Dr, 2004, 13(7): 787-797. |
| [12] | Scheid M P, Woodgett J R. Unravelling the activation mechanisms of protein kinase B/Akt. Febs Lett, 2003, 546(1): 108-112. |
| [13] | Mayo L D, Donner D B. The PTEN, Mdm2, p53 tumor suppressor-oncoprotein network. Trends Biochem Sci, 2002, 27(9): 462-467. |
| [14] | Ye B, Jiang L L, Xu H T, et al. Expression of PI3K/AKT pathway in gastric cancer and its blockade suppresses tumor growth and metastasis. Int J Immunopath Ph, 2012, 25(3): 627-636. |
| [15] | Hovelmann S, Beckers T L, Schmidt M. Molecular alterations in apoptotic pathways after PKB/Akt-mediated chemoresistance in NCI H460 cells. Brit J Cancer, 2004, 90(12): 2370-2377. |
| [16] | Yu L, Alva A, Su H, et al. Regulation of an ATG7-beclin 1 program of autophagic cell death by caspase-8. Science, 2004, 304(5676): 1500-1502. |
| [17] | Ren S, Gao C, Zhang L, et al. PI3K inhibitors changed the p53-induced response of Saos-2 cells from growth arrest to apoptosis. Biochem Bioph Res Co, 2003, 308(1): 120-125. |
| [18] | Yang W L, Wang J, Chan C H, et al. The E3 ligase TRAF6 regulates Akt ubiquitination and activation. Science, 2009, 325(5944): 1134-1138. |
| [19] | 梁若飞, 刘艳辉. PI3K/Akt/mTOR信号通路靶向治疗胶质细胞瘤研究进展. 中华神经外科疾病研究杂志, 2013, 12(4): 375-377. Liang R F, Liu Y H. Research progress of targeting PI3K/Akt/mTOR signaling pathway on glioma therapy. Chinese Journal of Department of Neurosurgery Disease Research, 2013, 12(4): 375-377. |
| [20] | Kubota N, Okada S, Inada T, et al. Wortmanin sensitizes human glioblastoma cell lines carrying mutant and wild type TP53 gene to radiation. Cancer Lett, 2000, 161(2): 141-147. |
| [21] | Hu L, Zaloudek C, Mills G B, et al. In vivo and in vitro ovarian carcinoma growth inhibition by a phosphatidylinositol 3- kinase inhibitor (LY294002). Clin Cancer Res, 2000, 6(3): 880-886. |
| [22] | Cheng Y, Zhang y, Zhang L, et al. MK-2206, a novel allosteric inhibitor of AKT, synergizes with gefitinib against malignant glioma via modulating both autophagy and apoptosis. Mol Cancer Ther, 2012, 11(1): 154-164. |
| [23] | Schnetzke U, Fischer M, Kuhn A K, et al. The E3 ubiquitin ligase TRAF6 inhibits LPS-induced AKT activation in FLT3-ITD-positive MV4-11 AML cells. J Cancer Res Clin Oncol, 2013, 139(4): 605-615. |
| [24] | Luo J, Manning, B D, Cantley L C. Targeting the PI3K-Akt pathway in human cancer: Rationale and promise. Cancer Cell, 2003, 4(4): 257-262. |
| [25] | 邢长英, 归绥琪. SOCS3作用机制与妇产科研究进展. 生殖与避孕, 2007, 27(4): 287-291. Xing C Y, Gui S Q. Research progress of SOCS3's mechanisms and obstetrics and gynecology. Journal of Reproduction & Contraception, 2007, 27(4): 287-291. |
| [26] | 牛丽娜, 陈显久. SOCS3结构和作用机制研究进展. 现代肿瘤医学, 2014, 22(11): 2757-2760. Niu L N, Chen X J. Research progress of SOCS3 on its structure and mechanisms. Journal of Modern Oncology, 2014, 22(11): 2757-2760. |
| [27] | 秦伟. 细胞因子信号转导抑制蛋白3与骨髓增殖性肿瘤关系的研究进展. 中国实验血液学杂志, 2010, 18(4): 1101-1104. Qin W. Research advances on relationship suppressor of cytokine signaling and myeloproliferative neoplasms. Journal of Experimental Hematology, 2010, 18(4): 1101-1104. |
| [28] | 薛帆, 崔雪薇, 张春东. 细胞因子信号传导抑制蛋白-3(SOCS-3)作用的研究进展. 中国当代医药, 2011, 18(4): 18-19. Xue F, Cui X W, Zhang C D. Research progress of SOCS3 on its function. Journal of China Modern Medicine, 2011, 18(4): 18-19. |
| [29] | 林娜, 姚晓光, 李南方. 细胞因子信号转导抑制因子3的研究进展. 中国医学科学院学报, 2012, 34(2): 178-182. Lin N, Yao X G, Li N F. Research advances in suppressor of cytokine signaling 3. Acta Academiae Medicinae Sinicae, 2012, 34(2): 178-182. |
| [30] | 李晟, 王大文, 朱诗建, 等. 细胞因子信号传导抑制蛋白-3在前列腺癌中作用的研究进展. 临床泌尿外科杂志, 2014, 29(9): 845-847. Li S, Wang D W, Zhu S J, et al. Research progress of suppressor of cytokine signaling-3 in prostate cancer. The Journal of Clinical Department of Urology, 2014, 29(9): 845-847. |
| [31] | Danielle L, Douglasj K R, Ilton H. SOCS proteins: negative regulators of cytokine signaling. Stem Cells, 2001, 19(5): 378-387. |
| [32] | Liu R Y, Zeng Y Y, Zhe Z. JAK/STAT3 signaling is required for TGF-beta-induced epithelial-mesenchymal transition in lung cancer cells. Int J Oncol, 2014, 44(5): 1643-1651. |
| [33] | Wang S W, Sun Y M. The IL-6/JAK/STAT3 pathway: potential therapeutic strategies in treating colorectal cancer (review). Int J Oncol, 2014, 44(4): 1032-1040. |
| [34] | Yang G L, Ma F, Zhong M X. Interleukin-11 induces the expression of matrix metalloproteinase 13 in gastric cancer SCH cells partly via the PI3K-AKT and JAK-STAT3 pathways. Mol Med Rep, 2014, 9(4): 1371-1375. |
| [35] | Lo H W, Cao X, Zhu H, et al. Constitutively activated STAT3 frequently with epidermal growth factor receptor in high-grade gliomas and targeting STAT3 sensitizes them to lressa and alkylators. Clin Cancer Res, 2008, 14(19): 6042-6054. |
| [36] | Wu K, Chang Q S, Lu Y J, et al. Gefitinib resistance resulted from STAT3-mediated Akt activation in lung cancer cells. Oncotarget, 2013, 4(12): 2430-2437. |
| [37] | Sharma D, Saxena N K, Vertino P M, et al. Leptin promotes the proliferative response and invasiveness in human endometrial cancer cells by activating multiple signal-transduction pathways. Endocr-related Cancer, 2006, 13(2): 629-640. |
| [38] | Saxena N K, Titus M A, Ding X, et al. Leptin as a novel profibrogenic cytokine in hepatic stellate cells: mitogenesis and inhibition of apoptosis mediated by extracellular regu-lated kinase (Erk) and Akt phosphorylation. Faseb J, 2004, 18(11): 1612-1614. |
| [39] | Bjorbaek C, El-Haschimi K, Frantz J D, et al. The role of SOCS-3 in leptin signaling and leptin resistance. J of Biol Chem, 1999, 274(42): 30059-30065. |
| [40] | Bjorbaek C, Elmquist J K, Frantz J D, et al. Identification of SOCS-3 as a potential mediator of central leptin resistance. Mol Cell, 1998, 1(4): 619-625. |
| [41] | Sharm D, Wang J, Ping P, et al. Adiponectin antagonizes the oncogenic actions of leptin in hepatocellular carcinogenesis. Hepatology, 2010, 52(5): 1713-1722. |
| [42] | Francipane M G, Eterno V, Spina V, et al. Suppressor of cytokine signaling 3 sensitizes anaplastic thyroid cancer to standard chemotherapy. Cancer Res, 2009, 69(15): 6141-6148. |
| [43] | Frobose H, Ronn S G, Heding P E, et al. Suppressor of cytokine signaling-3 inhibits interleukin-1 signaling by targeting the TRAF-6/TAK1 complex. Mol Endocrinol, 2006, 20(7): 1587-1596. |
| [44] | Yajima T, Murofushi Y, Zhou H B, et al. Absence of SOCS3 in the cardiomyocyte increases mortality in a gp130-dependent manner accompanied by contractile dysfunction and ventricular arrhythmias. Circulation, 2011, 124(24): 2690-2701. |
| [45] | Nam K W, Chae S, Song H Y, et al. The role of wogonin in controlling SOCS3 expression in neuronal cells. Biochem Bioph Res Co, 2014, 450(4): 1518-1524. |
| [46] | 林芳, 崔强, 钱程. 携带 SOCS-3 基因的溶瘤腺病毒的构建及体外抗肿瘤活性的研究. 浙江理工大学学报, 2008, 25(1): 106-112. Lin F, Cui Q, Qian C. Construction and in vitro studies carried SOCS-3 oncolytic adenovirus gene antitumor activity. Journal of Zhejiang Sci-Tech University, 2008, 25(1): 106-112. |
 2015, Vol. 35
2015, Vol. 35




