文章信息
- 万方, 张斌, 陈民良, 陈进聪, 陈雪岚
- WAN Fang, ZHANG Bin, CHEN Min-liang, CHEN Jin-cong, CHEN Xue-lan
- 比较pta及ack敲除对钝齿棒杆菌产L-精氨酸生理代谢的影响
- Comparsion of the Effects of pta and ack Deletion on Physiological Metabolism of L-arginine-producing Strain Corynebacterium crenatum
- 中国生物工程杂志, 2015, 35(9): 28-34
- China Biotechnology, 2015, 35(9): 28-34
- http://dx.doi.org/10.13523/j.cb.20150905
-
文章历史
- 收稿日期: 2015-05-18
- 修回日期: 2015-06-15
2 南昌大学生命科学学院 南昌 330031
2 College of Life Science, Nanchang University, Nanchang 330031, China
L-精氨酸是人和动物的半必需氨基酸,其在生物体中具有降低血氨、维持体内氮平衡的作用[1];作为NO的前体物质,具有舒张血管的功能[2];同时还可以通过增强机体免疫[3],预防癌症等。由于在生理功能方面扮演的重要角色,其在食品及医药工程中应用广泛。现今,微生物发酵是工业生产精氨酸的主要来源。随着全球L-精氨酸需求地不断增大,如何通过代谢工程进行分子育种选育高产L-精氨酸菌株成为研究的热点。目前,科研工作者主要通过加强精氨酸生物合成途径的代谢流量获得高产精氨酸菌株。例如,敲除负调控基因argR[4, 5];对精氨酸反馈抑制的关键酶基因argB进行定点突变,降低ArgB对精氨酸的敏感性[6];过表达L-精氨酸合成相关的基因簇argCJBDF-argGH[7]。此外,谷氨酸是精氨酸和脯氨酸生物合成共同竞争的前体物质,李小曼等[8]通过敲除编码γ-谷氨酰激酶的proB基因,从而使代谢通量流向精氨酸的合成途径,精氨酸产量达到了13.78g/L,较出发菌株提高了13.6%。因此,旁支代谢途径的切断,对L-精氨酸合成网络的集流是必要的。
L-精氨酸生物合成网络涉及糖酵解、磷酸戊糖途径和三羧酸循环(tricarboxylic cycle,TCA)等主要代谢途径。乙酰CoA不仅是TCA循环的前体物质[9],其还可以通过pta基因编码的磷酸乙酰基转移酶及ack基因编码的乙酸激酶合成乙酸[10]。因此,降低乙酰CoA的分解途径,提高其通往TCA循环的代谢通量是精氨酸集流的必要条件之一。本课题组前期通过基因组尺度代谢网络模型(genome scale metabolism network model,GSMN)预测提高精氨酸产量的64个敲除位点中,对代谢通量影响值较高的包括参与脯氨酸合成途径的proC、天冬氨酸合成的lysA、乙酸合成的pta和ack等基因。其中,pta对代谢通量的影响值为-118.16,ack对代谢通量的影响值为118.16,两者绝对值大小一致且影响较大,表明二者敲除都对精氨酸的合成有一定的促进作用。因此,本研究拟通过无痕敲除技术分别敲除pta和ack基因,比较二者分别敲除后对细胞生理代谢及精氨酸积累的影响,从中挑选更有利于提高精氨酸产量的敲除为后续工作服务。
1 材料与方法 1.1 材 料 1.1.1 菌株和质粒本实验所用的菌株和质粒见表 1。
| Strains and plasmids | Characteristics | Source |
| Strains | ||
| Escherichia coli DH5α | Clone host strain | Stored in our lab. |
| C. crenatum MT-M4 | C. crenatum with argR lethal mutation and argB site-directed mutation for over-producing L-arginine | Stored in our lab. |
| C.crenatum MT-M4 Δpta | C. crenatum MT-M4 with pta deletion | This study |
| C.crenatum MT-M4 Δack | C. crenatum MT-M4 with ack deletion | This study |
| Plasmids | ||
| pMD18-T | T-vector,2.7kb,AmpR,lacZ | TaKaRa Co. |
| pK18mobsacB | Mobilizable E. coli vector,KmR,sacB | Stored in our lab. |
| pK18mobsacB-Δpta | pK18mobsacB with the flanking regions of the C. crenatum MT-M4 pta gene | This study |
| pK18mobsacB-Δack | pK18mobsacB with the flanking regions of the C. crenatum MT-M4 ack gene | This study |
2×Taq Mix购自上海近岸科技有限公司;PCR产物纯化及切胶回收试剂盒购自北京赛百盛基因技术有限公司;质粒提取试剂盒购自Omega公司;T4 DNA ligase、限制性内切核酸酶(HindIII和XbaI)均购自TaKaRa公司;引物的合成及DNA测序由南京金斯瑞生物科技有限公司完成;其余试剂均为国产分析纯。
主要仪器包括培养箱、PCR仪、电泳仪、电转仪、冷冻离心机、紫外分光光度计、恒温摇床、酶标仪等。
1.1.3 培养基及培养条件LB培养基用于钝齿棒杆菌和大肠杆菌的培养。LB感受态培养基用于钝齿棒杆菌电转感受态细胞的制备,配方为含1% Tween80及3%甘氨酸的LB培养基;SOC培养基用于钝齿棒杆菌感受态细胞电转后的复苏,配方(g/L)如下:蛋白胨20,酵母粉5,葡萄糖3.6,氯化钠0.5,氯化镁0.95,氯化钾0.186,硫酸镁1.2。
种子培养基用于C. crenatum的扩大培养,其配方如下(g/L):葡萄糖 30,玉米浆 25,硫酸铵 45,磷酸二氢钾 0.5,MgSO4·7H2O 0.5,尿素 1.5,pH7.2,装液量30ml/250ml锥形瓶,115℃灭菌10min;发酵培养基用于L-精氨酸的发酵,其配方如下(g/L):葡萄糖 120,玉米浆 25,硫酸铵 45,磷酸二氢钾 0.05,MgSO4·7H2O 0.5,CaCO3 30,pH7.2,装液量25ml/250ml挡板三角瓶,115℃灭菌10min。
培养温度:大肠杆菌37℃,钝齿棒杆菌30℃。抗生素的工作浓度:氨苄青霉素100μg/ml,卡那霉素25μg/ml。
1.1.4 引物由于钝齿棒杆菌与谷氨酸棒杆菌DNA序列的高度同源(99%)[11],本研究根据谷氨酸棒杆菌全基因组(http://www.ncbi.nlm.nih.gov/nuccore/BX927147.1)序列信息,利用Oligo软件设计用于扩增pta和ack基因的上、下同源臂的引物,所有引物及测序工作均由南京金斯瑞生物科技有限公司完成。本实验所用引物见表 2。
| Primers | Sequences(5′-3′) | Restriction sites |
| pta-up-F | CGCAAGCTT GCTTCGATGGATTCGATTTGG | Hind III |
| pta -up-R | CTTGAGCAGCCAGTTTTCAAAGAGTTCGGCGCTCATGACTGGTTC | |
| pta -down-F | GAAAACTGGCTGCTCAAGAGCTAATGGCATTGGCAC | |
| pta -down-R | GCATCTAGAGGTGGAAGTGAGTGGAAGAAAC | Xba I |
| ack-up-F | CGCAAGCTTCTGAACAGCTTGGTGAAATCG | Hind III |
| ack-up-R | GAGTTCAAAACAAGTGCCAATGCCATTAGCTGCGTCCTCC | |
| ack-down-F | GGCATTGGCACTTGTTTTGAACTCTTCGCTTAGCTCTCCTGGTTAG | |
| ack-down-R | GCATCTAGATTGACTTTGGGCGAGTTAGG | Xba I |
| M13(-47) | CGCCAGGGTTTTCCCAGTCACGAC | |
| M13(RV-M) | GAGGGGATAACAATTTCACACAGG | |
| Note:Bold bases indicated restrict sites. Underlined bases indicated complementary sequences for overlap PCR | ||
以pta基因敲除质粒的构建为例,将C. crenatum MT-M4单菌落作为模板,采用引物对pta-up-F/pta-up-R和pta-down-F/pta-down-R分别通过PCR扩增pta的上下同源臂。利用PCR产物回收试剂盒回收pta的上下同源臂,并等摩尔数混合,以引物对pta-up-F/pta-down-R进行重叠PCR(overlap PCR),通过切胶回收获得pta同源片段。将此同源片段连接到pMD18-T载体上并导入E. coil DH5α感受态细胞,以M13通用引物筛选阳性克隆子,并进行测序验证。验证正确后,提取质粒,以Hind III和Xba I进行双酶切获得酶切后的pta同源片段,然后与经同样双酶切的pK18mobsacB进行酶连反应后导入E. coli DH5α感受态细胞。通过M13引物筛选阳性克隆子后利用质粒提取试剂盒提取质粒,获得pta基因敲除质粒pK18mobsacB-Δpta。
ack基因敲除质粒pK18mobsacB-Δack的构建如上所述。
1.2.2 pta与ack基因敲除菌株的构建pta与ack基因的敲除采用无痕敲除技术,第一次同源重组利用卡那霉素抗性作为正向筛选标记。第二次利用蔗糖致死基因sacB作为反向筛选标记。以pta敲除菌株的构建为例,具体方法如下:在电压3 000V、电击时间5ms的条件下进行电转,将敲除质粒pK18mobsacB-Δpta导入C. crenatum MT-M4感受态细胞。复苏后的感受态细胞涂布在含卡那霉素(10μg/ml)的LB平板上,通过引物对pta-up-F/pta-down-R筛选阳性单交换子。将此单交换子接种于5ml LB液体培养基,30℃、220r/min过夜培养,培养液稀释100倍后涂布于含10%蔗糖的LB平板,诱导第二次同源重组。通过引物对pta-up-F/pta-down-R筛选阳性双交换子,从而获得pta基因敲除菌株C. crenatum MT-M4 Δpta。
ack基因敲除菌株C. crenatum MT-M4 Δack的构建如上所述。
1.2.3 发酵实验将基因缺失菌株C. crenatum MT-M4 Δpta、C. crenatum MT-M4 Δack与出发菌株C. crenatum MT-M4划线培养至LB平板,30℃培养48h。挑取单菌落接种到5ml LB液体培养基,30℃、220r/min培养24h。取1ml菌液接种到30ml种子培养基,30℃、220r/min培养24h。以10%的接种量接种到25ml的发酵培养基,30℃、200r/min发酵108h,每隔12h取样200μl。
1.2.4 菌体生长量的测定将离心后的菌体加1ml 0.125mol/L HCl中和过量的CaCO3。稀释适当倍数后测定其OD562。按公式1OD=0.375g菌体计算干重[12]。
1.2.5 L-精氨酸产量的测定发酵液中L-精氨酸的测定采用改良的坂口试剂法[13]。将发酵液用超纯水稀释适当的倍数至250μl,然后加入1ml 0.375mol/L的NaOH及250μl的坂口试剂混匀,30℃水浴20min,测定其OD520。
1.2.6 葡萄糖含量的测定采用3,5-二硝基水杨酸(DNS)法[14]测定发酵液中的残糖量。将发酵液用超纯水稀释适当的倍数至1ml,加入750μl的DNS试剂沸水浴5min,迅速冷却至室温,再稀释适当的倍数后测定其OD540。
2 结 果 2.1 pta与ack基因敲除质粒的构建以C. crenatum MT-M4单菌落为模板,利用表 2中的引物通过PCR扩增获得长为385bp和477bp的pta上下同源臂,以及长为483bp和420bp的ack上下同源臂;再通过overlap PCR获得长为862bp的pta同源片段,以及长为903bp的ack同源片段。其琼脂糖凝胶电泳结果如图 1(a)和(c)所示。将同源片段切胶回收后,按1.2.1 方法所述获得敲除质粒pK18mobsacB-Δpta和pK18mobsacB-Δack。
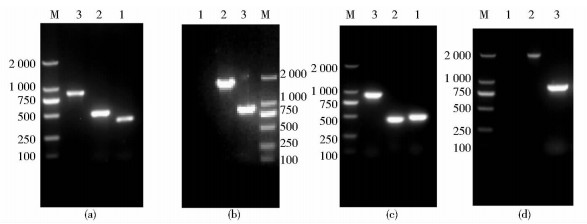
|
| 图 1 pta与ack基因敲除菌株的PCR鉴定 Fig. 1 The identification of the strains with the pta or ack deletion by PCR (a) M: DL2000 marker; 1: pta-up; 2: pta-down; 3: pta fusion fragment (b) M: DL2000 marker; 1: Negative control; 2: C. crenatum MT-M4; 3: C. crenatum MT-M4 Δpta (c) M: DL2000 marker; 1: ack-up; 2: ack-down; 3: ack fusion fragment (d) M: DL2000 marker; 1: Negative control; 2: C. crenatum MT-M4; 3: C. crenatum MT-M4 Δack |
敲除质粒pK18mobsacB-Δpta与pK18mobsacB-Δack通过电转的方式导入C. crenatum MT-M4,利用引物对pta-up-F/pta-down-R及ack-up-F/ack-down-R进行阳性双交换子的筛选。由于pta、ack基因的敲除,阳性双交换菌株仅能扩增到与同源臂片段长度一致的片段,分别为862bp、903bp;而对照组C. crenatum MT-M4则扩增到长度为1 811bp的包含完整pta的片段以及长为2 080bp包含完整ack基因的片段。琼脂糖凝胶电泳结果[图(1b)、(1d)]与预期结果一致,表明重组菌株C. crenatum MT-M4 Δpta与C. crenatum MT-M4 Δack构建成功。
2.3 C. crenatum MT-M4 Δpta、C. crenatum MT-M4 Δack与C. crenatum MT-M4 精氨酸发酵实验分析为了探究pta、ack基因敲除对钝齿棒杆菌生理代谢的影响,以出发株C. crenatum MT-M4为对照组,基因缺失菌株C. crenatum MT-M4 Δpta、C. crenatum MT-M4 Δack为实验组,在葡萄糖为唯一碳源的条件下进行摇瓶发酵实验,并比较两基因缺失菌株的菌体生长、精氨酸产量及葡萄糖消耗等的情况。如图 2(a)所示,C. crenatum MT-M4 Δpta与C. crenatum MT-M4 Δack的菌体生长速率基本一致,108h菌株生长量分别达到10.34g/L、10.20g/L,较出发菌株分别提高了9.19%、7.71%;图 2(b)所示,两基因缺失菌株C. crenatum MT-M4 Δpta、C. crenatum MT-M4 Δack与出发株C. crenatum MT-M4的葡萄糖消耗基本一致;如图 2(c)所示,C. crenatum MT-M4 Δpta、C. crenatum MT-M4 Δack的精氨酸产量较出发菌株分别提高了26.20%和12.81%,达15.46g/L和13.82g/L。由表 3可以看出,C. crenatum MT-M4 Δpta、C. crenatum MT-M4 Δack的葡萄糖转化率(yield on glucose)分别提高了29.41%、11.76%,产率(specific yield)分别提高了16.28%、4.65%。由此可见,pta、ack的敲除不仅有利于精氨酸的积累,同时能够促进细胞的生长及提高葡萄糖转化率;但pta的敲除更有利于碳源流向精氨酸的合成。
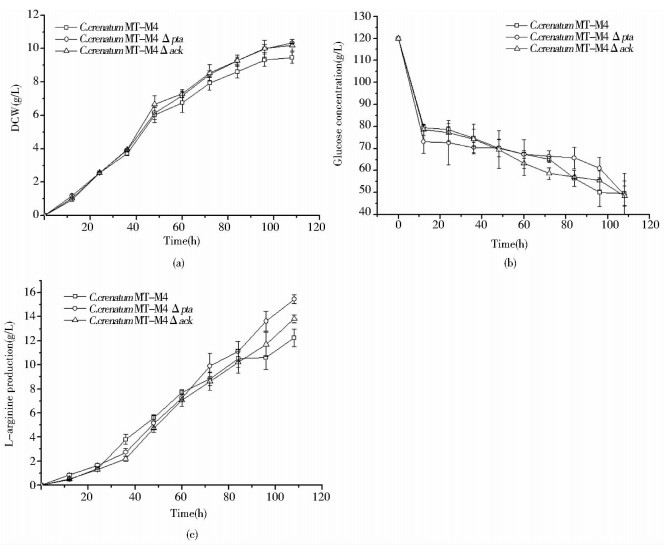
|
| 图 2 两基因缺失菌株与出发菌株L-精氨酸发酵的比较 Fig. 2 Comparison of L-arginine fermination between gene deletion strains and original strain (a) Cell concentration (b)Glucose concentration (c)L-arginine production |
| Strain | Maximum DCW (g/L) | Glucose consumed (g/L) | Maximum arginine (g/L) | Yield on glucose (g/g) | Specific yield (g/g) |
| C.crenatum MT-M4 | 9.47 ± 0.33 | 70.30 ± 5.65 | 12.25 ± 0.75 | 0.17 ± 0.03 | 1.29 ± 0.05 |
| C. crenatum MT-M4 Δpta | 10.34 ± 0.02 | 70.98 ± 9.64 | 15.46 ± 0.37 | 0.22 ± 0.05 | 1.50 ± 0.06 |
| C. crenatum MT-M4 Δack | 10.20 ± 0.35 | 71.50 ± 4.59 | 13.82 ± 0.33 | 0.19 ± 0.02 | 1.35 ± 0.06 |
GSMN模型作为重要的系统生物学分析工具,是以物种的全基因组序列和代谢通量分析方法为基础,构建基因-蛋白质-代谢反应三者的相互关系,并结合一系列的能量和前体代谢物的生化反应,重构模拟物种的代谢网络[15]。因此这为研究微生物的代谢网络,选育高产菌株提供了有力的育种手段。现今,许多科研工作者致力于基因组尺度代谢网络模型指导微生物的分子育种。例如,Huang等[16]对链霉菌在基因组尺度代谢通量分析指导的条件下进行gdhA的敲除以及dahp、accA2、zwf2的过表达,其FK506产量提高了47%; Li等[17]在GSMN模型分析的指导下对Bacillus subtilis进行ldh与pdhC基因的双敲除,其异丙醇产量提高了70%。本研究基于基因组尺度代谢网络模型的指导,对编码乙酸合成途径的两个酶的基因进行敲除,构建了pta和ack基因缺失菌株C. crenatum MT-M4 Δpta、C. crenatum MT-M4 Δack。发酵结果显示,其精氨酸产量分别提高了26.20%、12.81%。这说明通过GSMN对基因改造靶点的预测是准确的。这也为今后通过分子育种获得更高产精氨酸的钝齿棒杆菌提供了精确的指导。
pta和ack分别编码乙酸合成途径的两个重要酶--磷酸乙酰基转移酶和乙酸激酶。pta和ack基因的缺失,阻断了精氨酸合成的旁支代谢途径--乙酸合成途径,降低了乙酰CoA分解途径,这不仅有利于乙酰CoA流往TCA循环,为精氨酸的合成提供更多的前体物质α-酮戊二酸,而且也为精氨酸合成途径的第一步反应谷氨酸生成乙酰谷氨酸提供了更多的底物。因此,pta和ack基因的敲除均有利于精氨酸的合成。而pta的敲除更有利于精氨酸的积累,这可能是因为pta编码乙酸合成途径的第一个酶,它的敲除节约了更多碳流,使代谢通量更多的流向TCA循环,从而更有利于精氨酸的合成。
基因敲除可能会引起营养缺陷,从而抑制细胞的生长。例如,Kimura等[18]敲除了dtsR1基因,发现细胞生长急剧下降,这是由于该基因的缺失造成菌株成为脂肪酸营养缺陷型菌,需外源添加脂肪酸恢复细胞的生长。而本研究通过敲除pta、ack基因阻断乙酸合成途径,发现菌体生长不但没有受到抑制,反而有所提高了。究其原因可能是乙酸的合成会降低胞内pH,而钝齿棒杆菌生长的最适pH为6.5~7.0[19],且精氨酸的前体物质谷氨酸合成的关键酶谷氨酸脱氢酶在pH中性条件下酶活最高,而pH降到6.5时酶活下降近一半[20]。由此可见胞内pH对精氨酸合成具有显著影响。乙酸合成途径的阻断使得细胞内的pH维持在近中性范围,不仅有利于细胞进行各项生命活动从而促进细胞的生长,而且有利于精氨酸的合成。因此,结合基因组尺度代谢网络模型的预测,切断竞争之路,是实现一种既利于菌体生长又利于目的产物积累的分子育种方式。
| [1] | Batshaw M L, MacArthur R B, Tuchman M. Alternative pathway therapy for urea cycle disorders: twenty years late. The Journal of Pediatrics, 2001, 138(1): 46-55. |
| [2] | Ignarro L J, Buga G M, Wei L H, et al. Role of the arginine-nitric oxide pathway in the regulation of vascular smooth muscle cell proliferation. Proceedings of the National Academy of Sciences, 2001, 98(7): 4202-4208. |
| [3] | Zhu X, Pribis J P, Rodriguez P C, et al. The central role of arginine catabolism in T-cell dysfunction and increased susceptibility to infection after physical injury. Annals of Surgery, 2014, 259(1): 171-178. |
| [4] | Park S H, Kim H U, Kim T Y, et al. Metabolic engineering of Corynebacterium glutamicum for L-arginine production. Nature Communications, 2014, 5: 4618. |
| [5] | 陈雪岚,汤立,焦海涛,等. 钝齿棒杆菌argR基因缺失株的构建及其对精氨酸生物合成途径相关基因转录水平的影响. 微生物学报, 2013, 53(1): 92-98. Chen X L, Tang L, Jiao H T, et al. Construction of Corynebacterium crenatum AS 1. 542ΔargR and analysis of transcriptional levels of the related genes of arginine biosynthetic pathway. Acta Microbiologica Sinica, 2013, 53(1): 92-98. |
| [6] | Xu M, Rao Z, Dou W, et al. Site-directed mutagenesis and feedback-resistant N-acetyl-L-glutamate kinase (NAGK) increase Corynebacterium crenatum L-arginine production. Amino Acids, 2012, 43(1): 255-266. |
| [7] | Xu M, Rao Z, Yang J, et al. Heterologous and homologous expression of the arginine biosynthetic argC - H cluster from Corynebacterium crenatum for improvement of L-arginine production. Journal of Industrial Microbiology & Biotechnology, 2012, 39(3): 495-502. |
| [8] | 李小曼, 赵智, 张英姿, 等. γ-谷氨酰激酶基因敲除对产L-精氨酸钝齿棒杆菌8-193生理代谢的影响. 微生物学报, 2011, 51(11): 1476-1484. Li X M, Zhao Z, Zhang Y Z, et al. Effect of gamma-glutamyl kinase gene knock-out on metabolism in L-arginine-producing strain Corynebacterium crenatum 8-193. Acta Microbiologica Sinica, 2011, 51(11): 1476-1486. |
| [9] | Owen O E, Kalhan S C, Hanson R W. The key role of anaplerosis and cataplerosis for citric acid cycle function. Journal of Biological Chemistry, 2002, 277(34): 30409-30412. |
| [10] | Schmidt M, Schönheit P. Acetate formation in the photoheterotrophic bacterium Chloroflexus aurantiacus involves an archaeal type ADP-forming acetyl-CoA synthetase isoenzyme I. FEMS Microbiology Letters, 2013, 349(2): 171-179. |
| [11] | Dou W, Xu M, Cai D, et al. Improvement of L-arginine production by overexpression of a bifunctional ornithine acetyltransferase in Corynebacterium crenatum. Applied Biochemistry and Biotechnology, 2011, 165(3): 845-855. |
| [12] | Xu H, Dou W, Xu H, et al. A two-stage oxygen supply strategy for enhanced l-arginine production by Corynebacterium crenatum based on metabolic fluxes analysis. Biochemical Engineering Journal, 2009, 43(1):41-51. |
| [13] | Liang X H, Sun J L, Chen S L, et al. Determination L-arginine from grape juice with sakaguchi reaction. Advanced Materials Research, 2013, 662: 301-304. |
| [14] | Miller G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry, 1959, 31(3): 426-428. |
| [15] | 王晖, 马红武, 赵学明. 基因组尺度代谢网络研究进展. 生物工程学报, 2010, 26(10): 1340-1348. Hui W, Ma H W, Zhao X M. Progress in genome-scale metabolic network: a review. Chinese Journal of Biotechnology, 2010, 26(10): 1340-1348. |
| [16] | Huang D, Li S, Xia M, et al. Genome-scale metabolic network guided engineering of Streptomyces tsukubaensis for FK506 production improvement. Microbial Cell Factories, 2013,12(1): 1-18. |
| [17] | Li S, Huang D, Li Y, et al. Rational improvement of the engineered isobutanol-producing Bacillus subtilis by elementary mode analysis. Microbial Cell Factories, 2012,11(1): 101-122. |
| [18] | Kimura E, Abe C, Kawahara Y, et al. A dtsR gene-disrupted mutant of Brevibacterium lactofermentum requires fatty acids for growth and efficiently produces L-glutamate in the presence of an excess of biotin. Biochemical and Biophysical Research Communications, 1997, 234(1): 157-161. |
| [19] | 苏令鸣, 王宜敏, 刘铁敏,等. L-精氨酸产生菌的选育及其发酵条件的研究.工业微生物, 2002, 32(1): 1-4. Su L M, Wang Y M, Liu T M, et al. Studies on the breeding of L-arginine-producing mutant and its fermentation conditions. Industrial Microbiology, 2002, 32(1): 1-4. |
| [20] | Shiio I, Ozaki H. Regulation of nicotinamide adenine dinucleotide phosphate-specific glutamate dehydrogenase from Brevibacterium flavum, a glutamate-producing bacterium. J Biochem, 1970, 68(5): 633-647. |
 2015, Vol. 35
2015, Vol. 35




