文章信息
- 康学军, 杨怡姝
- KANG Xue-jun, YANG Yi-shu
- HIV-1潜伏感染体外实验模型研究进展
- Research Progress on in vitro Models of HIV-1 Latency
- 中国生物工程杂志, 2015, 35(8): 96-102
- China Biotechnology, 2015, 35(8): 96-102
- http://dx.doi.org/10.13523/j.cb.20150814
-
文章历史
- 收稿日期:2015-04-10
- 修回日期:2015-04-27
尽管高效抗逆转录病毒治疗(highly active antiretroviral therapy,HAART)可以有效地抑制人免疫缺陷病毒I型(human immunodeficiency virus type 1,HIV-1)的复制及血浆病毒载量,延缓发病进程,提高患者生存质量,但不能从根本上治愈艾滋病(acquired immunodeficiency syndrome,AIDS)。HIV-1在体内建立的潜伏感染是清除病毒的一个重要障碍[1]。为减少HIV-1潜伏感染的病毒储存库,一方面需要了解HIV-1潜伏感染的建立和维持机制,从而阻断潜伏感染的建立;另一方面采用潜伏感染再激活剂(latency reactivation agent,LRA)诱导潜伏病毒表达,使其被病毒或免疫介导的机制破坏,以实现清除潜伏感染储存库的目的[2, 3]。因此采用HIV-1潜伏感染模型研究潜伏的机制及筛选LRA是目前艾滋病研究的一个重要领域。采用猴免疫缺陷病毒(simian immunodeficiency virus,SIV)感染非人灵长类动物或HIV-1感染人源化小鼠建立的潜伏感染模型虽提供了有价值的信息[4, 5, 6],但因受到动物来源稀少、价格昂贵、操作复杂等因素影响,难以大规模开展应用。采用永生化细胞系或原代细胞建立的体外HIV-1 潜伏感染模型,目前广泛应用于研究HIV-1潜伏感染的建立、维持机制或筛选评价LRA中。
1 永生化细胞系实验模型HIV-1潜伏感染的最初证据来自体外感染的永生化细胞系。存活的感染细胞低表达或不表达HIV-1基因,但当受到各种刺激(如T细胞活化)后,HIV-1基因表达可以上调。如HIV-1慢性感染U937细胞或A3.01细胞,分别衍生得到的U1细胞或ACH2细胞。在这两种实验体系中,分别存在反式激活蛋白(transactivator,Tat)蛋白H13L突变[7, 8]或反式激活应答元件(trans-activation response,TAR)结构突变[7, 9],削弱了Tat蛋白反式激活HIV-1原病毒基因组转录延伸的作用,促进了HIV-1潜伏感染的建立。在这些慢性感染的细胞系中约90%~98%的细胞携带HIV-1原病毒,但并不表达病毒蛋白。由于存在Tat或TAR突变,使得这两个潜伏模型用于研究体内潜伏感染存在一些争议,不过这些突变也证实了转录抑制是建立和保持HIV-1潜伏感染的关键。此外,这些传代细胞系慢性感染模型目前仍广泛用于筛选与评价LRA[10, 11, 12, 13]及探讨潜伏感染机制等的研究[14, 15, 16, 17]。
另一个常用的潜伏感染模型是J-Lat模型[18]。该模型由表达绿色荧光蛋白(green fluorescent protein,GFP)的HIV感染Jurkat细胞衍生而来,感染后首先经流式分选GFP阴性的细胞,即未感染细胞及含转录沉默原病毒的细胞,之后用12-氧-十四烷酰佛波醇-13-乙酸酯(12-O-tetradecanoyl-phorbol-13-acetate,TPA)或肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)活化,流式分选GFP阳性的细胞,即可被再激活的潜伏感染细胞。这部分细胞约占最初细胞群的0.06%以内,当细胞不受刺激时,基本处于转录沉默状态,无GFP表达。在该模型中,HIV-1启动子对Tat的刺激没有反应性,潜伏感染形成的原因主要是HIV-1原病毒整合在或邻近异染色质区域,即HIV-1原病毒整合位点处的染色质环境在转录起始水平就阻断了原病毒的转录。根据整合位置的不同,J-Lat模型又可形成多种亚细胞克隆。J-Lat模型目前仍广泛用于HIV-1潜伏感染机制及高通量筛选LRA的研究中[15, 19, 20, 21]。亦有研究者在 J-Lat模型的基础上,采用双色荧光报告病毒分析潜伏感染的形成机制[22]。
HIV-1原病毒的活化状态与感染细胞的活化状态密切相关,体内最主要的潜伏感染细胞是处于静息期不分裂的记忆性CD4+ T淋巴细胞。采用可持续分裂增殖的永生化细胞,能否反映体内HIV-1潜伏感染的本质还值得探讨。与传代细胞系相比,原代人细胞可能更准确地反映患者来源的潜伏感染细胞,所以有必要在原代人细胞中建立HIV-1的潜伏感染模型。
2 静息CD4+ T细胞潜伏感染模型2005年Swiggard等[23]首先采用阴性选择方法分离纯化处于G0/G1a期、未受活化刺激的静息CD4+ T细胞。阴性选择法可以避免活化T细胞或污染树突状细胞。之后采用离心接种方式,用具有复制能力的HIV-1毒株直接感染分离得到的静息CD4+ T细胞,建立HIV-1感染及潜伏感染。该模型中有0.3%的细胞表达HIV-1 p24蛋白,呈现产毒性感染。用αCD3/αCD28抗体刺激后,可诱导4.5%的细胞表达HIV-1 p24蛋白,即再激活了潜伏的HIV-1感染。与体内感染相比,在该体外系统中的病毒整合水平和潜伏感染水平较高,这可能与采用离心方式高水平接种病毒有关。本模型证明了HIV-1可直接在G0/G1a期静息CD4+ T细胞中建立潜伏感染,推测在体内T细胞未受到活化时也可形成潜伏病毒库。
为提高HIV-1感染静息CD4+ T细胞的效率,Saleh等[24]在分离得到静息CD4+ T细胞后,使用CCR7配体(CCL19及CCL21)进行刺激,虽不诱导活化标志物CD69或CD25表达,但可以增加静息CD4+ T细胞对HIV-1的易感性,促进病毒感染及潜伏的形成。该模型的优点是重复性好、HIV-1原病毒整合率高、病毒复制程度有限、T细胞不活化等,是评价组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)类化合物再激活潜伏感染的作用强度、毒性及作用机制的良好模型[25]。随后有研究者[26]采用CXCL9、CXCL10和CCL20等趋化因子处理静息CD4+ T细胞。它们介导的效应与CCL19和CCL21相似,均不直接活化静息CD4+ T细胞,也不改变其他趋化因子受体的表达;但却可通过诱导肌动蛋白素的去磷酸化及肌动蛋白多聚化的改变,允许HIV-1在静息CD4+ T细胞进行有效的核定位及整合,促进病毒的感染与潜伏。
2012年Greene等采用阴性选择技术,从未感染志愿者外周血中分离静息记忆CD4+ T细胞[27]。以离心接种的方法感染可表达Luciferase或mCherry的NL4-3毒株,感染后的细胞在含5μmol/L沙奎那韦(Saquinavir)条件下培养3天,阻止残留的病毒播散感染。当此模型受T细胞活化剂刺激时,可迅速再激活HIV-1表达,明确了多种潜伏感染的再激活剂。如豆蔻酸-佛波醇-乙酸酯(phorbol-12-myristate-13-acetate,PMA)或离子霉素(Ionomycin)等刺激后,Luciferase活性可升高61~248倍,mCherry表达亦可升高7.3倍。
3 活化的CD4+ T细胞潜伏感染模型原代静息CD4+ T细胞是研究潜伏感染的适宜细胞。但由于静息细胞中缺乏能够有效激活转录的细胞转录因子及dNTP等,导致HIV-1的反转录过程及整合过程受阻,使得这些细胞不易被HIV-1直接感染,在体外难以得到足够的潜伏感染细胞用于大规模研究。因此,有研究者采用一轮或多轮刺激,活化CD4+ T细胞,使之对HIV-1易感。之后,在特定培养条件下,促进感染的活化CD4+ T细胞回复到静息状态。该过程也与体内HIV-1优先在活化的CD4+ T细胞中复制,部分感染的CD4+ T细胞存活下来,回到静息记忆状态,不再表达病毒基因,形成潜伏感染的过程相类似(图 1)。
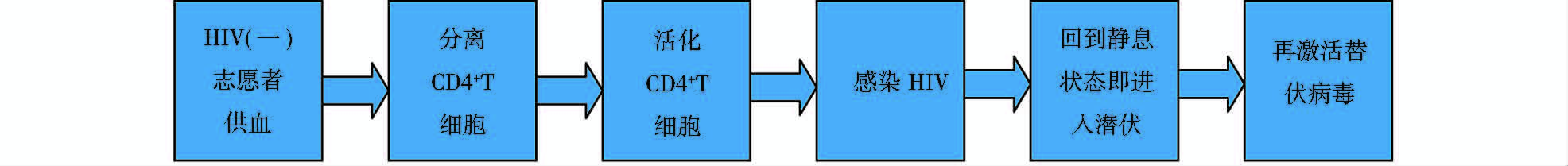
|
| 图 1 活化的CD4+ T细胞潜伏感染模型构建流程 Fig. 1 The construction of in vitro HIV-1 latency model with activated CD4+ T cells |
2006年Sahu等[28]从HIV-1阴性志愿者血中分离纯化CD4+ T细胞,用CD3抗体及IL-2刺激活化,获得CD4+ CD69+ CD25+ HLA-DR+ 表型的活化CD4+ T细胞。采用有复制能力的HIV-1毒株,以感染复数(multiplicity of infection,moi)为1~10感染上述活化的CD4+ T细胞。HIV-1感染3~4天以后,10%的细胞为产毒性感染。随后与贴壁的脑瘤细胞H80共培养2个月,促进感染的细胞进入静息状态,建立潜伏感染。一般情况下,CD4+ T细胞在体外活化后,最初DNA合成增加,细胞数量增加,细胞进行增殖。但当细胞分裂5~6次之后,细胞分裂减慢,10%~20%的细胞死亡;培养3天后,死细胞比例逐渐增高。为避免细胞死亡,在该模型中采用H80细胞作为饲细胞,保持CD4+ T细胞存活,促进感染的活化CD4+ T细胞回复到静息状态。不过,在H80饲细胞上培养的CD4+ T细胞胞体比完全活化的CD4+ T细胞小,但又比从血中新鲜分离到的静息T细胞大。对这些细胞表面的活化标志物进行分析显示,部分为CD69- CD25- HLA-DR- 细胞,即静息细胞;部分为CD69+ CD25- HLA-DR- 细胞,即表达早期活化标志物的半静息状态细胞,后者并非处于真正的静息状态。在该模型中,使用的毒株是具有复制能力的HIV-1毒株,潜伏感染的建立与Tat/TAR突变无关,潜伏感染形成的机制不同于由永生化细胞系建立的潜伏感染。在每一百万个培养细胞中约有5×104个潜伏感染细胞,即潜伏感染细胞的产率为5%,该比例比HIV-1感染者体内的潜伏感染比例高103~104倍。此外,在该模型中约8%的细胞内可检测到HIV-1 p24蛋白表达,提示某些长寿的静息记忆T细胞中,存在持续低水平的HIV-1产毒感染,即该模型同时存在HIV-1产毒感染和潜伏感染。当用蛋白激酶C(protein kinase C,PKC)激活剂,如0.5 μmol/L prostratin 处理,可再激活潜伏感染,使表达HIV-1 p24蛋白的细胞上升2倍。
2008年Marini等[29]模拟体内CD4+ T细胞的活化条件,采用抗原负载的单核细胞来源树突状细胞(Antigen-loaded Monocyte-derived dendritic cells,Ag-MDDC)活化原代CD4+ T细胞,之后感染具有复制能力的HIV-1毒株,采用磁珠阴性选择技术去除未感染的细胞以及感染的静息细胞,富集活化的具有记忆表型的感染细胞(CD45RO+ CD62L+ CCR7+ )。在存在IL-7条件下继续培养,促进细胞回到静息状态,建立潜伏感染。与Sahu模型相比,本模型采用低moi(0.02)进行染毒,可引发病毒复制但不显著影响细胞的活力。加入IL-7后不诱导细胞增殖,却可避免细胞死亡,促进回到静息状态。该潜伏模型中,细胞不表达与活化或增殖相关的标志物,病毒复制亦停止。采用针对CD3/CD28的单抗或抗原刺激,可激活潜伏感染。本模型适于研究HIV-1潜伏感染的建立和再激活机制,以及HIV-1潜伏感染细胞表面的标志物[30]。该模型的不足在于活细胞为最初的20%,产生的潜伏感染细胞产率仅为2%,无法满足高通量筛选研究的需求。此外,有研究显示IL-7可活化潜伏HIV-1,因此利用IL-7促进活化细胞回到静息状态是否影响潜伏感染还存在疑问[31]。
2009年有研究者[32, 33]首先从健康志愿者外周血单核细胞中分离得到高纯度的幼稚CD4+ T细胞,采用CD3/CD28抗体使之活化后,在不同的条件下分别诱导分化成Th1,Th2或非极性化细胞群(non-polarized T cell,NP)。其中Th1和Th2群与体内的效应型记忆T细胞(effector memory T cell,TEM)和中央型记忆T细胞(central memory T cell,TCM)都比较接近,而NP群则更接近于TCM。NP与新鲜分离的TCM的区别在于NP再现了幼稚细胞标志物CD45RA,并与记忆细胞标志物CD45RO共表达。不同于前两个潜伏实验模型,本模型采用离心接种方式感染复制缺陷型HIV-1病毒(defective human immunodeficiency virus,DHIV)。之后在IL-2条件下培养回到静息状态,建立潜伏感染。该潜伏状态可被CD3/CD28抗体刺激再激活。与常规的病毒感染方式相比,采用离心方法进行感染,大大提高了DHIV病毒的感染效率。理论上DHIV可进入细胞完成反转录、整合过程,并能表达除env之外的基因,但不能产生具有感染性的子代病毒颗粒,不能播散感染。因此,当细胞受到CD3/CD28抗体刺激后,细胞内表达p24蛋白应该是病毒再激活的明确标志。不过近年来有研究者发现尽管使用的是复制缺陷型病毒,但是由于重组,仍可产生具有复制能力的病毒,并观察到了感染播散[34]。这项发现推动了对采用该潜伏模型得到的研究资料进行再分析及对缺陷病毒生物安全性的再评估。此外,本模型中在IL-2条件下培养感染活化的CD4+ T细胞,但鉴于IL-2可活化潜伏的HIV-1,不能确定IL-2是否干扰了这些细胞的静息状态[35]。与其他模型相比,该模型建立时间缩短至一个月,可用于导致病毒再激活的信号通路,原代细胞中病毒启动子的甲基化状态及评价 LRA再激活作用等的研究[36, 37]。
2009年Yang等[38]采用αCD3/αCD28/IL-2混合物活化从外周血中分离得到原代CD4+ T细胞后,转导携带Bcl-2的慢病毒载体EB-FLV,在不加入细胞因子刺激或饲细胞的条件下培养淘汰死亡细胞,使CD4+ T细胞进入长寿的静息状态,获得的细胞类似于效应记忆细胞TEM。细胞再次活化后,感染可表达GFP的复制缺陷型毒株NL4-3-△vpr-△env-drEGFP。在无细胞因子及其他刺激下培养4天后,最初表达GFP的细胞有20%~30%转为GFP阴性。流式分选GFP阴性细胞,富集潜伏感染的细胞。在此模型中,潜伏感染的细胞处于G0/G1期,表型与TEM高度一致,高水平表达CD45RO,低表达CCR7。潜伏状态下,GFP表达率为0.2%,当用CD3/CD28抗体再激活潜伏感染时,可诱导1%~3%的细胞表达GFP。由于NL4-3-△vpr-△env-drEGFP毒株中的LTR、rev、tat基因未改变,此模型中的再激活信号通路保持完整,可用于CD4+ T细胞中LRA的筛选[39, 40, 41]。
2010年Tyagi参考Yang/Siliciano和Sahu模型[42],采用αCD3/αCD28/IL-2混合物活化CD4+ T细胞,感染携带GFP或mCherry报告基因的HIV-1毒株,流式分选感染的细胞,与H80饲细胞共培养,促进感染细胞进入转录沉默状态,建立潜伏感染。该模型中的潜伏感染细胞呈静息中央记忆细胞TCM表型。不过,尽管这些细胞不分裂,但仍可掺入溴脱氧尿苷(bromodeoxyuridine,Brdu),表达中等水平的增殖细胞相关的核抗原Ki67,即不处于完全的静息状态。
以上各活化的CD4+T细胞潜伏感染模型的比较见表 1所示。
| 1)Th1: CD45RO+ CCR5+,2)Th2:: CD45RO+ CD294+,3)NP: CD45RO+ CCR5+ CD62L+ CD27+ CD127+ | |||||||||
| 模型 | CD4+ T细胞活化物 | HIV毒株类型/moi | 感染后培养条件 | 潜伏细胞表型 | 产率 | 再激活标志物 | 周期(月) | 应用 | 参考文献 |
| Sahu | αCD3抗体/IL-2 | 有复制能力的HIV毒株/1~10 | H80饲细胞 | CD69+/-CD25- HLA-DR - | >5% | p24 | 2 | 评价LRA | [28] |
| Marini | Ag-MDDC | 复制能力的HIV毒株/0.02 | IL-7 | CD45RO+CD62L+ CCR7+ | 2% | p24 | 2 | 潜伏感染的建立及再激活机制 | [29, 30] |
| Bosque | αCD3/αCD28抗体 | 复制能力的HIV毒株/50 | IL-2 | Th11)/Th22)/NP3) | 11%Th1/40%Th2/3%NP | p24 | 1 | 再激活的信号通路,评价LRA | [32, 33, 36, 37] |
| Yang | αCD3/αCD28/IL-2 | 复制缺陷型毒株NL4-3-△6-drEGFP/<0.1 | Bcl-2 | CD45RO+RAdim CCR7dim CD25dim | 1~3% | GFP/mCherry | >3 | LRA筛选 | [38, 39, 40, 41] |
| Tyagi | αCD3 /αCD28抗体/IL-2 | Δgag HIV载体/未注明 | αCD3/αCD28/IL-2 | CD45RA-CD45RO+ CD27lowCCR7lowCD38+ CD25- | 20% | GFP/mCherry | <1 | 潜伏感染的建立及再激活机制,LRA筛选 | [42] |
综上所述,目前HIV-1潜伏感染体外实验模型主要是采用野生型或缺陷型HIV-1病毒感染永生化细胞系、静息或活化的CD4+ T细胞。但是HIV-1感染者体内的潜伏感染细胞类型众多,除静息记忆CD4+ T细胞外,还涉及巨噬细胞、小胶质细胞、树突状细胞等。此外,在体内HIV-1潜伏感染的建立是一个复杂的过程,受到病毒和细胞多种因素的调控。因此,单一的潜伏模型不能满足研究的需求。而且在某特定模型中确定的潜伏感染再激活剂,在其他模型中或患者体内未必有再激活作用[43, 44]。分析其原因可能是不同的潜伏模型使用的T细胞亚群不同、驱动病毒再激活的细胞信号通路不同、使用的毒株的遗传组成不同,使用的细胞增殖状态不同等。为更全面了解HIV-1潜伏感染库及再激活剂的作用,还需进一步建立和完善适宜的体内及体外研究模型。
| [1] | Chun T W, Fauci A S. HIV reservoirs: pathogenesis and obstacles to viral eradication and cure. AIDS, 2012, 26(10): 1261-1268. |
| [2] | Kent S J, Reece J C, Petravic J, et al. The search for an HIV cure: tackling latent infection. Lancet Infect Dis, 2013, 13(7): 614-621. |
| [3] | Sgarbanti M, Battistini A. Therapeutics for HIV-1 reactivation from latency. Curr Opin Virol, 2013, 3(4): 394-401. |
| [4] | Deere J D, Schinazi R F, North T W. Simian immunodeficiency virus macaque models of HIV latency. Curr Opin HIV AIDS, 2011, 6(1): 57-61. |
| [5] | Marsden M D, Kovochich M, Suree N, et al. HIV latency in the humanized BLT mouse. J Virol, 2012, 86 (1): 339-347. |
| [6] | Brooks D G, Kitchen S G, Kitchen C M, et al. Generation of HIV latency during thymopoiesis. Nat Med, 2001, 7(4): 459-464. |
| [7] | Cannon P, Kim S H, Ulich C, et al. Analysis of Tat function in human immunodeficiency virus type 1-infected low level-expression cell lines U1 and ACH-2. J Virol, 1994, 68(3): 1993-1997. |
| [8] | Emiliani S, Fischle W, Ott M, et al. Mutations in the tat gene are responsible for human immunodeficiency virus type 1 postintegration latency in the U1 cell line. J Virol, 1998, 72(2): 1666-1670. |
| [9] | Emiliani S, Lint C V, Fischle W, et al. A point mutation in the HIV-1 Tat responsive element is associated with postintegration latency. Proc Natl Acad Sci USA, 1996, 93(13): 6377-6381. |
| [10] | Barquero A A, Davola M E, Riva D A, et al. Naturally occurring compounds elicit HIV-1 replication in chronically infected promonocytic cells. BioMed Research International, 2014,989101. |
| [11] | Fonteh P, Meyer D. In vitro reactivation of latent HIV-1 by cytostatic bis(thiosemicarbazonate) gold(III) complexes. BMC Infectious Diseases, 2014, 14: 680. |
| [12] | Doyon G, Sobolewski M D, Huber K, et al. Discovery of a small molecule agonist of phosphatidylinositol 3-kinase p110α that reactivates latent HIV-1. PLoS One, 2014, 9(1): e84964. |
| [13] | Sahu G K, Sango K, Selliah N, et al. Anti-HIV designer T cells progressively eradicate a latently infected cell line by sequentially inducing HIV reactivation then killing the newly Gp120-positive cells. Virology, 2013, 446:268-275. |
| [14] | Park J, Lim C H, Ham S, et al. Genome-wide analysis of histone modifications in latently HIV-1 infected T cells. AIDS, 2014, 28(12): 1719-1728. |
| [15] | Patel P, Ansari M Y, Bapat S, et al. The microRNA miR-29a is associated with human immunodeficiency virus latency. Retrovirology, 2014, 11(1): 108. |
| [16] | Bhaskar A, Munshi M, Khan S Z, et al. Measuring glutathione redox potential of HIV-1-infected macrophages. J Biol Chem, 2015, 290(2): 1020-1038. |
| [17] | Vemula S V, Veerasamy R, Ragupathy V, et al. HIV-1 induced nuclear factor I-B(NF-IB) expression negatively regulates HIV-1 replication through interaction with the long terminal repeat region. Viruses, 2015, 7(2): 543-558. |
| [18] | Jordan A, Bisgrove D, Verdin E. HIV reproducibly establishes a latent infection after acute infection of T cells in vitro. EMBO J, 2003, 22(8): 1868-1877. |
| [19] | Barton K M, Archin N M, Keedy K S, et al. Selective HDAC inhibition for the disruption of latent HIV-1 infection. PLoS One, 2014, 9(8): e102684. |
| [20] | Anderson I, Low J S, Weston S, et al. Heat shock protein 90 controls HIV-1 reactivation from latency. Proc Natl Acad Sci USA, 2014, 111(15): 1528-1537. |
| [21] | Abreu C M, Price S L, Shirk E N, et al. Dual role of novel ingenol derivatives from Euphorbia tirucalli in HIV replication: inhibition of de novo infection and activation of viral LTR. PLoS One, 2014, 9(5): e97257. |
| [22] | Dahabieh M S, Ooms M, Brumme C, et al. Direct non-productive HIV-1 infection in a T-cell line is driven by cellular activation state and NF-κB. Retrovirology, 2014, 11(1): 17. |
| [23] | Swiggard W J, Bayto P C, Yu J J, et al. Human immunodeficiency virus type 1 can establish latent infection in resting CD4+ T cells in the absence of activating stimuli. J Virol, 2005, 79(22): 14179-14188. |
| [24] | Saleh S, Solomon A, Wightman F, et al. CCR7 ligands CCL19 and CCL21 increase permissiveness of resting memory CD4+ T cells to HIV-1 infection: a novel model of HIV-1 latency. Blood, 2007, 110(13): 4161-4164. |
| [25] | Margolis D M. Histone deacetylase inhibitors and HIV latency. Curr Opin HIV AIDS, 2011, 6 (1): 25-29. |
| [26] | Cameron P U, Saleh S, Sallmann G, et al. Establishment of HIV-1 latency in resting CD4+ T cells depends on chemokine-induced changes in the actin cytoskeleton. Proc Natl Acad Sci USA, 2010, 107(39): 16934-16939. |
| [27] | Lassen K G, Hebbeler A M, Bhattacharyya D, et al. A flexible model of HIV-1 latency permitting evaluation of many primary CD4+ T-cell reservoirs. PLoS One, 2012, 7: e30176. |
| [28] | Sahu G K, Lee K, Ji J, et al. A novel in vitro system to generate and study latently HIV infected long-lived normal CD4+ T-lymphocytes. Virology, 2006, 355(2): 127-137. |
| [29] | Marini A, Harper J M, Romerio F. An in vitro system to model the establishment and reactivation of HIV-1 latency. J Immunol, 2008, 181(11): 7713-7720. |
| [30] | Iglesias-Ussel M, Vandergeeten C, Marchionni L, et al. High levels of CD2 expression identify HIV-1 latently infected resting memory CD4+ T cells in virally suppressed subjects. J Virol, 2013, 87(16): 9148-9158. |
| [31] | Wang F X, Xu Yan, Sullivan J, et al. IL-7 is a potent and proviral strain-specific inducer of latent HIV-1 cellular reservoirs of infected individuals on virally suppressive HAART. J Clin Invest, 2005, 115(1): 128-137. |
| [32] | Bosque A, Planelles V. Induction of HIV-1 latency and reactivation in primary memory CD4+ T cells. Blood, 2009, 113(1): 58-65. |
| [33] | Bosque A, Famiglietti M, Weyrich A S, et al. Homeostatic proliferation fails to efficiently reactivate HIV-1 latently infected central memory CD4+ T cells. PLoS Pathog, 2011, 7: e1002288. |
| [34] | Bonczkowski P, Spiegelaere W D, Bosque A, et al. Replication competent virus as an important source of bias in HIV latency models utilizing single round viral constructs. Retrovirology, 2014, 11: 70. |
| [35] | Mitsuyasu R T. The potential role of interleukin-2 in HIV-1. AIDS, 2001, 15: 22-27. |
| [36] | Mejia E J, Loveridge S T, Stepan G, et al. Study of marine natural products including resorcyclic acid lactones from Humicola fuscoatra that reactivate latent HIV-1 expression in an in vitro model of central memory CD4+ T cells. J Nat Prod, 2014, 77(3): 618-624. |
| [37] | Wei D G, Chiang V, Fyne E, et al. Histone deacetylase inhibitor romidepsin induces HIV expression in CD4+ T cells from patients on suppressive antiretroviral therapy at concentrations achieved by clinical dosing. PLoS Pathog, 2014, 10(4): e1004071. |
| [38] | Yang H C, Xing S F, Shan L, et al. Small-molecule screening using a human primary cell model of HIV latency identifies compounds that reverse latency without cellular activation. J Clin Invest, 2009, 119(11): 3473-3486. |
| [39] | Shan L, Xing S F, Yang H C, et al. Unique characteristics of histone deacetylase inhibitors in reactivation of latent HIV-1 in Bcl-2-transduced primary resting CD4+ T cells. J Antimicrob Chemother, 2014, 69(1): 28-33. |
| [40] | Shan L, Deng K, Shroff N S, et al. Stimulation of HIV-1 specific cytolytic T-lymphocytes facilitates elimination of latent viral reservoir after virus reactivation. Immunity, 2012, 36(3): 491-501. |
| [41] | Planelles V, Wolschendorf F, Kutsch O. Facts and fiction: cellular models for high throughput screening for HIV-1 reactivating drugs. Curr HIV Res, 2011, 9 (8): 568-578. |
| [42] | Tyagi M, Pearson R J, Karn J. Establishment of HIV latency in primary CD4+ cells is due to epigenetic transcriptional silencing and P-TEFb restriction. J Virol, 2010, 84(13): 6425-6437. |
| [43] | Spina C A, Anderson J, Archin N M, et al. An in-depth comparison of latent HIV-1 reactivation in multiple cell model systems and resting CD4+ T cells from aviremic patients. PLoS Pathog, 2013, 9: e1003834 |
| [44] | Sahu G, Cloyd M. Latent HIV in primary T lymphocytes is unresponsive to histone deacetylase inhibitors. J Virol, 2011, 8: 400-406. |
 2015, Vol. 35
2015, Vol. 35




