文章信息
- 黄鹏, 李文姝, 谢君, 鲍建瑛, 曹晓娥, 余龙, 徐一新
- HUANG Peng, LI Wen-shu, XIE Jun, BAO Jian-ying, CAO Xiao-e, YU Long, XU Yi-xin
- 人源类溶菌酶蛋白6在毕赤酵母中的重组表达及活性分析
- Expression of Human Lysozyme-like Protein 6 in Pichia pastoris and Analysis of Enzymatic Activity of the Protein
- 中国生物工程杂志, 2015, 35(8): 30-37
- China Biotechnology, 2015, 35(8): 30-37
- http://dx.doi.org/10.13523/j.cb.20150805
-
文章历史
- 收稿日期:2015-07-10
2. 上海健康医学院药学院 上海 200237;
3. 上海纽约大学文理学部 上海 200122;
4. 复旦大学遗传工程国家重点实验室 上海 200433
2. College of Pharmacy, Shanghai University of Medicine and Health Sciences, Shanghai 200237, China;
3. College of Arts and Sciences, New York University, Shanghai 200122, China;
4. State Key Laboratory of Genetic Engineering, Fudan University, Shanghai 200433, China
溶菌酶是1922年由英国科学家Fleming首先在人的唾液、眼泪和鼻粘液中发现的,其可通过水解细菌细胞壁肽聚糖的N-乙酰胞壁酸C-1与N-乙酰氨基葡糖C-4之间的糖苷键,破坏肽聚糖骨架,在细菌内部渗透压的作用下引起菌体破裂从而达到杀菌效果[1]。溶菌酶在人体的分布广泛,研究表明其参与机体的先天性免疫防御机制,有抗感染、抗病毒、免疫调节等作用[2, 3]。人溶菌酶属于c型溶菌酶家族,这一家族还包含六种类溶菌酶蛋白[4]。人的类溶菌酶蛋白主要存在于男性生殖系统中,初步研究表明人精子类溶菌酶蛋白1(human sperm lysozyme-like protein 1,hSLLP1)和人类溶菌酶蛋白4(human lysozyme-like protein 4,hLyzl4)均在男性的生殖系统表达,并在精卵结合过程中发挥一定作用[4, 5, 6]。总的来看,人的类溶菌酶蛋白相关研究仍处于起步阶段。HLyzl6是人的六种类溶菌酶蛋白之一,其在男性生殖系统中所发挥的具体作用并不明确,Wei等[7]在对小鼠类溶菌酶蛋白6进行研究时发现了hLyzl6也具有杀菌活性,但对于hLyzl6酶学特性和具体功能并未进行详细研究,这方面的研究工作迄今未见报道。
巴斯德毕赤酵母(Pichia pastoris)是一种能高效表达外源蛋白的真核表达系统,具有遗传稳定、表达水平高、蛋白可翻译后加工、产物可分泌、可高密度发酵等许多优点,应用十分广泛[8, 9]。本研究首次利用巴斯德毕赤酵母GS115表达系统对hLyzl6进行重组表达并对其体外酶活性进行分析,为进一步开展hLyzl6的生物学功能研究和临床应用开发奠定了基础。
1 材料与方法 1.1 材 料 1.1.1 菌种与质粒毕赤酵母GS115、大肠杆菌DH5α、溶壁微球菌由本室保存,克隆载体pMD18-T购自TaKaRa Biotechnology公司,酵母表达载体pPIC9K购自Invitrogen公司。
1.1.2 试剂酵母氮源培养基(YNB)购自Invitrogen公司;PCR试剂、Pyrobest DNA聚合酶和限制性核酸内切酶EcoR I、Not I和Sac I购自TaKaRa Biotechnology公司;核酸和蛋白分子量标准、T4连接酶购自大连宝生物工程有限公司;人溶菌酶标准品购自Sigma公司;测序及引物(表 1)合成均由上海生工生物工程技术服务公司完成。
| Name | Primer sequence (5′-3′) |
| hLyzl6-f | GGGGAATTCTCTCTGATCTCTAGATGC |
| hLyzl6-r | GGGGCGGCCGCTCATCTCAATCTGCATGG |
| α-Factor | TACTATTGCCAGCATTGCTGC |
| 3′-AOX | GCAAATGGCATTCTGACATCC |
LB培养基:1%酵母提取物,2%胰蛋白胨,1% NaCl。YPD培养基:1%酵母提取物,2%胰蛋白胨,2%葡萄糖。MD/MM固体培养基:1.34%YNB,4×10-5 %生物素,2%葡萄糖/0.5%甲醇。BMGY/BMMY培养基:1%酵母提取物,2%胰蛋白胨,1.34%YNB,4×10-5 %生物素,0.1 mol/L磷酸钾缓冲液(pH 6.0)100 ml,1%甘油/0.5%甲醇。
1.1.4 生物信息学软件同源度分析使用Vector NTI Suite 8,氨基酸序列比对使用ClustalW2进行。
1.2 方 法 1.2.1 HLyzl6基因合成与载体构建根据hLyzl6的氨基酸序列(GenBank:XM_006725329)和毕赤酵母密码子偏爱性设计并人工合成hLyzl6基因片段,在5′端引入EcoR I酶切位点,在3′端引入Not I酶切位点,将合成好的hLyzl6基因连接入克隆载体pMD18-T中并测序。质粒经EcoR I和Not I双酶切后,通过凝胶电泳分离回收目的基因片段,连接于经相同双酶切处理的表达载体pPIC9K中,连接产物转化入大肠杆菌DH5α感受态细胞。将转化菌液涂布于含100μg/ml氨苄青霉素的LB琼脂平板过夜培养,再挑取单菌落接种于LB液体培养基过夜培养,提取质粒后进行酶切鉴定,构建真核重组表达质粒命名为pPIC9K-hlyzl6。
1.2.2 重组毕赤酵母菌株转化与筛选用Sac I对pPIC9K-hlyzl6进行线性化处理后,通过电转化法(电压1 500 V,电容25 μF,电阻200 Ω)将其转化至毕赤酵母GS115感受态细胞中。将转化菌液涂布于MD平板培养基上,进行初步筛选,再挑取长出的转化菌落划线到含G418的YPD平板培养基(浓度分别为0.5、1和3 mg/ml),进行高拷贝菌株筛选。
1.2.3 HLyzl6蛋白的诱导表达将筛选出的重组毕赤酵母菌株GS115-pPIC9K-hlyzl6接种于25 ml BMGY种子培养基,30 ℃摇床培养36 h。将种子培养基以1%接种量转接至含有2.5 L BMGY培养基的5 L发酵罐中,30 ℃发酵培养36 h至甘油耗尽。加入甲醇至0.5%浓度进行诱导表达,每隔12 h取样并加入相同浓度甲醇,诱导开始72 h后结束发酵。
1.2.4 HLyzl6蛋白的纯化根据本研究室已报道的方法进行甲壳素亲和纯化[10 ,11],将发酵液离心(5 000 r/min,4℃,30 min),收集上清。取20 ml甲壳素亲和层析介质与500 ml上清混合,室温搅拌吸附30 min,沉淀10 min后,倾去上清,将甲壳素亲和层析介质装填色谱柱,用pH 6.4的0.02 MPBS灌流柱床至流出液A280nm至基线,换用选定的醋酸溶液洗脱,分管收集洗脱液后进行SDS-PAGE分析,然后合并。用1mol/L碳酸盐缓冲液调节洗脱液的pH至7.0后装入截留范围4~6 kDa的透析袋中,对水透析12 h后冷冻干燥,进行进一步分析。
1.2.5 温度对hLyzl6酶活性的影响使用pH 6.24的磷酸缓冲液配置微球菌底物溶液,OD450nm为0.8左右,将底物溶液分别置于4 ℃,10 ℃,20 ℃,30 ℃,40 ℃,50 ℃,60 ℃,70 ℃,80 ℃水浴,取50 mg/L的hLyzl6溶液0.1 ml与2.5 ml预热的底物溶液混合,保持温度恒定,反应1 min读取A450nm值,计算ΔA450nm值,以测得的最大活性为参照,绘制温度-相对活性曲线。
1.2.6 pH对hLyzl6酶活性的影响在上一步实验确定的最适反应温度下,使用pH分别为4.5,5.0,5.5,6.0,6.5,7.0,7.5的缓冲液配制溶壁微球菌底物溶液,OD450nm为0.8左右。取50 mg/L的hLyzl6溶液0.1 ml与2.5 ml底物溶液混合,室温反应1 min读取A450nm值,计算ΔA450nm值,以测得的最大活性为参照,绘制pH-相对活性曲线。
1.2.7 离子对hLyzl6酶活性的影响配制OD450nm=0.8左右的微球菌底物溶液,分别含有0.01 mol/L的Na+,Co+,Ni+,Zn2+,Cu2+,Hg2+,Mn2+,Ca2+,Fe3+ 10种离子,取50 mg/L的hLyzl6溶液0.1 ml与2.5 ml底物溶液混合,室温反应1 min读取A450nm值,以hLyzl6在含Na+溶液中的活性为对照,计算hLyzl6在其它离子溶液中的相对活性。
1.2.8 HLyzl6酶活性测定使用最适反应pH的缓冲液分别配置浓度为50 mg/L的hLyzl6溶液和OD450nm为0.8左右的溶壁微球菌底物溶液,在最适反应温度下,将0.1 ml的hLyzl6溶液与2.5 ml底物溶液混合,维持温度恒定反应1 min读取A450nm值,计算hLyzl6活性。酶活性单位(U/mg)的定义为在最适反应条件下,OD450nm每分钟下降0.001为一个酶活力单位。酶活力计算公式为:每mg酶的活力单位=[A450nm(0时)-A450nm′(1min时)]×1000/样品毫克数。
1.2.9 HLyzl6毒力测定制作双层琼脂平板,下层为含1.5 %琼脂的LB培养基,上层为含0.6 %琼脂的LB培养基。向4 ml冷却至45 ℃左右的上层培养基中加入50 μl溶壁微球菌过夜培养液,充分摇匀后,倾倒于已凝固的下层培养基之上。配制质量浓度为0.1、0.5、1.5、10、20、50 mg/L的hLyzl6溶液,用打孔器制作的滤纸小碟分别浸入上述溶液中吸附15 s,然后移入凝固的培养基表面,每一培养皿对角排放4片吸附同一浓度hLyzl6溶液的滤纸小碟,37 ℃过夜培养,重复3次,以无菌水作为空白对照。测量抑菌圈直径(mm),计算抑菌圈平均直径,将hLyzl6溶液浓度转换为对数值,用最小二乘法求出EC50。
1.2.10 HLyzl6与人溶菌酶杀菌活性比较制作双层琼脂平板,待上层培养基完全凝固后,在琼脂平板上放置灭菌后的牛津小杯。将纯化的hLyzl6和人溶菌酶标准品分别用0.1mol/L PBS配置浓度为50 mg/L的工作液,取各溶液250μl分别加于牛津小杯中,置37 ℃培养过夜后观察结果,以无菌水作为空白对照。
2 结 果 2.1 序列比对和同源度分析
将全长的hLyzl6与人溶菌酶、hSLLP1、hLyzl4的氨基酸序列比对,结果表明hLyzl6与三者间均有一定的同源度,其中与人溶菌酶(hLyz)的为59.5 %(表 2)。HLyzl6的长度、预测的分子量、尤其是8个保守的半胱氨酸和2个保守的酶催化位点Glu35和Asp52均符合c型溶菌酶家族特征 (图 1)。
| hLyz | hSLLP1 | hLyzl4 | hLyzl6 | |
| hLyz | 63.1 | 55.0 | 59.5 | |
| hSLLP1 | 54.6 | 56.6 | ||
| hLyzl4 | 55.0 | |||
| hLyzl6 |

|
| 图 1 HLyzl6与c型溶菌酶家族蛋白氨基酸序列比对 Fig. 1 Alignment of amino acid sequences of hLyzl6 with other c-type lysozymes Gaps that were introduced into the sequences were shown as dashes; Residues that were shaded showed eight conserved cysteine residues of c-type lysozymes; Inverted triangles indicated the key amino acids involved in catalytic activity of c-type lysozymes |
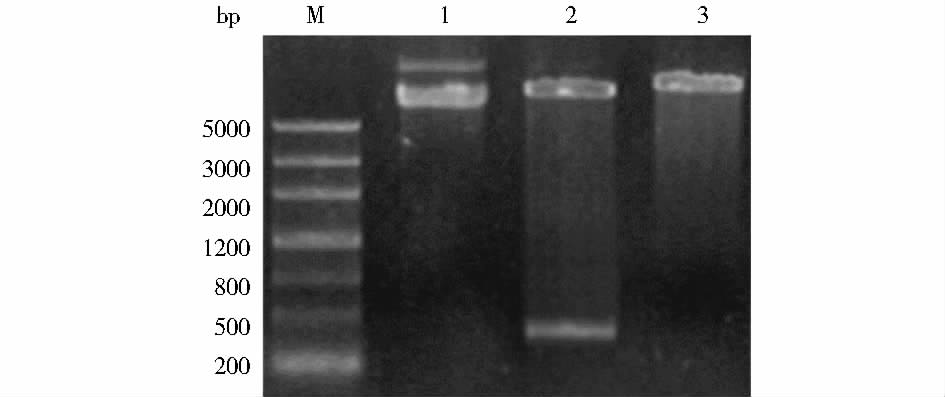
将构建完成的重组质粒pPIC9K-hlyzl6经EcoR I和Not I双酶切后进行琼脂糖凝胶电泳,结果显示酶切产物在400 bp处出现特异条带,结果与预期相符(图 2)。
|
| 图 2 重组质粒酶切鉴定 Fig. 2 Identification of recombinant expression plasmid M: DNA Marker; 1: pPIC9K-hlyzl6 plasmid; 2: Recombinant plasmid digested by EcoR I and Not I; 3: Recombinant plasmid digested by Sac I |
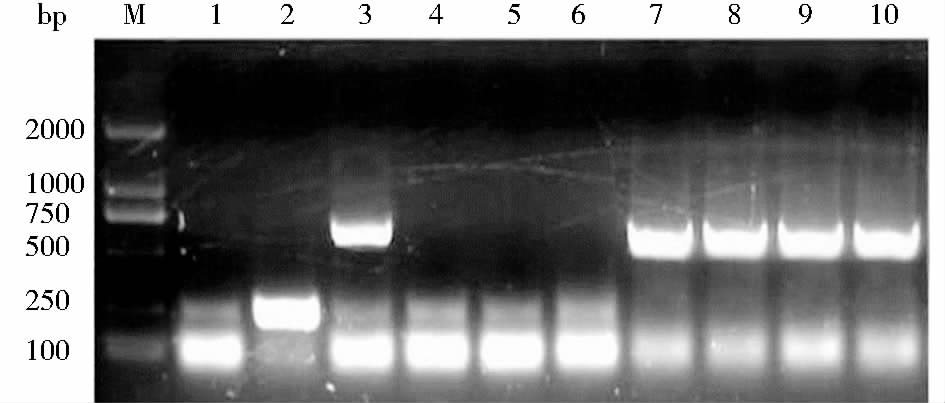
重组表达质粒pPIC9K-hlyzl6经Sac I线性化后电转化毕赤酵母感受态细胞,依次经MD平板筛选和G418梯度筛选后得到高拷贝转化子,挑取菌落抽提其DNA,以重组载体臂引物α-Factor和3′-AOX 进行PCR鉴定,约有50 %的克隆扩增到约579 bp的片段(图 3),与预期大小相符表明hLyzl6基因已整合入毕赤酵母基因组。经α-Factor引物直接测序验证基因序列无误。
|
| 图 3 阳性重组毕赤酵母菌株PCR鉴定 Fig. 3 Identification of positive recombinants by PCR M: DNA Marker; 3,7~10: Positive recombinants; 1~2,4~6:Negative clones |
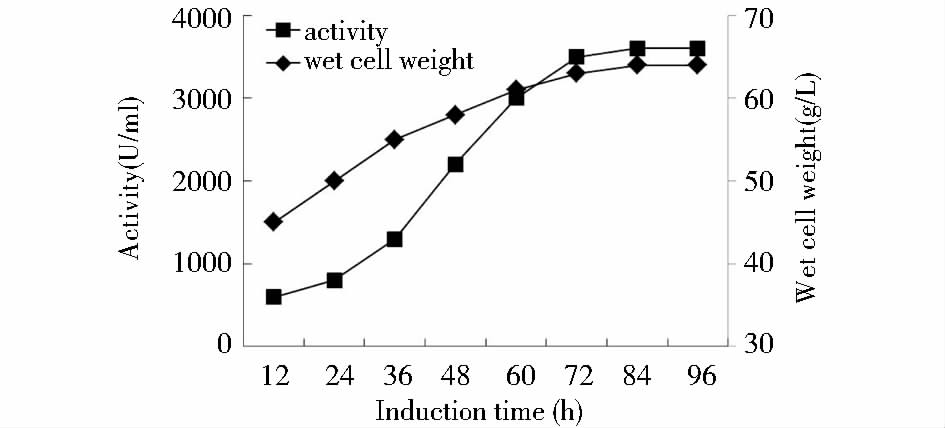
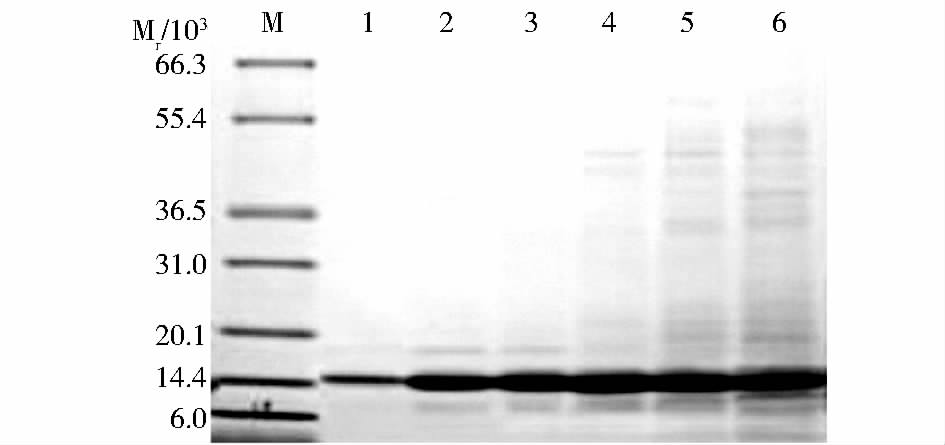
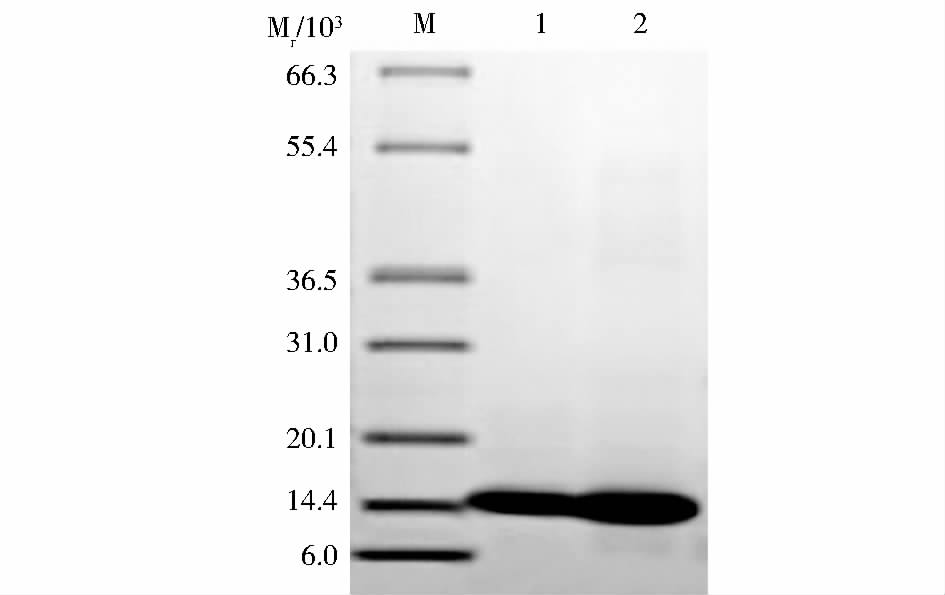
发酵结束后对发酵液上清进行活性检测,结果表明随着诱导时间的增加,单位发酵液上清中酶活性也逐渐增加,酶活性在72 h左右达到最高(图 4)。对发酵液上清进行SDS-PAGE分析,目的蛋白在14.8 kDa处表达,与hLyzl6蛋白预期大小一致,初步表明hLyzl6在毕赤酵母中获得成功表达(图 5)。甲壳素亲和层析纯化hLyzl6后进行SDS-PAGE,灰度扫描显示hLyzl6约占总蛋白的99 %以上(图 6)。
|
| 图 4 发酵液菌体和活性增长曲线 Fig. 4 Increment curve of cell and lytic activity in the culture broth |
|
| 图 5 发酵液上清的SDS-PAGE分析 Fig. 5 SDS-PAGE of fermentation supernatant M: Molecular weight marker; 1~6: Fermentation supernatant |
|
| 图 6 HLyzl6纯化蛋白的SDS-PAGE分析 Fig. 6 SDS-PAGE of purified hLyzl6 M: Molecular weight marker; 1~2: HLyzl6 |
使用测定溶菌酶活性的标准条件即pH 6.24的反应体系中测定温度对hLyzl6活性的影响,结果表明hLyzl6的最适温度为40 ℃左右,在20 ℃~50 ℃的范围内可保持大部分的杀菌活性 (图 7)。

|
| 图 7 温度对hLyzl6活性的影响 Fig. 7 Effect of temperature on hLyzl6 activity |
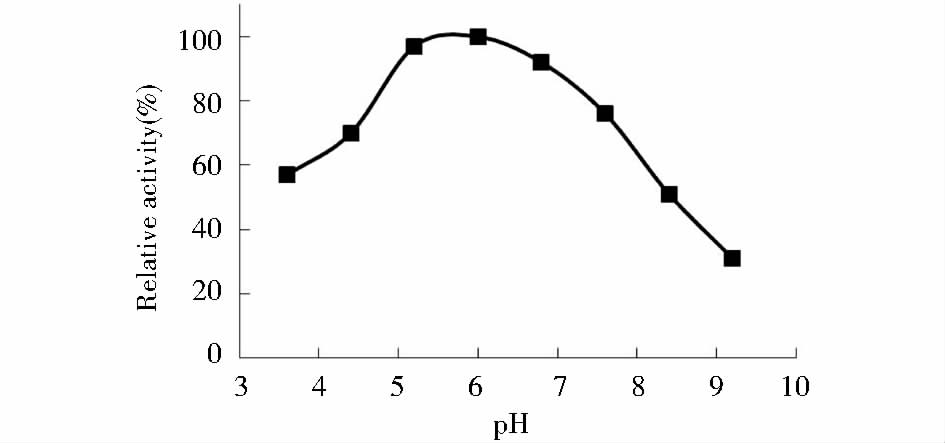
在hLyzl6的最适温度40 ℃下测定其在不同pH的反应体系中的活性,随着pH的提高,hLyzl6活性先上升,达到最高点之后开始下降。结果表明hLyzl6在较宽的pH范围内都有杀菌活性,但在偏酸性的条件下可保持大部分的杀菌活性,其最适反应pH为5.5左右(图 8)。
|
| 图 8 pH对hLyzl6活性的影响 Fig. 8 Effect of pH on hLyzl6 activity |
实验结果表明,Co+,Ni+,Zn2+,Cu2+,Hg2+,Mn2+,Ca2+,Fe3+ 9种离子对hLyzl6活性均有影响,其中,Cu2+的影响最为显著,hLyzl6活性完全丧失(表 3)。
| Metal ion | Na+ | Cu2+ | Fe3+ | Zn2+ | Co+ | Hg2+ | Mn2+ | Ni+ | Ca2+ |
| Relative activity(%) | 100 | 0 | 34.0 | 44.2 | 48.1 | 78.3 | 77.3 | 77.8 | 79.5 |
通过标准的酶活性测定方法测得重组hLyzl6蛋白活性为54 700 U/mg,使用抑菌圈法测定EC50,求得回归方程为y=4.7515+0.5197x,相关系数为0.9876,EC50为30.2799 mg/L,结果表明本研究构建的重组毕赤酵母表达菌株能够分泌对溶壁微球菌具有良好杀灭活性的hLyzl6。双层平板扩散法测定结果显示hLyzl6对溶壁微球菌的杀灭活性小于人溶菌酶(图 9)。

|
| 图 9 HLyzl6与人溶菌酶杀菌活性比较 Fig. 9 Activity comparison of hLyzl6 and human lysozyme 1: HLyzl6; 2: Human lysozyme; 3: Negative control |
随着基因工程技术的成熟,通过重组技术表达外源蛋白已获得成功。在用于表达外源蛋白的各种表达系统中大肠杆菌因繁殖迅速、操作简便、成本低廉而得到广泛应用,但其属于原核表达系统,在表达外源基因时缺乏对真核生物蛋白质的复性功能和修饰加工系统,导致外源蛋白复性困难,不能形成正确的空间构象,从而影响蛋白功能。因此在目前已发表的类溶菌酶蛋白相关研究工作中,大肠杆菌主要用于表达蛋白进行抗体制备,而在对类溶菌酶蛋白进行功能研究时,则主要采用毕赤酵母表达系统,如Mandal等[5]采用毕赤酵母X-33菌株对hSLLP1进行重组表达,Sun等[12]、李新新等[13]均采用毕赤酵母GS115对hLyzl4进行重组表达。Wei等[7]研究发现了hLyzl6具有杀菌活性,但其仍然采用的是大肠杆菌表达系统。而毕赤酵母属于真核表达系统,除了具有大肠杆菌表达系统的优点外,其在表达外源蛋白时较易进行诱导表达,目的蛋白分泌入培养液,而其自身仅分泌极少量内源蛋白,从而简化了纯化步骤,大大降低生产成本;毕赤酵母可对外源蛋白进行适当的糖基化,对于表达需要正确形成天然结构或在胞内不稳定的蛋白以及有毒蛋白有着明显的优势;在适当的条件下,外源蛋白通过毕赤酵母表达系统可获得较高表达量[14],这些优势使毕赤酵母成为表达类溶菌酶蛋白的理想选择。在使用这一表达系统时需要注意的是,有多种因素可以影响外源基因在毕赤酵母中的表达水平,其中密码子偏爱性是重要因素之一。偏爱密码子的使用程度与基因表达水平之间存在显著的相关性,如Ile的密码子ATA、Pro的密码子CCG、Ala的密码子GCG、Gly的密码子GGG、Arg的密码子CGC、CGA、CGG等的使用频率统计数为零[15],外源基因中含有的这些密码子往往成为其在毕赤酵母中高效表达的瓶颈。为了提高hLyzl6的表达效率,本研究根据毕赤酵母密码子偏爱性对hLyzl6基因进行优化设计和基因全序列人工合成[16]。
通过MD和G418平板分别筛选,本研究得到了高效分泌表达hLyzl6的酵母菌株,经甲醇诱导后在发酵液上清中检测到了目的蛋白和杀菌活性,蛋白表达量在诱导72 h后不再明显上升。然而,对于重组蛋白质的研究利用而言,能否进行低成本、高得率的纯化是关键环节。Wei等[7]在使用大肠杆菌表达hLyzl6时,在其蛋白序列中引入了GST标签,以便于对重组蛋白进行纯化。本研究使用了甲壳素亲和介质对发酵液上清中的hLyzl6进行纯化,这是基于甲壳素与溶菌酶的天然底物肽聚糖结构的相似性,且不需向蛋白序列中引入纯化标签,保持了hLyzl6的天然结构。本研究室已经对甲壳素进行了改造,使其适宜用作纯化溶菌酶家族蛋白的层析介质,并实现了对人g 2型溶菌酶的高效分离纯化[10, 11, 17]。本研究采用甲壳素作为分离纯化hLyzl6的亲和吸附介质,也取得较为理想的效果,纯化的蛋白纯度>99.0 %,表明除了g型溶菌酶外,甲壳素亲和介质也可对c型溶菌酶家族的蛋白进行高效的分离纯化。
HLyzl6是人c型溶菌酶家族成员之一,人的六种类溶菌酶蛋白与人溶菌酶的氨基酸序列一致性均较低,在已进行了初步研究的几种人的类溶菌酶蛋白中,于人溶菌酶序列一致性最高的是hSLLP1,其次为hLyzl6,序列一致性为59.5 %。人溶菌酶的催化位点含有两个保守的残基,即Glu35和Asp53。在类溶菌酶蛋白中,这两个残基发生了替代,如在hSLLP1中,这两个残基分别被Thr35和Asn52替代,因此hSLLP1并不具有杀菌活性,主要在精卵结合中发挥作用[5];在hLyzl4中Glu35得到保留,另一个位点被Gly53替代,研究表明hLyzl4保留了一定的杀菌活性[13]。与两者不同,hLyzl6保留这两个关键残基(图 1),这意味着hLyzl6可能具有较强的杀菌活性,本研究证实了这一点,经标准方法测定,hLyzl6的酶活性达54 700 U/mg。尽管人溶菌酶在人体内具有广泛分布,但睾丸中并无人溶菌酶的表达[18],而类溶菌酶蛋白主要在雄性哺乳动物生殖系统,如睾丸、附睾、精子等部位有特异表达,因此提示hLyzl6在男性生殖系统先天性免疫方面具有一定作用。
需要指出的是,本研究也同时测定了人溶菌酶的活性,为78 500 U/mg。使用双层琼脂平板扩散法对hLyzl6和人溶菌酶的杀菌活性进行比较,结果显示前者对溶壁微球菌的杀灭活性小于后者(图 9)。由此可见,虽然hLyzl6保留了决定杀菌活性的两个关键残基,但其杀菌活性低于人溶菌酶(至少对溶壁微球菌)。不过这并不排除hLyzl6对某些导致男性生殖系统感染的细菌具有特异的杀灭活性。如同在本研究室对人g 2型溶菌酶的研究工作中所发现的情况,体外抗菌谱分析表明人g 2型溶菌酶对革兰氏阴性细菌杀灭活性比人溶菌酶更强,对于一些临床常见的男性生殖系统感染性疾病的耐药菌,如耐药肠球菌等具有良好的杀灭活性,且可在高渗环境下发挥杀菌活性,因此其可以弥补人溶菌酶作用的不足[17]。在接下来的研究工作中,本室将对hLyzl6的抗菌谱进行筛查,寻找其特异的敏感致病菌株。近些年各种耐药细菌的出现使得寻找与开发新型抗菌药物显得非常迫切,类溶菌酶蛋白由于具有杀菌活性,也成为潜在候选分子之一。与抗生素相比,类溶菌酶蛋白具有无残留、不会诱导耐药性产生的特点,使其在临床药物开发等方面也具有潜在的应用前景。
总的来看,本研究成功实现了hLyzl6在毕赤酵母中的高效分泌表达,并证实其在体外具有杀菌活性,这些工作为进一步研究hLyzl6在男性生殖系统中的功能及其临床开发奠定了基础。
| [1] | Prager E M, Jolles P. Lysozymes-Model Enzyme in Biochemistry and Biology. Basel: Switzerland, Birkhauser Verlag, 1996.9-31. |
| [2] | Chen X J, Niyonsaba F, Ushio H, et al. Synergistic effect of antibacterial agents human β-defensins, cathelicidin LL-37 and lysozyme against Staphylococcus aureus and Escherichia coli. Journal of Dermatological Science, 2005, 40:123-132. |
| [3] | Lee-Huang S, Huang P L, Sun Y T, et al. Lysozyme and RNases as anti-HIV components in beta-core preparations of human chorionic gonadotropin. Proc Natl Acad Sci USA, 1999, 96(6): 2678-2681. |
| [4] | Zhang K X, Gao R, Zhang H X, et al. Molecular cloning and characterization of three novel lysozyme-like genes, predominantly expressed in the male reproductive system of humans, belonging to the c-type lysozyme/alpha-lactalbumin family. Biology of Reproduction, 2005, 73(5): 1064-1071. |
| [5] | Mandal A, Klotz K L, Shetty J, et al. SLLP1, a unique, intra-acrosomal, nonbacteriolytic, c lysozyme-like protein of human spermatozoa. Biology of Reproduction, 2003, 68(5): 1525-1537. |
| [6] | Sachdev M, Mandal A, Mulders S, et al. Oocyte specific oolemmal SAS1B involved in sperm binding through intra-acrosomal SLLP1 during fertilization. Developmental Biology, 2012, 363(1): 40-51. |
| [7] | Wei J, Li S J. Characterisation of Lyzls in mice and antibacterial properties of human LYZL6. Asian Journal of Andrology, 2013, 15(6): 824-830. |
| [8] | Charoenrat T, Ketudat M, Stendahl A H, Oxygen-limited fed-batch process: an alternative control for Pichia pastoris recombinant protein processes. Bioprocess and Biosystems Engineering, 2005, 27(6): 399-406. |
| [9] | Gasser B, Prielhofer R, Marx H, et al. Pichia pastoris: protein production host and model organism for biomedical research. Future Microbiology, 2013, 8(2): 191-208. |
| [10] | 黄鹏, 李文姝, 谢 君等. 甲壳素亲和层析在人g2型溶菌酶制备中的应用. 免疫学杂志, 2015, 31(5): 430-435. Huang P, Li W S, Xie J, et al. Application of chitin affinity chromatography in purification of recombinant HLysG2. Immunological Journal, 2015, 31(5): 430-435. |
| [11] | 黄鹏. 人c型和g2型溶菌酶的功能研究及人c型溶菌酶制备条件的优化. 上海: 复旦大学, 2008. Huang P. Studies on function of human c- and g2-type lysozymes and opimization of the preparation conditions of human c-type lysozyme. Shanghai: Fudan University, 2008. |
| [12] | Sun R L, Shen R L, Li J, et al. Lyzl4, a novel mouse sperm-related protein, is involved in fertilization. Acta Biochim Biophys Sin, 2011, 43: 346-353. |
| [13] | 李新新, 陶建军, 余 龙. 人源溶菌酶基因LYZL4在毕赤酵母中的重组表达及活性测定. 中国生物工程杂志, 2014, 34(1): 79-85. Li X X, Tao J J, Yu L. Recombinant human lysozyme LYZL4: expression in Pichia pastoris and its antibacterial activity. China Biotechnology, 2014, 34(1): 79-85. |
| [14] | Romanose M A, Scorer C A, Clare J J. Foreign gene expression in yeast: a review. Yeast, 1992, 8(6): 423-488. |
| [15] | Cheng K J, Forsberg C W, Bae H D, et al. Phytase of ruminal microorganism. US Patent 5939303, 1999. |
| [16] | 赵翔, 霍克克, 李育阳. 毕赤酵母的密码子用法分析. 生物工程学报, 2000, 16(3): 308-311. Zhao X, Huo K K, Li Y Y. Synonymous codon usage in Pichia pastoris. Chinese Journal of Biotechnology, 2000, 16(3): 308-311. |
| [17] | Huang P, Li W S, Xie J, et al. Characterization and expression of HLysG2, a basic goose- type lysozyme from the human eye and testis. Molecular Immunology, 2011, 48(4): 524-531. |
| [18] | Mason D Y, Taylor C R. The distribution of muramidase (lysozyme) in human tissues. Journal of Clinical Pathology, 1975, 28(2): 124-132. |
 2015, Vol. 35
2015, Vol. 35




