文章信息
- 朱志坚, 连凯琪, 杨帆, 张伟, 郑海学, 杨孝朴
- ZHU Zhi-jian, LIAN Kai-qi, YANG Fan, ZHANG Wei, ZHENG Hai-xue, YANG Xiao-pu
- 稳定表达鼠源整联蛋白αvβ6的CHO-677细胞系的构建
- Establishment of a Stable CHO-677 Cell Line Expressing Murine αvβ6 Integrin
- 中国生物工程杂志, 2015, 35(8): 23-29
- China Biotechnology, 2015, 35(8): 23-29
- http://dx.doi.org/10.13523/j.cb.20150804
-
文章历史
- 收稿日期:2015-04-30
- 修回日期:2015-05-19
2. 中国农业科学院 兰州兽医研究所 家畜疫病病原生物学国家重点实验室 兰州 730046
2. State Key Laboratory of Veterinary Etiological Biology, Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, China
口蹄疫(foot-and-mouth disease,FMD)是一种感染偶蹄动物的高度接触性传染病,其宿主包括牛、猪、绵羊、山羊等。该病病原为口蹄疫病毒(FMDV),是小RNA病毒科口蹄疫病毒属的典型成员,至少存在7种血清型,即亚洲1型、A型、O型、C型和南非1、2和3型,且型间无交叉保护性[1, 2] 。FMDV病毒基因是一种单股正链的RNA,大约为8.5 kb,仅含有一个长的开放阅读框,首先被翻译成一个大的多聚蛋白,然后通过自裂解以及蛋白酶3C和L蛋白的作用裂解成4种结构蛋白以及15种非结构蛋白[3, 4, 5, 6]。
识别并吸附细胞表面的受体是病毒起始感染的重要步骤[7]。之前的研究表明,FMDV可以利用4种整联蛋白(αvβ1、αvβ3、αvβ6和αvβ8)感染宿主细胞[8, 9];细胞培养适应毒株也可以利用硫酸乙酰肝素(heparan sulfate)受体感染宿主细胞[10, 11];近年来,有研究者证实存在尚未被鉴定的第三类受体[12, 13]。虽然,FMDV具有利用多种受体的能力,但病毒在易感宿主中的复制和感染只与整联蛋白受体有关,其通常表达在表皮细胞上作为病毒的主要受体介导FMDV对宿主的感染[14]。针对最先验证可作为FMDV受体的整联蛋白αvβ3,本实验室前期构建了可稳定表达αvβ3的细胞系,并利用FMDV对其生物学特性进行了验证。然而,研究表明,在FMDV可高效复制的牛上皮细胞表位上表达的是整联蛋白αvβ6而不是αvβ3,αvβ6是决定病毒嗜性的主要受体[15]。并且,多个研究已证明αvβ6是FMDV最有效的受体[16, 17],因此构建可稳定表达整联蛋白αvβ6的细胞系对研究口蹄疫病毒具有重要的意义。FMDV的自然宿主是牛、猪等,但是乳鼠在实验室常被作为一种重要的实验动物模型,被用于分离野毒、病毒传代以及动物的半数致死剂量(LD50)实验等。因此,在这个研究中我们克隆了乳鼠整联蛋白αvβ6的两个亚基基因,构建到pLVX-Tight-Puro慢病毒载体上,并转入CHO-677细胞,建立了CHO-677-mαvβ6细胞系。CHO-677细胞是一种口蹄疫整联蛋白受体和硫酸乙酰肝素受体都缺失的细胞,使其成为构建稳定表达整联蛋白αvβ6细胞系的最佳选择[12, 18]。最后,我们从基因、蛋白和功能水平上验证了CHO-677-mαvβ6细胞系得以成功构建。
1 材料与方法 1.1 材 料3日龄SPF级乳鼠(BALB/c小鼠)购自兰州兽医研究所实验动物场。pOK-12、pLVX-Tight-Puro慢病毒载体、BHK-21细胞、293T细胞、鼠源整联蛋白亚基αv和β6以及Asia1/HN/CHA/06毒株和O/BY/CHA/2010毒株的多克隆抗体血清均为本实验室保存;兔抗αv多克隆抗体和兔抗β6多克隆抗体为本实验室前期通过原核表达αv和β6的部分胞外域蛋白并免疫新西兰大白兔制备获得。CHO-677(或pgsD-677; ATCC CRL-2244)细胞购于美国模式培养物保藏中心(ATCC)。Lenti-XTM Tet-Off诱导表达系统购自Clontech公司。抗生素G418 Sulfate(E859)购自Amresco公司;嘌呤霉素(Puromycin)(P9620)购自Sigma公司。
1.2 基因克隆将3日龄乳鼠安乐处死,解剖取其肺脏和心脏组织,研磨后按照Trizol提取RNA操作说明提取组织RNA,使用反转录酶M-MLV reverse Transcriptase进行反转录,程序为:25℃,10 min; 37℃,1 h;70℃,15 min。然后使用DNA聚合酶LA-Taq version 2.0 plus dye扩增αv和β6的基因[19]。根据GenBank数据库中已公布鼠源αvβ6的参考序列,设计了两对引物αvF和αvR、β6F和β6R。使用梯度PCR扩增,将扩增出来与预期大小相符的条带胶回收纯化,连接pMD-18T载体。然后送北京金唯智公司测序。
1.3 CHO-677-mαvβ6细胞系的建立我们利用表 1中的引物引入相应的酶切位点,通过pOK-12作为过渡载体,把αv和β6的基因最终连接到pLVX-Tight-Puro载体上,而且IRES作为非帽依赖性元件连接在αv和β6的基因中间,起始β6基因的翻译。最终得到pLVX-mαv-IRES-mβ6质粒,并通过测序验证正确。该质粒和慢病毒系统中的辅助质粒分别被转染293T包装细胞,然后按照1∶1的比例感染CHO-677细胞。用已探索的最佳抗生素G418浓度(500μg/ml)和嘌呤霉素(Puromycin)浓度(4 μg/ml)对转染后的CHO-677细胞进行连续加压筛选,最终形成单克隆并进行扩大培养,得到的细胞系被命名为CHO-677-mαvβ6。
| Name | Sequence(5′ →3′ )a,b | Genome position |
| αvF αvR β6F β6R IRESF IRESR pL-αvF pL-αvR pL-β6F pL-β6R | ATGGCTGCTCCCGGGCGC TCAGGTTTCAGAGTTTCCT ATGGGGATTGAGCTGGTCTG CTACCCATCTGAGGAAAGGCCT CTAGCTAGCGCCCCTCTCCCTCCCCCCCCCCTAA CGGGCGGCCGCTGTGGCCATATTATCATCGTGT TTTGCGGCCGCGCCACCATGGCTGCTCCCGGGCGC CTAGCTAGCTCAGGTTTCAGAGTTTCCTTCGCCATT CGGTCTAGAGCCACCATGGGGATTGAGCTGGTCTG TCGACGCGTCTACCCATCTGAGGAAAGGCCT | 1-18 3117-3135 1-20 2343-2364 1-25 562-584 1-18 3117-3143 1-20 2343-2364 |
| a: Red letters represent restriction enzyme site; b: Blue letters represent the Kozak sequence | ||
为了检测小鼠αv和β6基因是否被导入CHO-677细胞中并得到表达,分别从基因和蛋白水平两个方面对CHO-677-mαvβ6细胞系进行了检测。同时,考虑到细胞系的遗传稳定性,在细胞系传至20代后,进行重复检测。
1.4.1 基因水平检测提取细胞系的总RNA,进行反转录,用αvF和αvR、β6F和β6R分别扩增αv和β6亚基的基因,对扩增产物进行电泳分析,并连接到pMD-18T载体上进行测序。
1.4.2 蛋白水平检测通过间接免疫荧光技术对细胞系CHO-677-mαvβ6中异二聚体整联蛋白的表达情况进行鉴定[20]。具体过程如下,将构建好的细胞系细胞铺于6孔板中培养36 h,待细胞长至约50%单层,用4%的多聚甲醛固定30 min,并用0.1%的TritonX-100通透25 min,随后用5%的牛血清蛋白在室温封闭1 h;用TBST漂洗3次,加入兔抗αv多克隆抗体(1∶50)和兔抗β6单克隆抗体(1∶50)37℃孵育1 h,用TBST洗3次;再用异硫氰酸荧光素标记的山羊抗兔二抗(1∶400)在室温分别避光孵育2 h,用TBST洗3次,加入4,6-二氨基-2-苯茚二酮(DAPI)染核15 min。最后用奥林巴斯BX-40荧光显微镜获取荧光图片进行分析。
1.5 CHO-677-mαvβ6细胞系功能性鉴定为了验证该细胞系表达mαvβ6的功能活性,在细胞系稳定传至20代后,通过FMDV感染进一步鉴定该细胞系。选用FMDV Asia1/HN/CHA/06株和O/BY/CHA/2010株感染该细胞系CHO-677-mαvβ6及其亲本细胞CHO-677,并进行病毒RNA、病毒蛋白和病毒滴度的检测。
1.5.1 病毒RNA检测为确定病毒Asia1/HN/CHA/06和O/BY/CHA/2010在CHO-677-mαvβ6和CHO-677两种细胞系上的复制水平,将传20代稳定之后的两种细胞接6孔板,培养过夜至细胞单层长满培养孔,用PBS洗2次,分别加入1 ml的病毒液(感染复数MOI=1),5% CO2、37℃的培养箱中孵育1 h,吸弃病毒液,加入2 ml新鲜培养基(含2% FBS的DMEM培养基),5% CO2、37℃的培养箱中分别培养12 h、24 h、36 h、48 h和60 h后收取样品,利用Trizol法提取细胞样品中的总RNA,并依照两步法Prime Script RT-PCR操作说明进行实时荧光定量RT-PCR。FMDV的复制水平利用标准曲线函数y = -3.416log(x) + 42.85进行计算[21]。
1.5.2 病毒生长曲线测定通过TCID50进一步检测两种血清型的毒株在细胞系CHO-677-mαvβ6和其亲本细胞CHO-677上的感染能力。细胞处理如上所述,收取不同时间点的样品后,反复冻融2~3次,离心取上清在BHK-21细胞上测定不同时间点收获病毒的TCID50,绘制病毒生长曲线。利用Reed-Muench法计算TCID50。每组实验分别重复3次测TCID50,取其平均值绘制生长曲线。
1.6 统计分析以GAPDH基因为内参对照,采用2-△△Ct法对荧光定量RT-PCR进行统计,利用SPSS19.0软件进行数据处理,分析差异显著性。结果以“平均值±标准误”表示,P<0.05为差异显著性标准。
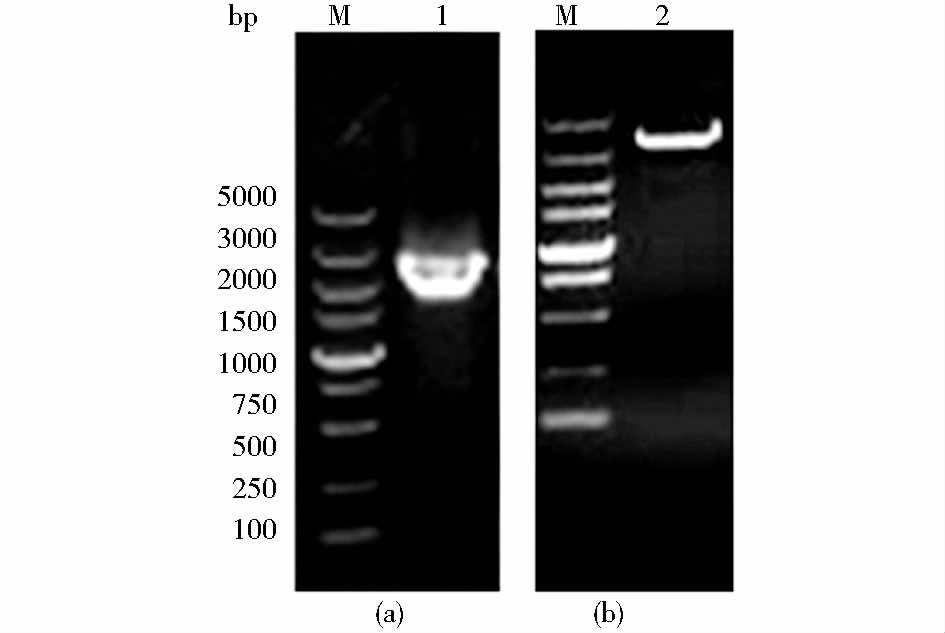
2 结 果 2.1 αv和β6亚基基因的扩增以提取的乳鼠组织总RNA为模板,进行反转录。以获得的cDNA为模板,用设计的引物对αvF和αvR、β6F和β6R扩增αv和β6的基因,扩增产物大小约为3 135和2 364 bp,与预期的目的片段大小相符,连接pMD-18T载体送公司测序,结果表明成功克隆了鼠源αv和β6的基因(图 1)。
|
| 图 1 乳鼠整联蛋白αv和β6亚基PCR扩增产物电泳结果 Fig. 1 PCR products from suckling mouse integrin subunits αv and β6 were electrophoresed through 1.0% agarose gels (a) The PCR product of β6 (2364 bp) gene (b) PCR product of αv (3135 bp) gene M: DL5000 DNA Marker |
以重组质粒pLVX-mαv-IRES-mβ6为模板,PCR扩增出与目的片段大小相符的条带,而以pLVX-Tight-Puro为模板没有扩增出合适的片段(图 2)。测序结果表明,目的基因已成功插入pLVX-Tight-Puro表达载体,且开放阅读框完全正确。

|
| 图 2 重组质粒pLVX-mαv-IRES-mβ6的PCR鉴定结果 Fig. 2 Identification of the recombinant plasmid pLVX-mαv-IRES-mβ6 by PCR (a) The PCR products amplified of αv (lane 1) and β6 (lane 2) genes from pLVX-αv-IRES-β6 (b) The PCR product of IRES gene (lane 3). Molecular weight marker fragment (TaKaRa) was in lane M |
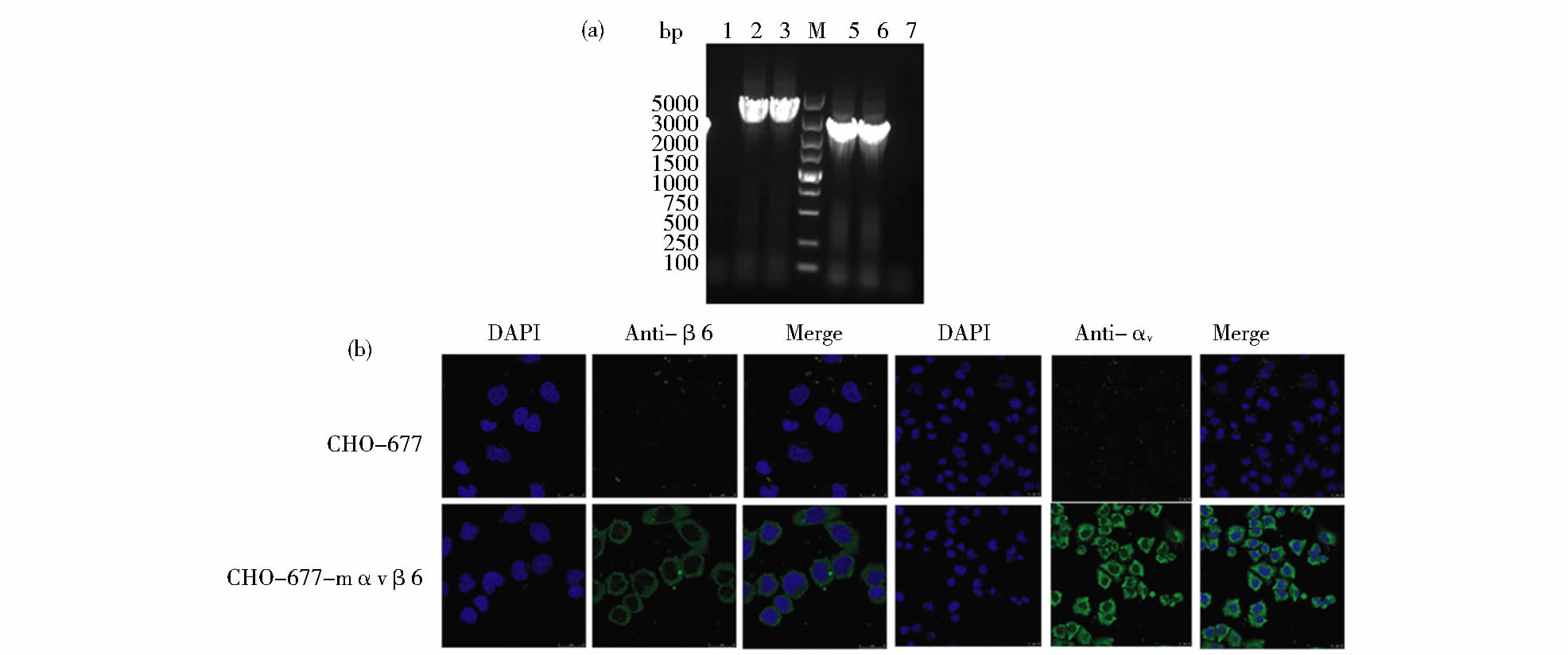
用PCR和间接免疫荧光技术从基因和蛋白水平检测CHO-677-mαvβ6细胞系中的αv和β6整联蛋白亚基。细胞系传20代稳定之后,用PCR检测αv和β6基因,结果与预期一样,能够检测出目的条带,且扩增出的目的片段连接T载体测序后,序列与插入的基因相符(图 3a)。然后,用间接免疫荧光检测细胞系CHO-677-mαvβ6中异二聚体整联蛋白的表达情况。结果显示,CHO-677-mαvβ6细胞系中能够检测到高强度荧光,并且绿色荧光均匀致密地分布于细胞核以外区域,说明外源蛋白αvβ6主要表达在细胞膜及细胞质内;而亲本细胞CHO-677中仅出现微弱的荧光(图 3b),这可能是非特异性反应的结果。进一步表明αv和β6基因已经成功导入重组细胞并能稳定表达。
|
| 图 3 细胞系CHO-677-mαvβ6的鉴定结果 Fig. 3 Identification of CHO-677-mαvβ6 cell line (a) Detection of integrin subunit αv and β6 genes in CHO-677-mαvβ6 cell line at the twentieth passages by PCR,The PCR products of αv gene (lanes 2,3) and β6 gene (lanes 5,6) are shown in CHO-677-mαvβ6 cell line,lanes 1and 7 are the negative control of αv gene and β6 gene,respectively. Molecular weight marker (TaKaRa) in lane M (b) Expression of integrin subunits αv and β6 in CHO-677-mαvβ6 cell line at the twentieth passages by IFA Photographs were taken at a magnification of 40 fold. One representative experiment is shown |
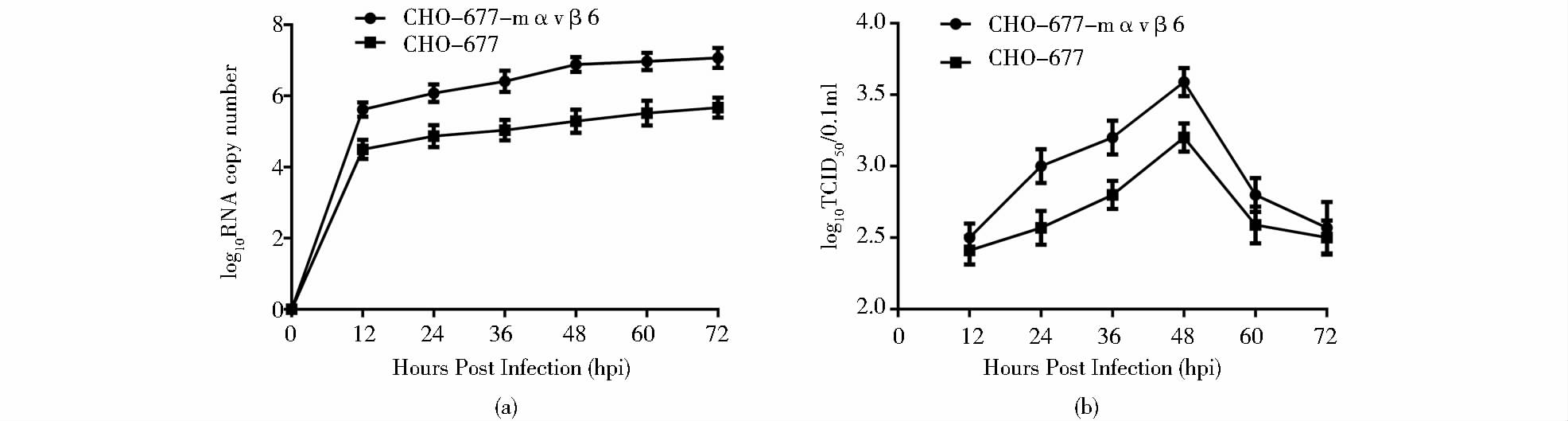
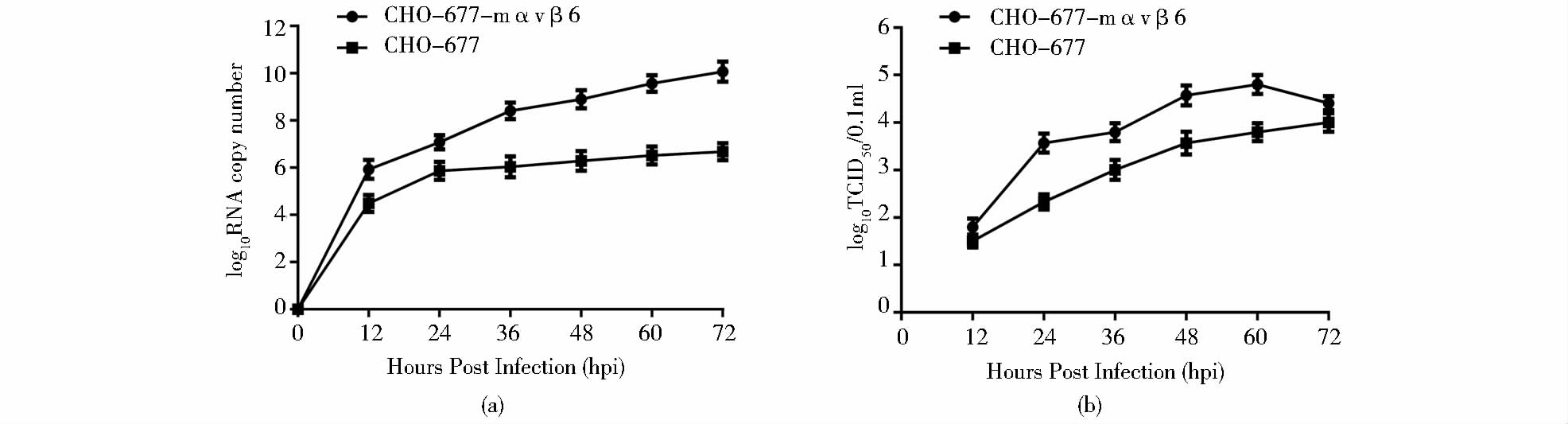
为了研究CHO-677-mαvβ6细胞系的功能特点,用FMDV的两种血清型毒株Asia1/HN/CHA/06和O/BY/CHA/2010感染CHO-677-mαvβ6细胞和CHO-677亲本细胞,分析了FMDV对细胞的易感性。为了分析病毒在两种细胞中的复制能力,用不同时间点收获的两种病毒上清进行实时荧光定量RT-PCR实验。结果表明,亲本细胞CHO-677中两种病毒的RNA复制水平均比细胞系CHO-677-mαvβ6低,并具有显著差异(表 2、表 3、图 4a和图 5a)。同时对两种毒株在两种细胞上的生长曲线进行比较,将不同时间点收获的上清液在BHK-21细胞上测定TCID50,然后根据不同时间点的TCID50绘制出病毒生长曲线,结果表明Asia1/HN/CHA/06毒株和O/BY/CHA/2010毒株在细胞系CHO-677-mαvβ6上的生长曲线明显高于亲本细胞CHO-677,并且在24 h、36 h、48 h和60 h具有显著差异(表 2、表 3、图 4b和图 5b)。FMDV RNA拷贝数和生长曲线两种生物学特性显示,细胞系CHO-677-mαvβ6比亲本细胞CHO-677对FMDV更易感,这说明鼠源整联蛋白αvβ6的导入增加了CHO-677-mαvβ6对FMDV的易感性,进一步证实了细胞系CHO-677-mαvβ6得以成功构建。
| Time (h) | Replicates | RNA copy number / TCID50 | |
| CHO-677-mαvβ6 | CHO-677 | ||
| 12 | 3 | 5.62±0.2a/2.50±0.10 | 4.49±0.27b/2.41±0.1 |
| 24 | 3 | 6.08±0.25a/3.00±0.12a | 4.87±0.31b/2.57±0.12b |
| 36 | 3 | 6.42±0.30a/3.20±0.12a | 5.03±0.29b/2.80±0.08b |
| 48 | 3 | 6.89±0.21a/3.59±0.09a | 5.29±0.33b/3.20±0.10b |
| 60 | 3 | 6.97±0.24a/2.80±0.13a | 5.52±0.35b/2.59±0.13b |
| 72 | 3 | 7.07±0.28a/2.57±0.17 | 5.67±0.28b/2.50±0.12 |
| a,b. Values with different superscripts within the same row differ significantly (P﹤0.05). The same as below | |||
| Time (h) | Replicates | RNA copy number / TCID50 | |
| CHO-677-mαvβ6 | CHO-677 | ||
| 12 | 3 | 5.92±0.41a/1.80±0.18 | 4.49±0.36b/1.50±0.14 |
| 24 | 3 | 7.08±0.30a/3.57±0.20a | 5.87±0.38b/2.33±0.16b |
| 36 | 3 | 8.41±0.35a/3.80±0.19a | 6.03±0.44b/3.00±0.21b |
| 48 | 3 | 8.89±0.38a/4.57±0.21a | 6.29±0.42b/3.57±0.24b |
| 60 | 3 | 9.57±0.36a/4.80±0.20a | 6.52±0.39b/3.80±0.19b |
| 72 | 3 | 10.07±0.43a/4.41±0.15 | 6.67±0.37b/4.00±0.20 |
|
| 图 4 FMDV Asia1/HN/CHA/06株在CHO-677-mαvβ6和CHO-677 细胞系中的生长特点 Fig. 4 Growth characteristics of FMDV Asia1/HN/CHA/06 strain in CHO-677-mαvβ6 and CHO-677 cells (a) The levels of viral RNA replication dynamics were determined in infected CHO-677-mαvβ6 cells at different time points by real-time PCR Copy numbers of FMDV were calculated using the standard curve function [y = -3.416log(x) + 42.85] (b) Single-step growth curves of Asia1/HN/CHA/06 in CHO-677-mαvβ6 and CHO-677 cells |
|
| 图 5 FMDV O/BY/CHA/2010株在CHO-677-mαvβ6和CHO-677 细胞系中的生长特点 Fig. 5 Growth characteristics of FMDV O/BY/CHA/2010 strain in CHO-677-mαvβ6 and CHO-677 cells (a) The levels of viral RNA replication dynamics were determined in infected CHO-677-mαvβ6 cells at different time points by real-time PCR Copy numbers of FMDV were calculated using the standard curve function [y = -3.416log(x) + 42.85] (b) Single-step growth curves of O/BY/CHA/2010 in CHO-677-mαvβ6 and CHO-677 cells |
口蹄疫作为一种高度感染性传染病,它的爆发严重影响着国家和地区的经济发展,对肉制品安全产生重大威胁。由于其病原FMDV的宿主范围广,变异频率高,对多种动物健康状况和生产能力的影响持久,使其成为一种具有重要经济意义的动物疫病[22, 23]。病毒的细胞表面受体在其宿主范围和组织嗜性中起着重要的作用。牛、猪以及野生偶蹄类动物是FMDV的自然宿主,然而乳鼠是FMDV实验室研究中重要的模型动物,具有很多优点,如便于操作、节约饲养空间和经费等。先前关于整联蛋白受体的研究主要集中在FMDV自然宿主牛和猪等牲畜上,而乳鼠作为FMDV的重要模式动物,且鼠源整联蛋白与猪或牛源整联蛋白有着高度的同源性,所以对乳鼠整联蛋白的研究具有重要的意义。另外,试验中用于构建细胞系的靶标细胞CHO-677不表达整联蛋白受体(αvβ1、αvβ3、αvβ6和αvβ8)和硫酸乙酰肝素受体[12],有助于对细胞系的验证;并且,成功构建后的细胞系CHO-677-mαvβ6用于研究整联蛋白αvβ6作为受体在FMDV感染中所发挥的作用时具有更强的特异性。
本文首先克隆了乳鼠整联蛋白αvβ6的基因,构建表达αvβ6的慢病毒载体,然后与辅助质粒共转染293T包装细胞,包装成慢病毒颗粒,再感染靶标细胞,经过抗生素筛选获得单克隆细胞系CHO-677-mαvβ6,通过PCR和间接免疫荧光实验从基因和蛋白水平检测了该细胞系,最后用FMDV感染,验证了该细胞系的功能。结果显示,该细胞系比亲本细胞更易感FMDV,证实我们成功构建了细胞系CHO-677-mαvβ6。为深入研究整联蛋白αvβ6作为病毒受体所发挥的功能及生物学意义提供了基础和平台。
| [1] | Mason P W, Grubman M J, Baxt B. Molecular basis of pathogenesis of FMDV. Virus Res, 2003, 91(1): 9-32. |
| [2] | Grubman M J, Baxt B. Foot-and-mouth disease. Clin Microbiol Rev, 2004, 17(2): 465-493. |
| [3] | Steinberger J, Grishkovskaya I, Cencic R, et al. Foot-and-mouth disease virus leader proteinase: structural insights into the mechanism of intermolecular cleavage. Virology, 2014, 468-470: 397-408. |
| [4] | Santos J A, Gouvea I E, Judice W A, et al. Hydrolytic properties and substrate specificity of the foot-and-mouth disease leader protease. Biochemistry, 2009, 48(33): 7948-7958. |
| [5] | Zunszain P A, Knox S R, Sweeney T R, et al. Insights into cleavage specificity from the crystal structure of foot-and-mouth disease virus 3C protease complexed with a peptide substrate. J Mol Biol, 2010, 395(2): 375-389. |
| [6] | Belsham G J. Translation and replication of FMDV RNA. Curr Top Microbiol Immunol, 2005, 288: 43-70. |
| [7] | O’Donnell V, Larocco M, Duque H, et al. Analysis of foot-and-mouth disease virus internalization events in cultured cells. J Virol, 2005, 79(13): 8506-8518. |
| [8] | Ruiz-Saenz J, Goez Y, Tabares W, et al. Cellular receptors for foot and mouth disease virus. Intervirology, 2009, 52(4): 201-212. |
| [9] | Gullberg M, Muszynski B, Organtini L J, et al. Assembly and characterization of foot-and-mouth disease virus empty capsid particles expressed within mammalian cells. J Gen Virol, 2013, 94(8): 1769-1779. |
| [10] | Bai X, Bao H, Li P, et al. Effects of two amino acid substitutions in the capsid proteins on the interaction of two cell-adapted PanAsia-1 strains of foot-and-mouth disease virus serotype O with heparan sulfate receptor. Virol J, 2014, 11: 132. |
| [11] | Wang G, Wang Y, Shang Y, et al. How foot-and-mouth disease virus receptor mediates foot-and-mouth disease virus infection. Virol J, 2015, 12(1): 9. |
| [12] | Berryman S, Clark S, Kakker N K, et al. Positively charged residues at the five-fold symmetry axis of cell culture-adapted foot-and-mouth disease virus permit novel receptor interactions. J Virol, 2013, 87(15): 8735-8744. |
| [13] | Mohapatra J K, Pandey L K, Rai D K, et al. Cell culture adaptation mutations in foot-and-mouth disease virus serotype A capsid proteins: implications for receptor interactions. J Gen Virol, 2015, 96(3): 553-564. |
| [14] | Rieder E, Henry T, Duque H, et al. Analysis of a foot-and-mouth disease virus type A24 isolate containing an SGD receptor recognition site in vitro and its pathogenesis in cattle. J Virol, 2005, 79(20): 12989-12998. |
| [15] | Monaghan P, Gold S, Simpson J, et al. The alpha(v)beta6 integrin receptor for Foot-and-mouth disease virus is expressed constitutively on the epithelial cells targeted in cattle. J Gen Virol, 2005, 86(10): 2769-2780. |
| [16] | Berryman S, Clark S, Monaghan P, et al. Early events in integrin alphavbeta6-mediated cell entry of foot-and-mouth disease virus. J Virol, 2005, 79(13): 8519-8534. |
| [17] | Monaghan P, Simpson J, Murphy C, et al. Use of confocal immunofluorescence microscopy to localize viral nonstructural proteins and potential sites of replication in pigs experimentally infected with foot-and-mouth disease virus. J Virol, 2005, 79(10): 6410-6418. |
| [18] | Zhao Q, Pacheco J M, Mason P W. Evaluation of genetically engineered derivatives of a Chinese strain of foot-and-mouth disease virus reveals a novel cell-binding site which functions in cell culture and in animals. J Virol, 2003, 77(5): 3269-3280. |
| [19] | Zhang Y, Zheng H X, Zhang Z D. Establishment of a Murine alpha nu beta 1 transgenic CHO-K1 cell line and its susceptibility to foot-and-mouth disease virus type Asia 1/HN/2006 in China. J Ani Vet Adv, 2013,12 (1): 108. |
| [20] | Ma X, Li P, Bai X, et al. Sequences outside that of residues 93-102 of 3A protein can contribute to the ability of foot-and-mouth disease virus (FMDV) to replicate in bovine-derived cells. Virus Res, 2014, 191: 161-171. |
| [21] | Gu Y X, Gao Z L, Zhou J H, et al. Establishment and evaluation of stable cell lines inhibiting foot-and-mouth disease virus by RNA interference. Biomed Res Int, 2014, 2014: 109428. |
| [22] | Zhang Z D, Hutching G, Kitching P, et al. The effects of gamma interferon on replication of foot-and-mouth disease virus in persistently infected bovine cells. Arch Virol, 2002, 147(11): 2157-2167. |
| [23] | Knowles N J, Samuel A R. Molecular epidemiology of foot-and-mouth disease virus. Virus Res, 2003, 91(1): 65-80. |
 2015, Vol. 35
2015, Vol. 35




