文章信息
- 谢欢, 于慧敏, 沈忠耀
- XIE Huan, YU Hui-min, SHEN Zhong-yao
- 芬芥素类脂肽生物表面活性剂的结构性能与合成强化
- Structure, Properties and Synthesis Reinforcement of Fengycins: Lipopeptide Biosurfactant
- 中国生物工程杂志, 2015, 35(7): 102-110
- China Biotechnology, 2015, 35(7): 102-110
- http://dx.doi.org/10.13523/j.cb.20150714
-
文章历史
- 收稿日期:2015-01-22
- 修回日期:2015-04-17
表面活性剂是一种具有两亲性的重要化工原料,被广泛应用于石油化工、精细化工、农业、食品与化妆品行业及环境工程等领域[1]。以芽孢杆菌为首的诸多微生物能够通过次级代谢合成多种生物表面活性剂,与传统化学合成的表面活性剂相比,具有对环境友好、表面活性优异、结构功能多样化、安全性高等突出优点,是目前研究的热点[2, 3]。此外,生物表面活性剂还具有抑菌、抗肿瘤、抗感染等诸多生物活性[4, 5, 6],因而在植物病虫害防治、食品工程、医药开发、临床治疗等方面具有良好的应用前景[7]。
生物表面活性剂根据其结构特点可分为六大类:糖脂类、脂肽/脂蛋白类、磷脂类、脂多糖-蛋白复合物、脂肪酸和中性脂类[8]。脂肽类生物表面活性剂是由亲水的寡肽和疏水的长链脂肪酸两部分组成的特殊分子[7],根据氨基酸的结构可分为环状脂肽和线形脂肽[9],在农业植物病害防治、提高石油采收率等领域具有应用潜力。脂肽类分子的生产菌株主要为芽孢杆菌Bacillus spp.,研究最为广泛的枯草芽孢杆菌(Bacillus subtilis)的环状脂肽产物有表面活性素(surfactin)、芬芥素(fengycin)和伊枯草菌素(iturin)三大家族[7, 9]。其中,表面活性素是一种高效稳定的脂肽类表面活性剂,能将水的表面张力由72 mN/m降到最低27 mN/m,是已有报道中表面活性最优异的生物表面活性剂[10]。芬芥素和伊枯草菌素具有与部分化学农药相当的生物活性,能够显著抑制植物真菌的生长[11]。尤其芬芥素对丝状真菌展现出极强的抑制作用[12],因而近年来芬芥素对植物病害的防治机理与潜在应用吸引了研究者的广泛关注。此外,如何提高芬芥素生物合成的产量也成为了研究的热点。本文就芬芥素的结构性能、合成机理以及生物合成强化策略进行简要综述,以期为进一步研究芬芥素在生物农药方面的应用提供参考。
1 脂肽家族芬芥素类生物表面活性剂 1.1 芬芥素的基本结构与表面活性素及伊枯草菌素类似,芬芥素也由亲水的肽环和疏水的β-脂肪酸链两部分组成[13]。多肽部分含10个氨基酸,包括4个D型构象氨基酸和一个非天然氨基酸鸟氨酸。氨基酸链序列为L-Glu、D-Orn、L-Tyr、D-allo-Thr、L-Glu、D-Ala/Val、L-Pro、L-Glu、D-Tyr、L-Ile,由第三位的L-酪氨酸和最后一位的L-异亮氨酸以内酯键结合。β-羟基脂肪酸链长度为14-18个碳原子,与肽段的N端相连构成疏水尾部[14]。不同之处在于,表面活性素通过β-羟基脂肪酸链与肽段形成内酯键成环,伊枯草菌素则是β-氨基脂肪酸与肽段以酰胺键成环,两者的肽环部位均包含7个天然氨基酸,脂肪酸链则由12-16个碳原子组成。芬芥素与表面活性素和伊枯草菌素的基本分子结构对比如图 1所示。
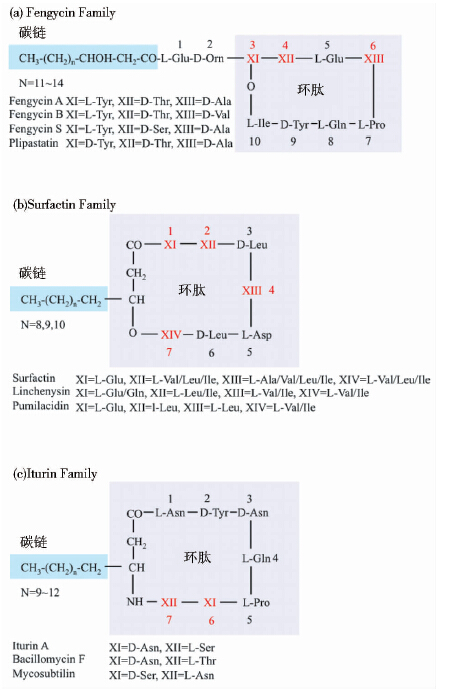
|
| 图 1 芬芥素、表面活性素和伊枯草菌素分子结构 Fig. 1 Structures of representative members within the three lipopeptide families (a) Fengycin family (b) Surfactin family (c)Iturin family |
枯草芽孢杆菌合成的芬芥素是由多种结构相似的同系物组成的混合物,统称芬芥素家族,其结构上的差异主要在于脂肪酸链的长度以及肽环特定位点氨基酸的种类的不同。根据多肽第六位氨基酸的不同将早期鉴定的芬芥素同系物分为A、B两类:芬芥素A的第六位氨基酸残基为丙氨酸,而芬芥素B的第六位氨基酸为缬氨酸[15, 16, 17]。Sang-Cheol等[18]于2010年分离得到的Bacillus amyloliquefaciens LSC04菌株经鉴定能合成一种新型结构的芬芥素,将其命名为芬芥素S,该分子与芬芥素A的区别在于第四位氨基酸残基为丝氨酸。
此外,大侧柏素Plipastatin也隶属芬芥素家族,是一种理化性质与芬芥素极为相似的脂肽类抗生素,与后者的区别仅为第三位酪氨酸构型不同。大侧柏素最初由Nishikiori等人从蜡状芽孢杆菌产物中发现[19],随后Tsuge[20]和Niran[21]等人在枯草芽孢杆菌株的代谢产物中分离纯化得到了大侧柏素。现有的电喷射离子化/碰撞诱导解离(ESI/CID)技术产生特征离子碎片从而能够快速精准鉴定芬芥素分子结构,包括脂肪酸链长度与特定位点氨基酸的种类[16]。
相应的,表面活性素家族与伊枯草菌素家族也包含了诸多在特定位点氨基酸种类有差异的同系物,这些异构体的结构差异与枯草芽孢杆菌中脂肽分子的非核糖体肽合成机制是息息相关的。三大脂肽类表面活性剂家族主要的同系物分子结构见图 1。
2 芬芥素的生物合成与调控 2.1 非核糖体肽合成体系研究表明,芬芥素、表面活性素和伊枯草菌素等脂肽分子的多肽部分在枯草芽孢杆菌中是通过特殊的非核糖体肽合成酶(non-ribosomal peptide synthetases,NRPSs)生物合成。非核糖体肽合成酶是由多个功能模块组成的复合酶体系,各模块负责活化不同的氨基酸使肽段延长[13]。每个模块包含一个由550个氨基酸残基构成的腺苷酰化结构域(adenylation domain,A domain),负责识别和腺苷酰化特定的氨基酸。此外模块中还有一个缩合结构域(condensation domain,C domain)与肽酰基载体蛋白(peptide carrier protein,PCP),被活化的氨基酸随即被传递到PCP的辅因子4′-磷酸泛酰巯基乙胺上,在缩合结构域的作用下与前一个模块的肽链相连接,该过程按照相邻合成酶各组成模块的顺序依次向前直到多肽合成结束[22, 23]。非核糖体肽合成酶亚基的最后一个模块中通常会包含一个差向异构酶结构域(epimerization domain,E domain),其作用是将被激活的L-氨基酸转化为D-氨基酸,某些合成酶模块也能直接活化D构象的氨基酸。综上所述,全酶由多个模块按照特定的空间顺序排列而成,模块的数量、种类以及排列次序决定了产物肽链的长短、氨基酸种类和顺序。非核糖体肽与核糖体肽合成机理对比如图 2所示。
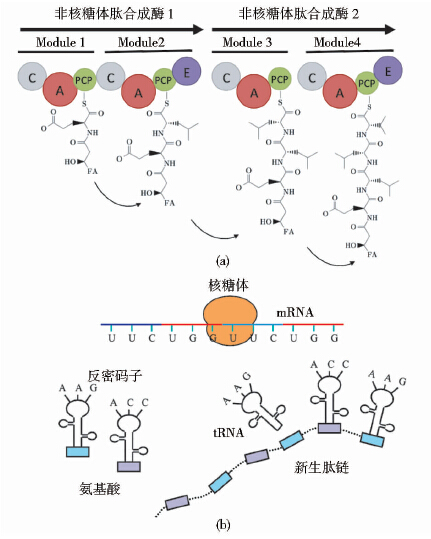
|
| 图 2 非核糖体肽与核糖体肽合成途径 Fig. 2 Biosynthesis of non-ribosomal and ribosomal peptide (a)Non-ribosomal peptide synthesis (b)Ribosomal peptide synthesis |
芬芥素合成酶基因簇包含五个开放阅读框ORFs,分别编码芬芥素合成酶的五个亚基,这五个开放阅读框在fen操纵子中以fenC,fenD,fenE,fenA,fenB的顺序线性排列并共享同一个启动子[13, 22, 23]。芬芥素合成酶FenC负责活化并组装第一位和第二位氨基酸L-谷氨酸和L-鸟氨酸,脂肪酸链被连接在由FenC活化的L-谷氨酸上。FenD活化第三位和第四位氨基酸L-酪氨酸和D-苏氨酸,FenE活化第五位L-谷氨酸和第六位D-丙氨酸/缬氨酸,FenA活化第七位L-脯氨酸、第八位L-谷氨酸和第九位D-酪氨酸,而FenB则负责组装最后一位氨基酸L-异亮氨酸[24]。由此可见,芬芥素A/B型的合成主要取决于FenE合成酶。Shu等[24]通过对B. subtilis F29-3的研究发现合成酶FenE包含两个氨基酸激活模块FenE1和FenE2,分别负责活化L-谷氨酸和D-丙氨酸/缬氨酸。体外ATP-PPi交换反应实验表明,FenE2更倾向于利用L-缬氨酸而非L-丙氨酸作为底物,这能很好地解释B. subtilis F29-3在自然条件下合成的芬芥素B是芬芥素A的两倍。如图 3所示。
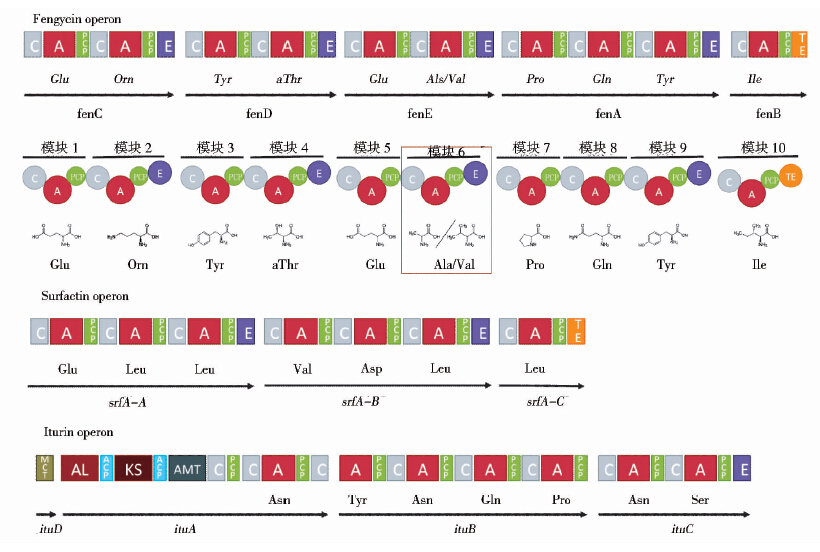
|
| 图 3 芬芥素、表面活性素和伊枯草菌素家族合成酶基因簇及其产物 Fig. 3 Operons of fengycin,surfactin and iturin synthases |
与芬芥素合成基因簇类似,编码表面活性素合成酶的基因srfA-A,srfA-B,srfA-C与srfA-D共同构成srfA操纵子,由SrfA-A和SrfA-B负责组装前六位氨基酸,SrfA-C组装第七位氨基酸。srfA-C编码的第一个硫酯结构域TE负责终止肽链延伸并释放多肽产物,而srfA-D编码的第二个硫酯/酰基转移结构域(thioesterase / acyltransferase domain,Te/At domain)则具有激活并启动表面活性素肽链合成反应的功能[7]。
不同于芬芥素和表面活性素,伊枯草菌素是通过聚酮合成酶(polyketide synthase,PKS)-非核糖体肽合成酶杂合体系(PKS-NRPS)合成的[25]。后三个基因ituA、ituB和ituC负责编码合成伊枯草菌素肽环结构的非核糖体肽合成酶(NRPSs)。位于操纵子最上游的ituD负责编码丙二酰辅酶A转酰酶(MCT domain),如图 3所示,ituA的部分基因也与聚酮化合物合成酶相关,这些基因编码的聚酮合成酶参与脂肽类分子碳链合成的最终步骤并为肽段部分氨基酸分子的组装做好准备[26]。
欧洲枯草芽孢杆菌测序项目结果显示,B.subtilis 168染色体最大的两个操纵子都是编码非核糖体肽合成酶的基因,分别为位于32°到35°的表面活性素操纵子(srf operon)和位于167°到171°的一个合成酶基因簇pps[15, 27]。后者共包含五个pps合成酶基因,其中ppsE基因与B.subtilis F29-3菌株的fenB基因在结构上高度相似(74%)[15]。根据这个结果,Tosato等[28]推测pps基因的产物即为芬芥素合成酶。但该基因在野生B.subtilis 168菌株中并未得到表达,采用反相高效液相色谱法(使用ODS Hypersil C18硅胶色谱柱,紫外检测器,波长210 nm,乙腈作为流动相,流速为0.75 ml/min;利用甲醇抽提发酵液酸沉产物可得到Fengycin粗产品)也未能在其代谢产物中检测到芬芥素类同系物。Tsuge等[29]研究发现lpa-8是pps基因簇表达的关键因素,引入外源lpa-8基因之后对产物进行结构鉴定显示B.subtilis 168的衍生菌株能够合成大侧柏素plipastatin,结果证实pps基因簇编码的是大侧柏素的合成酶复合体。
2.3 芬芥素的合成调控因素从上个世纪90年代至今,相关研究对芬芥素合成酶的亚结构和功能已有较为清晰的阐述,但在枯草芽孢杆菌中关于其合成调控机制的报道仍然很少。研究发现degQ基因的敲除会导致芬芥素同系物合成水平明显降低,但对表面活性素的生物合成并无明显影响[29]。由此推测DegQ能够通过影响DegU /DegS双因子调控系统的活性从而促进枯草芽孢杆菌合成芬芥素。此外董伟欣等[30]报道phoP基因对枯草芽胞杆菌NCD-2菌株中芬芥素的合成具有正调控功能。磷酸化的PhoP并非与芬芥素合成酶基因簇的启动子区相结合,而是通过影响下游其他基因的表达从而间接调控芬芥素合成酶基因的表达。
3 芬芥素的抑菌作用 3.1 芬芥素的抑菌活性早在1986年,Vanittanakom等[12]就发现芬芥素对植物病原体真菌的活性有抑制作用,但其对细菌和酵母无明显效果。近年来国内外涌现出许多关于芬芥素抗生活性的研究报道(表 1),结果显示芬芥素对白粉病菌Podosphaera fusca[31]、番茄茄灰霉菌Botrytis cinerea[32]、桃软腐病菌Rhizopus stolonifer[33, 34]、油菜菌核病菌Sclerotinia sclerotiorum[35]等多种农业致病菌都有优异的抑菌活性,在防治植物病害方面有广阔的应用前景。
| 来源菌株 | 芬芥素种类 | 目标菌株 | 主要宿主 | 文献 |
| B. subtilis UMAF6639 | Fengycins | Podosphaera fusca | 玄参科 | Romero D.,et al. 2007[31] |
| B. subtilis CPA-8 | Fengycin A(C15-C18) Fengycin B(C15-C16) | Monilinia Laxa | 蔷薇科 | Yánez V.,et al. 2012[36] |
| B. subtilis NCD-2 | Fengycin A | Botrytis Cinerea | 葡萄科/茄科 | DONG W.,et al. 2013 [32] |
| B. subtilis Fmbj | Fengycin A(C14-C17) | Rhizopus Stolonifer | 蔷薇科 | Tang Q.,et al. 2014 [34] |
进一步研究发现,尽管大部分脂肽类生产菌株能同时合成三类脂肽分子,但与表面活性素及伊枯草菌素相比,芬芥素表现出更为显著的抗真菌活性,且芬芥素合成酶基因(fen)发生缺失突变的菌株对病原体真菌的拮抗活性显著降低[32],揭示了芬芥素在植物致病菌的防治中发挥主要作用。
3.2 芬芥素的抑菌机理研究芬芥素的抑菌机理研究对预测微生物对脂肽抗生素的耐受性,指导生物农药研发,寻找诊断靶点等都具有积极作用。目前关于芬芥素的研究普遍认为脂肽芬芥素分子和大部分天然抗菌多肽物质类似,其生物抗菌活性的机理与它能够增强细胞质膜的渗透性有关[37]。Deleu等[38]发现芬芥素对细胞膜有显著的扰乱作用,通过基于芬芥素浓度的两态跃迁过程导致磷脂双分子层损伤从而令细胞死亡:在低浓度下,芬芥素聚合形成孔洞导致膜的渗透率发生变化;在高浓度下,芬芥素和已报道的表面活性素类似,作为洗涤剂促进细胞膜溶解。该过程主要由芬芥素对脂质双分子层的吸引力等物理化学性质所驱动。
体外研究发现,芬芥素对单分子膜和双层膜都有渗透能力(结合并插入),芬芥素较小的肽环结构和优异的两亲性有利于其分子从水相插入膜结构并加速渗透过程。相比含有凝胶态脂质的紧密双分子层,芬芥素更易于插入流动性的分子膜[39]。唐群勇等[40]通过31PNMR研究脂肽与模拟细胞膜的相互作用发现,芬芥素可破坏细胞膜中磷酰基的结构,此外还能抑制桃软腐菌DNA的复制从而改变致病菌的细胞周期。还有研究发现芬芥素对真菌呼吸代谢的HMP途径有抑制作用,能够影响线粒体NADH脱氢酶和琥珀酸脱氢酶的活性,并抑制该微生物对蛋白质的利用[40]。
除了通过破坏病原体细胞形态与结构产生直接拮抗作用,也有研究表明芬芥素和表面活性素还可以激发植物体可诱导防御机制,增强农作物对病原体进一步感染的抵抗性[41]。
4 芬芥素生物合成强化虽然芬芥素具有优异的抗真菌性能,该类脂肽分子的实际应用因产量低而受到较大限制。在三大脂肽类物质中,表面活性素在发酵罐中的产量已高达6 450mg/L[42],伊枯草菌素通过固态发酵得到2 700mg/kg基质的产量[43],而芬芥素目前已报道的最高产量仅为982 mg/L[44]。目前,利用枯草芽孢杆菌生物合成芬芥素的强化研究采用的主要手段有:利用基因工程更换强启动子提高芬芥素合成酶基因表达水平,通过细胞固定化培养和无泡式反应器提高芬芥素产量,添加金属元素提高生物质量和芬芥素产量[43]。表 2列出了近年来针对芬芥素生物合成的研究手段及效果。
| 生产菌株 | 发酵条件 | 策略 | 芬芥素mg/L | 文献来源 |
| B. subtilis S499 | 30℃,72 h | 优化培养基组成 | 95 | Philippe J.,et al. 1999[45] |
| B. subtilis BS2508 | 30℃,72 h | 替换强启动子(pamyQ) | 434 | Marc O.,et al. 2007 [41] |
| B. subtilis ATCC21332 | 30℃,48 h | 固定化培养(TPFIBR)补充Fe2+ | 680 | Gancel F.,et al. 2009 [46] |
| B. subtilis ATCC21332 | 30℃,72 h | 固定化培养(PPch) | 320 | Chtioui O.,et al. 2010 [47] |
| B. subtilis ATCC21332 | 30℃,72 h | 中空纤维膜空气-液体 接触反应器 | 982 | Coutte F.,et al. 2010 [44] |
| B. subtilis ATCC21332 | 30℃,72 h | 旋转磁盘无泡反应器 | 838 | Chtioui O.,et al. 2012 [48] |
| B. subtilis ATCC21332 | 30℃,72 h | 旋转磁盘无泡反应器 调节氧传递系数 | 944 | Chtioui O.,et al. 2014 [49] |
上表中芬芥素产量均利用反相高效液相色谱测得,样品由发酵上清液通过C18固相萃取柱制备。
4.1 补充金属元素诸多研究表明在培养基中添加Mg2+、K+、Mn2+、Fe2+等金属元素能够显著提高发酵过程中枯草芽孢杆菌的生物质量和脂肽类分子的产量[45]。在LB发酵液(100mmol/L MOPS缓冲液)中添加0.35%二价铁离子Fe2+后ATCC21332菌株芬芥素产量由对照组310mg/L变680mg/L,提高了近1.1倍[46]。
4.2 更换启动子Marc Ongena等[41]在研究芬芥素和表面活性素的生物活性时通过将枯草芽孢杆菌中的芬芥素启动子pfen替换为强启动子pamyQ构建得到Bs2508菌株,经检测Bs2508的芬芥素产量为434 mg/L,而初始菌株Bs2500在相同培养条件下则检测不到芬芥素的合成,该实验表明启动子亦是影响枯草芽孢杆菌芬芥素合成的重要因素之一。
4.3 细胞固定化在早期研究中,枯草芽孢杆菌ATCC21332被认为只能合成表面活性素类脂肽分子,浮游态细胞培养液中无法检测到芬芥素的存在[50]。近年来随着细胞固定化培养技术的发展,相关研究发现以ppch作为固定载体经过72 h的发酵,B. subtilis ATCC 21332菌株芬芥素的产量能达到320 mg/L左右[47],与此同时表面活性素的产量也有2.0~4.3倍的增长。进一步探究表明,枯草芽孢杆菌合成芬芥素与培养过程中生产菌株生物膜的形成状况有着紧密联系。通过固定化细胞培养的方法促进发酵过程中枯草芽孢杆菌生物膜的形成能够有效地提高芬芥素的产量。
4.4 无泡反应器由于脂肽类分子具有优异的表面活性性能,传统生物反应器利用鼓泡和搅拌强制通氧会导致发酵过程中大量起泡从而严重影响菌体生长,与此同时大量脂肽类产物从发酵液转移到泡沫中不利于进一步分离纯化,因而解决发酵过程中起泡问题成为优化生产工艺的关键[42]。使用传统化学消泡剂会产生传质速率降低、抑制反应以及对细胞产生毒害等问题[51],现有的解决方案是采用无泡式生物反应器,已报道的该类反应器主要分为中空纤维膜空气-液体接触反应器[44]和旋转磁盘反应器[48](图 4)。
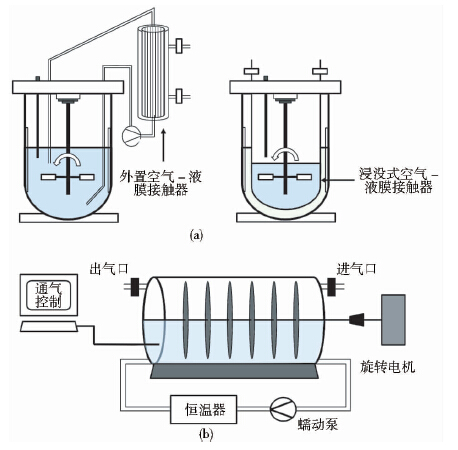
|
| 图 4 无泡反应器示意图 Fig. 4 Schematic diagram of bubbleless reactor (a)Bubbleless reactor with hollow fiber membrane(b) Rotating discs bioreactor |
前者将中空纤维膜空气-液体接触器集成到传统发酵罐中作为供氧系统,发酵液和空气分别在接触器纤维膜两侧流动循环,氧气在气体扩散的作用下通过中空纤维膜上的气孔传递到发酵基质液相中,该设计能有效解决发酵起泡的问题。目前实验室采用的该类反应器主要有气液接触器外置式和内置浸没式两种设计(图 4(a))[44]。经过72 h的发酵,气液接触器外置的反应器中ATCC21332菌株的芬芥素产量为622 mg/L,气液接触器内置的反应器中芬芥素产量高达982 mg/L,研究者认为后者发酵时相对较低水平的氧气传递是提高芬芥素发酵产量的重要原因。该反应器的显著缺点是装置复杂、成本高、生产规模难以扩大。
实验室采用旋转磁盘反应器进行发酵时[图 4(b)],细胞聚集在部分浸没于培养基的不锈钢磁盘表面,这些磁盘平行固定于中轴上由电机驱动以稳定的速率旋转,培养基液面通气实现供氧并解决了发酵起泡的问题。该反应器具有结构简单、能耗低、操作方便、便于扩大生产规模等优点。利用该反应器ATCC21332的芬芥素产量由393 mg/L提高到838 mg/L[48]。
此外,本课题组研究表明,过表达YerP等跨膜蛋白可以提高表面活性素的产量[52];通过将枯草芽孢杆菌中固有的表面活性素启动子替换为更强的Pgrac后得到的工程菌株的表面活性素产量在原有基础上提高了近十倍;与此同时通过发酵过程泡沫回流设计,在5 L发酵罐中实现了表面活性素的高浓度积累。由此推论,启动子改造和过程强化很可能也是实现芬芥素高产的关键因素。然而,由于枯草芽孢杆菌在不适宜条件或胁迫条件下,容易生成大量芽孢,从而终止目标产物的合成。因此,芽孢生成的阻断或者寻找新宿主菌株也可能成为提高芬芥素产量的有效途径。
5 总结与展望枯草芽孢杆菌能合成芬芥素、表面活性素、伊枯草菌素等多种具有表面活性及抑菌活性的脂肽分子。芬芥素的表面活性较表面活性素和伊枯草菌素虽略逊一筹,但其优异的抗生活性及在农作物保护等领域良好的应用前景吸引了广泛的关注。目前关于芬芥素的分子结构及非核糖体肽合成体系已有较为清晰完整的阐释,但其合成调控机制与抑菌机理有待进一步研究。
现有的研究成果也为提高芬芥素生物合成产量提供了很好的思路,一方面可以利用基因工程提高芬芥素合成酶基因的表达水平并阻断芽孢生成等不利因素,另一方面可以采用固定化培养、无泡反应器设计、调节供氧水平、补充金属元素等手段对生产工艺进行优化。结合基因工程和工艺优化,芬芥素的生物合成有望得到进一步的提升,并为其实际应用提供良好的基础。
| [1] | 方云, 夏咏梅. 生物表面活性剂. 北京: 中国轻工业出版社, 1992:1-160. Fang Y, Xia Y M. Biosurfactants. Beijing: China Light Industry Press, 1992:1-160. |
| [2] | 杨福廷. 脂肽类生物表面活性剂研究进展. 精细化工, 2006, 23(2): 121-124. Yang F T. Progress in research of lipopeptide biosurfactants. Fine Chemicals, 2006, 23(2): 121-124. |
| [3] | 吕应年, 杨世忠, 牟伯中. 脂肽的分离纯化与结构研究. 微生物学通报, 2005, 32(1): 67-73. Ying N L, Yang S Z, Mu B Z. Isolation and identification of a lipopeptide. Microbiology, 2005, 32(1):67-73. |
| [4] | Kim S, Kim J Y, Kim S H, et al. Surfactin from Bacillus subtilis displays anti-proliferative effect via apoptosis induction, cell cycle arrest and survival signaling suppression. FEBS Letters, 2007, 581(5): 865-871. |
| [5] | Hwang M H, Lim J H, Yun H I, et al. Surfactin C inhibits the lipopolysaccharide-induced transcription of interleukin-1β and inducible nitric oxide synthase and nitric oxide production in murine RAW 264.7 cells. Biotechnology Letters, 2005, 27(20): 1605-1608. |
| [6] | Kikuchi T, Hasumi K. Enhancement of plasminogen activation by surfactin C: augmentation of fibrinolysis in vitro and in vivo. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 2002, 1596(2): 234-245. |
| [7] | Peypoux F, Bonmatin J M, Wallach J. Recent trends in the biochemistry of surfactin. Applied Microbiology and Biotechnology, 1999, 51(5): 553-563. |
| [8] | Lang S. Biological amphiphiles (microbial biosurfactants). Current Opinion in Colloid & Interface Science, 2002, 7(1): 12-20. |
| [9] | 刘向阳, 杨世忠, 牟伯中.微生物脂肽的结构. 生物技术通报, 2005, 4: 18-26. Liu X Y, Yang S Z, Mou B Z.Molecular structures of microbial lipopeptides. Biotechnology Bulletin, 2005, 4: 18-26. |
| [10] | Noah K S, Bruhn D F, Bala G A. Surfactin production from potato process effluent by Bacillus subtilis in a chemostat.Twenty-Sixth Symposium on Biotechnology for Fuels and Chemicals. New Jersey:Humana Press, 2005: 465-473. |
| [11] | Sandrin C, Peypoux F, Michel G. Coproduction of surfactin and iturin A, lipopeptides with surfactant and antifungal properties, by Bacillus subtilis. Biotechnology and Applied Biochemistry, 1990, 12(4): 370-375. |
| [12] | Vanittanakom N, Loeffler W, Koch U, et al. Fengycin-a novel antifungal lipopeptide antibiotic produced by Bacillus subtilis F-29-3. The Journal of Antibiotics, 1986, 39(7): 888-901. |
| [13] | Chen C L, Chang L K, Chang Y S, et al. Transposon mutagenesis and cloning of the genes encoding the enzymes of fengycin biosynthesis in Bacillus subtilis. Molecular and General Genetics MGG, 1995, 248(2): 121-125. |
| [14] | Schneider J, Taraz K, Budzikiewicz H, et al. The structure of two fengycins from Bacillus subtilis S499. Zeitschrift fur Naturforschung C, 1999, 54(12): 859-866. |
| [15] | Steller S, Vollenbroich D, Leenders F, et al. Structural and functional organization of the fengycin synthetase multienzyme system from Bacillus subtilis b213 and A1/3. Chemistry & Biology, 1999, 6(1): 31-41. |
| [16] | Wang J, Liu J, Wang X, et al. Application of electrospray ionization mass spectrometry in rapid typing of fengycin homologues produced by Bacillus subtilis. Letters in Applied Microbiology, 2004, 39(1): 98-102. |
| [17] | Ongena M, Jacques P, Touré Y, et al. Involvement of fengycin-type lipopeptides in the multifaceted biocontrol potential of Bacillus subtilis. Applied Microbiology and Biotechnology, 2005, 69(1): 29-38. |
| [18] | Sang-Cheol L, Kim S H, Park I H, et al. Isolation, purification, and characterization of novel fengycin S from Bacillus amyloliquefaciens LSC04 degrading-crude oil. Biotechnology and Bioprocess Engineering, 2010, 15(2): 246-253. |
| [19] | Nishikiori T, Naganawa H, Muraoka Y, et al. Plipastatins: new inhibitors of phospholipase A2, produced by Bacillus cereus BMG302-fF67. III. Structural elucidation of plipastatins. The Journal of Antibiotics, 1986, 39(6): 755-761. |
| [20] | Tsuge K, Ano T, Shoda M. Isolation of a gene essential for biosynthesis of the lipopeptide antibiotics plipastatin B1 and surfactin in Bacillus subtilis YB8. Archives of Microbiology, 1996, 165(4): 243-251. |
| [21] | Roongsawang N, Thaniyavarn J, Thaniyavarn S, et al. Isolation and characterization of a halotolerant Bacillus subtilis BBK-1 which produces three kinds of lipopeptides: bacillomycin L, plipastatin, and surfactin. Extremophiles, 2002, 6(6): 499-506. |
| [22] | Lin G H, Chen C L, Tschen J S M, et al. Molecular cloning and characterization of fengycin synthetase gene fenB from Bacillus subtilis. Journal of Bacteriology, 1998, 180(5): 1338-1341. |
| [23] | Lin T P, Chen C L, Chang L K, et al. Functional and transcriptional analyses of a fengycin synthetase gene, fenC, from Bacillus subtilis. Journal of Bacteriology, 1999, 181(16): 5060-5067. |
| [24] | Shu H Y, Lin G H, Wu Y C, et al. Amino acids activated by Fengycin synthetase FenE. Biochemical and Biophysical Research Communications, 2002, 292(4): 789-793. |
| [25] | Ongena M, Jacques P. Bacillus lipopeptides: versatile weapons for plant disease biocontrol. Trends in Microbiology, 2008, 16(3): 115-125. |
| [26] | Roongsawang N, Washio K, Morikawa M. Diversity of nonribosomal peptide synthetases involved in the biosynthesis of lipopeptide biosurfactants. International Journal of Molecular Sciences, 2010, 12(1): 141-172. |
| [27] | Tognoni A, Franchi E, Magistrelli C, et al. A putative new peptide synthase operon in Bacillus subtilis: partial characterization. Microbiology,1995, 141(3): 645-648. |
| [28] | Tosato V, Albertini A M, Zotti M, et al. Sequence completion, identification and definition of the fengycin operon in Bacillus subtilis 168. Microbiology,1997, 143(11): 3443-3450. |
| [29] | Tsuge K, Ano T, Hirai M, et al. The genes degQ, pps, and lpa-8 (sfp) are responsible for conversion of Bacillus subtilis 168 to plipastatin production. Antimicrobial Agents and Chemotherapy, 1999, 43(9): 2183-2192. |
| [30] | 董伟欣, 李社增, 鹿秀云, 等. 枯草芽胞杆菌 NCD-2 中调控因子 PhoP对 fengycin 合成的调控作用. 植物病理学报, 2014, 44(2): 180-187. Dong W X, Li D Z, Lu X Y, et al. Regulation of fengycin biosynthase by regulator PhoP in the Bacillus subtilis strain NCD-2. Acta Hytophthologica Sinica, 2014, 44(2): 180-187. |
| [31] | Romero D, de Vicente A, Rakotoaly R H, et al. The iturin and fengycin families of lipopeptides are key factors in antagonism of Bacillus subtilis toward Podosphaera fusca. Molecular Plant-Microbe Interactions, 2007, 20(4): 430-440. |
| [32] | Dong W, Li B, Li S, et al. The fengycin lipopeptides are major components in the Bacillus subtilis strain NCD-2 against the growth of Botrytis cinerea. Acta Phytopathologica Sinica, 2013, 43(4): 401-410. |
| [33] | Tao Y, Bie X, Lv F, et al. Antifungal activity and mechanism of fengycin in the presence and absence of commercial surfactin against Rhizopus stolonifer. The Journal of Microbiology, 2011, 49(1): 146-150. |
| [34] | Tang Q, Zhou X, Lu Z, et al. Effects of fengycin from Bacillus subtilis fmbJ on respiratory chain and nutrients utilization of Rhizopus stolonifer. Food Science, 2011, 32(11): 248-254. |
| [35] | Ramarathnam R, Bo S, Chen Y, et al. Molecular and biochemical detection of fengycin and bacillomycin D-producing Bacillus spp., antagonistic to fungal pathogens of canola and wheat. Canadian Journal of Microbiology, 2007, 53(7): 901-911. |
| [36] | Yánez-Mendizábal V, Zeriouh H, Viáas I, et al. Biological control of peach brown rot (Monilinia spp.) by Bacillus subtilis CPA-8 is based on production of fengycin-like lipopeptides. European Journal of Plant Pathology, 2012, 132(4): 609-619. |
| [37] | Deleu M, Paquot M, Nylander T. Effect of fengycin, a lipopeptide produced by Bacillus subtilis, on model biomembranes. Biophysical Journal, 2008, 94(7): 2667-2679. |
| [38] | Deleu M, Paquot M, Nylander T. Fengycin interaction with lipid monolayers at the air-aqueous interface implications for the effect of fengycin on biological membranes. Journal of Colloid and Interface Science, 2005, 283(2): 358-365. |
| [39] | Eeman M, Deleu M, Paquot M, et al. Nanoscale properties of mixed fengycin/ceramide monolayers explored using atomic force microscopy. Langmuir, 2005, 21(6): 2505-2511. |
| [40] | 唐群勇, 周小虹, 陆兆新, 等. Bacillus subtilis fmbJ 产 Fengycin 对Rhizopus stolonifer呼吸链及营养物质利用的影响. 食品科学, 2011, 32(11): 248-254. Tang Y Q, Zhou X H, Lu Z X, et al. Effects of fengycin from Bacillus subtilis fmbJ on respiratory chain and nutrients utilization of Rhizopus stolonifer. Food Science, 2011, 32(11):248-254. |
| [41] | Ongena M, Jourdan E, Adam A, et al. Surfactin and fengycin lipopeptides of Bacillus subtilis as elicitors of induced systemic resistance in plants. Environmental microbiology, 2007, 9(4): 1084-1090. |
| [42] | Yeh M S, Wei Y H, Chang J S. Bioreactor design for enhanced carrier-assisted surfactin production with Bacillus subtilis. Process Biochemistry, 2006, 41(8): 1799-1805. |
| [43] | Khan A W, Zohora U S, Rahman M S, et al. Production of iturin A through glass column reactor (GCR) from soybean curd residue (okara) by Bacillus subtilis RB14-CS under solid state fermentation (SSF). Advances in Bioscience and Biotechnology, 2012, 3(2): 143-148. |
| [44] | Coutte F, Lecouturier D, Yahia S A, et al. Production of surfactin and fengycin by Bacillus subtilis in a bubbleless membrane bioreactor. Applied Microbiology and Biotechnology, 2010, 87(2): 499-507. |
| [45] | Jacques P, Hbid C, Destain J, et al. Optimization of biosurfactant lipopeptide production from Bacillus subtilis S499 by Plackett-Burman design.Twentieth Symposium on Biotechnology for Fuels and Chemicals. New Jersey:Humana Press, 1999: 223-233. |
| [46] | Gancel F, Montastruc L, Liu T, et al. Lipopeptide overproduction by cell immobilization on iron-enriched light polymer particles. Process Biochemistry, 2009, 44(9): 975-978. |
| [47] | Chtioui O, Dimitrov K, Gancel F, et al. Biosurfactants production by immobilized cells of Bacillus subtilis ATCC 21332 and their recovery by pertraction. Process Biochemistry, 2010, 45(11): 1795-1799. |
| [48] | Chtioui O, Dimitrov K, Gancel F, et al. Rotating discs bioreactor, a new tool for lipopeptides production. Process Biochemistry, 2012, 47(12): 2020-2024. |
| [49] | Chtioui O, Dimitrov K, Gancel F, et al. Selective fengycin production in a modified rotating discs bioreactor. Bioprocess and Biosystems Engineering, 2014, 37(2): 107-114. |
| [50] | Davis D A, Lynch H C, Varley J. The production of surfactin in batch culture by Bacillus subtilis ATCC 21332 is strongly influenced by the conditions of nitrogen metabolism. Enzyme and Microbial Technology, 1999, 25(3): 322-329. |
| [51] | Lee B S, Kim E K. Lipopeptide production from Bacillus sp. GB16 using a novel oxygenation method. Enzyme and Microbial Technology, 2004, 35(6): 639-647. |
| [52] | Li X, Yang H, Yu H M, et al. Overexpression of specific proton motive force-dependent transporters facilitate the export of surfactin in Bacillus subtilis. Journal of Industrial Microbiology & Biotechnology, 2015, 42(1): 93-103. |
 2015, Vol. 35
2015, Vol. 35




