文章信息
- 易善勇, 杨晶, 官丽莉, 王艳芳, 黄建, 王立勇, 李海燕, 李校堃, 姜潮
- YI Shan-yong, YANG Jing, GUAN Li-li, WANG Yan-fang, HUANG Jian, WANG Li-yong, LI Hai-yan, LI Xiao-kun, JIANG Chao
- 成纤维细胞生长因子9(FGF9)的研究进展
- Research Progresses On The Fibroblast Growth Factor 9
- 中国生物工程杂志, 2015, 35(7): 94-101
- China Biotechnology, 2015, 35(7): 94-101
- http://dx.doi.org/10.13523/j.cb.20150713
-
文章历史
- 收稿日期:2015-03-31
- 修回日期:2015-04-15
2. 吉林农业大学中药材学院 长春 130118
2. School of Traditional Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130118, China
FGF9最初发现于人类神经胶质瘤细胞系[1],其具有神经胶原激活因子的活性,基于其活性最初被命名为胶质细胞激活因子(glia-activating factor,GAF)。FGF9是一种自分泌或旁分泌生长因子,在许多生理过程起着至关重要的作用,包括胚胎发育[2]。人FGF9基因编码一个由207个氨基酸组成的蛋白质序列,分子质量约为23kDa。FGF9主要分布于细胞和组织中,包括成骨细胞、软骨细胞、血管内皮细胞、晶状体上皮细胞,以及皮肤、肝、肾脏、胃、生殖系统、淋巴组织等。研究发现,FGF9具有多种生物学活性,作为胞间信号分子它参了血管形成、胚胎发育、损伤修复、细胞凋亡、神经再生、肿瘤生长等多项生理和病理过程,尤其是在卵巢癌发生、骨骼发育、神经再生、性腺分化等过程中起着重要的作用。因此,临床上应用FGF9对诊断卵巢癌、治疗软骨障碍、软骨发育不全及性腺分化机制的研究,且越来越受到人们的关注。
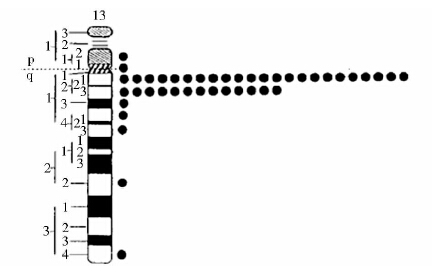
1 FGF9概述 1.1 FGF9特征人FGF9定位于13号染色体短臂上(13q11-q12)[3] (图 1),牛FGF9基因定位于12号染色体上。1997年,Mattei等利用原位杂交的方法确定了小鼠FGF9基因,该基因定位于14号染色体上。Colvin 等[4]对小鼠FGF9cDNA和基因组DNA进行分析,发现小鼠FGF9基因跨越34kb,包含3个外显子和2个内含子;编码区含有627个脱氧核苷酸,共编码208个氨基酸;在FGF9的3′端非编码区(3′-UTR)存在一个潜在的多腺苷酸化位点;FGF9的5′端非编码区(5′-UTR)和外显子1具有一个高G/C区域,具有哺乳动物启动子的普遍特点。通过研究分析,不同种属的FGF9具备高度同源性,人、牛、鼠的FGF9cDNA序列均为单拷贝基因。在编码区,人和鼠之间的同源性为88.7%,仅有一个氨基酸不同,人FGF9蛋白的第9位是天冬酰胺,鼠的为丝氨酸。鼠和牛之间的同源性为88.5%,而人和牛之间的同源性则高达94.9%。
FGF9的空间构象是由C端和N端的2个α螺旋和12个β折叠组成的一个类似金字塔形的结构[5, 6]。在结构上,FGF9和 FGF16、FGF20相似,为同一亚家族成员,FGF9与FGF家族FGF1、FGF2具有30%的同源性,并且氨基酸保守区完全相同,具有三叶草核心结构。FGF9与FGF16、FGF20均没有经典的信号肽序列,但其能依靠N端的35个氨基酸作为非剪切信号肽以及位于96~101位的EFISIA基序所具有的疏水性分泌到细胞外[7]。
1.2 FGF9的生物学功能FGF9是一种肝素结合生长因子,为单链多肽,具有多种生物学活性,其活性依赖于肝素的存在。FGFR主要有4种(FGFR1~FGFR4),均为单链酪氨酸激酶受体,结构十分相似,由胞外区、跨膜区、胞内区组成。FGF9主要与FGFR2和FGFR3结合,FGFR的结合需要肝素、受体和配体间形成三分子复合体[8]。
FGF9及其受体在骨骼发育过程中起重要作用。在骨骼发育早期,FGF9能促进软骨细胞肥大;在骨骼发育后期,其主要调节生长板的血管化和成骨过程[9]。在牙齿发育过程中FGF9与FGF4在调节牙尖的形成信号中心原发性釉结节中的表达水平上调,继而在继发性釉结节上表达[10],且FGF9的表达从原发性釉结节扩延到内釉上皮处。在连续不断切牙的生长过程中,FGF9表达于牙颈环上皮处[11]。从而认为作为上皮信号分子FGF9在牙齿发育各阶段中间接地诱导牙上皮与间充质之间相互作用,在牙齿形态调节中起作用,甚至其可能参与成牙本质细胞分化过程。FGF9广泛存在于中枢神经及外周神经系统中,对许多脑神经元有维持生存和促进生长及修复受损神经元并再生的作用,能显著的延缓神经元死亡[12]和保护神经细胞的作用并防止脊根神经节神经的坏死[13],在小脑颗粒神经元的迁移中也起到关键作用[14]。此外,FGF9还具有促进组织修复[15]、调节视力[16]、调节性腺分化[1]、促进毛发再生[17]、控制盲肠的形成[18]及卵巢癌肿瘤发生[19]等多种生物活性。
2 FGF9的表达研究 2.1 大肠杆菌表达FGF9大肠杆菌是目前应用最广泛的蛋白质表达系统[20],是首个用于生产重组蛋白的宿主菌,具有清楚的遗传背景、简单的培养操作、较高的转化和转导效率、快速的繁殖生长、低廉的成本及大规模地快速生产目的蛋白等优点[21]。黄炜等[22]通过采用PCR技术扩增FGF9,并将其克隆入原核表达载体pET30a(+)中,建立了小鼠FGF9的原核表达体系,成功地将该重组质粒转入大肠杆菌BL21(DE3)中并进行表达,采用亲和层析技术获得了纯度大于95%的FGF9重组蛋白,其表达量达到总蛋白质量的40%,插入到载体中的片段经测序与FGF9的天然序列也保持一致,小鼠FGF9在大肠杆菌中的成功表达为其与FGFR3在骨骼发育和修复中的作用及相关功能的研究奠定了重要基础。
2.2 昆虫细胞表达FGF9杆状病毒-昆虫细胞表达系统是一种真核细胞表达系统,具有多种蛋白质转录后加工修饰、表达水平极高、可表达非常大的基因及多个外源基因等优点,其表达的蛋白质根据其本身的特性分布在昆虫细胞内外。李慧等[23]采用RT-PCR技术,从新鲜人脑胶质瘤组织中获取人FGF9全编码区cDNA并克隆到pCRTMⅡ质粒及pYEX4T-1真核表达质粒中,经测序验证后将人FGF9 cDNA定向克隆入pFastBac质粒并转座入Bacmid中,在昆虫细胞Sf9中进行表达,采用SDS-PAGE对表达产物进行分析,成功地在昆虫细胞表达系统中表达出人FGF9重组蛋白。
2.3 动物细胞表达FGF9应用哺乳动物细胞表达系统生产药用蛋白是21世纪生物制药工业的主要发展方向。哺乳动物细胞表达目的基因的产物不但能正确组装成多亚基蛋白质,而且与天然的蛋白质结构、糖基化类型和方式几乎一致,相比较大肠杆菌、酵母、昆虫细胞等系统有了较大的优势。眭蕊等[24]采用PCR扩增人FGF9基因,全长序列交换入线性表达载体,连接产物转化感受态细胞,PCR及基因测序鉴定阳性克隆,重组病毒质粒在脂质体介导下与结构质粒和包膜质粒共转染293T细胞包装为人FGF9过表达慢病毒;PCR及测序证实人FGF9基因正确克隆于病毒质粒,感染293T细胞后,荧光显微镜观察到绿色荧光蛋白(eGFP),Western blot检测到FGF9融合蛋白表达。通过成功构建人FGF9慢病毒表达载体并在293T细胞中表达,为在体内外研究FGF9的功能及其与肿瘤等疾病的关系提供了基础。
目前,关于FGF9的表达研究的文献相对较少。而获得外源目的蛋白的重要技术手段是DNA重组,大肠杆菌在表达外源蛋白的水平上相对于其他表达系统具有明显优势,非常适合结构简单的小分子质量蛋白质的表达,同时FGF9为单链多肽且为糖基化位点,因此,相对于昆虫细胞与动物细胞表达FGF9,可认为大肠杆菌是目前最适合表达FGF9的系统。
3 FGF9适应征的机制 3.1 FGF9诱发卵巢癌的机制研究FGF9具有癌基因活性,研究发现其与肺癌[25]、肝癌[26]、前列腺癌[27]、大肠癌及子宫内膜癌的发生、发展有着重要的关系。增殖细胞、促进上皮细胞恶性转化和浸润内皮细胞都与FGF9的参与相关,在卵巢癌发生、发展过程中起到了关键作用。
3.1.1 FGF9具有癌基因活性,在子宫内膜样癌中高表达在胚胎发育过程中,许多调控基因与肿瘤发生及侵袭生长密切相关。其中Wnt信号通路可阐明恶性肿瘤的形成和胚胎发育的一些共同特征。Wnt通路主要包括细胞外因子(Wnt)、跨膜受体(frizzled)、胞质蛋白(β-catenin)及核内转录因子(TCF)等。其下游靶基因大多为参与细胞增生与凋亡的基因,Wnt通路通过对细胞增生、运动及分化产生影响进而在胚胎发育中发挥了重要作用。β-catenin是一种多功能蛋白质,广泛存在于各种类型的细胞,如内皮细胞、成纤维细胞、成骨细胞,在参与这些细胞的增殖、分化和凋亡等方面发挥了重要的调节作用。由于β-catenin主要负性调控因子APC、Axin等失活或β-catenin蛋白癌基因突变,约40%子宫内膜样癌(ovarian endometrioid adenocarcinoma,OEA)有Wnt信号激活。Hendrix等[28]运用Focus Formation Assay法对β-catenin调节异常而表达激活的OEA与Wnt/β-catenin途径表达的完整OEA基因进行表达差异比较,发现前者FGF9的表达比后者增加了6倍多,这间接说明了FGF9作为Wnt通路的一个下游靶点有癌基因活性且促进了OEA形成。因此,FGF9的研究对阐明OEA发生机制具有重要意义。
3.1.2 FGF9参与并促进细胞增殖,与EOC发生有关FGFR2和FGFR3是与FGF9密切相关的受体,在胃癌、肺癌、卵巢癌、乳腺癌和子宫内膜癌等均有发现FGFR2基因扩增或错义突变。FGFR2基因改变可使其解脱自我抑制或产生FGF信号自分泌环致使FGFR2信号异常激活[29]。在卵巢癌各类型中,FGFR2的突变频率分别是浆液性囊腺癌的2.4%、子宫内膜样癌的2.2%,其它类型(透明细胞型癌和黏液性囊腺癌)均未检测到[19]。此外,在无血清培养基上培养EOC细胞时,FGFR2b能防止细胞自发死亡[30]。
对于很多细胞类型来讲,FGF9是一种有效的促细胞分裂剂[31],当其与细胞表面受体结合之后,通过刺激靶细胞内DNA合成增加促进细胞分裂增殖。有研究表明,FGF9作为一个自分泌未分化调节牛卵巢功能的因子,通过下调生成类固醇受激激素和类固醇酶基因表达并伴随刺激细胞增殖[32]。Kathpalia等[33]的研究发现,在皮肤鳞状细胞癌中FGF9具有上调表达作用。Mulder等[34]报道嗜酸性食管炎患者中FGF9表达明显升高,与基底细胞过度增生有关。Wang等[35]研究发现芳香烃受体在肺腺癌中高表达,其激动剂-苯丙(A)芘能通过调节成纤维细胞和肿瘤细胞之间的联系促进肿瘤细胞增殖。
3.1.3 FGF9促进上皮细胞恶性转化β-catenin是Wnt信号传导通路的重要部分,由CTNNB1基因编码,在细胞间黏附和Wnt信号转导通路中起着关键作用,而16%~54% OEA存在CTNNB1基因突变。在人类许多肿瘤中Wnt信号转导通路都呈异常表达,包括黑色素瘤、髓母细胞瘤、肝母细胞瘤、结肠癌、前列腺癌、卵巢癌子、宫内膜癌等。从而可推测通过β-catenin/TCF转录靶点编码的蛋白质在细胞恶性转化中起到了重要作用[36],因此,FGF9作为Wnt通路下游靶点可导致细胞恶性转化。
3.1.4 FGF9促进上皮细胞和内皮细胞浸润卵巢癌细胞的分裂、分化和形变为卵巢癌浸润提供了基础,卵巢癌组织被癌细胞间质浸润后快速增大,并逐渐向血管和淋巴管浸润,导致卵巢癌随之发生转移。Kard等[37]的研究发现,FGF9及其mRNA在卵巢癌细胞株A121(P)、A121(A) 和A90中有过度表达,并且在外源性FGF9刺激下细胞株增殖明显增加,FGF9的高亲和力受体均存在于3种细胞株中。癌细胞浸润和转移与很多细胞信号转导通路也有关联,其中Wnt信号通路与癌细胞浸润和转移就有着密切关系,而FGF9作为Wnt信号通路的下游靶点,能介导异常通路激活,从而促进细胞增生和浸润[38]。
3.2 FGF9对骨骼发育的作用机制 3.2.1 促进膜内成骨骨骼发育分为两种形式:膜内成骨和软骨内成骨。FGF9的主要受体为FGFR2和FGFR3。FGFR2主要在软骨膜和骨膜中表达,而FGFR3主要在软骨生长板内的软骨细胞中表达[39]。FGF9通过促进膜内成骨进行骨再生,体外培养小鼠颅骨,给予FGF9后,发现颅缝融合和骨细胞分化增强[40];Dai等[41]研究发现单独的内软骨细胞是不能阻止软骨分化的牙髓肝细胞矿化的,其与外源的FGF9结合可以促进牙髓干细胞软骨成骨,同时也部分地阻止了矿化,但FGF9可通过与FGFR3结合激活这种抑制作用;在对去卵巢大鼠静脉注射FGF9的试验中发现大鼠形成新生骨、骨吸收表面积减少及股骨中段皮质骨骨密度增加[42];敲除小鼠部分FGFR2基因后,其软骨细胞增殖、分化虽正常,但形如侏儒,分析原因是由于干骺端骨生成障碍所造成的。此外,已有研究证明FGF9在骨关节炎治疗中可作为疾病调修候选药物[43]。
3.2.2 抑制软骨内成骨FGF9与FGFR3共同结合抑制软骨内成骨过程,近年来的研究表明它们的结合在长骨发育过程中起着负调节作用[44]。目前,FGF9与FGFR3在软骨细胞内的作用机制已初有了解。在体外实验中,经FGF9处理的或由FGFR3激活突变而来的细胞中转录因子STAT1活化增加,随之其下游分子(如细胞周期蛋白激酶抑制P21)表达上调,致使软骨细胞增殖被抑制[45, 46];小鼠被敲除STAT1基因(STAT1-/-)后,经FGF9处理小鼠分离出的软骨细胞,发现其生长并未受到抑制[47];综上可说明 FGFR3通过STAT1途径直接抑制软骨细胞的增生。此外,FGFR3还可通过作用于其他软骨细胞调节分子,如IHH(具有发育调节功能的一种分泌性蛋白)和PTHrP等途径影响软骨细胞的生长[44, 48]。FGF9基因突变使其与FGFR3结合力减弱,致使多发性骨性连接综合征3型的发生[49]。多发性骨性连接综合征的原因则是FGF9基因外显子2的错义突变[50]。
3.3 FGF9对性腺分化的调节作用机制性腺具有发育成睾丸或卵巢的潜在能力。在睾丸分化过程中,Y染色体上的基因Sry(sex determining region on Y chromosome,Sry)起着开关作用。基因Sox9(SRY-related high mobility group-box gene 9)继Sry在两性生殖嵴表达后第一个在Sertoli前体细胞中表达[1]。FGF9在性别决定过程中极为关键,参与了性腺细胞增殖、Sertoli细胞分化和中肾细胞迁移过程并发挥重要作用。
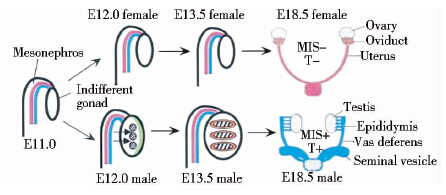
3.3.1 FGF9调节性腺体腔上皮细胞增殖睾丸Sertoli前体细胞来源于体腔上皮细胞,是第一个分化形成睾丸的特异性细胞,在雄性特异性基因的表达过程中起着重要作用[51, 52],而细胞增殖可促进Sertoli前体细胞的形成[53]。Schmahl和Capel[54]研究发现,FGF9通路被阻断,可以使性腺体积减小、减少或停止雄性特异性基因表达、Sertoli细胞分化及睾丸索形成。在哺乳动物生殖发育期间,雌雄小鼠在胚胎发育第11天(E11.0)每个中肾内侧性腺在形态上相同无所谓性腺(indifferent gonad),中肾中包括缪勒氏管和中肾管,在E11.0和E13.5之间,睾丸是卵巢的2倍大,形态上出现睾丸索,此时雄性体腔上皮细胞增殖(绿色),中肾细胞转移到睾丸内(箭头),形成睾丸索组织(阴影)[55](图 2),在E18.5后,两性体腔上皮细胞向性腺迁移,体腔上皮细胞若迁移至睾丸索中便形成了Sertoli细胞与间质细胞。
3.3.2 FGF9调节中肾细胞迁移中肾细胞在性腺原基体腔上皮细胞增殖的同时向性腺迁移形成睾丸索[56]。在Sry基因表达后,中肾内血管内皮细胞、肌上皮细胞和小管周肌样细胞等开始转移至XY性腺[57, 58] (图 2)。Buehr等[58]的研究结果,显示睾丸索在薄膜屏障阻止早期性腺中的中肾细胞向XY性腺迁移的条件下无法正常形成。而XX性腺细胞在诱导迁移过程中,性腺发育成睾丸索样结构,雄性特异性基因也获得表达。中肾细胞在睾丸发育早期时能被FGF9诱导转移。在小鼠交配11.5天后,睾丸索可在外源FGF9诱导XX性腺下形成,并且FGF9也促进了Sox9表达。但在正常XY性腺中,睾丸索在中肾细胞被阻断迁移的条件下发育失败,从而使得FGF9-/-小鼠发生性别反转[57]。
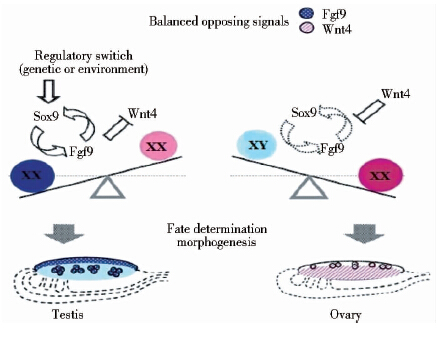
3.3.3 FGF9双向潜能性腺中拮抗信号调控决定性别哺乳动物的性别决定是一个基因编码调节睾丸和卵巢发育通路平衡的过程,到目前为止,主要研究集中在调节这些通路的转录因子(SRY、Sox9、NR0B1)、生长因子((FGF9、PDGF))和信号分子(WNT4、RSPO1、β-catenin)上[59]。FGF9与Sox9之间有一个互动的正反馈循环[60]。决定雄性发育的方向不仅取决于雄性基因的表达(如Sox9),而且也取决于对雌性基因的抑制[61]。FGF9与WNT4之间的对抗平衡决定哺乳动物性腺的命运,SRY则是改变哺乳动物雄性性别的开关,这种平衡是通过Sox9的上调来实现的。在XY性腺中,Sox9起始FGF9转录并上调FGF9,同时FGF9反过来维持Sox9表达,形成了一个正向前馈环,并诱使FGFR2在Seroli前体细胞的细胞核中定位[62]。因此,性腺的发育是通过雄性信号分子(Sox9、FGF9)与雌性信号分子(WNT4、RSPO1)之间相互竞争来决定的[63]。在存在SRY的条件下,FGF9/SOX9正反馈环发挥作用,雌性信号被抑制,性腺则发育成睾丸;在缺乏SRY的条件下,WNT4和RSPO1关闭FGF9/SOX9反馈环,性腺分化转为雌性通路[1, 4](图 3)。FGF9是睾丸发育通路中非常重要的信号分子,在胎儿的睾丸中其可以直接作用于生殖细胞并抑制减数分裂和促进向雄性方向发育[64],但也有研究发现,在非症候群型46,XY紊乱的患者中FGF9不经常地参与雄性性腺异常发育[65]。敲除FGF9会导致Sertoli细胞分化失败,使得雄性到雌性发生性反转。在缺乏FGF9的XY性腺中,Sox9表达不能被维持,此时WNT4表达上调,转向雄性通路的性腺分化被阻止[60]。综上所述,FGF9在双向潜能性腺拮抗信号调控决定性别过程中发挥了极其重要的作用。
FGF9作为成纤维细胞生长因子家族中的一员,具有多种生物学功能。其作为一种不可替代的细胞因子,在骨骼发育、神经再生、性腺分化等过程中起着重要的作用。此外,FGF9与其他FGF同样有促分裂效应及促进细胞生长的作用,在组织修复、调节视力、促进毛发再生及卵巢癌肿瘤发生等方面也有着重要的生物学意义。目前,对FGF9的研究主要集中在骨骼发育、性腺分化、卵巢癌肿瘤发生等机制方面,在对其进行表达生产方面的研究甚少。本实验室通过植物反应器油体系统表达FGF9,利用农杆菌介导转化的方法浸染拟南芥和红花,从而得到重组蛋白oleosin-FGF9,这为生产外源蛋白FGF9提供了一条新的思路,目前利用该系统已经成功的表达出了aFGF、bFGF、KGF1、EGF、VEGF、MT等许多具有重要临床应用价值和开发潜力的药用重组蛋白。FGF9条件性诱导卵巢上皮癌的研究对未来判定卵巢上皮癌前期病变、治疗反应、风险预测及个体化治疗提供了新的思路,并对阐明卵巢上皮癌的发病机制具有重大意义。对FGF9在促进膜内成骨及抑制软骨内成骨机制方面虽有一定的研究,但FGF9对成骨细胞增殖和分化的影响及作用机制尚不清楚,FGF9 是否还与其他骨骼疾病的发生,以及是否还有其他未知的新功能等问题都还需要通过进一步的实验研究加以阐明。在性别分化方面,FGF9与性别调控网络中其他基因的互作关系研究也尚少,FGF9基因在睾丸早期正常发育模式的建立及其在XY性腺形成中的作用也是亟待解决的课题。此外,在其他组织中FGF9是否也有表达,其生物学作用在动物实验得到的结果在人体内是否相同也有待研究。因此,未来对FGF9的生物学功能,尤其在卵巢癌发生、骨骼发育及性腺分化等方面的研究需要进一步加深。
| [1] | Kim Y,Kobayashi A,Sekido R,et al.Fgf9 and wnt4 act as antagonistic signals to regulate mammalian sex determination.PLoS Biol,2006,4(6):e187. |
| [2] | Chen T M,Hsu C H,Shaw-Jenq Tsai,et al.AUF1 p42 isoform selectively controls both steady-state and PGE2-induc ed FGF9 mRNA decay. Nucleic Acids Research,2010,38(22):8061-8071. |
| [3] | Mattei M G,Penault-Llorca F,Coulicr F,et al.The human FGF9 Gene maps to chromosomal region 13q11-q112. Genomics,1995,291(2):811-812. |
| [4] | Colvin J S,Feldman B,Ornitz D M,et al.Genomic organization and embryonic expression of the mouse fibroblast growth factor 9 gene.Developmental Dynamics,1999,216(1):72-88. |
| [5] | Eriksson A E,Cousens L S,Weaver L H,et al.Three-dimensional structure of human basic fibroblast growth factor.PNAS,1991,88(8):3441-3445. |
| [6] | Plotnikov A N,Eliseenkova A V,IbrahimiO A,et al.Structure of fibroblast growth factor9 reveals regions implicated in dimerization and autoinhibition.J Biol Chem,2001,276(6):4322-4329. |
| [7] | Revest J M,De Moerlooze L,Dickson C.Fibroblast growth factor 9 secretion is mediated by a non-cleaved amino-terminal signal sequence.J Biol Chem,2000,275(11):8083-8090. |
| [8] | Harmer N J,Robinson C J,Adam L E,et al.Multimers of the fibroblast grow the factor(FGF)FGF receptor saccharide complex are formed on long oligomers of heparin.Biochem J,2006,393(Pt3):741-748. |
| [9] | Hung I H,Yu K,Lavine K J,et al.FGF9 regulates early hypertrophic chodrocyte differentiation and skeletal vascularizat-ion in the developing stylopod.Developmmental Biology,2007,307(12):300-313. |
| [10] | Kettunen P,Thesleff I.Expression and function of FGFs-4,-8,and-9suggest functional redundancy and repetitive use as epithelial signals during tooth morphogenesis.Dev Dyn,2004,211(3):256-268. |
| [11] | Porntaveetus T,Otsuka-Tanaka Y,Albert Bason M,et al.Expression of fibroblast growth factors(FGFs) in murine tooth development.J Anat,2011,218(5):534-543. |
| [12] | Nakagami M,Saito H,Matsuki N.Basic fibroblast growth factor and brain-derived neurotrophic factor promote survi-val and neuronal circuit formation in organotypic hippocampal culture.Jpn J Pharmacol,1997,75(4):319-326. |
| [13] | Marini A M,Spiga G,Machetti I.Toward the development of strategies to prevent ischemic neuronal injury. in vitro studies.Ann NY Acad Sci,1997,825:209-219. |
| [14] | Lin Y,Chen L,Lin C,et al.Neuron-derived FGF9 is essential for scaffold formation of bergmann radial fibers and migration of granule neurons in the cerebellum.Developmental Biology,2009,329(1):44-54. |
| [15] | Kaye D M,Kelly R A,Smith T W.Cytokines and cardiac hypertrophy: roles of angiotensin II and basic fibroblast growth factor.Clin Exp Pharmacol Physiol,1996,3:S136-S141. |
| [16] | Puk O,Moller G,Geerlof A,et al.The pathologic effect of a novel neomorphic Fgf9 Y162Callele is restricted to decreased vision and retarded lens growth.PLoS One,2011,6(8):23678. |
| [17] | Gay D,Kwon O,Zhang Z K,et al.Fgf9 from dermal γδ T cells induces hair follicle neogenesis after wounding.Nat Med,2013,19(7):916-923. |
| [18] | Al Alam D,Sala F G,Baptista S,et al.FGF9-Pitx2-FGF10 signaling controls cecal formation in mice . Developmental Biology,2012,369(2):340-348. |
| [19] | Byron S A,Gartside M G,Wellens C L,et al.FGFR2 mutations are rare across histologic subtypes of ovarian cancer.Gynecol Oncol,2010,117(1):125-129. |
| [20] | Dong X,Tang B,Li J,et al.Expression and purification of intact and functional soybean (Glycine max) seed ferritin complex in Escherichia coli.J Microbiol Biotechnol,2008,18(2):299-307. |
| [21] | Nuc P, Nuc K.Recombinant protein production in Escherichia coli.Postepy Biochem,2006,52(4):448-456. |
| [22] | 黄炜,余瑛,鲁秀敏,等.小鼠FGF9在大肠杆菌中的表达与纯化.西南农业学报,2009,22(6):1773-1775. Huang W,Yu Y,Lu X M,Fang J J,et al.Expression and purification of mouse fibroblast growth factor 9 in E.coli. Southwest China Journal of Agricultural Sciences,2009,22(6):1773-1775. |
| [23] | 李慧,魏刚,于永利.以Bacmid-杆状病毒-昆虫细胞系统表达人FGF9.中国免疫学杂志,1999,15(10):440-443. Li H,Wei G,Yu Y L.Expression of human fibroblast growth factor 9 in bacmid-baculovirus expression system.Chinese Journal of Immunology,1999,15(10):440-443. |
| [24] | 眭蕊,刘群,李锐锐,等.人FGF9慢病毒表达载体的构建、包装及鉴定.中国医药导报,2013,10(30):16-19. Sui R,Liu Q, Li R R,et al.Construction and identification of human FGF9 lentiviral expression vector.China Herald of Medicine,2013,10(30):16-19. |
| [25] | Ohgino K,Soejima K,Yasuda H,et al.Expression of fibroblast growth factor 9 is associated with poorprognosis in patie- nts with resected non-small cell lung cancer.Lung Cancer,2014,83(1):90-96. |
| [26] | 杨浩.miR-140-5p通过靶向调节TGFBRl和FGF9抑制肝细胞癌增殖和侵袭转移.长沙:中南大学,湘雅医院,2013. Yang H.MicroRNA-140-5 Psuppresses Tumor Growth and Metastasis by Targeting TGFBR1 and FGF9 in Hepatocellular carcinoma.Changsha:Central South University,Xiangya Hospital,2013. |
| [27] | Li Z G,Mathew P,Yang J,et al.Androgen receptor-negative human prostate cancer cells induce osteogenesis in mice through FGF9-mediated mechanisms.The Journal of Clinical Investigation,2008,118(8):2697-2710. |
| [28] | Hendrix N D,Wu R,Kuick R,et al.Fibroblast growth factor has oncogenic activity and is a downstream target of Wnt signaling in ovarian endometrioid adenocarcinomas.Cancer Res,2006,66(3):1354-1362. |
| [29] | Katoh M.Cancer genomics and genetics of FGFR2(review).Int J Oncol,2008,33(2):233-237. |
| [30] | Steele I A,Edmondson R J,Leung H Y,et al.Ligands to FGF receptor2-Ⅲb induce proliferation,motility protection from cell death and cytoskeletal rearrangements in epithelial ovarian cancer cell lines.Growth Factors,2006,24(1): 45-53. |
| [31] | Wing L,Chen H,Chuang P,et al.The mammalian target of rapamycin P70 ribosomal S6 kinase but not phesphatidylinositi3 kinaseakt signaling is responsible for fibroblast growth factor-9-induced cell proliferation.J Biol Chem,2005,280(20):19937-19947. |
| [32] | Schreiber N B,Spicer L J.Effects of fibroblast growth factor 9(FGF9)on steroidogenesis and gene expression and control of FGF9 mRNA in bovine granulosa cells.Endocrinology,2012,153(9):4491-4501. |
| [33] | Kathpalia V P,Mussak E N,Chow S S,et al.Genome-wide transcripttional profiling in human squamous cell carcinoma of the skin identifies unique tumor-associated signatures.J Dermatol,2006,33(5):309-318. |
| [34] | Mulder D J,Pacheco I,Hurlbut D J,et al.FGF9 induced proliferative response to eosinophilic inflammation in oesophagitis.Gut,2009,58(2):166-173. |
| [35] | Wang C K,Chang H,Chen P H,et al.Aryl hydrocarbon receptor activation and overexpression upregulated fibroblast growth factor-9 in human lung adenocarcinomas.Int J Cancer,2009,125(4):807-815. |
| [36] | Schwartz D R,Wu R,Kardia S L R,et al.Novel candidate targets of β-catenin/T-cell factor signaling identified by gene expression profiling of ovarian endometrioid adeno Carcinomas.Cancer Research,2003,63(11):2913-2922. |
| [37] | Kard K,Gross J L,Crickard U,et al.Basic Fibroblast growth factor and receptor expression in human ovarian cancer.Gynecol Oncol,1994,55(2):277-284. |
| [38] | Sarkar F H,Li Y,Wang Z,et al.The role of nutraceuticals in the regulation of Wnt and Hedgehog signaling in cancer.Cancer Metastasis Rev,2010,29(3):383-394. |
| [39] | Valverde-Franco G,Liu H,Davidson D,et al.Defective bone mineralization and osteopenia in young adult FGFR3-/-mice.Hum Mol Genet,2004,13(3):271-284. |
| [40] | Ignelzi M A Jr,Wang W,Young A T.Fibroblast growth factors lead to increased Msx2 expression and fusion in calvarial sutures.J Bone Miner Res,2003,18(4):751-759. |
| [41] | Dai J W,Wang J,Lu J T,et al.The effect of co-culturing costal chondrocytes and dental pulp stem cells combined with exogenous FGF9 protein on chondrogenesis and ossification in engineered cartilage. Biomaterials,2012,33(31):7699-7711. |
| [42] | Taiwo Y O.Approaches in developing new anabolic therapies.International Conference on Osteoporosis and Bone Research,Beijing,2003.Beijing:Chinese Society of Osteoporosis and Bone MineralResearch Chinese Medical Association.International Chinese Hard Tissue Society,2003:10-11. |
| [43] | Wang S X,Bendele A M,Moore E M.The chondroprotective effect of FGF9 in an experiment model of osteoarthritis.Osteoarthritis and Cartilage,2012,20(1):S40-S41. |
| [44] | Ornizt D M.FGF signaling in the developing endochondral skeleton.Cytokine & Growth Factor Reviews, 2005,16(2):205-213. |
| [45] | Weksler N B,Lunstrum G P,Reid E S,et al.Differential effects of fibroblast growth factor(FGF)9 and FGF2 on proliferation,differentiation and terminal differentiation of chondrocytic cells in vitro.Biochem J,1999,342(Pt3):677-682. |
| [46] | Aikawa T,Segre G V,Lee K.Fibroblast growth factor inhibits chondrocytic growth through induction of p21 and subsequent inactivation of cyclin E-Cdk2.J Biol Chem,2001,276(31):29374-29352 |
| [47] | Xiao L P,Naganawa T,Obugunde E,et al.Stat1 controls postnatal bone formation by regulating fibroblast growth factor signaling in osteoblasts.J Biol Chem,2004,279(26): 27743-27752. |
| [48] | Minina E,Kreschel C,Naski M C,et al.Interaction of FGF,IHH/Pthlh,and BMP signaling integrates chondrocyte proliferation and hypertrophic differentiation.Dev Cell,2002,3(3):439-449. |
| [49] | Wu X L,Gu M M,Yang J M,et al.A unique point mutation in the fibroblast growth factor 9 gene(FGF9) defines a new Multiple Synostosis Syndrome in a large Chinese family. Am J Hum Genet,2008. |
| [50] | Wu X L,Gu M M,Huang L,et al.Multiple synostoses syndrome Is due to a missense mutation in exon 2 of FGF9 gene.The American Journal of Human Genetics,2009,85(1):53-63. |
| [51] | Cory A T,Boyer A,Silversides D W,et al.Presumptive pre-Sertoli cells express genes involved in cell proliferation and cell signaling during a critical window in early testis differentiation.Mol Reprod Dev,2007,74(12):1491-1504. |
| [52] | Chen T M,Kuo P L.Microsatellite in the 3'untranslated region of human fibroblast growth factor9(FGF9) gene exhibits pleiotropic effect on modulating FGF9 protein expression.Hum Mutat,2007,28(1):98. |
| [53] | DiNapoli L,Capel B.SRY and the standoff in sex determination.Mol Endocrinol,2008,22(1):1-9. |
| [54] | Schmahl J,Capel B.Cell proliferation is necessary for the determination of male fate in the gonad.Dev Biol,2003,258(2):264-276. |
| [55] | Colvin J S,Green R P,Schmahl J,et al.Male-to-female sex reversal in mice lacking fibroblast growth factor 9.Cell,2001,104(6):875-889. |
| [56] | Gassei K,Schlatt S.Testicular morphogenesis:comparison of in vivo and in vitro models to study male gonadal development.Ann N Y Acad Sci,2007,1120:152-167. |
| [57] | Merchant-Larios H,Moreno-Mendoza N,Buehr M.The role of the mesonephros in cell differentiation and morphogenesis of the mouse fetal testis.Int J Dev Biol,1993,37(3):407-415. |
| [58] | Cool J,Carmona F D,Szucsik J C,et al.Peritubular myoid cells are not the migrating population required for testis cord formation in the XY gonad.Sex Dev,2008,2(3):128-133. |
| [59] | Loke J,Pearlman A,Radi O,et al.Mutations in MAP3K1 tilt the balance from SOX9/FGF9 to WNT/β-catenin signaling.Human Molecular Genetics,2014,3(4):1073-1083. |
| [60] | Kim Y,Capel B. Balancing the bipotential gonad between alternative organ fates: A new perspective on an old problem.Developmental Dynamics,2006,235:2292-2300. |
| [61] | Jameson S A,Lin Y T,Capel B.Testis development requires the repression of Wnt4 by Fgf signaling. Developmental Biology,2012,370(1):24-32. |
| [62] | Bagher-i F S,Sim H,Harley V R,et al.Loss of Fgfr2 leads to partial XY sex reversal.Biol,2008,314(1):71-83. |
| [63] | Maatouk D M,DiNapoli L,Capel B,et al.Stabilization of bcatenin in XY gonads causes male-to-female sex-reversal.Human Molecular Genetics,2008,17(19):2949-2955. |
| [64] | Bowles J,Feng C W,Spiller C,et al.FGF9 suppresses meiosis and promotes male germ cell fate in mice. Developmental Cell,2010,19(3):440-449. |
| [65] | Machado A Z,da Silva T E,Frade Costa E M,et al.Absence of inactivating mutations and deletions in the DMRT1 and FGF9 genes in a large cohort of 46,XY patients with gonadal dysgenesis.European Journal of Medical Genetics,2012,55(12):690-694. |
 2015, Vol. 35
2015, Vol. 35