文章信息
- 温赛, 杨建国
- WEN Sai, YANG Jian-guo
- 地衣芽孢杆菌原生质体电转化方法的研究
- Transformation of Undomesticated Strains of Bacillus licheniformis by Protoplast Electroporation
- 中国生物工程杂志, 2015, 35(7): 76-82
- China Biotechnology, 2015, 35(7): 76-82
- http://dx.doi.org/10.13523/j.cb.20150711
-
文章历史
- 收稿日期:2015-04-08
- 修回日期:2015-05-19
2. 北京化工大学生命科学与技术学院 北京 100029
2. College of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China
自1872年芽孢杆菌(Bacillus)作为一个属被首次提出后,芽孢杆菌已经成为现代发酵工业的核心菌种。而地衣芽孢杆菌(Bacillus lichenifarmis)是最具应用潜力和价值的芽孢杆菌之一。不同于绝大多数芽孢杆菌在生长过程中严格需氧,地衣芽孢杆菌属兼性厌氧菌,所以对生长和发酵条件的适应性更强。这种内生孢子土壤细菌(endospore-forming soil bacterium)目前被广泛用于蛋白质的胞外表达,产物包括α-淀粉酶、蛋白酶、脂肪酶、青霉素酶等,最高产量可达25g/L[1, 2]。地衣芽孢杆菌也被用于生产多肽类抗生素(如杆菌肽)、有机酸、高分子聚合物(如多聚谷氨酸)等产品[2],对现代工业生产具有重要意义。
近年来,随着分子生物学技术的发展和地衣芽胞杆菌模式菌株B. lichenifarmis DSM 13(ATCC 14580)全基因组的测序完成[3],更多的研究开始针对地衣芽孢杆菌进行基因水平的改造和优化[4, 5, 6, 7, 8]。而采用一种有效方法将外源DNA(载体)转化进入宿主细胞是对地衣芽孢杆菌进行遗传改造的前提。与枯草芽孢杆菌等其他芽孢杆菌近亲所不同的是,地衣芽胞杆菌具有无自然感受态[9, 10, 11]和有特殊的限制性修饰系统[12, 13]等特性,使得地衣芽孢杆菌的转化率十分低下。目前所报道的地衣芽孢杆菌转化方法主要为原生质体转化法[10, 11, 13, 14, 15]和电转化法[9, 16, 17]。这两种方法分别基于PEG介导DNA与原生质体发生凝聚和瞬时高压电击穿孔这两种不同机制,将外源DNA转入经特殊处理后的地衣芽胞杆菌细胞,但总体而言阳性克隆的得率仍然很低,特别是一些重要的野生工业菌株转化尤为困难[13, 18, 19]。
针对这个问题,本研究首次提出了一种将原生质体转化法和电穿孔法相结合的转化方法,即地衣芽孢杆菌原生质体电转化法。该方法一方面利用了原生质体脱壁的特性,有效减少了DNA的穿透阻力;另一方面利用瞬时电击穿孔的机制增加了质粒DNA进入原生质体细胞的数量,由此提高地衣芽孢杆菌的转化效率。本研究以两种用于工业生产的野生地衣芽孢杆菌菌株为对象(产耐高温淀粉酶菌株B. licheniformis CICC 10181、产碱性蛋白酶菌株B. licheniformis CICC 20204),通过对影响转化效率的若干关键因素进行优化,成功获得了游离型和整合型两种不同表达载体的阳性转化子。该转化技术的建立为地衣芽孢杆菌的菌种改造和工业应用奠定了良好的基础。
1 材料与方法 1.1 材 料 1.1.1 菌株和质粒B. licheniformis CICC 10181、B. licheniformis CICC 20204均购自中国工业微生物菌种保藏管理中心。地衣芽孢杆菌整合型质粒pAX01购自美国俄亥俄州立大学菌种保存中心(Bacillus Genetic Stock Center,Ohio State University)。地衣芽孢杆菌游离型质粒pGJ103为南京农业大学微生物学国家重点实验室构建并惠赠。
1.1.2 试剂及培养基溶菌酶(lysozyme)购于Sigma公司(code 0663),使用前用SMPP培养基配成100mg/ml母液,过滤灭菌,1ml/管,分装冻存。氯霉素及红霉素购自北京全新拓达公司。限制性内切核酸酶为NEB产品。过滤纱布(400目)购于拜尔迪公司。
4×PAB培养基: 6g/L牛肉膏,6g/L酵母膏,20g/L蛋白胨,14g/L NaCl,19.3g/L K2HPO4·3H2O,5.3g/L KH2PO4。用去离子水定容至1L高压灭菌,加入过滤灭菌的50%(m/V)葡萄糖溶液8ml。
2×SMM溶液:4.6g/L马来酸,8.1g/L MgCl2·6H2O,1mol/L蔗糖。用NaOH调pH至6.5,121℃灭菌。而后加入2mol/L蔗糖至终浓度为1mol/L。
菌体保护液SMPP:20g/L BSA,0.1mol/L蔗糖,1×PAB培养基,1×SMM溶液。其中,BSA、蔗糖需单独灭菌后再加入。
电转液SMMP(与SMPP相比不含PAB培养基):20g/L BSA,0.1mol/L蔗糖,1×SMM溶液。
DM3培养基(原生质体再生及筛选):8g/L琼脂,5g/L水解酪蛋白,5g/L酵母粉,1.5g/L KH2PO4,4.6g/L K2HPO4·3H2O,45.5g/L山梨醇(或45.5g甘露醇),10g/L 淀粉,0.5%(m/V)葡萄糖,0.09g/L BSA,0.02mol/L MgCl2。葡萄糖、MgCl2需单独灭菌后再加入。
1.2 方 法 1.2.1 地衣芽孢杆菌原生质体的制备[20]挑取地衣芽孢杆菌LB平板上的单菌落接种于1×PAB培养基中,37℃摇床培养过夜。次日按照1%~2%(V/V)的比例转接入新鲜的1×PAB培养液中(OD600=0.5),200r/min转速下振荡培养约12h至对数生长后期(OD600=4.5~5.0)。将培养液离心10min收集菌体,之后用9ml菌体保护液SMPP重悬,再加入100mg/ml溶菌酶至终浓度为10mg/ml,于37℃摇床低速振荡(100r/min)温浴40min,至视野中95%以上的细菌均成为球形原生质体时(约5×109个/ml),即得地衣芽孢杆菌原生质体。
1.2.2 质粒DNA电转化原生质体及原生质体再生[21]将原生质体在4℃、6 000r/min离心5min后,用预冷的电转液SMMP重悬细胞并反复洗涤两次以上,之后用约500μl电转液SMMP重悬原生质体,使原生质体终浓度约为1×108个/ml。将原生质体以每管120μl分装,电击前与0.5μg质粒轻柔混合后冰置上5min,然后转移至预冷的0.2cm电击杯中,设置25μF电容,400Ω电阻,以0.6kV/mm电击一次,电击后立即加入1ml预冷的电转液SMMP,并转移至离心管中,于37℃、100r/min摇床培养12h。将质粒pGJ103的转化子涂于含氯霉素(4μg/ml)的固体DM3培养基上进行再生筛选;质粒pAX01转化子涂于含红霉素(10μg/ml)的固体DM3培养基上进行再生筛选。每个实验重复3次,计算平均转化率(CFU/μg DNA)。
原生质体的再生率(%)=[酶解混合液经SMMP稀释后涂布DM3再生培养基长出的菌落数/(原生质体生成率×总菌落数)]×100%
1.2.3 地衣芽孢杆菌质粒和染色体DNA提取地衣芽孢杆菌转化子胞内质粒DNA提取方法参照北京博大泰克公司质粒纯化试剂盒产品使用指南。染色体DNA提取主要参照《精编分子生物学实验指南》“细菌基因组DNA的小量制备”方法。
2 结 果 2.1 生长曲线的测定微生物在培养基中的生长、胞内物质的合成直接影响微生物的生理状态,因而对原生质体制备、电击效率等环节产生较大影响,需要对地衣芽孢杆菌的生长曲线进行绘制。我们以生产耐高温α-淀粉酶的地衣芽孢杆菌工业菌株CICC 10181为例,在50ml的1×PAB培养基中对该菌进行培养及生物量监测。如图 1所示,37℃下振荡培养4h后地衣芽孢杆菌进入对数生长期,此时OD600约为1.0,之后生物量快速增长,直至培养14h后进入稳定期,OD600维持在5.6~6.0。
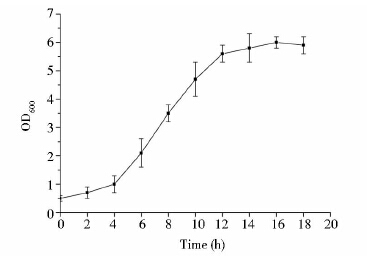
|
| 图 1 地衣芽孢杆菌生长曲线 Fig. 1 Growth curve of B. licheniformis strain |
制备原生质体时,细菌细胞壁的组成成分和生长状态对溶菌酶的水解作用有较大的影响。我们分别选取了对数生长前期、中期、后期,以及稳定期的B. licheniformis CICC 10181细胞,即转接后培养了4h、8h、12h、16h的菌液,在统一细胞终浓度后采用酶解方法[20] 制备原生质体细胞并检测细菌生长时间对原生质体制备效果的影响。
在终浓度为10mg/ml的溶菌酶作用30min后,通过相差显微镜镜检,计算原生质体(圆形细胞)的得率。由图 2可见,地衣芽孢杆菌在对数生长期的后期(连续培养12h后)所制备的原生质体比例最高,达到90%以上;而对数前期、中期和稳定期的原生质体比例均在80%以下。实验结果说明,不是菌体生长越幼嫩,溶菌酶水解细胞壁的效果越好,在对数生长期后期的地衣芽孢杆菌细胞更适合酶解制备原生质体。
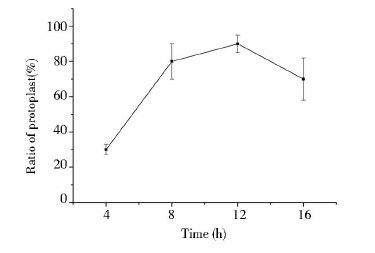
|
| 图 2 细胞生长阶段对原生质体制备的影响 Fig. 2 Effect of cell growth phase on the generation of protoplast |
溶菌酶水解细胞壁的时间过短将影响原生质体的形成率,时间过长则造成细胞脱壁太彻底,同时在一定程度上破坏细胞膜,导致原生质体破碎,使其再生更加困难[15]。为了考察溶菌酶的最适作用时间,首先将 B. licheniformic CICC 10181培养至对数生长期后期,然后加入溶菌酶作用于细胞,分别在20min、30min、40min、50min、60min时取样镜检计算原生质体的形成率,以及稀释后涂布再生培养基以计算再生率。由图 3可见,随着时间的延长,原生质体形成率呈现增长趋势,60min时原生质体形成率可达到98%。另外,原生质体的再生率在酶解作用20min时为30%,随着时间的延长呈逐渐下降趋势。由于溶菌酶作用40min时地衣芽孢杆菌原生质体形成率已达96%,且再生率较高(25%),所以确定溶菌酶的最适作用时间为40min。

|
| 图 3 溶菌酶作用时间对原生质体制备和再生的影响(双线图) Fig. 3 Effect of incubation time with lysozyme on the formation and regeneration of protoplast |
地衣芽孢杆菌原生质体缺少细胞壁的屏障,有效减少了DNA进入细胞的阻力,但也增加了细胞对瞬时高压电击穿孔的敏感性,需要准确把握电击电压的大小。本实验首先试验了将0.5μg游离型质粒pGJ103(10μl)与120μl地衣芽孢杆菌原生质体细胞(1×108 CFU/ml)混合后,分别在0.1kV/mm、0.2kV/mm、0.3kV/mm、0.4kV/mm、0.5kV/mm、0.6kV/mm、0.7kV/mm、0.8kV/mm的电压条件下进行电转化。电击后的菌液于SMMP中复苏12h之后涂布含氯霉素4μg/ml的DM3原生质体再生筛选培养基平板,待转化子长出后计算不同电压对应的转化率(图 4)。结果显示,0.1~0.5kV/mm电击电压下的地衣芽孢杆菌原生质体转化率较低,为0~0.65×102 CFU/μg DNA。电击电压为0.6kV/mm时转化率最高,达到1.0×102 CFU/μg DNA,也高于0.7kV/mm (0.92×102 CFU/μg DNA)和0.8kV/mm时的转化率(0.49×102 CFU/μg DNA)。因此,地衣芽孢杆菌原生质体最适电转化电压为0.6kV/mm。
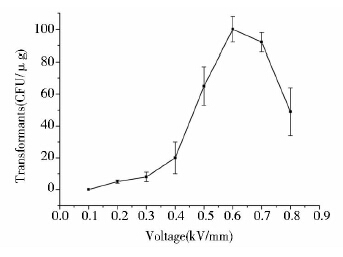
|
| 图 4 电击电压对原生质体电转化效率的影响 Fig. 4 Effect of voltage on the electrotransformation efficiency |
渗透压保护剂(osmoprotectant)的选择是影响原生质体再生的一个重要因素。 DM3培养基中原有渗透压保护剂为琥珀酸钠(sodium succinate)[20],但琥珀酸钠对两种常用抗生素——卡那霉素和奇霉素的活性有抑制性[22],会影响本方法的适用范围。因此,我们实验并对比了另外4种渗透压保护剂:0.5mol/L蔗糖(sucrose)、0.5mol/L山梨醇(sorbitol)、0.5mol/L甘露醇(mannitol)、0.5mol/L葡萄糖(glucose)和0.5mol/L海藻糖(trehalose)。实验结果证明,DM3培养基中含0.5mol/L的山梨醇或甘露醇时原生质体转化率较高(约为1.1×102CFU/μg DNA),略高于蔗糖转化率(0.82×102CFU/μg DNA),且明显高于海藻糖(0.7×102CFU/μg DNA)和葡萄糖(0.2×102CFU/μg DNA)的转化率。因此,0.5mol/L的山梨醇或甘露醇可代替琥珀酸钠作为促进地衣芽孢杆菌原生质体再生的渗透压保护剂。
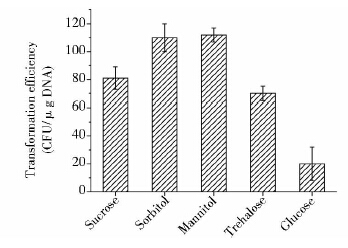
|
| 图 5 渗透压保护剂对原生质体电转化效率的影响 Fig. 5 Effect of osmoprotectant on protoplast electrotransformatio efficiency |
除B. licheniformis CICC 10181外,本研究对产碱性蛋白酶的B. licheniformis CICC 20204也进行了转化实验,以进一步证明原生质体电转化法对工业地衣芽胞杆菌菌株具有普适性。另外,考虑到整合型质粒在继代过程中不依赖抗性压力对工业生产具有重要的意义,我们对整合型质粒pAX01的转化效果也进行了研究和对比。
实验结果显示,野生菌株B. licheniformis CICC 10181和B. licheniformis CICC 20204通过原生质体电转化法均实现了不同类型质粒的成功转化(表 1)。其中,游离型质粒pGJ103的转化效率高于整合型质粒pAX01,分析认为这与质粒pAX01分子质量较大,且pAX01在细胞内还需通过同源重组完成基因整合有关。此外,该结果也说明原生质体电转化法对于环形DNA和线性DNA(pAX01经PvuI单酶切线性化后转化细胞)的转化均适用。我们对每个质粒对应的抗性转化子中随机选取10株提取质粒进行酶切或提取基因组进行红霉素基因PCR扩增以鉴定阳性克隆,结果全部为阳性。
| 地衣芽孢杆菌菌株 | 感受态细胞(μl) | 质粒(μg) | 转化子/个 | |
| 整合质粒pAX01 | 游离质粒pGJ103 | |||
| CICC 10181 | 120 | 1 | 52±8 | 110±10 |
| CICC 20204 | 120 | 1 | 45±5 | 88±14 |
由于难以像枯草芽孢杆菌那样产生自然感受态,地衣芽孢杆菌的转化一直较为困难。目前采取的转化方法主要为原生质体转化法和电转化法两种。总的来说,原生质体转化法虽然反应条件温和,但需要PEG介导原生质体细胞与DNA自发凝聚,因此转化效率较低。而电转化法虽步骤简单,但对于细胞壁厚且带有大量负电荷的芽胞杆菌效果却并不显著。在本研究的前期实验中,分别采用原生质体转化法[14]和电转化法[9]对野生地衣芽孢杆菌进行质粒pGJ103转化均未得到稳定的转化结果,且最高转化率未超过20CFU/μg DNA。针对以上问题,我们尝试将两种方法结合起来,即首先通过制备原生质体的方法去掉阻碍外源DNA进入细胞的细胞壁组分,再利用瞬时电压冲击细胞膜产生短暂穿孔,使DNA无需借助凝聚作用而是在电场作用下高效的进入细胞内。这样做一方面减少了DNA的穿膜阻力,另一方面增加了原生质体细胞接收外源DNA的量,因此提高了地衣芽孢杆菌的转化效率。
本研究重点考察了原生质体制备、电转电压和再生条件等环节对转化效果的影响。实验证明,处于对数生长期后期的地衣芽孢杆菌对溶菌酶作用较敏感,在终浓度为10mg/ml的溶菌酶作用40min后原生质体比例可达到96%以上。而地衣芽孢杆菌原生质体由于失去了细胞壁的保护,对电击操作尤为敏感,电压在超过最适电压(0.6kV/mm)后转化效率快速下降,远低于地衣芽孢杆菌电转化文献中的电转电压(1.25~2.1kV/mm)[9, 16]。这主要与原生质体细胞可耐受的电压阈值较低有关,较高的电流脉冲会破坏细胞膜的稳定结构,导致细胞死亡率上升。因此,提高细胞转化后的再生率是提升转化效率的关键。已有研究显示,渗透压保护剂的存在可以平衡转化后细胞内的高膨胀压力,预防细胞膨胀或皱缩,具有提高细胞存活率的作用[15]。例如,在巨大芽孢杆菌的电击复苏液中加入山梨醇[23]、枯草芽孢杆菌电击液中加入海藻糖[24]、地衣芽胞杆菌电击液中加入山梨醇和甘露醇[25],以及在芽孢杆菌原生质体再生培养基中加入山梨醇[15]、蔗糖[14, 26]、明胶[27]、琥珀酸盐[22]等,均显著提高了宿主细胞的转化效率。本实验中,我们也对DM3再生筛选培养基中的渗透压保护剂进行了优化,在对比了5种渗透压保护剂后发现,山梨醇或甘露醇是较适宜的渗透压稳定剂,转化效率最高可达到1.1×102CFU/μg DNA。
为验证原生质体电转化法具有良好的适用性,我们选取了两株工业地衣芽孢杆菌菌株,即产耐高温淀粉酶菌株CICC 10181和产碱性蛋白酶菌株CICC 20204为实验对象,并分别进行了游离型质粒pGJ103和整合型质粒pAX01的成功转化。由于整合型质粒继代稳定,不依赖抗生素,所以整合型质粒的成功转化对工业发酵而言具有重要意义。另外,整合型质粒成功转化也证明了本方法适用于地衣芽孢杆菌染色体基因敲除等操作,具有更广泛的应用潜力。综上,本研究建立并优化了一种高效的地衣芽孢杆菌原生质体电转化方法,该方法的建立为地衣芽孢杆菌,尤其是野生型菌株的遗传改造奠定了良好的技术基础。
| [1] | Harwood C R. Bacillus subtilis and its relatives: molecular biological and industrial workhorses. Trends in Biotechnology, 1992, 10(7): 247-256. |
| [2] | Schallmey M, Singh A, Ward O P. Developments in the use of Bacillus species for industrial production. Canadian Journal of Microbiology, 2004, 50 (1): 1-17. |
| [3] | Veith B, Herzberg C, Steckel S, et al. The complete genome sequence of Bacillus licheniformis DSM13, an organism with great industrial potential. Journal of Molecular Microbiology and Biotechnology, 2004, 7(4): 204-211. |
| [4] | Nahrstedt H, Wittchen K D, Rachman M A, et al. Identification and functional characterization of a type I signal peptidase gene of Bacillus megaterium DSM319. Applied Microbiology and Biotechnology, 2004, 64 (2): 243-249. |
| [5] | Waldeck J, Meyer-Rammes H, Nahrstedt H, et al. Targeted deletion of the uvrBA operon and biological containment in the industrially important Bacillus licheniformis. Applied Microbiology and Biotechnology, 2007, 73 (6): 1340-1347. |
| [6] | Waldeck J, Meyer-Rammes H, Wieland S, et al. Targeted deletion of genes encoding extracellular enzymes in Bacillus licheniformis and the impact on the secretion capability. Journal of Biotechnology, 2007, 130 (2): 124-132. |
| [7] | Nahrstedt H, Waldeck J, Grne M, et al. Strain development in Bacillus licheniformis: construction of biologically contained mutants deficient in sporulation and DNA repair. Journal of Biotechnology, 2005, 119 (3): 245-254. |
| [8] | Borgmeier C, Bongaerts J, Meinhardt F. Genetic analysis of the Bacillus licheniformis degSU operon and the impact of regulatory mutations on protease production. Journal of Biotechnology, 2012, 159 (1-2): 12-20. |
| [9] | Tangney M, Diderichsen B, Priest F. A method for electrotransformation of Bacillus licheniformis NCIB 6346 by plasmid DNA. Biotechnology Techniques, 1994, 8 (7): 463-466. |
| [10] | 陈万用, 印小明. 芽孢杆菌原生质体的形成和质粒转化的研究. 微生物学报, 1986, 26 (2): 134-142. Chen W Y, Yin X M. Formation of protoplast and plasmid transformation in the genus Bacillus. Acta Microbiologica Sinica, 1986, 26 (2): 134-142. |
| [11] | Jensen K K, Hulett F M. Protoplast transformation of Bacillus licheniformis MC14. Journal of General Microbiology, 1989, 135 (8): 2283-2287. |
| [12] | Rey M W, Ramaiya P, Nelson B A, et al. Complete genome sequence of the industrial bacterium Bacillus licheniformis and comparisons with closely related Bacillus species. Genome Biology, 2004, 5 (10): R77. |
| [13] | Waschkau B, Waldeck J, Wieland S, et al. Generation of readily transformable Bacillus licheniformis mutants. Applied Microbiology and Biotechnology, 2008, 78 (1): 181-188. |
| [14] | Prágai Z, Holczinger A, Sík T. Transformation of Bacillus licheniformis protoplasts by plasmid DNA. Microbiology, 1994, 140 (2): 305-310. |
| [15] | 莫静燕, 陈献忠, 王正祥. 地衣芽孢杆菌原生质体的制备、再生及转化研究. 生物技术, 2009, 19 (5): 75-77. Mo J Y, Chen X Z, Wang Z X. Preparation, regeneration and genetic transformation of Bacillus licheniformis protoplasts. Biotechnology, 2009, 19 (5): 75-77. |
| [16] | Brigidi P, De Rossi E, Riccardi G, et al. A highly efficient electroporation system for transformation of Bacillus licheniformis. Biotechnology Techniques, 1991, 5 (1): 5-8. |
| [17] | 唐雪明, 邵蔚蓝, 王正祥, 等. 地衣芽孢杆菌感受态细胞的诱导形成及其高效电转化方法. 无锡轻工大学学报, 2002, 21 (5): 460-463. Tang X M, Shao W L, Wang Z X. Formation of competent Bacillus licheniformis cell and high efficiency electrotransformation for vectors. Journal of Wuxi University of Light Industry, 2002, 21 (5): 460-463. |
| [18] | Leonard C G, Mattheis D K, Mattheis M J, et al. Transformation to prototrophy and polyglutamic acid synthesis in Bacillus licheniformis. Journal of Bacteriology, 1964, 88 (1): 220-225. |
| [19] | Wati M R, Priest F G, Mitchell W J. Mutagenesis using Tn917 in Bacillus licheniformis. FEMS Microbiology Letters, 1990, 71 (1-2): 211-214. |
| [20] | Chang S, Cohen S. High frequency transformation of Bacillus subtilis protoplasts by plasmid DNA. Molecular and General Genetics, 1979, 168 (1): 111-115. |
| [21] | Romero D, Pérez-García A, Veening J-W, et al. Transformation of undomesticated strains of Bacillus subtilis by protoplast electroporation. Journal of Microbiological Methods, 2006, 66 (3): 556-559. |
| [22] | Jandová Z, Tichy P. Selective regeneration of Bacillus subtilis protoplasts transformed to kanamycin resistance. Folia Microbiologica, 1987, 32 (1): 82-84. |
| [23] | Shark K B, Smith F D, Harpending P R, et al. Biolistic transformation of a procaryote, Bacillus megaterium. Applied and Environmental Microbiology, 1991, 57 (2): 480-485. |
| [24] | 张晓慧. 海藻糖改善枯草芽孢杆菌电转化方法的研究. 南京: 南京农业大学,食品科学技术学院, 2010. Zhang X H. Improvement in Electroporation Transformation Efficiency of Gene for Bacillus subtilis with Trehalose. Nanjing: Nanjing Agricultural University, College of Food Science and Technology,2010. |
| [25] | Xue G P, Johnson J S, Dalrymple B P. High osmolarity improves the electro-transformation efficiency of the gram-positive bacteria Bacillus subtilis and Bacillus licheniformis. Journal of Microbiological Methods, 1999, 34 (3): 183-191. |
| [26] | Cue D, Lam H, Dillingham R L, et al. Genetic manipulation of Bacillus methanolicus, a gram-positive, thermotolerant methylotroph. Applied and Environmental Microbiology, 1997, 63 (4): 1406-1420. |
| [27] | Bourne N, Dancer B N. Regeneration of protoplasts of Bacillus subtilis 168 and closely related strains. Journal of General Microbiology, 1986, 132 (2): 251-255. |
 2015, Vol. 35
2015, Vol. 35




