文章信息
- 李智力, 易小萍, 储炬, 庄英萍, 张嗣良
- LI Zhi-li, YI Xiao-ping, CHU Ju, ZHUANG Ying-ping, ZHANG Si-liang
- PK-15细胞微载体悬浮培养生产猪细小病毒的工艺研究
- A Microcarrier Cell Culture Process for propagating Porcine Parvovirus in PK-15 Cells
- 中国生物工程杂志, 2015, 35(7): 62-67
- China Biotechnology, 2015, 35(7): 62-67
- http://dx.doi.org/10.13523/j.cb.20150709
-
文章历史
- 收稿日期:2015-04-02
- 修回日期:2015-04-30
猪细小病毒(PPV)是一种无囊膜的单股负链DNA病毒,对环境耐受力强,是引起母猪繁殖障碍的主要病原之一[1]。PPV感染母猪后,能紧紧吸附在母猪受精卵细胞透明带的外表面,部分PPV能穿过透明带进入卵细胞。感染母猪的黄体出现萎缩,不能正常抑制排卵和分泌孕酮,这会危及胎儿,造成胎儿流产、死产、木乃伊胎和母猪恢复发情周期[2, 3, 4]。近年来,PPV强毒株的出现使得此病在世界范围内的发病率急剧增加,且范围在不断扩大。目前,猪细小病毒病的预防方式主要以接种灭活疫苗为主。很多实验室都已开发出PPV灭活疫苗[5, 6, 7, 8, 9]。高效的灭活疫苗和佐剂能诱导猪体产生大量的病毒中和抗体。这些抗体能有效的预防野毒株的感染[5]。养殖场的大量实践证明,猪细小病毒灭活疫苗能有效的预防猪感染猪细小病毒[7, 10, 11]。
PPV可在多种细胞中增殖,如原代猪肾细胞、猪睾丸细胞、猪的传代细胞系(如PK-15)、人的传代细胞(如HeLa、Hep-2、KB、Lu32)[12]。PPV的复制需要借助宿主细胞的合成和代谢体系,因此PPV对宿主细胞有一定的选择性。Oraveerakul等[13]通过试验发现,PPV对宿主细胞的选择性并不是在吸附和进入细胞的过程中体现,而是在于病毒的复制、转录及蛋白质表达。当细胞绝大部分处于旺盛的有丝分裂期时进行病毒接种最佳,这个时期的许多细胞处于细胞有丝分裂S期(DNA合成期),因为PPV的复制需要利用宿主细胞的DNA合成酶。
传统的疫苗生产方式大多是用滚瓶为细胞提供贴附表面,而每个滚瓶都是一个独立的细胞培养单元,其细胞质量、病毒产量和滴度均不同,导致疫苗批次间差异大、操作劳动强度高,隐性污染也会引起高内毒素。1967年,Van Wezel[14]和Tree等[15]将微载体培养系统引入大规模贴壁依赖性哺乳动物细胞培养,进行病毒疫苗和其他生物产品的生产。随着微载体培养技术的成熟,反应器微载体悬浮培养系统正逐渐取代传统的鸡胚和滚瓶生产模式。亟待开发一种有效的、稳定的猪细小病毒反应器微载体悬浮培养工艺以应对猪细小病毒疫情的暴发。
本文在实验室自制低血清培养基的基础上从接毒时间、感染复数、收毒时间和血清含量等几个方面优化了病毒静置培养工艺,并尝试将此工艺从静置培养工艺扩展到反应器微载体悬浮培养系统中,同时对病毒培养过程中的代谢特性进行了相关研究。
1 材料与方法 1.1 细胞系贴壁依赖性PK-15细胞(猪肾细胞)由武汉病毒研究所提供。
1.2 培养基及反应器PK-15细胞培养所用培养基为低血清培养基P-LSM(苏州沃美,货号P22301-2),使用时加入3%新生牛血清(Gibco)即可。
5L动物细胞反应器由上海国强装备有限公司提供。
1.3 PPV在PK-15细胞上接毒时间优化将PK-15细胞以4×104 cells/cm2的密度接种于6孔板中,2ml/孔。待细胞生长6h、12h和24h,弃去培养基,用PBS洗涤2次,以MOI为1接种PPV病毒,病毒感染液为无血清P-LSM培养基,37℃下感染1h,弃上清液,用PBS洗涤2次,加入 P-LSM(含3% NBCS)培养基,37℃ 5% CO2培养箱恒温培养;于不同时间收毒。
1.4 PPV在PK-15细胞上接毒MOI优化将PK-15细胞以4×104 cells/cm2的密度接种于6孔板中,2ml/孔。待细胞生长12h后,弃去培养基,用PBS洗涤2次,分别以MOI为0.1、1和3接种PPV病毒,病毒感染液为无血清P-LSM培养基,37℃下感染1h,弃上清液,用PBS洗涤2次,加入P-LSM(含3% NBCS)培养基,37℃ 5% CO2培养箱恒温培养;于不同时间收毒。
1.5 血清对PPV感染的的影响接毒时间为12h,MOI为1,感染时血清含量分别为无血清、1%、3%、5%和10%,37℃感染1h,换为P-LSM(含3% NBCS),培养48h后收毒,测定病毒滴度。
1.6 转瓶上接毒时间优化Cytodex1微载体浓度为2.0g/L,细胞接种密度为25cells/microcarrier,置于37℃ 5%CO2培养箱中培养。分别于12h、24h和36h全体积换为无血清P-LSM培养基,并以MOI为1接种PPV。每隔12h取样测毒价。
1.7 反应器培养细胞培养阶段:微载体浓度为2.0g/L,细胞接种密度为25cells/microcarrier,半体积搅拌4h补加P-LSM(含3% NBCS)至工作体积。温度36.5℃,pH 7.2,溶氧控制为40%空气饱和度,转速45r/min。
病毒接种阶段:细胞培养24h后停转速,让微载体自然沉降,用无血清P-LSM培养基清洗2遍,加入无血清P-LSM(含猪细小病毒),37℃感染1h,换为P-LSM(含3% NBCS),换液体积为工作体积的80%。
1.8 分析方法孔板和方瓶中培养的细胞采用台盼蓝拒染法计活细胞密度和细胞活率。微载体上培养的细胞采用结晶紫计数法。葡萄糖、乳酸、谷氨酰胺、氨等胞外代谢物浓度通过NOVA 400测定。病毒滴度通过测定病毒TCID50得到。
2 结果与讨论 2.1 PPV接毒时间优化PPV的复制需要宿主细胞的DNA合成酶,最适宜在具有旺盛增殖能力并处于有丝分裂时期的细胞内增殖,为了考察接毒时间对PPV毒价的影响,下面对接毒时间进行优化。
如图 1所示,细胞接种后6h以MOI为1接种PPV病毒,细胞生长受到明显抑制,24h达到最大细胞密度,仅为初始接种密度的2倍,随后活细胞密度出现明显下降。接种病毒后6h检测到病毒滴度出现大幅度下降,同文献上报道的现象相似。可能原因是病毒在此阶段大量的进入细胞内,且包膜蛋白遭到降解,裸露出核酸DNA,通过免疫荧光检测方法检测到有感染性的病毒粒子大量减少。随着病毒利用细胞内的代谢物进行病毒的复制和组装,在随后24h病毒滴度急剧增加,在60h病毒滴度达到最大值107.1 TCID50/ml。
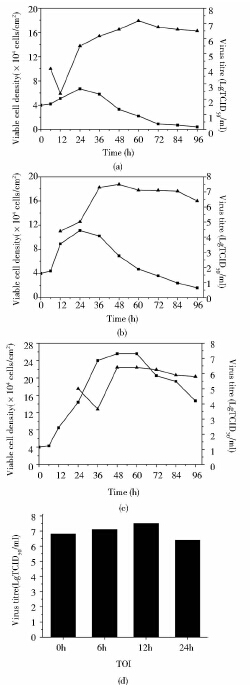
|
| 图 1 6h、12h和24h接毒时细胞和病毒的增殖曲线 Fig. 1 The growth curve of PK-15 cells (■) and the virus titre of PPV (▲) when infected at 6h,12h and 24h |
细胞接种后6h接毒,因接种病毒时间过早,严重影响了细胞的正常生长,导致PK-15细胞只能倍增1.7倍。通过延迟接毒时间来增加细胞的增殖,或许可以提高病毒滴度。故采用细胞接种后12h以MOI为1接种PPV病毒,最大细胞密度得到一定改善,24h达到最大细胞密度,为初始接种密度的3倍,随后开始下降。在48h达到最大病毒滴度107.5 TCID50/ml。
细胞接种后24h接种PPV病毒,细胞最大密度得到了进一步提高,48h达到最大细胞密度,为初始接种密度的6倍,但最大病毒滴度较12h接毒出现了显著下降,在60h达到最大病毒滴度106.5 TCID50/ml。
通过比较上述不同接毒时间下的最大病毒滴度,细胞接种后12h以MOI为1接种PPV病毒为最佳接毒时间,最大病毒滴度显著高于其余三组。虽然理论上细胞数越多,其所收获的病毒也应该越多,但PPV病毒只在一定范围内满足此规律,说明细胞密度并不是病毒滴度的决定性因素,同时也与细胞的生长周期息息相关。这主要是由于PPV病毒在增殖子代病毒时需要宿主细胞DNA复制相关的酶参与,只有细胞处于指数生长前期时其DNA复制酶的活性最高。
2.2 PPV感染复数MOI优化除了接毒时间会影响病毒的最终滴度外,接毒时的感染复数对病毒的增殖能力也起着至关重要的作用。感染复数直接决定着接毒时被感染的细胞比例。感染比例过低,产毒时间过长;感染比例过高,需要大量的种毒,在生产上对病毒种子库造成很大的压力。为了获得较高的病毒效价,以及尽量减少接毒量,需要选择合适的感染复数。
如图 2所示,MOI为0.1时最大病毒滴度明显低于高MOI组,且其达到最大病毒滴度的时间延长了24h;MOI为3时最大病毒滴度相对于MOI为1并没有明显的提高,但其需要大量的种毒。以MOI为1接种病毒时,接种后36h能达到最大病毒滴度107.5 TCID50/ml。故选择MOI为1为最佳感染复数。
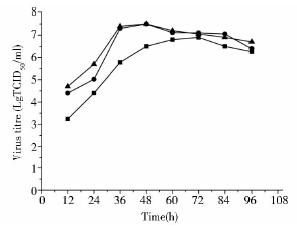
|
| 图 2 12h接毒时不同MOI下的病毒增殖曲线 Fig. 2 The virus titre of PPV at different MOIs when infected at 12h MOI: 0.1 (■),1 (●),3 (▲) |
因上述的接毒方法都是无血清接毒,接毒前需要清洗和换液,工艺繁琐,且容易染菌。故研究接毒时血清对最终病毒滴度的影响。试验结果表明,接毒时血清的含量对最大病毒滴度有显著的影响。如图 3所示,无血清接毒时病毒滴度最高,当含有3%的血清时TCID50下降一个滴度,当含有10%的血清时TCID50下降两个滴度。故接毒感染时应采用无血清接毒后再换为含血清的培养基来支持细胞的生长及病毒的繁殖。
|
| 图 3 不同血清浓度感染下的最大病毒滴度 Fig. 3 The maximum virus titre when infected at different serum concentration |
在上述优化病毒工艺的过程中发现乳酸对葡萄糖得率和病毒生长曲线存在一定的关联性。如图 4所示,随着病毒滴度的不断升高,乳酸对葡萄糖得率也不断增大,当病毒滴度达到最大值时,乳酸对葡萄糖得率也基本达到最大值,三个接毒时间下的最大得率均为1.8~2.5,而且明显高于细胞培养过程中的得率,随后开始呈下降趋势。说明病毒的增殖需要细胞能快速提供能量和中间代谢物,满足其快速繁殖的需求。此现象至今还鲜有报道,将有望成为实时监测病毒繁殖的重要指标,并可望作为工业生产中确定病毒最佳收毒时间的依据。
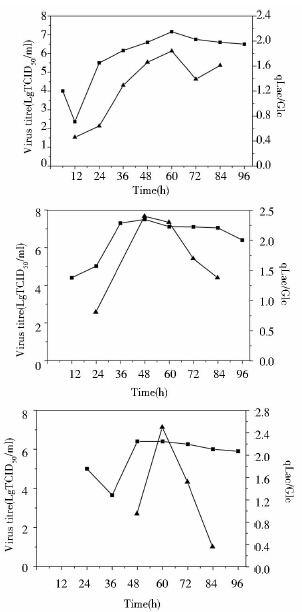
|
| 图 4 6h、12h和24h接毒时病毒增殖曲线和乳酸对葡萄糖得率 Fig. 4 The virus titre of PPV (■) and the yield coefficients of lactate to glucose (▲) when infected at 6h,12h and 24h |
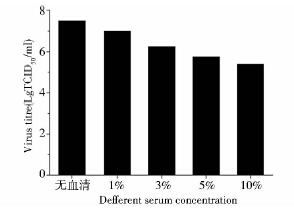
通过比较微载体悬浮培养和方瓶静置培养生产病毒的区别,主要体现在细胞的生长周期上,由静置培养的优化结果可发现,PPV病毒的接毒时间至关重要,故对微载体悬浮培养系统中PPV病毒的接毒时间进行优化。
如图 5所示,在微载体悬浮培养PK-15细胞时,其最佳接毒时间为细胞接种后24h,所能达到最大病毒滴度为107.3 TCID50/ml。最佳接毒时间相对于方瓶静置培养延迟了12h,主要原因可能是细胞在微载体系统中从悬浮状态转变为贴壁状态需要的时间较静置培养更长,且贴壁之后的延滞期也更长。微载体悬浮培养时病毒接毒时间宜采用细胞接种后24h。
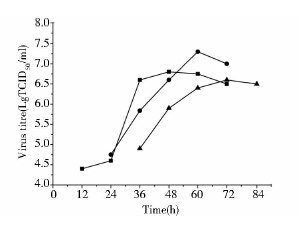
|
| 图 5 转瓶中不同接毒时间下的病毒生产曲线 Fig. 5 The virus titre of PPV at different infection time,12h (■),24h (●),36h (▲) |
为了将优化结果在反应器微载体系统上得到重复,并进一步验证病毒滴度和乳酸对葡萄糖得率之间的相关性,在5L反应器上进行PK-15细胞培养接种PPV病毒实验。如图 6所示,接种PPV病毒36h后达到最大病毒滴度107.2 TCID50/ml,乳酸对葡萄糖得率随病毒滴度的上升而增大。优化结果在反应器微载体系统上得到很好的重现,而且乳酸对葡萄糖得率可以作为指针PPV病毒收获时间的重要参数。若能实时监控葡萄糖的消耗和乳酸的生成,将能比较准确实时监控猪细小病毒生产过程。
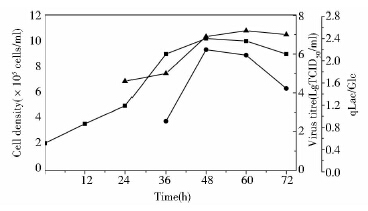
|
| 图 6 5L反应器中PK-15细胞的生长曲线和PPV的生产曲线及乳酸对葡萄糖得率 Fig. 6 The growth curve of PK-15 cells (■) and the virus titre of PPV in 5L bioreactor (▲) and the yield coefficients of lactate to glucose (●) |
通过PPV接毒时间优化表明,细胞接种后12h接种PPV所得到的最大病毒滴度最高。说明提高PPV的产量不仅要提高病毒感染时的细胞密度,更重要的是需要找到合适的接毒时间,因为PPV的复制需要宿主细胞的DNA合成酶,当细胞处于指数生长期时细胞的DNA合成酶活性最高。Mengeling等[16]报道,在刚传细胞或不等细胞长成单层时接毒最佳,优化结果显示,在PK-15细胞指数生长前期接种PPV最佳。接毒时的感染复数也是决定病毒增殖能力的重要参数,MOI优化实验表明PPV最佳MOI为1。流感病毒等大多采用低MOI进行感染[17],受感染细胞增殖出来的病毒可以跨膜转运至健康细胞,或分泌到胞外进行二次感染。但PPV的增殖需要宿主细胞DNA合成酶的参与,当受感染的细胞增殖出大量的病毒时,健康的PK-15细胞已经进入指数生长后期,细胞的DNA合成酶活性降低,不能支持PPV的大量增殖。同时发现PPV感染时血清的存在对最大病毒滴度造成很大的影响,无血清感染最佳。杨琴等[18]的研究也表明培养基中血清含量越高,流感病毒滴度越低,由于血清中存在非特异性的蛋白质、补体或其他小分子物质,覆盖力细胞表面的流感病毒受体。
目前,大多疫苗生产企业仍采用滚瓶生产模式进行病毒生产,存在批次间差异大、占地面积多、劳动强度大等缺点,本文通过优化PPV接毒时间将原工艺放大到微载体悬浮培养系统中,实现了5L反应器培养,最大病毒滴度较原工艺下降了0.3个滴度,可能原因是反应器上无血清洗涤不够充分,残留的血清对最大病毒滴度造成影响。
PPV在PK-15细胞增殖的过程中,因PPV对温度敏感[19],当病毒滴度达到最大后不能维持,而是持续下降,确定合适的收毒时间对PPV生产至关重要,通过研究PK-15细胞接种PPV后胞外代谢特性,首次发现乳酸对葡萄糖得率和病毒滴度存在一定的相关性,当病毒滴度达到最大时,乳酸对葡萄糖的得率也达到最大,并从能量和代谢的角度予以阐述,这将为PPV以至其他病毒收毒时间的确定提供重要依据。
| [1] | Bergeron J, Hebert B, Tijssen P. Genome organization of the Kresse strain of porcine parvovirus: identification of the allotropic determinant and comparison with those of NADL-2 and field isolates. Journal Of Virology, 1996, 70(4):2508-2515. |
| [2] | Dunne H W, Gobble J L, Hokanson J F. Porcine reproductive failure associated with a newly identified'SMEDI' group of picorna viruses. American Journal of Veterinary Research, 1965, 26(2): 1284-1297. |
| [3] | Mengeling W L, Cutlip R C. Pathogenesis of in utero infection: experimental infection of five-week-old porcine fetuses with porcine parvovirus. American Journal of Veterinary Research, 1975, 36(8): 1173-1177. |
| [4] | Joo H S, Donaldson-Wood C R, Johnson R H. Observations on the pathogenesis of porcine parvovirus infection. Archives of Virology, 1976, 51(2): 123-129. |
| [5] | Suzuki H, Fujisaki Y. Immunizing effect of inactivated porcine parvovirus vaccine on piglets. National Institute of Animal Health Quarterly, 1976, 16(2): 78-81. |
| [6] | Joo H S, Johnson R H. Serological responses in pigs vaccinated with inactivated porcine parvovirus. Australian Veterinary Journal, 1977, 53(4): 550-552. |
| [7] | Fujisaki Y, Ichihara T, Sasaki N. Field trials on inactivated porcine parvovirus vaccine for prevention of viral stillbirth among swine. National Institute of Animal Health Quarterly, 1978, 18(3): 180-185. |
| [8] | Mengeling W L, Brown T T, Paul P S, et al. Efficacy of an inactivated virus vaccine for prevention of porcine parvovirus-induced reproductive failure. American Journal of Veterinary Research, 1979, 40(7): 204-207. |
| [9] | Wrathall A E, Wells D E, Cartwright S F, et al. An inactivated, oil-emulsion vaccine for the prevention of porcine parvovirus-induced reproductive failure. Research in Veterinary Science, 1984, 36(5): 136-143. |
| [10] | Vannier P, Brun A, Chappuis G, et al. Study of the efficacy of an inactivated virus vaccine against porcine parvovirus. Annales de Recherches Vétérinaires, 1986, 17(4): 425-432. |
| [11] | Wrathall A E. Field trials of an inactivated, oil-emulsion porcine parvovirus vaccine in British pig herds. Veterinary Record, 1988, 122(1): 411-418. |
| [12] | Kradowks, Ellis J A, Meehan B. Viral wastingsyndrome of swine: experimental reproduction of postweaning multisystemic wasting syndrome in gnotobiotic swine by coinfection with circovirus2 and porcine parvovirus. VetPathol, 2000, 37(3): 254-263. |
| [13] | Oraveeerakul K, Sooccchoi C, Molitor T W. Detection of porcine parvovirus using nonradioactive nucleic acid hybridization. Vet Diagn Inreat, 1990, 36(2): 85-91. |
| [14] | Van Wezel A. Growth of cell-strains and primary cells on micro-carriers in homogeneous culture. Nature, 1967, 21(6): 64-65. |
| [15] | Tree J A, Richardson C, Fooks A R, et al. Comparison of large-scale mammalian cell culture systems with egg culture for the production of influenza virus A vaccine strains. Vaccine, 2001, 19(25-26): 3444-3450. |
| [16] | Mengeling W L, Pejsak Z, Paul P S. Biological assay of attenuated strain NADL-2 and virulent strain NADL-8 of porcine parvovirus. Am J Vet.Res, 1984, 45(11): 2403-2407. |
| [17] | Kunal A, Frank J, Luis M, et al. Bioprocess optimization for cell culture based influenza vaccine production. Vaccine, 2011, 29(17): 3320-3328. |
| [18] | 杨琴, 张兴晓, 杨灵芝. 3种细胞培养流感病毒的比较. 动物医学进展, 2009,30(11):76-79. Yang Q, Zhang X X, Yang L Z. Comparison of cultureing influenza virus in three kinds of cell lines. Progress In Veterinary Medicine, 2009,30(11):76-79. |
| [19] | 魏战勇, 崔保安, 张素梅, 等. 猪细小病毒在PK细胞中的增殖过程. 中国兽医学报, 2005,25(5):453-455. Wei Z Y, Cui B A, Zhang S M, et al. The replication of porcine parvovirus in PK-15 cell cultures. Chinese Journal Of Veterinary Science, 2005,25(5):453-455. |
 2015, Vol. 35
2015, Vol. 35




