文章信息
- 张登央, 张英, 张丽君, 王妍
- ZHANG Deng-yang, ZHANG Ying, ZHANG Li-jun, WANG Yan
- 3D技术制备骨修复生物材料的功能和安全性评价
- In vitro functionality and in-vivo Safety Assessment of Bone Repair Scaffold Using 3D Printing Technology
- 中国生物工程杂志, 2015, 35(7): 55-61
- China Biotechnology, 2015, 35(7): 55-61
- http://dx.doi.org/10.13523/j.cb.20150708
-
文章历史
- 收稿日期:2015-03-11
- 修回日期:2015-04-15
骨组织损伤是人类健康面临的一大难题。随着医学科学的发展,骨水泥材料和人工骨移植技术已经较为广泛地应用于临床,但至今仍存在一些问题。例如,有机质骨水泥的生物相容性差,成形过程放热大,有可能加重患者的病情;无机质骨水泥则会发生体内成形固化速率慢,柔韧度较差的现象;人工骨移植治疗方案始终存在着来源限制与可能存在的免疫反应等问题。而组织工程是一种重要的潜在替代治疗措施,有望最终解决这个问题[1]。
组织工程支架材料的目的是为细胞提供一个三维(three dimensional,3D)支架,有利于细胞的黏附、增殖及分化,为细胞生长提供合适的环境支持。3D支架的制作在组织工程研究中起着非常重要的作用,它是组织工程实现产业化的关键。
传统的3D支架制作技术有溶剂浇铸-粒子沥滤法[2]、气体发泡法[3]、乳化/冻干法、相分离法等,但考虑到材料的多孔性及孔径时,采用上述方法制作的医用再生材料具有一定的局限性。利用3D打印机制作支架材料是目前国际上再生医学研究的一个热点[4, 5]。Zopf等[6]报道了利用3D打印的气管夹板进行气管支气管软化病的治疗,经过治疗后一年,婴儿患者长出了左侧主干支气管。一般利用核磁共振成像获得患者骨损伤部位的三维数据,获得的三维数据通过软件转换为三维打印模型,编译为3D打印机识别的文件格式,利用快速成型技术制作骨组织模型和组织支架[7],将此个性化制作的支架材料在体外进行适应性处理后,移植入患者的病变部位,可能会极大的缓解患者的病症,甚至挽救一些患者的生命。Tarafder等[8]利用3D技术制作的磷酸三钙(tricalcium phosphate,TCP)支架,移植入小鼠股骨缺陷模型中进行治疗,发现在早期可加速新生骨组织的骨细胞生成。
本实验描述了一种利用3D打印机快速制作聚乳酸-羟基乙酸[9]/羟基磷灰石[poly(lactide-co-glycolide)/hydroxyapatite,PLGA/HA]复合3D支架的方法,对制作的3D材料进行相应的机械性能检测,体外支持人骨髓间质干细胞(human bone marrow derived mesenchymal Stem Cells,hMSC)增殖分化试验及体内生物安全性评估。
1 材料与方法 1.1 材 料 1.1.1 支架材料PLGA(75∶25),相对分子质量为10万,购自于深圳市光华伟业实业有限公司;HA,购自于Sigmaaldrich公司;二噁烷购自阿拉丁试剂有限公司。
1.1.2 设备及耗材3D打印设备为Automation 3200,使用的软件为NVVIEWER,由清华大学深圳研究生院提供;3D打印用容器、针头购自与日本MUSASHI公司;细胞培养箱购自美国热电公司;CKX41倒置显微系统购自日本奥林巴斯;BHC-1000Ⅱ A2生物安全柜购自江苏苏净公司;台式离心机购自Eppendorf公司; Quanta 450扫描电镜为美国FEI公司制造;迪瑞产CS-600B 全自动生化分析仪;深圳普康产PE-6800半自动血细胞分析仪。
1.1.3 细胞与试剂hMSC细胞(ATCC PCS-500-012)购自美国典型培养物保藏中心(American Type Culture Collection,ATCC);细胞基础培养基(ATCC PCS-500-030,PCS-500-041)和成软骨基础培养基(HUXMA-90041)购自赛业(广州)生物科技有限公司;完全培养基和成软骨完全培养基为含有终浓度10%胎牛血清的基础培养基和成软骨基础培养基;胎牛血清、胰酶购自Gibco公司;重组人β1a干扰素(recombinant human interferon-β1a,rhIFN-β1a)由本实验室制备;重组人神经生长因子(recombinant human nerve growth factor,rhNGF)由本实验室制备;酶标羊抗鼠抗体、鼠抗Ⅱ型胶原(collagenⅡ)抗体购自Abcam公司;Alcian Blue溶液购自Sigmaaldrich公司;核固红复染试剂盒购自上海杰美公司。
1.1.4 实验动物健康大耳白兔,雌雄不限,体重1.8~2.0kg,由长春生物制品研究所有限责任公司提供。
1.2 方 法 1.2.1 支架材料的制备和预处理PLGA分为3组,分别称取1.2g、1.8g和3.0g的PLGA,加入至5ml的二噁烷中,完全溶解;各组固定HA 质量为3g,加入适量体积的二噁烷中浸润,搅动,使其完全浸润;各组将溶解后的PLGA与HA混合搅拌均匀。
1.2.2 3D支架的打印及后处理打印一个4cm×4cm×2cm的立体支架,3D打印设备为Automation 3200;设置立体材料支架的打印参数:层与层之间材料垂直交叉式堆叠,每层内采用平行式放置,每条之间的间隙为2mm,Z轴方向每次的步进高度为0.2mm,X轴和Y轴方向的移动速项为2mm/s,出料口的孔径控制在0.5~0.1mm,出料口的压力控制在30~60psi。将预处理好的支架材料加入到打印设备的原料储存室中,运行程序,按照设定好的程序打印出所设计的立体支架。打印过程维持支架平台温度为-20~-10℃,并且持续给予冷风使固液相分离成型。支架打印完后,进行真空冷冻干燥。
1.2.3 材料机械性能检测3种制备的材料,由深圳市材料表面分析检测中心进行拉伸强度和弯曲强度测试,测试仪器为万能电子试验机,测试方法为GB/T 1040和GB/T 9341。
1.2.4 3D支架的切割及预处理3D材料用激光切割为1cm×1cm×2cm的小块,密封包装经γ射线辐射杀菌后,放置于适宜的无菌容器中,用75%乙醇完全浸没材料,浸泡过夜处理,弃去乙醇,用无菌生理盐水清洗3次,将材料置于适当无菌容器中,加入5ml生理盐水37℃浸泡24h,浸提液和材料分别用于进行安全性评价中的热原实验和皮下植入实验。支架材料用于细胞分化实验前需将材料在完全培养基中浸泡24h,取出后以无菌滤纸吸干残留溶液后接种hMSC。
1.2.5 hMSC细胞的培养及接种hMSC细胞培养于T175透气细胞瓶中,用完全培养基培养,待细胞铺满瓶底,加入2ml胰酶消化1min,加入10ml完全培养基终止胰酶消化反应,将细胞悬液收集至离心管中,离心收集细胞,离心后弃上清培养基,加入适量的完全培养基重悬细胞密度至2×106cell/ml。将进行过无菌处理的3D支架置于6孔板中,将细胞逐滴滴至材料中心,每块材料滴加0.5ml,静置1h,然后加入3ml完全培养基,置于37℃、5%CO2培养箱中培养。
1.2.6 hMSC在支架上增殖和成骨分化的电镜检测hMSC接种于支架材料后,于第7天取材料,用磷酸盐缓冲盐水(phosphate buffered saline,PBS)清洗材料,3%戊二醛固定,乙醇系列脱水,临界点干燥,喷金,扫描电镜观察hMSC在支架上的黏附增殖情况。同时将未接种细胞的支架材料进行电镜观察。
1.2.7 hMSC细胞的成软骨诱导分化待细胞在3D材料上培养2~3天后,吸去完全培养基。阴性组加入完全培养基,阳性对照组加入成软骨完全培养基。阳性组每3天更换一次成软骨完全培养基,共诱导分化培养21天。阴性组每3天更换一次完全培养基,共培养21天。
1.2.8 hMSCs成骨分化的糖胺聚糖(glycosaminoglycan,GAG)检测 将6孔板阳性组的成软骨完全培养基移去,用PBS清洗材料2次后,将材料取至一个新的24孔板中,向材料表面滴加入胰酶0.2ml,消化细胞2min,然后加入1ml完全培养基将材料中的细胞冲洗至24孔板中,静置于37℃、5%CO2培养箱中孵育72h。待第3天,小心抽去孔里的培养基,加入清理液清洗,酸性液孵育3min,Alcian Blue染色液室温处理30min,清洗2次,核固红复染后倒置显微镜下观察。阴性对照同样按照上述方法处理。
1.2.9 软骨细胞特异标志物collagenⅡ的免疫印迹检测胰酶消化材料上的细胞,加入1ml 完全培养基终止胰酶反应,计数后每组均离心收集1.0×105个细胞,弃上清液,加入20μl的细胞裂解液,作用10min后,离心后取上清液,加入2×的蛋白质上样缓冲液,混匀热处理后上样进行变性聚丙烯酰胺凝胶电泳。电泳后将分离胶上的蛋白质转印至聚偏二氟乙烯膜,封闭液封闭,抗collagenⅡ抗体孵育,酶标二抗孵育,加入底物显色液显色。
1.2.10 3D支架材料在动物体内的安全性评估按现行的医疗器械生物学评价标准及《中华人民共和国药典》(2010版)等相关标准对3D支架的热原、皮下植入等内容进行测试。每个实验平行为3只,实验取平均值。
1.2.11 热原实验实验前选取最高与最低体温相差不超过0.4℃的3只家兔。用于试验受试材料生理盐水浸提液的制备方法见1.2.4 。经耳缘静脉按10ml/kg剂量缓慢注入已预热至38℃的浸提液,保证在15min内注射完毕。注射完毕后每隔1h测量一次体温,共测3次,取肛温最高值减去基础体温即为体温升高值。
1.2.12 皮下植入试验受试材料的处理见方法1.2.4。取健康新西兰大白兔3只,除去兔背部试验部位被毛,消毒后用钝器解剖法在距离脊柱两侧旁2cm皮肤切口部位制备一个皮下囊,囊的底部距皮肤切口应为1cm以上,将受试材料块植入皮下,将皮肤缝合,饲养12周,期间注意观察并记录家兔一般状况、活动、饮食、饮水、体重增长等情况,分别于皮下植入前,以及植入后4周、8周、12周称体重,耳缘静脉采血,测血常规指标和血清生化指标。
2实验结果 2.1 3D材料的打印打印机按照上述程序进行3D支架材料的打印,可以打印出外观及结构符合预期的3D支架,经过后期的真空冷冻干燥,得到如图 1所示的3D支架材料。

|
| 图 1 3D支架材料图 Fig. 1 Photo of 3D scaffold (a)Bird’s-eye view (b)View of longitudinal section |
质量比按照不同比例混合后的PLGA/HA复合材料,其拉伸强度和弹性强度的测量值见表 1。其中PLGA∶HA为3∶5的材料,其拉伸强度和弹性强度为人体软骨平均值的5.35倍和5.25倍,选择该组进行进一步的试验。
材料经过处理后,在电镜下观察细胞的生长状况,见图 2,其中图 2(a)是未接种细胞的材料电镜图,材料表面有小孔,粗糙;图 2(b)为接种hMSC的材料,可见到细胞贴附,材料表面光滑,细胞之间连接平滑,可见处于伸展状态的细胞,细胞生长状态良好。
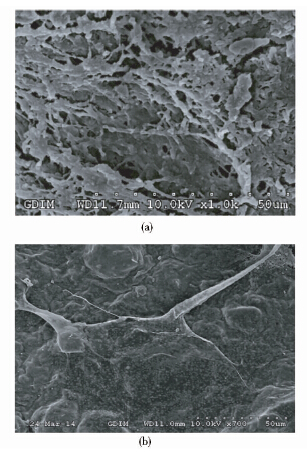
|
| 图 2 空白材料电镜图(a)和MSC在材料表面的电镜图(b) Fig. 2 SEM photo of blank biomaterial(a) and SEM photo of hMSC on biomaterial(b) |
结果蛋白聚糖染色后,阴性组的细胞形态呈长梭形,细胞周围并未见蓝色的糖蛋白出现,见图 3(a);而阳性组有明显的细胞形态变化,且细胞周围有大量蛋白聚糖出现,见图 3(b)。
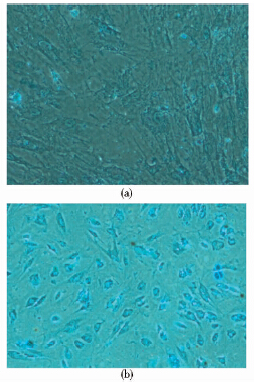
|
| 图 3 GAG检测图 Fig. 3 GAG detection photo of MSC on biomaterial (a)Negative control (b)Positive control |
阴性组和阳性组细胞进行Ⅱ型胶原的免疫印迹检测。结果显示各组均有collagen Ⅱ免疫条带出现,其中阴性组最低,阳性组collagen Ⅱ的表达水平高于阴性组。灰度分析值证明阳性组的相对表达量较阴性组都有明显差异(P<0.01)。表明支架材料可促进hMSC向成软骨细胞的分化,见图 4。

|
| 图 4 不同实验组Ⅱ型胶原的Western blot检测结果 Fig. 4 Western blot result of collagenⅡ of different experimental groups 1:Negative control;2:Positive control |
在测试的3只家兔中,体温升高均低于0.6℃,并且3只家兔体温升高总和低于1.4℃,供试品PLGA/HA支架的热原检查符合国家规定。检测结果见图 5。

|
| 图 5 受试品的动物热原检测结果 Fig. 5 Pyrogen tests of experiment samples based on animal method 1: 0.5h before medication; 2: 1h after medication; 3: 2h after medication; 4: 3h after medication |
供试品支架材料的处理见方法1.2.4。家兔皮下植入受试材料后12周期间,其一般状况、活动、饮食、饮水、体重增长等情况均无异常;其血清生化指标与植入前比较也无明显异常,检测结果见图 6;其血常规指标与植入前比较无明显异常,检测值见图 7;植入12周后,植入的受试材料块已经降解并吸收,植入处周围组织无化脓,也无分泌物,材料的周围组织部位病理检测结果显示均为正常组织(结果未显示)。表明供试品支架材料的动物皮下植入试验符合规定。

|
| 图 6 实验动物的血生化指标检测值 Fig. 6 Serum biochemical values of experimental animal 1: Serum total protein (g/L);2: Albumin (g/L);3: Globulin (g/L);4: Alanine transaminase (U/L);5: Urea nitrogen (mmol/L);6: Creatinine (μmol/L) |

|
| 图 7 实验组动物的血常规检测结果 Fig. 7 Blood test resμlt of experiment animal 1: Leukocyte(109/L); 2: Lymphcyte(%); 3: Neutrophil(%); 4: Granulocyte(%);5: Erythrocytes (1012/L); 6: Platelet(109/L) |
PLGA为FDA批准可用于体内的生物可降解材料,可以随着时间的增加逐渐降解,不会对新鲜骨组织的生长造成影响,网格状拓扑结构便于血管的生成和体液的交换,能够将PLGA的降解产物带入体液循环,便于细胞的生长和分化及新生骨组织的生成。Attawia等[11]采用粒子沥滤法制备的三维PLGA/HA(50∶50)复合材料支架,种植上骨细胞后,骨细胞可完好吸附增殖。本实验选用了PLGA(75∶25),相对分子质量为10万,保证了制作的材料在体内有2~3个月的降解周期[10],不影响新鲜骨组织的生成。根据支架材料的不同应用功能,选用合适比例的PLGA,从而达到相应的应用效果[12]。
3D打印技术主要是通过软件编写立体材料参数,通过精准控制打印机实现材料的喷印,而材料的固化成型则依赖不同的成型机制。骨修复材料文献中常选用多聚物液体固化技术或熔融沉积成技术结合3D打印机而形成骨修复材料的3D打印。本实验利用的是一种传统的相分离成型技术结合3D打印机而形成的方法。具体过程是将无机材料和有机材料在易挥发性有机溶剂下溶解混匀,形成具有一定黏度的液体,通过压力控制的喷嘴喷至表面温度为-15℃左右的工作台面,同时给予工作台面一定强度的冷风,这样喷出的液体中有机材料和无极材料会快速的固化,溶剂挥发,固相和液相分离,最终会形成预设的3D支架[13]。之后成型的3D材料通过冷冻干燥、清除残留的有机溶剂后,最终成为所需要的可用于实验的支架材料。
支架材料进行力学强度测试,混合材料的拉伸强度和弯曲强度值的测定值为38MPa和42MPa,分别为人软骨强度[10]的5.35倍和5.25倍,均大于人体软骨的强度。较高的强度可能是符合临床试验需求的,一方面因为骨架强度会随着成分的降解而降低,且由于加入了无机物HA,可能会促进支架强度的降低。因此,为了保证PLGA/HA支架材料在细胞培养及体内实验过程中保持特定的立体结构,保证其自生强度的下降能被新骨沉积形成的强度所弥补,其降解前力学性能高于相应人骨力学性能是降解骨材料的必要条件。Giordano等[14]利用3D打印机制备的PLA(相对分子质量为23万)三维支架材料,其弯曲强度在制备48h后和冻干1周后分别为93MPa和206MPa,但其拉伸强度仅分别为10MPa和11MPa。Giordano等制备的有机材料支架,其弯曲强度远大于拉伸强度,是由材料本身的特性所决定,本试验选用的混合材料,使制备的材料即具备了有机材料的弹性也具备了无机材料的硬度,临床应用效果会更为有效。
本实验的软骨分化对照组选用的诱导物质为经典的TGF-β3[15]。除此之外,尝试了其他细胞因子或蛋白质的成软骨诱导效果[16],如rhNGF、胸腺肽、rhIFN-β。通过实验发现,TGF-β3联合使用某些细胞因子能够更好的促进hMSC的成软骨分化效果,随后的实验将进一步研究联合使用细胞因子的诱导分化的机制。
本实验按现行的国家药监局颁布的医疗器械生物学评价标准及药典等相关标准对受试材料的热原、溶血、全身急性毒性、皮内刺激性、皮下植入等内容(仅部分实验显示)进行测试(GB/T 16886,医疗器械生物学评价)。动物实验结果显示,受试支架材料的热原检查、溶血试验、全身急性毒性试验、皮内刺激性试验、皮下植入试验等内容均符合医疗器械生物学评价标准。表明本实验制作3D支架材料的方法是可行的,后期实验将进行支架材料在动物体内的药效学试验,以进一步的验证本方法制备的3D支架材料的功能。
| [1] | 王佃亮. 组织工程的诞生与发展-组织工程. 中国生物工程杂志, 2014,34 (5): 122-129. Wang D L. The birth and development of tissue engineering. China Biotechnology, 2014,34 (5): 122-129. |
| [2] | 陈思诗,杨庆,沈新元,等.溶剂浇铸-粒子沥滤法制备PBS/PCL组织工程支架. 东华大学学报,2009,35 (4):391-395. Chen S S, Yang Q, Shen X Y, et al. PBS/PCL scaffold for tissue engineering prepared by solvent casting/particulate leaching. Journal of Donghua University(Natural Science), 2009, 35 (4):391-395. |
| [3] | Huang Y C, Mooney D J. Gas Foaming to Fabricate Polymer Scaffolds in Tissue Engineering. In: Ma P X, Elisseeff J. Scaffolding in Tissue Engineering. Boca Raton:CRC Press, 2005:155-167. |
| [4] | Murphy S V, Atala A. 3D bioprinting of tissues and organs. Nature Biotechnology, 2014,32(8):773-785. |
| [5] | Melchels F, Wiggenhauser P, Warne D, et al. CAD/CAM-assisted breast reconstruction. Biofabrication, 2011,3(3):1-8. |
| [6] | Zopf D A, Hollister S J, Nelson M E. Bioresorbable airway splint created with a three-dimensional printer. The New England Journal of Medicine, 2013,368(21):2043-2045. |
| [7] | Banks J. Adding value in additive manufacturing: Researchers in the United Kingdom and Europe look to 3D printing for customization. IEEE Pulse, 2013,4(6):22-26. |
| [8] | Tarafder S, Davies N M, Bandyopadhyay A, et al. 3D printed tricalcium phosphate bone tissue engineering scaffolds: effect of SrO and MgO doping on in vivo osteogenesis in a rat distal femoral defect model. Biomaterials Science, 2013,1(12):1250-1259. |
| [9] | Gentile P, Chiono V, Carmagnola I. An overview of poly(lactic-co-glycolic) acid (PLGA)-based biomaterials for bone tissue engineering. International Journal of Molecular Sciences, 2014, 15(3):3640-3659. |
| [10] | Parsons J R. Cartilage. In: Black J, Hastings G. Handbook of Biomaterials Properties. New York: Chapman & Hall, 1998: 40-46. |
| [11] | Attawia M A, Herbert K M, Laurencin C T. Osteoblast-like cell adherance and migration through 3-dimensional porous polymer matrices. Biochemical and Biophysical Research Communications, 1996, 213(2):639-644. |
| [12] | Li S M. Hydrolytic degradation characteristics of aliphatic polyesters derived from lactic and glycolic acids. Journal of Biomedical Materials Research, 1999,48(3): 342-353. |
| [13] | Liu L, Xiong Z, Yan Y N, et al. Porous morphology, porosity, mechanical properties of poly(α-hydroxy acid)-tricalcium phosphate composite scaffolds fabricated by low-temperature deposition. Journal of Biomedical Materials Research, 2007, 82A(3): 618-629. |
| [14] | Giordano R A, Wu B M, Borland S W, et al. Mechanical properties of dense polylactic acid structures fabricated by three dimensional printing. Journal of Biomaterials Science, Polymer Edition, 1996, 8(1):63-75. |
| [15] | Indrawattana N, Chen G P, Tadokoro M, et al. Growth factor combination for chondrogenic induction from human mesenchymal stem cell. Biochemical and Biophysical Research Communications, 2004, 320(3):914-919. |
| [16] | Cicione C, Muinos-Lopez E, Hermida-Gomez T. Alternative protocols to induce chondrogenic differentiation: transforming growth factor-β superfamily. Cell and Tissue Banking, 2014,12(2):195-207. |
 2015, Vol. 35
2015, Vol. 35




