文章信息
- 石亚辉, 于新惠, 张颖, 罗勤
- SHI Ya-hui, YU Xin-hui, ZHANG Ying, LUO Qin
- 单核细胞增生李斯特菌中RsbU缺失株的构建及对生物被膜形成的影响
- Effect of the Deletion of RsbU on Biofilm Formation in Listeria Monocytogenes
- 中国生物工程杂志, 2015, 35(7): 45-54
- China Biotechnology, 2015, 35(7): 45-54
- http://dx.doi.org/10.13523/j.cb.20150707
-
文章历史
- 收稿日期:2015-01-19
- 修回日期:2015-04-13
生物被膜(biofilm)是细菌在生长过程中,为适应生存环境而吸附于惰性或活性材料表面形成的一种与浮游细胞相对应的生长方式[1]。它是细菌分泌的多糖基质、纤维蛋白和脂质蛋白等,将其自身包绕其中而形成的具有一定空间结构的多细胞聚合(multicellularity)膜样物[2, 3]。生物被膜显著增强了细菌对各种杀菌剂的耐受能力(生物被膜菌对抗生素的敏感程度只有浮游菌的1/1000~1/10),耐热性也相应增加,对环境变化不敏感,因此抗逆性极大增强,成为细菌抵御外界不良环境的一种重要形式[4]。
单核细胞增生李斯特菌(Listeria monocytogenes,Lm)是一种重要的革兰氏阳性食源性致病菌,它是人畜共患李斯特菌病(listeriosis) 的主要病原菌[5],能引起人和动物脑膜炎、败血症、流产等症状,因其高致死率(20%~30%感染者)而被WHO列入四大食源性致病菌之一[6, 7, 8, 9]。Lm 在自然界分布广泛,能在多数活性或非活性固体表面形成生物被膜,但其形成的具体分子机制尚不清楚[10]。
在革兰氏阳性菌中,σB是细菌抵御外界不良环境(如物理和化学因子胁迫,以及能量缺乏等压力)时主要的压力应答因子[11, 12, 13],在包括Lm、枯草芽孢杆菌和金黄色葡萄球菌等革兰氏阳性菌生物被膜的形成中起着重要的调控作用[14, 15, 16, 17, 18]。σB是sigB基因的编码产物,活性主要由一系列的Rsb蛋白(rsb基因的编码产物)来调节。在Lm和枯草芽孢杆菌中,sigB基因位于SigB操纵子(rsbR、rsbS、rsbT、rsbU、rsbV、rsbW、sigB和 rsbX)的第7位[19, 20]。正常状态下σB与RsbW结合处于失活状态,当外界压力信号传递到细胞内,RsbV 去磷酸化并与RsbW 蛋白结合释放出σB 因子从而调控相应的生理生化反应过程。 但RsbV 的去磷酸化途径各不相同:在枯草芽孢杆菌中,能量缺乏时主要由RsbP使RsbV去磷酸化,而物理和化学的压力信号主要由RsbU接受并与RsbT结合后,激活自身的丝氨酸磷酸酶活性使RsbV去磷酸化;在葡萄球菌中,高水平ATP下的环境压力(如NaCl高渗) 会启动一条受RsbU调节的途径激活sigB;在Lm中,由于缺乏传递能量压力信号的rsbP-rsbQ同源的操纵子结构,因此能量和物理、化学压力信号的传递均与RsbU相关[20, 21]。但这些传递外界压力信号的Rsb蛋白在细菌生物被膜形成中的具体作用,目前还没有相关文献详细阐述。Johannes和张青等[14, 15, 22, 23]报道在金色葡萄球菌中RsbU通过调节σB的活性来促进生物被膜的形成。但RsbU在Lm生物被膜的形成过程中是否也具有同样作用尚未见报道。本文试图通过比较研究Lm野生菌株(EGDe)、rsbU缺失突变株(EGDeΔrsbU)、sigB缺失突变株(EGDeΔsigB)以及rsbU和sigB双缺失突变株(EGDeΔsigBΔrsbU)在不同温度(25℃和37℃)、不同培养环境(营养丰富的BHI培养基和营养贫乏的MEM基础培养基)下生物被膜形成能力的差异,来探讨RsbU在Lm生物被膜形成过程中的作用,以及RsbU和σB在Lm生物被膜形成过程中的关系。
1 材料与方法 1.1 菌 株单核细胞增生李斯特菌野生菌株EGDe(血清型1/2a,全基因组序列已知[24]) 为德国维尔茨堡大学微生物系Werner Goebel 教授馈赠。sigB缺失菌株(ORF中间缺失315bp)EGDeΔsigB为本实验室冯莹颖所构建保存,rsbU缺失菌株(缺失5′端包括ATG在内的194bp) EGDeΔrsbU以及sigB和rsbU双缺失菌株EGDeΔsigBΔrsbU为本实验中构建保存。
1.2 EGDeΔrsbU和EGDeΔsigBΔrsbU缺失突变株的构建采用SOEing PCR方法(PCR-mediated recombination method[25]),以EGDe基因组DNA为模板使用引物对P1和P2、P3和P4(所用引物的序列见表 1)分别扩增出rsbU基因ORF上、下游A(530bp)和B(560bp)片段。然后以A、B片段为模板,以P1和P4为引物进行第二轮PCR,从而获得含有Bam HI和Sal I酶切位点的AB融合片段rsbU(A+B) (1 090bp)。双酶切后将融合片段AB连接到温敏穿梭重组质粒pLSV101上,成功构建重组穿梭质粒pLSV 101-rsbU(A+B),DNA测序验证。将重组穿梭质粒电转入EGDe和EGDeΔsigB感受态细胞中,按照王莉等[26]的方法,通过温度和抗生素选择压力获得同源重组子,在无抗培养基中连续传代以丢失双交换后的质粒,获得缺失突变株EGDeΔrsbU和EGDeΔsigBΔrsbU。分别以sigB基因上、下游引物对P5和P6 PCR扩增EGDeΔsigBΔrsbU中的sigB基因片段,以rsbU基因上、下游引物对P7和P8分别PCR扩增EGDeΔrsbU和EGDeΔsigBΔrsbU中的rsbU基因片段,以EGDe为阳性对照来验证rsbU和sigB基因的缺失。同时DNA测序进一步验证所得缺失菌株为rsbU单缺失突变株和sigB、rsbU双缺失突变株。
| Primer | Succession(5′-3′) |
| P1 : rsbU-A-BamH I-F | CGCGGATCCACTAATTGAACTCGGA |
| P2 : rsbU-A-R | TTTTTTCTAGCTCTCCTTACCG AAC |
| P3 : rsbU-B-F | GAGAGCTAGAAAAAAATTATCATTTGATGTACTA |
| P4 : rsbU-B-Sal I-R | CGCGTCGACTGGCGTATAAATCAGA |
| P5 : sigB -ck-F | TACCTCGAGCTGCCAAGCCTGAATA |
| P6 : sigB -ck-R | GTCGTCGACCGCTTTGGCCGCTCTA |
| P7 : rsbU -ck-F | GAGCAGGTCTTCCAGGAGTCAA |
| P8 : rsbU -ck-R | TACGCCTAATCCGGTGCTATCC |
该方法参照冯飞飞等[27]和Djordjevic等[28]的报道进行:将过夜活化的待测菌转接到新鲜的BHI培养基中培养至OD600为0.2,稀释100倍后,取200μl加入到96孔微孔板(NestBiotech Co. Ltd),每个样品设置6个重复;在MEM(minimal essential medium)培养基中培养时,由于Lm生长较慢,故各菌株均先在BHI培养基中过夜活化,用新鲜的MEM培养基洗涤两次菌体后,以1∶50转接到新鲜MEM培养基中,后续操作与在BHI培养基中培养时一致。将微孔板置于25℃ 和37℃中静置培养,分别在培养24h、48h、72h、5天和7天(在BHI培养基中培养5天和7天的样品,在72h之后,每隔24h小心吸走1/3培养液,换上等量的相应新鲜培养基)后,先用酶标仪(BioTeK,Synergy 2)测定各孔菌液的OD600值,以检测菌株的生长状况,然后弃去各孔培养基,所生成的生物被膜经蒸馏水洗涤,室温干燥后,用1%乙二酸铵结晶紫染色,酶标仪测定其OD595的光吸收值。所获得实验数据使用Origin 6.1和Spss进行分析处理。
1.4 显微镜观察生物被膜的形态结晶紫染色后的生物被膜,直接置于倒置显微镜下(重光COIC XDS-1B)观察,拍照记录。
2 结 果 2.1 EGDeΔrsbU和EGDeΔsigBΔrsbU缺失突变株的构建 2.1.1 重组穿梭质粒pLSV 101-rsbU(A+ B)的构建结果酶切验证图 1为重组穿梭质粒pLSV 101-rsbU(A+ B)的用Bam HI和Sal I双酶切结果。重组质粒经双酶切后形成了大小不同的两条片段,其中小片段约1 090bp与经过相同两种酶酶切后的rsbU(A+ B)片段的大小一致,大片段与经相同两种内切酶双酶切后的pLSV 101载体大小一致。表明rsbU(A+B)片段正确地插入了穿梭载体pLSV 101中,进一步的DNA测序结果也表明插入序列正确无误。
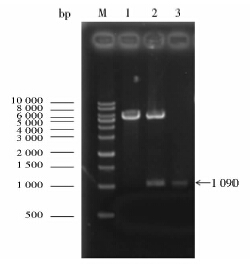
|
| 图 1 Bam HI 和Sal I双酶切验证重组穿梭质粒pLSV 101-rsbU(A+ B) Fig. 1 Double digestion of recombinant shuttle plasmid pLSV 101-rsbU(A+ B) by Bam HI and Sal I M: Marker; 1: pLSV 101 after digestion; 2: pLSV 101-rsbU(A+B) after digestion; 3: rsbU(A+B) after digestion |
以引物对P7和P8分别扩增EGDeΔrsbU和EGDeΔsigBΔrsbU中的rsbU基因,引物对P5和P6扩增EGDeΔsigBΔrsbU中的sigB基因,以EGDe为阳性对照,结果如图 2所示。以EGDeΔrsbU和EGDeΔsigBΔrsbU为模板的rsbU片段比EGDe的短约194bp,以EGDeΔsigBΔrsbU为模板的sigB片段比EGDe的短约315bp,其长度与预期结果一致,表明所得缺失菌株为rsbU单缺失突变株和sigB、rsbU双缺失突变株。同时,DNA测序结果也进一步证明EGDeΔrsbU和EGDeΔsigBΔrsbU构建成功。
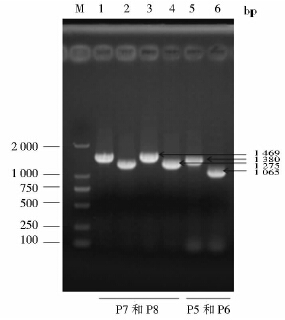
|
| 图 2 PCR验证EGDeΔrsbU和EGDeΔsigBΔrsbU中rsbU 和sigB基因的缺失 Fig. 2 Verification of the deletion of sigB and rsbU in EGDeΔrsbU and EGDeΔsigBΔrsbU by PCR M: Marker; 1,3,5: EGDe; 2: EGDe rsbU; 4,6: EGDeΔsigBΔrsbU |
单核细胞增生李斯特菌生物被膜的形成会受到培养过程中的众多外在因素的共同影响,如培养时间、营养条件、培养温度、pH、离子浓度等[29],而温度和营养对生物被膜的形成尤为重要[30]。为了弄清楚RsbU在Lm生物被膜形成过程中的作用,以及RsbU和SigB在Lm生物被膜形成过程中的关系,我们比较了在两个典型的温度37℃和25℃下[31, 32],实验中常用的营养贫乏的MEM培养基和营养丰富的BHI培养基中sigB、rsbU单缺失及双缺失菌株的生物被膜形成能力与野生菌株EGDe之间的差异。为了便于叙述,下面分别阐述了25℃和37℃下不同营养的培养基中RsbU和(或)SigB缺失对Lm生物被膜形成的影响。
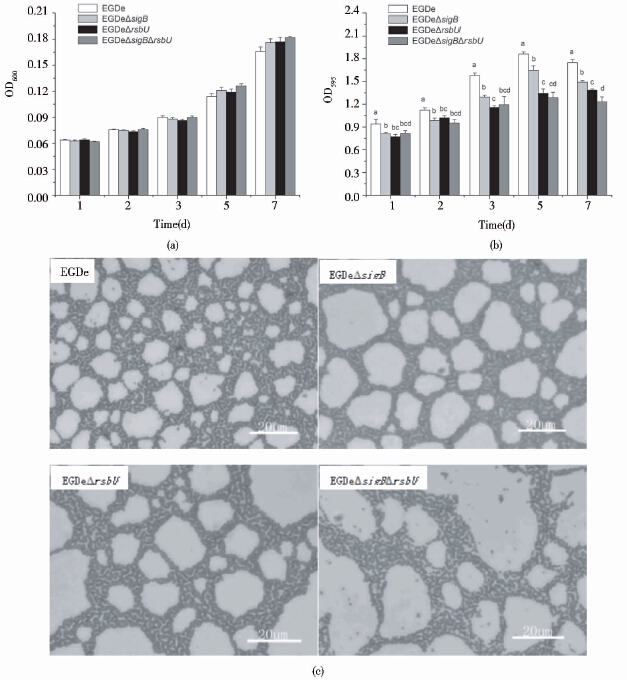
2.2.1 25℃条件下,不同培养基中RsbU和(或)SigB对生物被膜的影响如图 3(a)所示,25℃时,4种菌株在BHI中生长迅速,24h内即可进入生长的稳定期,因此,在没有更换培养基的条件下,细菌的生物量随着时间的延长而降低;当更换了1/3新鲜培养基后(3天后;见材料与方法1.3),细菌生长重新加快,生物量增加,但4种菌株在各时间段的生长量无明显差异。同时,如图 3(b)所示,4种菌株在24h、48h、72h、5天和7天的培养过程中,缺失菌株与野生菌株生物被膜的形成量在48h开始显现显著性差异,并且随着培养时间的延长差异越来越显著,而4种菌株在各时间段的生长量无明显差异,表明生物被膜形成量之间的差异与细菌培养过程中生长量的差异无关。在第7天时的缺失菌株与野生菌株生物被膜形成量的差异最明显,与野生菌株EGDe相比,EGDeΔsigB和EGDeΔsigBΔrsbU形成生物被膜的量极显著性(P<0.01)下降,分别下降了18.5%和17.7%; EGDeΔrsbU形成生物被膜的显著性(P<0.05)下降,下降了11.1%,但3种缺失菌株之间无显著性差异。显微镜观察的结果与微孔板定量测定的结果基本一致,EGDe形成的生物被膜比缺失菌株的更加致密、连续,EGDeΔsigB和EGDeΔsigBΔrsbU最差,EGDeΔrsbU比EGDeΔsigB稍好[图 3(c)]。
|
| 图 3 在25℃和BHI培养基中EGDe、EGDeΔsigB、EGDeΔrsbU及EGDeΔsigBΔrsbU 4种菌株生物被膜形成能力的比较 Fig. 3 Biofilm formation by L. monocytogenes EGDe,EGDeΔsigB,EGDeΔrsbU and EGDeΔsigBΔrsbU in BHI medium at 25℃ (a) The biomass of the four strains after 24h,48h,72h,5days and 7days of cultivation (b)Biofilm quantities for the four strains measured by microtiter plate assay after 24h,48h,72h,5days and 7days of incubation (c)Biofilm formed in the seventh day by the four strains observed under a 40×objective; Letters: Compared two groups,there is no same lowercase letters indicated significant differences between the groups (P<0.05),with the same lowercase letters indicated no significant difference between the groups (P> 0.05) |
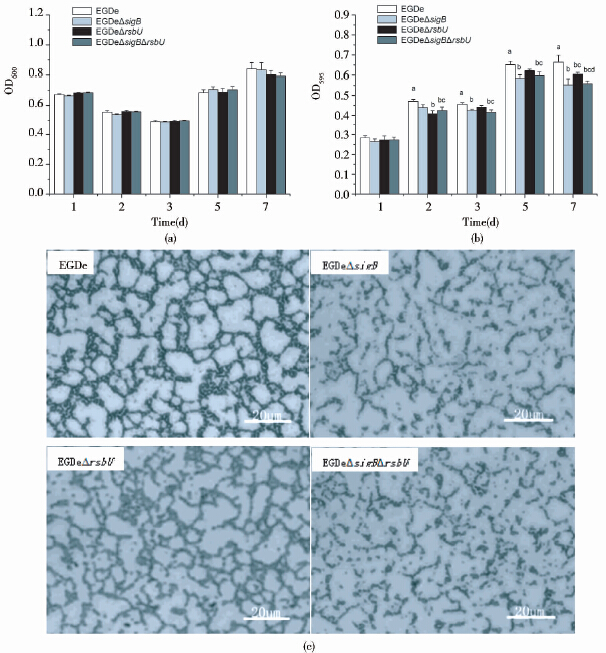
如图 4(a)所示,25℃时,细菌在MEM中生长的十分缓慢,其生长量随着时间延长而增加,到第7天达到最高峰,但4种菌株在各时间段的生长量并无明显差异。然而,缺失菌株与野生菌株生物被膜的形成量在24h就开始出现显著性差异,并且随着培养时间的延长差异越来越显著[图 4(b)],表明生物被膜形成量之间的差异与细菌培养过程中生长量的差异无关。在第7天时,与野生菌株EGDe相比3种缺失菌株形成生物被膜的量均极显著性(P<0.01)下降,EGDeΔsigB下降14.7%、EGDeΔrsbU下降20.8%、EGDeΔsigBΔrsbU下降29.6%;相对于EGDeΔsigB,EGDeΔrsbU的生物被膜形成能力也显著性下降;并且双缺突变株的生物被膜形成能力相对于单缺来说也显著性下降,表明RsbU可能还参与SigB之外的调控Lm生物被膜形成的途径。微孔板结果与显微镜观察结果相一致[图 4(c)]。
|
| 图 4 在25℃和MEM培养基中EGDe、EGDeΔsigB、EGDeΔrsbU及EGDeΔsigBΔrsbU 4种菌株生物被膜形成能力的比较 Fig. 4 Biofilm formation by L. monocytogenes EGDe,EGDeΔsigB,EGDeΔrsbU and EGDeΔsigB ΔrsbU in MEM medium at 25℃ (a) The biomass of the four strains after 24h,48h,72h,5days and 7days of cultivation (b) Biofilm quantities for the four strains measured by microtiter plate assay after 24h,48h,72h,5days and 7days of incubation (c) Biofilm formed in the seventh day by the four strains observed under a 40×objective; Letters: Compared two groups,there is no same lowercase letters indicated significant differences between the groups (P<0.05),with the same lowercase letters indicated no significant difference between the groups (P> 0.05) |
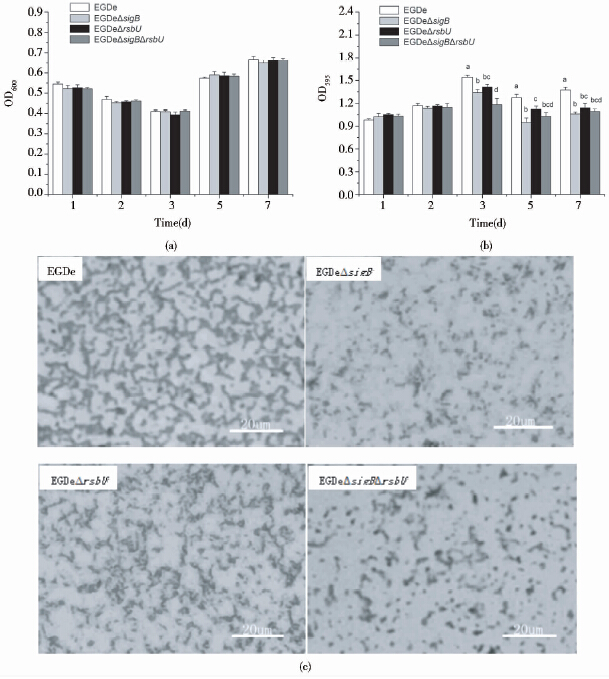
|
| 图 5 在37℃和BHI培养基中EGDe、EGDeΔsigB、EGDeΔrsbU及EGDeΔsigBΔrsbU 4种菌株生物被膜形成能力的比较 Fig. 5 Biofilm formation by L. monocytogenes EGDe,EGDeΔsigB,EGDeΔrsbU and EGDeΔsigBΔrsbU in BHI medium at 37℃ (a) The biomass of the four strains after 24h,48h,72h,5days and 7days of cultivation (b) Biofilm quantities for the four strains measured by microtiter plate assay after 24h,48h,72h,5days and 7days of incubation (c) Biofilm formed in the seventh day by the four strains observed under a 40×objective; Letters: Compared two groups,there is no same lowercase letters indicated significant differences between the groups (P<0.05),with the same lowercase letters indicated no significant difference between the groups (P> 0.05) |
如图 6(a)所示,在37℃、MEM培养基中,4种菌株生长量的变化趋势与在在25℃、MEM培养基中培养时一样,即细菌生长量持续上升,到第7天达到最高峰,不过,细菌在37℃时生长速率较25℃时快,生长量数值也较高。但是,四种菌株在各时间段的生长量无明显差异。同时,如图 6(b)所示,缺失菌株与野生菌株生物被膜的形成量在72h表现出显著性差异,并且随着培养时间的延长差异越来越显著,同时4种菌株在各时间段的生长量显示并无明显差异[图 6(a)],表明生物被膜形成量之间的差异与细菌培养过程中生长量的差异无关。在第7天时,与野生菌株EGDe相比3种缺失菌株形成生物被膜的量均呈极显著性(P<0.01)下降,EGDeΔsigB下降16.8%、EGDeΔrsbU下降19.1%、EGDeΔsigBΔrsbU下降19.9%,但3种缺失菌株之间并无显著性差异,该结果与显微镜观察的结果[图 6(c)]相一致。
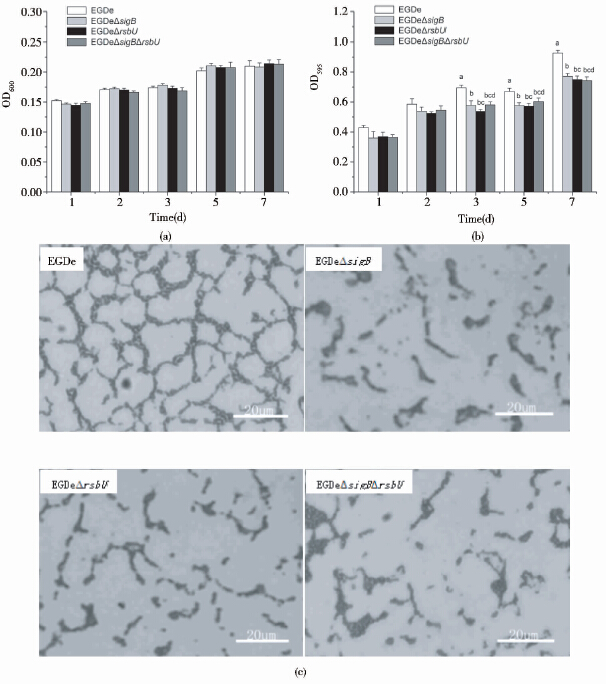
|
| 图 6 在37℃和MEM培养基中,EGDe、EGDeΔsigB、EGDeΔrsbU及EGDeΔsigBΔrsbU 4种菌株生物被膜形成能力的比较 Fig. 6 Biofilm formation by L. monocytogenes EGDe,EGDeΔsigB,EGDeΔrsbU and EGDeΔsigBΔrsbU in MEM medium at 37℃ (a) The biomass of the four strains after 24h,48h,72h,5days and 7days of cultivation (b) Biofilm quantities for the four strains measured by microtiter plate assay after 24h,48h,72h,5days and 7days of incubation (c) Biofilm formed in the seventh day by the four strains observed under a 40×objective; Letters: Compared two groups,there is no same lowercase letters indicated significant differences between the groups (P<0.05),with the same lowercase letters indicated no significant difference between the groups (P> 0.05) |
本文研究结果显示,RsbU和SigB影响Lm在不同温度和培养基中生物被膜的形成。如图 3~图 6所示,缺失RsbU和SigB后,Lm在不同温度(25℃和37℃)和不同培养基(营养丰富的BHI和营养贫瘠的MEM)中,生物被膜形成的能力都出现显著性下降,不仅生物被膜形成量降低,而且被膜内细菌的交联也变得疏松,孔径变大,并容易从所吸附的96孔板底脱落。同时,进一步比较Lm野生株和三种缺失突变株(RsbU和SigB单缺和双缺菌株)在相同温度不同培养基中,或者相同培养基不同温度条件下形成的生物被膜的绝对值及形态,我们发现,在25℃、MEM培养基中4种菌株生物被膜的形成量不仅远高于相同温度下BHI培养基中形成的生物被膜量(图 3和图 4),以及在相同培养基37℃下形成的生物被膜量(图 4和图 6),而且也远高于在37℃、BHI培养基中形成的生物被膜量(图 4和图 5);在25℃、MEM培养基中缺失菌株与野生菌株间显示出显著性差异的时间也比在其他3种培养条件下要早;形成的生物被膜也更加连续和致密。 该结果不仅表明较低温度和贫乏的营养条件有利于Lm生物被膜的形成,而且显示温度和培养条件显著影响RsbU和SigB调控Lm基因,特别是与生物被膜形成相关基因的表达。在低温(25℃)和贫瘠的营养条件(MEM)培养7天后[图 4(b)],缺失RsbU造成菌株形成的生物被膜量比单缺失SigB显著降低,表明该条件下RsbU在细菌传递环境压力信号和激活SigB中起着至关重要的作用;而在较高温度和(或)丰富的营养条件中,缺失RsbU和(或)SigB菌株之间的生物被膜形成能力并无显著差异,暗示在这些培养条件下,RsbU和SigB的活性没有充分表达或者还可能存在其他途径或因子(如Lm主要毒力调控因子PrfA[27])影响Lm生物被膜的形成。阐明影响Lm生物被膜形成的因素和机制将是我们今后研究的重点。
| [1] | Chicurel M. Bacterial biofilms and infections Slimebusters. Nature, 2000, 408(6810): 284-286. |
| [2] | Costerton J W. Introduction to biofilm. Int J Antimicrob Agents, 1999,11(3-4): 217-21,237-239. |
| [3] | Donlan R M, Biofilms: microbial life on surfaces. Emerg Infect Dis, 2002,8(9): 881-890. |
| [4] | 李燕杰, 杜冰, 董吉林, 等.食品中细菌生物被膜及其形成机制的研究进展.现代食品科技, 2009, 25(4): 435-438. Li Y J, Du B, Dong J L, et al. Research advance of bacterial biofilm and its formation mechanism in food . Modern Food Science And Technology, 2009, 25(4): 435-438. |
| [5] | Peterkin P I, Farber J M. Listeria monocytogenes, a food-borne pathogen. Microbiology Reviews, 1991,55(3):476-511. |
| [6] | Cotter P D, Gahan C G M, Hill C, A glutamate decarboxylase system protects Listeria monocytogenes in gastric fluid. Molecular Microbiology, 2001, 40(2): 465-475. |
| [7] | Ramaswamy, Cresence V, Rejitha V M, et al. Listeria-review of epidemiology and pathogenesis. Microbiol Immunol Infect, 2007, 40(1): 4-13. |
| [8] | Rocourt J, BenEmbarek P, Toyofuku H, et al. Quantitative risk assessment of Listeria monocytogenesin ready-to-eat foods: the FAO/WHO approach. FEMS Immunology and Medical Microbiology, 2003, 35(3): 263-267. |
| [9] | Vazquez-Boland J A, Kuhn M, Berche P, et al. Listeria pathogenesis and molecular virulence determinants. Clinical Microbiology Reviews, 2001, 14(3): 584-640. |
| [10] | Lemon K P, Higgins D E, Kolter R. Flagellar motility is critical for Listeria monocytogenes biofilm formation. Journal of Bacteriology, 2007,189(12): 4418-4424. |
| [11] | Neves E, Silva A C, Roche S M, et al. Virulence of Listeria monocytogenes isolated from the cheese dairy environment, other foods and clinical cases. Journal of Medical Microbiology, 2008, 57(4): 411-415. |
| [12] | Pané-Farré J, Jonas B, Forstner K, et al. The σB regulon in Staphylococcus aureus and its regulation. International Journal of Medical Microbiology, 2005, 296(4-5): 237-258. |
| [13] | Schaik W V, Tempelaars M H, Wouters J A, et al. The alternative sigma factor B of Bacillus cereus: response to stress and role in heat adaptation. Journal of Bacteriology, 2004, 186(2): 316-325. |
| [14] | Jager S, Mack D, Rohde H, et al. Disintegration of Staphylococcus epidermidis biofilms under glucose-limiting conditions depends on the activity of the alternative sigma factor B. Applied and Environmental Microbiology, 2005, 71(9): 5577-5581. |
| [15] | Knobloch J K M, Jger S, Horstkotte M A, et al. RsbU-dependent regulation of Staphylococcus epidermidis biofilm formation Is mediated via the alternative sigma factor B by repression of the negative regulator gene icaR. Infection and Immunity, 2004, 72(7): 3838-3848. |
| [16] | Veen S V, Abee T, Importance of sigB for Listeria monocytogenes static and continuous-flow biofilm formation and disinfectant resistance. Applied and Environmental Microbiology, 2010,76(23): 7854-7860. |
| [17] | Rachid S, Ohlsen K, Wallner U, et al. Alternative transcription factor sigma(B) is involved in regulation of biofilm expression in a Staphylococcus aureus mucosal isolate. Journal of Bacteriology, 2000, 182(23): 6824-6826. |
| [18] | 张强, 冯飞飞, 王莉, 等. 单核细胞增生李斯特菌SigmaB、PrfA因子对生物被膜形成影响的研究. 医学研究杂志, 2010, 39(10): 19-22. Zhang Q, Feng F F, Wang L, et al. Effect of SigmaB,PrfA on biofilm formation in listeria monocytogenes. Journal Of Medical Research, 2010, 39(10): 19-22. |
| [19] | Schaik W V, Abee T, The role of σB in the stress response of Gram-positive bacteria - targets for food preservation and safety. Current Opinion in Biotechnology, 2005, 16(2): 218-224. |
| [20] | 冯飞飞, 张晓莉, 罗勤, 等. SigmaB因子活性的调节及其在几种革兰氏阳性食源性致病菌中的作用. 微生物学报, 2008, 48(6): 839-843. Feng F F, Zhang X L, Luo Q, et al. The regulation of SigmaB activity and its role in some gram-positive food-borne pathogens——A review . Acta Microbiologica Sinica, 2008, 48(6): 839-843. |
| [21] | Shin J H, Brody M S, Price C W. Physical and antibiotic stresses require activation of the RsbU phosphatase to induce the general stress response in Listeria monocytogenes. Microbiology, 2010. 156(9): 2660-2669. |
| [22] | Knobloch J K M, Bartscht K, Sabottke A, et al. Biofilm formation by Staphylococcus epidermidis depends on functional RsbU, an activator of the sigB operon: differential activation mechanisms due to ethanol and salt stress. Journal of Bacteriology, 2001, 183(8): 2624-2633. |
| [23] | 张青, 雷呈祥, 赵旭.表皮葡萄球菌生物被膜形成分子机制的研究进展. 微生物学报, 2003, 43(5):681-685. Zhang Q, Lei C X, Zhao X.Progress on molecular mechanism of staphylococcus epidermidis biofilm. Acta Microbiologica Sinica, 2003, 43(5):681-685. |
| [24] | Glaser P, Frangeul L, Buchrieser C, et al. Comparative genomics of Listeria species. Science, 2001, 294(26): 849-852. |
| [25] | Luo Q, Zhou Q C, Deng L F, et al. Some essential elements on the inlC promoter for PrfA-dependent regulation in Listeria monocytogenes. Acta Microbiologica Sinica, 2007, 47(1):22-28. |
| [26] | 王莉, 冯飞飞, 张强, 等. 单核细胞增生李斯特菌毒力基因inlB/actA双缺失突变株的构建. 生物技术通报, 2010, (11): 182-185. Wang L, Feng F F, Zhang Q, et al. Construction of a mutant strain of listeria monocytogenes with a deletion of inlB and actA. Biotechnology Bulletin, 2010, (11): 182-185. |
| [27] | 冯飞飞, 张强, 王莉, 等. 毒力基因调控蛋白PrfA 促进单核细胞增生李斯特菌生物被膜的形成. 微生物学通报, 2011, 38(9): 1450-1457. Feng F F, Zhang Q, Wang L, et al. The virulence regulator PrfA plays a significant role in the Listeria monocytogenes biofilm formation. Microbiology China, 2011, 38(9): 1450-1457. |
| [28] | Djordjevic D, Wiedmann M, McLandsborough A. Microtiter plate assay for assessment of Listeria monocytogenes biofilm formation. Applied and Environmental Microbiology, 2002, 68(6): 2950-2958. |
| [29] | Moretro T, Langsrud S. Listeria monocytogenes: biofilm formation and persistence in food-processing environments. Biofilms, 2004, 1(02): 107-121. |
| [30] | Valderrama W B, Ostiguy N, Cutter C N. Multivariate analysis reveals differences in biofilm formation capacity amongListeria monocytogeneslineages. Biofouling, 2014, 30(10): 1199-1209. |
| [31] | Pan Y F, Breidt F, Gorski L. Synergistic effects of sodium chloride, glucose, and temperature on biofilm formation by Listeria monocytogenes serotype 1/2a and 4b strains. Applied and Environmental Microbiology, 2010, 76(5): 1433-1441. |
| [32] | 李燕杰, 朱小花, 夏雨, 等. 不同培养条件对单增李斯特菌生物被膜形成的影响研究. 食品研究与开发, 2010, 31(11): 188-192. Li Y J, Zhu X H, Xia Y, et al. The influence of various culture conditions on listeria monocytogenes biofilm formation. Food Research And Development, 2010, 31(11): 188-192. |
 2015, Vol. 35
2015, Vol. 35




