文章信息
- 柴鹏, 丰平仲, 王学伟, 王忠铭, 李谢昆, 袁振宏
- CHAI Peng, FENG Ping-zhong, WANG Xue-wei, WANG Zhong-ming, LI Xie-kun, YUAN Zhen-hong
- Chlorococcum sp.混养过程碳氮调控对累积类胡萝卜素和脂肪酸成分影响研究
- Effect of Carbon and Nitrogen Combination on the Cartenoid and Fatty Acids Accumulation of Chlorococcum sp. under Mixotrophic Cultivation
- 中国生物工程杂志, 2015, 35(7): 30-36
- China Biotechnology, 2015, 35(7): 30-36
- http://dx.doi.org/10.13523/j.cb.20150705
-
文章历史
- 收稿日期:2015-03-12
- 修回日期:2015-04-16
2. 中国科学院大学 北京 100039;
3. 中国科学院广州能源研究所 佛山三水能源环境技术创新与育成中心 佛山 528137
2. University of Chinese Academy of Sciences, Beijing 100039, China;
3. Foshan Innovation and Incubation Center of Energy and Environmental Technology, Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Foshan 528137, China
化石能源的持续燃烧使全球生存环境日益恶化,人们对于清洁能源的呼声也空前高涨。生物柴油作为一种绿色环保的可再生能源,不仅在生产过程有效地吸收温室气体,而且作为化石能源的替代品能够很好地适配现阶段的汽车引擎[1]。能源微藻具备产油率高、生产周期短、生存环境广等特点,被认为是制备生物柴油的理想原料[2,3]。
部分微藻可以混养,即在光照条件下进行光合自养的同时利用外源有机碳异养提高微藻的生长速率及油脂产率。一些文献曾报道过混合营养培养方式中有机碳源对螺旋藻和单针藻生长及油脂积累的影响[4, 5]。
本文以乙酸钠作为外源碳源,通过测定绿球藻Chlorococcum sp.生长过程中干重、油脂产率及脂肪酸组成探寻适宜的乙酸钠添加量,在此基础上设置不同梯度的硝酸钠浓度考察氮源与外源碳源的协同作用,为深入研究Chlorococcum sp.的混合营养生长提供依据。
1 材料与方法 1.1 实验藻株及培养条件本实验中所使用的绿球藻Chlorococcum sp.由中国科学院广州能源研究所生物质能生化转化实验室分离纯化保藏。
采用自主设计的培养体积为1L的柱状(Φ8.5cm,H75cm)气升式光生物反应器,石英通气管(φ0.6cm,Φ0.8cm)由中心位置开孔的橡胶塞固定。单侧日光灯提供光强为315μmol/(m2·s)的连续光照,通气管由底部通入含5%CO2的压缩空气,培养温度为(25±1)℃。选用BG-11液体培养基[6]扩充种子液。
1.2 实验设计 1.2.1 乙酸钠对微藻生长的影响藻种接种至装有灭菌处理的BG-11液体培养基的气升式光生物反应器培养6天,此时绿球藻达到对数生长期。取样离心,藻泥用无菌超纯水清洗3遍,接种至不同浓度乙酸钠(0g/L、0.25g/L、0.5g/L、1g/L、2g/L和4g/L)的BG-11培养基中,接种起始OD550nm为0.564,每组做两个平行。培养16天,隔天取样测定干重,实验结束后收集藻液测定总脂、色素及脂肪酸成分。
1.2.2 硝酸钠对微藻生长的影响参考标准BG-11液体培养基中1.5g/L硝酸钠对应的质量浓度,设计氮元素浓度(0g/L、0.1g/L、0.5g/L、1.0g/L和1.5g/L)不同,其他营养成分不变的BG-11培养基,按照1.2.1实验完毕后选出较优的乙酸钠添加浓度向5个实验组进行添加,每组做两个平行。培养16天,隔天取样称量干重,第4、8、12、16天取样进行总脂,色素及脂肪酸成分分析。
1.3 分析方法 1.3.1 取样取样前需向反应器中补加微藻培养过程中蒸发的水分,然后用灭菌处理的移液管在无菌操作台中取10ml用于微藻干重及类胡萝卜素含量的分析,取样后将反应器放回培养架,5min后划线标记液面位置。
在第4、8、12天分别量取300ml、150ml、100ml藻液用冷冻离心机5 000r离心5min,倒去上清液,用超纯水清洗并离心3次,冷冻干燥处理成藻粉备用。
1.3.2 细胞生长测定本实验采用改良的Zhu和Lee[7]的干重测定方法,玻璃纤维滤膜(Whatman,Φ47 mm)放于80℃烘箱12h,取出放入干燥皿冷却30min至恒重。称取初重记为dw(mg),将滤膜放于抽滤装置,移液枪量取5ml藻液抽滤,放回80℃烘箱烘干至恒重,冷却后称重记为DW(mg)。
微藻细胞干重计算公式为
M(g/L)= (DWx-dwx)÷5
细胞生物质产率计算公式为
P[mg/(L·d)]= 1 000×(Mx-M0)÷Tx
式中,Tx表示微藻培养天数;dwx与DWx分别表示第x天抽滤操作前后滤膜的质量;Mx与M0分别表示第x天和第0天微藻的细胞干重。 1.3.3 总脂含量测定总脂的测定参照Bigogno等[8]的方法并对总脂的提取步骤稍作改进。具体操作如下:准确称取100~150mg干藻粉于螺口玻璃瓶中,加入体积分数为10% DMSO的甲醇溶液2ml,密封45℃水浴搅拌45min;3 000r/min离心10min,收集上清液;以上提取步骤重复两次。取4ml乙醚∶正己烷为1∶1(体积比)的混合液加入玻璃瓶中,密封45℃水浴搅拌60min,离心10min,收集上清液;以上提取步骤重复两次。合并以上所得上清液,添加6ml去离子水,溶液静置5h分层,上层包含总脂成分,转移上层到预称重的EP管中,在氮保护下蒸发溶剂并冰冻干燥至少24h,称重求得总脂含量。
1.3.4 类胡萝卜素含量的测定类胡萝卜的测定参照Lichtenthaler[9]的方法,用分析纯甲醇试剂在水浴中加热提取色素,测定665nm、652nm和470nm处吸光值,总类胡萝卜素含量可以用下式计算得到
Chl.a=16.72×OD665-9.16×OD652
Chl.b=34.09×OD652-15.28×OD665
Cartenoid=221×(1 000×OD470-1.63×Chl.a-104.96×Chl.b)
式中Chl.a、Chl.b和Cartenoid分别表示叶绿素a、叶绿素b和类胡萝卜素含量,单位为mg/L;OD470、OD652和OD665分别为470nm、652nm和665nm波长下的吸光值。 1.3.5 脂肪酸组成及相对含量的测定本研究提取微藻脂肪酸的同时进行酯交换反应,通过分析脂肪酸甲酯成分从而实现对微藻脂肪酸的评价[10, 11]。具体操作步骤如下:称取20mg左右冻干藻粉装入10ml玻璃管中,加入2.5ml含2%硫酸的甲醇溶液,80℃下搅拌加热2.5h完成脂肪酸的甲酯化。样品冷却至室温后加入1ml饱和NaCl溶液和1ml正己烷,振荡后静置分层,通过有机系微孔滤膜(津腾,0.22μm)过滤,加入正十七烷酸甲酯作为内标,定容至1ml。脂肪酸甲酯利用岛津GC2010气相色谱进行定量分析,检测器为FID。升温程序为:190℃保持5min,以10℃/min升温至250℃,再保持7min。色谱柱为:DB-WAX(Agilent,USA),厚度0.25μm、长度30m、内径0.25μm。脂肪酸甲酯标样正十七烷酸甲酯购自Sigma公司。
2 结果与讨论 2.1 Chlorococcum sp.藻油脂肪酸成分的确定取甲酯化处理之后的Chlorococcum sp.藻油,采用气相色谱进行分析。结果如图 1所示。
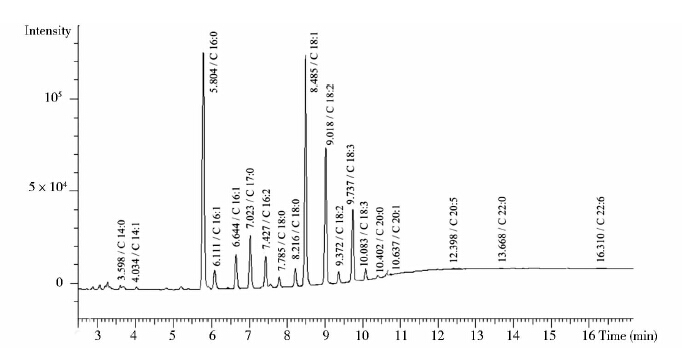
|
| 图 1 Chlorococcum sp.藻油甲酯化后的气相色谱图 Fig. 1 Gas chromatogram of fatty acid methyl ester of Chlorococcum sp. |
图 1显示Chlorococcum sp.藻油主要由15种脂肪酸组成,分别是饱和脂肪酸:豆蔻酸(C14∶0),棕榈酸(C16∶0),硬脂酸(C18∶0),花生酸(C20∶0),山嵛酸(C22∶0);单不饱和脂肪酸:棕榈油酸(C16∶1),油酸(C18∶1),二十碳烯酸(C20∶1);多不饱和脂肪酸:十六碳二烯酸(C16∶2),亚油酸(C18∶2),亚麻酸(C18∶3),二十碳五烯酸(C20∶5),二十二碳六烯酸(C22∶6)。该藻株与Patterson[12]报道的Chlorella sorokiniana藻株的脂肪酸组成十分接近[12]。采用正十七烷酸甲酯内标法对藻油进行定量分析发现,样品中可作为生物柴油原料的C16和C18脂肪酸成分占总脂肪酸的90%以上,表明Chlorococcum sp.是一株生产生物柴油原料油有潜力的藻株。
2.2 乙酸钠对Chlorococcum sp.生长及油脂积累的影响在添加不同浓度梯度乙酸钠的条件下,Chlorococcum sp.干重的变化如图 2所示。从图 2中可以发现,乙酸钠添加浓度为0~2g/L,Chlorococcum sp.接种后没有明显的延滞期,经过4天的对数期增长后进入稳定期。Chlorococcum sp.干重随乙酸钠浓度增加而升高。乙酸钠添加浓度增加到4g/L在起始阶段明显抑制Chlorococcum sp.的生长,经过4天的延滞期后微藻才到达对数期。
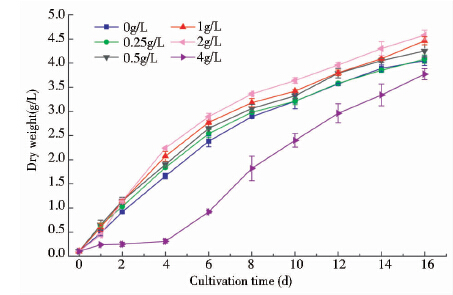
|
| 图 2 Chlorococcum sp.在不同浓度乙酸钠条件下的生长曲线 Fig. 2 Growth curves for Chlorococcum sp. grown under six sodium acetate concentration levels within sixteen days (means ± SD) |
表 1显示了不同乙酸钠浓度对Chlorococcum sp.干重及油脂积累的影响。从表中数据可以看出,乙酸钠的添加在提高Chlorococcum sp.干重的同时也促进藻细胞油脂的积累,与Roessler[13] “丰富的碳源有利于油脂的积累”的研究结论相符合。乙酸钠添加浓度在2g/L的条件下,Chlorococcum sp.的干重为4.58g/L,相较于空白组4.05g/L提升了13.1%;总脂产率为98.31mg/(L·d),相较于空白组78.06mg/(L·d)提升了25.9%;脂肪酸产率为85.02mg/(L·d),相较于空白组65.76mg/(L·d)提升了29.3%。
| Concentration level (g/L) | Dry weight (g/L) | Lipid content (%of dry weight) | Lipid productivity [mg/(L·d)] | FAMEs content (%of dry weight) | FAMEs productivity [mg/(L·d)] |
| 0 | 4.05±0.04 | 31.16±0.40 | 78.06±2.93 | 26.23±0.53 | 65.76±2.95 |
| 0.5 | 4.08±0.11 | 32.72±0.21 | 82.62±1.21 | 28.33±0.25 | 71.58±2.15 |
| 1 | 4.25±0.05 | 32.34±0.25 | 85.08±1.92 | 27.04±0.88 | 71.21±4.49 |
| 1.5 | 4.46±0.08 | 32.55±0.78 | 89.91±0.46 | 27.17±0.47 | 75.10±2.74 |
| 2 | 4.58±0.10 | 34.63±0.42 | 98.31±3.36 | 29.93±0.30 | 85.02±1.00 |
| 4 | 3.77±0.12 | 36.23±0.43 | 84.54±1.56 | 33.39±0.86 | 78.05±4.38 |
以上实验结果表明,Chlorococcum sp.在BG-11培养基中添加2g/L的乙酸钠,干重与油脂产率都能够得到很大幅度的提升。
2.3 硝酸钠对Chlorococcum sp.生长和油脂积累的影响在缺氮BG-11培养基中加入2g/L的乙酸钠,设计5个硝酸钠添加浓度(0g/L、0.1g/L、0.5g/L、1g/L、1.5g/L),Chlorococcum sp.生长情况见图 3。

|
| 图 3 不同浓度硝酸钠对Chlorococcum sp.生长的影响 Fig. 3 Effects of sodium nitrate concentrations on the growth of Chlorococcum sp. with five different pretreatments 0g/L:Parallel group,A and a; 0.1g/L:Parallel group,B and b; 0.5g/L:Parallel group,C and c; 1.0g/L:Parallel group,D and d; 1.5g/L:Parallel group,E and e |
Chlorococcum sp.藻细胞干重、类胡萝卜素及高级脂肪酸经甲酯化反应后生成脂肪酸甲脂的产率变化情况见图 4。
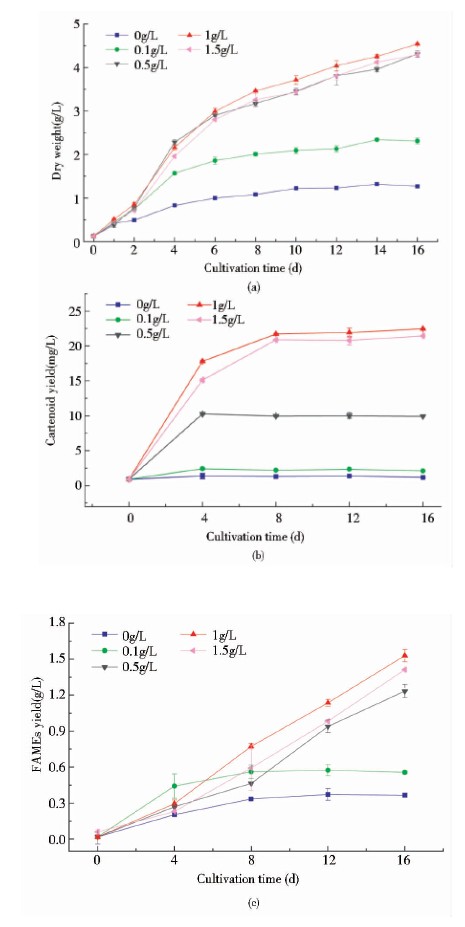
|
| 图 4 不同浓度硝酸钠藻细胞干重(a)、类胡萝卜素产量(b)和脂肪酸甲酯产量(c)的变化 Fig. 4 The growth curves(a),carotenoid yield(b) and FAMEs yield(c) for Chlorococcum sp. pretreated by different concentrations of sodium nitrate |
综合图 3与图 4(a)发现,Chlorococcum sp.生长过程中无明显的延滞期,第0天进入对数期,第4天转入稳定期,从图 3培养液颜色及图 4生长曲线能够得知:硝酸钠浓度为0~1g/L时,Chlorococcum sp.的生长情况与硝酸钠浓度呈正相关;而当硝酸钠浓度达到1.5g/L时对Chlorococcum sp.生长的促进作用降低。Merzlyak等[14]指出,长时间氮匮乏条件下,叶绿素a(蓝绿色)与叶绿素b(黄绿色)的含量明显下降。图 3显示随着培养天数的增加,0g/L和0.1g/L硝酸钠实验组中培养液颜色由绿色逐渐变成黄色,这与Merzlyak等的研究结果一致。
图 4(b)、(c)的结果表明,Chlorococcum sp.细胞中类胡萝卜素产量与脂肪酸甲酯产量的变化与藻细胞的生长趋势基本一致。此外,从图 4(b)中可以得到,0g/L和0.1g/L硝酸钠两组中类胡萝卜素产量并无明显升高,其他3组表明Chlorococcum sp.在0~4天类胡萝卜素产量快速增加,从第8天起,类胡萝卜素产量并没有随Chlorococcum sp.干重的增加而增加,类胡萝卜素产量在进入稳定期后变化不大;从图 4(c)中分析脂肪酸甲酯产量数据表明,0.5g/L、1g/L和1.5g/L硝酸钠3组的脂肪酸甲酯产量在第4天之后仍呈现线性增长。据此判断在Chlorococcum sp.生长后期积累的油脂主要成分为脂肪酸。
表 2显示的是不同硝酸钠浓度梯度对Chlorococcum sp.干重及油脂积累的影响。
| Concentration level (g/L) | Dry weight (g/L) | Lipid content (%of dry weight) | Lipid productivity [mg/(L·d)] | FAMEs content (%of dry weight) | FAMEs productivity [mg/(L·d)] | Cartenoid productivity [mg/(L·d)] |
| 0 | 1.27±0.01 | 49.98±0.31 | 38.68±0.69 | 28.78±0.11 | 22.02±0.34 | 0.016±0.005 |
| 0.1 | 2.31±0.07 | 44.88±0.37 | 63.81±2.51 | 24.11±0.38 | 34.00±1.61 | 0.074±0.004 |
| 0.5 | 4.31±0.07 | 36.66±0.59 | 97.78±3.22 | 28.61±0.12 | 76.25±1.59 | 0.564±0.001 |
| 1 | 4.54±0.03 | 38.62±0.07 | 108.59±0.88 | 33.69±0.10 | 94.78±0.88 | 1.347±0.003 |
| 1.5 | 4.29±0.01 | 37.42±0.14 | 99.34±0.71 | 32.90±0.12 | 87.39±0.61 | 1.284±0.004 |
分析表 2中数据得出,在硝酸钠浓度为1g/L时,Chlorococcum sp.干重达到了4.54g/L,类胡萝卜产率达到1.347mg/(L·d),比0.5g/L硝酸钠对照组的干重和类活萝卜素产率分别提高出5.34%和138.83%。这与薛敏[15]的“足够氮源有利于微藻中后期积累类胡萝卜素”的结论相一致。此外,在1g/L硝酸钠条件下,总脂产率和脂肪酸甲酯产率也分别达到了108.59mg/(L·d)和94.78mg/(L·d),其中总脂占藻细胞干重的38.62%,与董联等[16]以CO(NH2)2为氮源培养该株藻16天后取得的总脂含量38%接近。
表 3显示的是氮源对Chlorococcum sp.藻细胞脂肪酸组成的影响。
| Fatty acids composition (% of total Fatty acids) | Concentration of sodium nitrate(g/L) | |||||
| 0 | 0.1 | 0.5 | 1 | 1.5 | ||
| Subtotal fatty acids | C14:0 | 0.59 | 0.68 | 0.79 | 0.79 | 0.83 |
| C16:0 | 26.95 | 26.57 | 29.57 | 31.49 | 30.02 | |
| C18:0 | 1.47 | 2.75 | 2.96 | 2.92 | 3.23 | |
| C20:0 | 5.15 | 0.39 | 0.37 | 0.38 | 0.4 | |
| C22:0 | 0.33 | 0.07 | 0.06 | 0.08 | 0.17 | |
| C24:0 | 0.25 | 0.07 | 0.19 | 0.19 | 0.2 | |
| Subtotal | 34.74 | 30.53 | 33.94 | 35.85 | 34.85 | |
| Monoenoic fatty acids | C14:1 | 0.08 | 0.09 | 0.14 | 0.21 | 0.25 |
| C16:1 | 4.2 | 3.43 | 3.93 | 6.73 | 7.2 | |
| C18:1 | 20.81 | 35.43 | 32.14 | 27.53 | 29.09 | |
| C20:1 | 0.78 | 1.08 | 0.98 | 0.76 | 0.8 | |
| Subtotal | 25.87 | 40.03 | 37.19 | 35.23 | 37.34 | |
| Polyenoic fatty acids | C16:2 | 4.67 | 5.69 | 4.93 | 3.93 | 3.59 |
| C18:2 | 23.61 | 10.62 | 11.14 | 15.19 | 14.69 | |
| C18:3 | 9.3 | 11.29 | 10.91 | 8.22 | 7.95 | |
| C20:5 | 0.91 | 0.79 | 0.75 | 0.63 | 0.66 | |
| C22:6 | 0.9 | 1.05 | 1.14 | 0.95 | 0.92 | |
| Subtotal | 39.39 | 29.44 | 28.87 | 28.92 | 27.81 | |
| C16~C18 | 91.01 | 95.78 | 95.58 | 96.01 | 95.77 | |
从表 3中可以看出,Chlorococcum sp.藻细胞脂肪酸成分主要由C16与C18组成,占藻细胞总脂肪酸成分的90%以上,而这两种类型的脂肪酸被认为是制造生物柴油的理想原料[17]。除缺氮组之外,0.1g/L、0.5g/L、1g/L和1.5g/L 4组C16~C18所占比例分别为95.78%、95.58%、96.01%和95.77%,其中不饱和脂肪酸所占比例达到60%以上,极大地降低了后续加工成为生物柴油的冷凝点[18],从而在严寒的条件仍具备较好的流动性。此外,分析中检测到高附加值脂肪酸EPA(C20∶5)与DHA(C22∶6),两者的含量之和也占总脂肪酸的1.5%以上,表明Chlorococcum sp.在高附加值产品方面也具有一定的研究价值。
3 结 论在BG-11培养基中加入有机碳源乙酸钠,降低无机氮源硝酸钠条件下,绿球藻Chlorococcum sp.的干重及油脂含量都有显著增长。实验结果表明,在外源碳源乙酸钠添加浓度为2g/L,氮源硝酸钠为1g/L的改良BG-11培养液中,Chlorococcum sp.的生物质产率达到276.19mg/(L·d),类胡萝卜素和总脂产率分别达到1.347mg/(L·d)和108.59mg/(L·d),分析脂肪酸成分得知该培养条件下,作为生物柴油原料的脂肪酸成分C16和C18占到总脂肪酸96.01%,其中不饱和度达到64.16%,降低了生产为生物柴油的冷凝点,从而为其更广泛的应用奠定了基础。此外,高附加值脂肪酸EPA与DHA占脂肪酸总量也超过了1.5%,表明Chlorococcum sp.除了在制备生物柴油方面有明显优势外,在高附加值产品方面也蕴藏潜力。
| [1] | Scott S A, Davey M P, Dennis J S, et al. Biodiesel from algae: challenges and prospects. Current Opinion in Biotechnology, 2010, 21(3): 277-286. |
| [2] | Chisti Y. Biodiesel from microalgae. Biotechnology Advances, 2007, 25(3): 294-306. |
| [3] | Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances. Plant J, 2008, 54(4): 621-639. |
| [4] | 田辉,谯顺彬,彭晓东,等.无机与有机碳源混合营养培养对钝顶螺旋藻生长的影响.贵州农业科学,2011,39(10):122-124. Tian H, Qiao S L, Peng X D, et al. The influence of inoganic and organic carbon sources on mixotropic growth of Spirulina platensis. Guizhou Agricultural Sciences, 2011,39(10): 122-124. |
| [5] | 刘平怀, 杨勋, 时杰, 等. 有机碳源对单针藻细胞生长、油脂积累和光合作用的影响. 食品工业科技, 2012,33(18): 224-226,240. Liu P H, Yang X, Shi J, et al. Effect of organic carbon sources on growth rate, lipid productivity and photosynthesis of Monorapgidium sp. cells. Science and Technology of Food Industry, 2012,33(18): 224-226,240. |
| [6] | Rippka R, Deruelles J, Waterbury J B, et al. Generic assignments, Strain histories and properties of pure cultures of cyanobacteria. J Gen Microbiol, 1979, 111(1): 1-61. |
| [7] | Zhu C J, Lee Y K. Determination of biomass dry weight of marine microalgae. Journal of Applied Phycology, 1997, 9(2): 189-194. |
| [8] | Bigogno C, Khozin-Goldberg I, Boussiba S, et al. Lipid and fatty acid composition of the green oleaginous alga Parietochloris incisa, the richest plant source of arachidonic acid. Phytochemistry, 2002, 60(5): 497-503. |
| [9] | Lichtenthaler H K. Chlorophylls and carotenoids-pigments of photosynthetic biomembranes. Method Enzymol, 1987, 148(34):350-382. |
| [10] | Zhu L D, Wang Z M, Shu Q, et al. Nutrient removal and biodiesel production by integration of freshwater algae cultivation with piggery wastewater treatment. Water Res, 2013, 47(13): 4294-4302. |
| [11] | Indarti E, Majid M I A, Hashim R, et al. Direct FAME synthesis for rapid total lipid analysis from fish oil and cod liver oil. J Food Compos Anal, 2005, 18(2-3): 161-170. |
| [12] | Patterson G W. Effect of culture temperature on fatty acid composition of Chlorella sorokiniana. Lipids, 1970, 5(7): 597-600. |
| [13] | Roessler P G. Environmental-control of glycerolipid metabolism in microalgae-commercial implications and future-research directions. J Phycol, 1990, 26(3): 393-399. |
| [14] | Merzlyak M N, Chivkunova O B, Gorelova O A, et al. Effect of nitrogen starvation on optical properties, pigments, and arachidonic acid content of the unicellular green alga Parietochloris incisa (Trebouxiophyceae, Chlorophyta). J Phycol, 2007, 43(4): 833-843. |
| [15] | 薛敏. 氮磷培养条件对栅藻SP-01的生长和代谢产物的影响. 广州:中山大学, 生命科学学院,2012. Xue M. Effects of Nitrogen and Phosphate on the Growth and Metaboilsm of Scenedesmus SP-01. Guangzhou:Sun Yat-sen University, School of Life Sciences,2012. |
| [16] | 董联, 袁振宏, 王忠铭, 等. 光强与氮源对绿球藻GN38生长和油脂积累的影响. 可再生能源, 2014,32(01): 73-80. Dong L, Yuan Z H, Wang Z M, et al. Effect of light intensity and nitrogen source on the growth and lipid Chlorococcum sp. GN38. Renewable Energy Resources, 2014,32(01): 73-80. |
| [17] | Huang G H, Chen F, Wei D, et al. Biodiesel production by microalgal biotechnology. Appl Energ, 2010, 87(1): 38-46. |
| [18] | O'brien R D. Fats and Oils: Formulating and Processing for Applications. 3rd ed.Boca Raton:CRC Press, 2008. |
 2015, Vol. 35
2015, Vol. 35




