文章信息
- 徐登安, 赵纯钦, 张赤红, 陈静
- XU Deng-an, ZHAO Chun-qin, ZHANG Chi-hong, CHEN Jing
- 大麦水孔蛋白基因HvTIP2;1及其启动子的表达特性分析
- Expression Patterns of a Root-specific Barley Aquaporin Gene HvTIP2;1 and Promoter
- 中国生物工程杂志, 2015, 35(7): 15-21
- China Biotechnology, 2015, 35(7): 15-21
- http://dx.doi.org/10.13523/j.cb.20150703
-
文章历史
- 收稿日期:2015-03-19
- 修回日期:2015-04-15
植物启动子控制基因在特定组织、发育阶段及环境条件下表达[1]。组成型表达启动子是植物基因工程中常用的启动子,驱动靶基因在各组织中过量表达,造成养分和能量的浪费,对植物生长发育带来不良影响[2]。分离鉴定组织特异性或诱导型启动子,了解启动子的时空表达特性及作用机制成为分子生物学的研究热点之一。
植物的根具有吸收水分和无机盐、固定植物,并在干旱、盐碱和重金属土壤条件下保护植物地上部分,对植物的生长发育具有重要的生物学意义。利用拟南芥根特异表达基因AtWRKY6的启动子驱动细胞分裂素降解基因(CKX)在烟草和拟南芥根中特异性表达,使根系生物量增加60%,提高了植株抗干旱和抗重金属胁迫的能力[3]。分离鉴定植物根特异性启动子,对于利用转基因技术的作物品种改良工作意义重大。已经报道的植物根特异性启动子大部分来自模式植物。大麦是世界第四大主要粮食作物,具有耐瘠薄、抗寒抗旱及抗盐碱等优良特性,迄今已分离了来自大麦的ids-1、HvWAK1、HvPRX45、HvPRX2和OMT等根特异表达基因[4, 5, 6, 7]。然而,有关大麦根特异表达启动子的研究较少,Schuènmann等[8]和Kobayashi等[9]分别鉴定了大麦根特异表达基因Pht1和ids2的启动子及其调控机制。
分离和鉴定优良的组织特异性启动子是基因工程研究的重要内容之一。我们利用BB3基因表达芯片数据[10]和基因数字化差异显示技术筛选到一个大麦根特异表达的水孔蛋白基因HvTIP2;1,该基因编码一个TIPs 类(tonoplast intrinsic protein) 的水孔蛋白家族成员,在幼苗叶片中不表达,在幼根中的表达量也很低[11]。本文通过实时荧光定量RT-PCR(qRT-PCR)技术分析了该基因在不同组织和处理条件下的表达特征,利用PCR技术克隆基因启动子(Hv1310p),并构建不同长度启动子融合GUS基因的植物表达载体,经农杆菌介导的转基因实验分析其启动活性,以期为HvTIP2;1基因表达调控机制和作物基因工程研究提供理论依据和优良调控元件。
1 材料与方法 1.1 材 料 1.1.1 实验材料供试材料为栽培大麦(Hordeum vulgare)品种Golden Promise,种植于22℃温室中。将生长至三叶期的幼苗(洗净根部泥土)移至分别含有200mmol/L NaCl、20% PEG、0.1mmol/L ABA和0.1mmol/L AlCl3+0.5mmol/L MnCl3的Hoagland’s营养液中培养,对照组幼苗移至空白Hoagland’s营养液中培养。转基因烟草受体为普通烟草品种(Nicotiana tabacum L.)。
1.1.2 试剂T4 DNA连接酶、HindIII与NcoI限制性内切核酸酶、Ex-Taq DNA 聚合酶、Reverse Transcriptase M-MLV及pMD19-T克隆载体购自大连TaKaRa公司,胶回收试剂盒与质粒提取试剂盒购自天根生化科技有限公司,植物RNA提取试剂盒购自Omega Biotek公司,iQ SYBR Green SuperMix为Bio-Rad公司(美国)产品。
1.1.3 菌株及质粒pCAMBIA1301基础载体、大肠杆菌(Escherichia coli)JM109和农杆菌 (Agrobaterium tumefaciens) 菌株EHA105为本实验室保存。
1.2 方 法 1.2.1 大麦根特异表达基因筛选及验证利用PLEXdb数据库(http://www.plexdb.org/plex.php?database=Barley)中的BB3大麦芯片数据和HarvEST: Barley软件(http://harvest.ucr.edu/)提供的基因数字化差异显示工具筛选到根特异表达探针Contig1310_at,通过Blastn序列比对发现该探针对应HvTIP2;1基因(GenBank: AB540222.1)。根据基因编码区序列设计定量引物q1310F和q1310R(表 1),采用qRT-PCR方法检测该基因在幼苗期、成株期和灌浆期不同组织中的表达差异。
| Name | Sequence(5′ → 3′) | Position |
| q1310F | AAGTTCGTCACCCACGGAAA | Coding region |
| q1310R | GACCCAGTAGACCCAGTTGC | Coding region |
| 1310F1 | AAGCTTCTGCATTATCAGACAGAACT | Fig. 5 |
| 1310F2 | AAGCTTCGAAGGAAAGGCATTAGAAA | Fig. 5 |
| 1310R | CCATGGTGCGGATGATTACCACAA | Fig. 5 |
采用CTAB法提取大麦叶片基因组DNA。剪取发芽7天的大麦幼苗根、茎和叶,成株期大麦的根、茎、叶、花和茎节,以及灌浆期的大麦幼嫩种子,用于基因表达的组织差异性分析。分别剪取经ABA处理,以及非生物胁迫2h、10h和24h的处理组和对照组大麦幼根,用于基因表达特征的定量分析。样品经液氮速冻后,储于-80℃冰箱中备用。RNA提取方法参照试剂盒说明书。
1.2.3 大麦HvTIP2;1基因的表达特征分析将大麦总RNA反转录成cDNA进行qRT-PCR分析。cDNA 第一链合成的具体步骤按 TaKaRa 试剂盒说明书进行。qRT-PCR程序为: 95℃ 30s;95℃ 15s,60℃ 15s,72℃ 15s,40个循环。样本和内参分别设3个重复。以Actin为内参基因,采用2-△△Ct法计算基因的相对表达量。
1.2.4 启动子克隆及顺式作用元件分析利用HvTIP2;1基因序列比对IBSC公布的大麦基因组数据[12],获得基因全长序列(morex_contig_51093)。在转录起始位点上游序列设计两条上游引物1310F1和1310F2以及一条共用的下游引物1310R,并在上、下游引物5′端分别引入Hind Ⅲ和NcoⅠ限制性内切核酸酶位点(表 1,下划线部分表示酶切位点),以基因组DNA为模板,通过PCR方法克隆两条不同长度的启动子片段。PCR反应体系为:模板DNA 500ng,上、下游引物(10μmol/L)各1μl,10×PCR Buffer(Mg2+ plus)2μl,dNT PMixture(2.5mmol/L) 1.6μl,Ex-Taq DNA 聚合酶(5U/μl) 0.2μl,加双蒸水至20μl。PCR程序为:98℃ 5min;94℃ 30s,55℃ 30s,72℃ 90s,35个循环;72℃延伸10min。为验证启动子序列和探针序列来自同一基因,对1310F2和q1310R引物的PCR扩增片段进行测序验证。利用在线分析网站PLACE(http://www.dna.affrc.go.jp/PLACE/signalscan.html)和PLANTCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子顺式作用元件的预测分析[13, 14]。
1.2.5 PCR产物克隆及测序PCR扩增产物经2%的琼脂糖凝胶电泳分离,回收产物与 pMD19-T 载体连接,将连接产物转化大肠杆菌感受态细胞,经蓝白斑筛选阳性克隆,菌液PCR和质粒酶切初步鉴定后,送江苏金唯智生物科技有限公司测序。
1.2.6 表达载体构建及烟草转化根据图 1的载体结构示意图,采用Hind Ⅲ/Nco Ⅰ双酶切pCAMBIA1301基础表达载体与含启动子片段的重组子,分别回收pCAMBIA1301质粒酶切的大片段与目标启动子片段,经T4 DNA 连接酶连接,构建融合GUS基因的植物表达载体。阳性克隆经菌落PCR、质粒酶切和测序验证后导入农杆菌。

|
| 图 1 表达载体的结构示意图 Fig. 1 Schematic diagram of binary vector hyg: Hygromycin phosphotransferase gene; GUS: β-glucuronidase gene; Hv1310p: Inserted promoter |
采用农杆菌介导的叶盘转化法将新构建的表达载体转入普通烟草,将hyg基因PCR鉴定结果为阳性的T0代转基因植株移植到营养土钵。
1.2.7 GUS活性检测参照 Jefferson [15]的方法,对烟草组织进行GUS活性的定性和定量检测。将受检材料于GUS染液中,37℃浸泡过夜,使用95 %乙醇脱色并观察拍照。GUS荧光活性测定以单位时间内每毫克蛋白质分解底物MUG的纳摩尔数表示GUS酶活性。
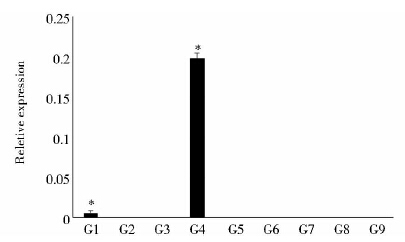
2 结果与分析 2.1 HvTIP2;1基因在不同发育阶段各组织中的表达差异利用qRT-PCR方法检测水孔蛋白基因HvTIP2;1在大麦苗期、成株期和灌浆期不同组织中的表达水平,结果显示(图 2),仅在根中检测到HvTIP2;1表达,且HvTIP2;1在幼苗根中的表达量极低,到了成株期表达量显著增加,约是幼苗期的35倍;而在大麦不同发育阶段的茎、叶、花、茎节及幼嫩种子中未见可检测的基因表达,表明HvTIP2;1属于根专一性表达基因。
|
| 图 2 HvTIP2;1基因在不同组织中的表达差异 Fig. 2 Expression of HvTIP2;1 gene in different tissue G1~G3: Root,stem and leaf of barley at seedling stage; G4~G8: Root,stem,leaf,flower and internode of barley at adult stage; G9: Young seed; * Significant difference at P < 0.05 |
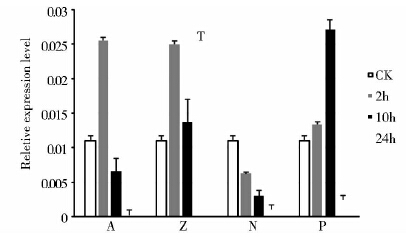
分别采用0.1mmol/L ABA、0.1mmol/L AlCl3+0.5mmol/L MnCl3、200mmol/L NaCl和20% PEG处理三叶期的大麦幼根,利用qRT-PCR方法检测处理2h、10h和24h后HvTIP2;1基因的表达水平变化(图 3)。结果显示,HvTIP2;1表达受ABA激素诱导,处理2h达到高峰值(约为对照的2.3倍),之后迅速回落(处理10h和24h的表达量约为对照组的0.5倍和0.02倍)。在铝、锰金属离子处理组,HvTIP2;1表达量明显增强,呈现升高-降低-升高的表达变化特征(处理2h、10h和24h的表达量约为对照组的2.2倍、1.1倍和2.3倍)。然而,盐处理组HvTIP2;1的表达量持续降低,在3个检测时间点的表达量约为对照组的0.6倍、0.2倍和0.1倍。在PEG处理组,HvTIP2;1表达量不断增加(处理2h、10h的表达量约为对照组的1.2倍和2.1倍),处理24h后又急剧下降,约为对照组的0.2倍,此时植株叶片萎蔫、失水严重。上述结果表明,HvTIP2;1基因表达受激素和多种非生物胁迫的调节,并呈现出不同的表达变化模式。
|
| 图 3 ABA处理和非生物胁迫下HvTIP2;1基因的qRT-PCR分析 Fig. 3 qRT-PCR analyses of HvTIP2;1 under ABA treatment and abiotic stresses CK: Control; A,Z,N and P: Four types of treatment with 0.1mmol/L ABA,0.1mmol/L AlCl3+0.5mmol/L MnCl2,200mmol/L NaCl and 20% PEG |
为验证启动子序列和探针序列是否位于同一基因,以大麦基因组DNA为模板,利用位于启动子区的上游引物1310F2和位于基因编码区的下游引物q1310R进行PCR扩增,并对扩增产物进行测序,序列分析证明启动子序列和探针序列来自同一基因。利用PLACE和PLANTCARE在线启动子分析工具对Hv1310p启动子序列进行预测分析(图 4)。该序列含有2个TATA框和5个CAAT框等基础启动子元件,一个根毛特异性元件RHERPATEXPA7,4个根特异表达元件ROOTMOTIFTAPOX1,2个热休克响应元件CCAATBOX1,1个多种环境胁迫响应的DRE/CRT(转录因子)顺式作用元件DRECRTCOREAT和1个ABA响应必须的核心顺式作用元件LTRECOREATCOR15,2个MYC识别位点和2个MYB识别位点,二者均受ABA和干旱的诱导。结果表明,HvTIP2;1基因可能对激素诱导、高温、干旱等多种环境胁迫作出响应。

|
| 图 4 Hv1310P启动子顺式作用元件预测分析 Fig. 4 Speculated cis-elements in promoter Hv1310P Number +1(bold A) is the transcription start site. The shadowed letters represent the core sequences of cis-elements. The arrows indicate the primer position of 1310F1,1310F2 and 1310R |
为了解Hv1310p的启动活性及根特异表达元件的调控作用,利用两条上游引物1310F1、1310F2(引物位置见图 4)和一条下游引物1310R组成的引物对,采用5′端缺失法分别扩增514bp和1 258bp的不同长度片段启动子,并进行克隆测序验证。结果显示,PCR产物大小、测序结果与预期一致,分别将其命名为Hv1310p1和Hv1310p2[图 5(a)],长片段的Hv1310p2含有1个根毛特异性元件和4个根特异表达元件,而短片段的Hv1310p1仅含有1个根特异表达元件。
采用Hind Ⅲ/NcoⅠ双酶切启动子的克隆重组子,回收目的片段用T4 DNA 连接酶连接到经同样酶切、含有GUS报告基因的pCAMBIA1301载体上,并转入大肠杆菌。将PCR鉴定、酶切验证与测序结果完全一致的重组子转化农杆菌,成功构建了植物表达载体pCAM-Hv1310p1和 pCAM-Hv1310p2[图 5(b)]。经农杆菌介导的烟草转化,获得了转基因烟草阳性植株。

|
| 图 5 pCAM-Hv1310p1和pCAM-Hv1310p2表达载体的构建 Fig. 5 Construction of vector pCAM-Hv1310p1 and pCAM-Hv1310p2 (a) PCR amplification of Hv1310 Ppromoter fragments M: DL2000; 1,2: Promoter Hv1310p1 and Hv1310p2 (b)Digestion of vector pCAM-Hv1310p1 and pCAM-Hv1310p2 M: DNA marker DL15000; 1,3: Vector pCAM-Hv1310p1 and pCAM-Hv1310p2; 2,4: pCAM-Hv1310p1 and pCAM-Hv1310p2 digested with Hind Ⅲ/NcoⅠ |
以未转化的烟草为对照,在成株期阶段对两种不同片段长度启动子驱动的GUS转基因植株进行组织化学染色比较分析。结果显示,两种载体转化的转基因烟草植株根部均有明显的GUS化学染色,而茎、叶和花组织中没有GUS活性[图 6(a)],表明Hv1310p启动子能够在根组织特异地驱动外源基因表达。GUS荧光活性的定量检测结果也发现[图 6(b)],转基因烟草的根器官显示较高的GUS活性[>30nmol/(mg·min)],而茎、叶和花器官中极低的荧光活性水平[<1.2nmol/(mg·min)]可能来自样本中其他本底杂质的干扰。此外,两种载体的转基因烟草根部GUS活性水平没有显著差别,说明这两种不同片段长度的启动子均有较好的启动活性。

|
| 图 6 转基因烟草的GUS活性检测 Fig. 6 GUS activity analysis of transgenic tobacco (a)GUS Histochemistry staining of transgenic tobacco (b)Quantitative analysis of GUS activity CK: Intact tobacco; pCAM-Hv1310p1 and pCAM-Hv1310p2: Transgenic tobacco transformed with pCAM-Hv1310p1 and pCAM-Hv1310p2,respectively; * Significant difference at P < 0.05 |
植物组织特异表达基因的筛选方法主要有文库消减杂交法、cDNA代表性差异分析和mRNA差异显示法等。随着高通量测序技术迅猛发展,公共数据库中汇集的大量基因组、转录组和芯片数据,为新基因克隆及功能研究提供了重要的生物学资源。本文基于大麦表达芯片数据,利用基因数字化差异显示技术和qRT-PCR分析方法,快速筛选获得一个根特异表达基因HvTIP2;1及其启动子,生物信息学分析结合qRT-PCR检验和转基因的功能实验,为快速鉴定组织特异表达基因及启动子提供了一条有效途径。
水孔蛋白作为一种功能性的跨膜输水蛋白家族,在水分运输和胞内渗透压的调控等方面表现出重要作用[16]。大多数水孔蛋白基因在转录水平上受盐、干旱、低温等多种环境胁迫的调节,表达模式多样 [17]。据Maurel等[18]的报道,发育叶片和成熟叶片中PIPs和TIPs类大麦水孔蛋白基因的表达水平差异较大,本研究也发现,根特异表达基因HvTIP2;1在成株期的表达量大幅度增加,并表现受发育调控的特点。在ABA激素诱导和盐、干旱及金属离子毒害等非生物胁迫处理下,HvTIP2;1表达水平变化明显,且呈现不同的表达变化模式,表明该基因可能参与植物根器官对激素应答和多种环境胁迫的响应。Wang等[19]报道,水稻根特异性基因OsGT1启动子含有8个根特异作用元件及多个与激素应答和非生物胁迫响应有关的作用元件,具有受激素和环境胁迫诱导的根特异性表达活性。HvTIP2;1基因启动子序列不仅含有多个根特异表达作用元件ROOTMOTIFTAPOX1,还具有MYC、MYB识别位点和DRE/CRT、CCAATBOX1等多个环境胁迫响应有关的顺式作用元件。因此,HvTIP2;1可能提供一个很好来源的诱导型根特异表达启动子。
通常组成型启动子对转基因植株的生长发育带来不良影响[20]。目前,转基因大麦多携带CaMV35S、Ubiquitin等组成型表达启动子,其在品种改良中的应用受到限制。本研究表明含有一个根特异表达元件的514bp短片段启动子Hv1310p1也能有效驱动GUS基因在烟草根器官中特异表达,因而在转基因作物品种培育中具有较好的应用前景。但关于Hv1310p启动子的诱导表达活性尚需进一步的实验证明。
| [1] | 柏亚男, 吴茂森, 何晨阳. 水稻基因启动子OsBTF3p的克隆和启动活性分析. 中国农业科学, 2009, 42(3): 862-868. Bai Y N, Wu M S, He C Y. Molecular cloning and activity analysis of a rice gene. Scientia Agricultura Sinica, 2009, 42(3): 862-868. |
| [2] | Li Y Y, Liu S J, Yu Z, et al. Isolation and characterization of two novel root-specific promoters in rice (Oryza sativa L.). Plant Sci, 2013, 207(6): 37-44. |
| [3] | Werner T, Nehnevajova E, llmer I K, et al. Root-specific reduction of cytokinin causes enhanced root growth, drought tolerance, and leaf mineral enrichment in Arabidopsis and tobacco. Plant Cell, 2010, 22(12): 3905-3920. |
| [4] | Okumura N, Nishizawa N K, Umehara Y, et al. An iron deficiency-specific cDNA from barley roots having two homologous cysteine-rich MT domains. Plant Molecular Biology, 1991, 17(3): 531-533. |
| [5] | Kaur R, Singh K, Singh J. A root-specific wall-associated kinase gene, HvWAK1, regulates root growth and is highly divergent in barley and other cereals. Funct Integr Genomics, 2013, 13(2): 167-177. |
| [6] | Kwasniewski M, Chwialkowska K, Kwasniewsk J, et al. Accumulation of peroxidase-related reactive oxygen species in trichoblasts correlates with root hair initiation in barley. J Plant Physiol, 2013, 170(2): 185-195. |
| [7] | Sugimoto M, Okada Y, Sato K, et al. A root-specific O-methyltransferase gene expressed in salt-tolerant barley. Bioscience, Biotechnology and Biochemistry, 2014, 67(5): 966-972. |
| [8] | Schuènmann P H D, Richardson A E, Smith F W, et al. Characterization of promoter expression patterns derived from the Pht1 phosphate transporter genes of barley (Hordeum vulgare L.). Journal of Experimental Botany, 2004, 55(398): 855-865. |
| [9] | Kobayashi T, Nakayama Y, Itai R N, et al. Identification of novel cis-acting elements, IDE1 and IDE2, of the barley IDS2 gene promoter conferring iron-deficiency-inducible, root-specific expression in heterogeneous tobacco plants. The Plant Journal, 2003, 36(6): 780-793. |
| [10] | Druka A, Muehlbauer G, Druka I, et al. An atlas of gene expression from seed to seed through barley development. Funct Integr Genomics, 2006, 6(3): 202-211. |
| [11] | Besse M, Knipfer T, Miller A J, et al. Developmental pattern of aquaporin expression in barley (Hordeum vulgare L.) leaves. Journal of Experimental Botany, 2011, 62(12): 4127-4142. |
| [12] | The International Barley Genome Sequencing Consortium. A physical, genetic and functional sequence assembly of the barley genome. Nature, 2012, 491(7426):712-717. |
| [13] | Higo K, Ugawa Y, Iwamoto M, et al. Plant cis-acting regulatory DNA elements (PLACE) database: 1999. Nucleic Acids Research, 1999, 27 (1): 297-300. |
| [14] | Rombauts S, Déhais P, Montagu M V, et al. PlantCARE, a plant cis-acting regulatory element database. Nucleic Acids Res, 2002, 30(1):325-327. |
| [15] | Jefferson R A. Assaying chimeric genes in plants: the GUS gene fusion system. Plant Molecular Biology Reporter, 1987, 5(4):387-405. |
| [16] | Katsuhara M, Akiyama Y, Koshio K, et al. Functional analysis of water channels in barley roots. Plant Cell Physiol, 2002, 43(8):885-893. |
| [17] | Parent B, Hachez C, Redondo E, et al. Drought and abscisic acid effects on aquaporin content translate into changes in hydraulic conductivity and leaf growth rate: a trans-scale approach. Plant Physiology, 2009, 149(4): 2000-2012. |
| [18] | Maurel C, Kado R T, Guern J, et al. Phosphorylation regulates the water channel activity of the seed-specific aquaporinα-TIP. EMBO J, 1995, 14(3): 3028-3035. |
| [19] | Wang Y Q, Zhu S Y, Wang Y, et al. Tissue and inducible expression of a rice glutathione transporter gene promoter in transgenic Arabidopsis. Botanical Studies, 2007, 48(7): 35-41. |
| [20] | 崔永兰, 钟晓丽, 张永明, 等. 两个水稻胚乳启动子的克隆及表达分析. 中国生物工程杂志, 2008, 28(8):57-61. Cui Y L, Zhong X L, Zhang Y M, et al. Cloning and expression analysis of two endosperm promoters in rice. China Biotechnology, 2008, 28(8): 57-61. |
 2015, Vol. 35
2015, Vol. 35




