文章信息
- 李娟, 刘丽娜, 胡丹, 朱旭辉, 龚秀芳, 赵琳, 钟璟皓, 潘秀珍, 王长军
- LI Juan, LIU Li-na, HU Dan, ZHU XU-hui, GONG Xiu-fang, ZHAO Lin, ZHONG Jing-hao, PAN Xiu-zhen, WANG Chang-jun
- 2型猪链球菌MocR家族转录调控因子SSU0562基因敲除突变体的构建及毒力分析
- Construction and Virulence Analysis of MocR Transcription Regulator SSU0562 Gene Knock-out Mutant in Streptococcus suis Serotype2
- 中国生物工程杂志, 2015, 35(7): 8-14
- China Biotechnology, 2015, 35(7): 8-14
- http://dx.doi.org/10.13523/j.cb.20150702
-
文章历史
- 收稿日期:2014-12-25
- 修回日期:2015-02-02
2. 贵阳医学院生物与工程学院 贵阳 550004
2. Guiyang Medical University, School of Biology & Engineering, Guiyang 550004, China
2型猪链球菌(Streptococcus suis serotype 2,S. suis2)作为一种人畜共患病病原体,分别于1998年、2005年在我国江苏和四川两省暴发了大规模的S. suis2感染猪和人的公共卫生事件,在患者中出现了国内外罕见的链球菌中毒性休克综合征(streptococcal toxic shock syndrome,STSS)[1]。除此之外,S.suis2还可导致人和猪患脑膜炎、急性败血症、心内膜炎、关节炎及猝死[2]。S.suis2的致病性与毒力因子有着非常密切的关系,常见的毒力相关因子主要有荚膜多糖(capsular polysaccharide,CPS)、胞外因子(extracellular factor,EF)、溶菌酶释放蛋白(muraminidase released protein,MRP)、纤连蛋白结合蛋白(fibronectin-binding protein,FBP)、溶血素(suilysin,SLY)等[3, 4, 5, 6]。
然而,上述毒力相关因子多从单一组分进行研究,不能有效地解析和评估各毒力因子之间可能的相互作用,从而导致分离于某些特定S. suis2菌株的毒力相关因子却在其他S. suis2菌株中得到与致病性无关的结果。例如,CPS,它就同时存在于强毒株,弱毒株和非致病性菌株中[7]。细菌在生存、代谢和致病等生命过程中的调控是复杂而有序的,细菌主要是通过非常精密的信号系统来感受并且响应外部环境(宿主)的改变,从而在不同的生命阶段(或感染阶段)和营养条件下,对不同的毒力基因进行调控表达,完成其侵袭、定植及致病等过程。为了进一步阐明S. suis2的致病机制,明白转录调控因子如何调控毒力因子是至关重要的。
在猪链球菌中MocR家族是一类重要的转录调节因子,调节多种生物学过程。MocR为GntR的亚家族。GntR具有非常保守的拓扑结构,在N端的69个氨基酸残基区域内氨基酸序列及其相似,并且形成保守的螺旋-转角-螺旋(helix-turn-helix,HTH)DNA结合区域,其C端则为高度分化的效应物/寡聚作用域(effector binding and oligomerization,E-b/O)[8],并以此将GntR进一步分类为6个亚家族:FadR、MocR、HutC、YtrA、AraR和PlmA[9, 10, 11],MocR的C端则为一个假定的氨基酸转移酶结构域,能够结合维生素B6辅酶-磷酸吡哆醛(pyridoxal 5′- phosphate,PLP)[12]。MocR与氨基酸转移酶第一类基团同源[13]。转移酶以磷酸吡哆醛(PLP)作为辅因子,催化氨基基团从氨基酸底物可逆性转移到α-酮酸上。转移反应是氨基酸代谢最重要的一步,因此,MocR亚家族很可能参与调节猪链球菌中氨基酸代谢,并且可能和碳水化台物、脂肪代谢有关。
本课题组前期已完成2型猪链球菌强毒株05ZYH33全基因组的测序和注释。通过基因组注释分析发现SSU0562编码蛋白具有DNA结合位点及PLP结合位点,推测其可能属于MocR家族。目前,尚无针对2型猪链球菌中MocR家族的研究报道,为探索MocR家族在05ZYH33中的调控作用,本文构建了S.suis2强毒株05ZYH33的MocR家族转录调控因子SSU0562基因突变株Δ0562,并对其生物学特性及毒力进行了系统性分析。
1 材料与方法 1.1 菌株、质粒及引物本实验所用的菌株、质粒及引物见表 1,引物由上海赛百胜基因技术有限公司合成。
| Strains,plasmids and primers | Phenotypes and correlative characters | Sources |
| Strains | ||
| 05ZYH33 | 血清型2型、强致病株 | 本室保存 |
| Δ0562 | 血清型2型、Spcr、SSU0562- | 本研究构建 |
| E. coli DH5a | deoR、recA、endA、hsdR、supE、thi、gyrA、relA | 本室保存 |
| Plasmids | ||
| pMD18-T | T载体、lacZ、Ampr | TaKaRa |
| pUC19 | E.coli 克隆载体、lacZ、Ampr | 本室保存 |
| pUC19- LSR | SSU0562基因敲除质粒、Ampr、Spcr | 本研究构建 |
| Primers | Sequences | |
| L1 | GAATTC CAAGTCCGCAGGCTTATCA (下划线为EcoRI酶切位点) | |
| L2 | GGATCC TACAAACAATCCCCCTCGAA(下划线为 BamHI酶切位点) | |
| R1 | CTGCAG TAATGGGGTTGAGGTTCAGG(下划线为 PstI酶切位点) | |
| R2 | AAGCTT CGACTTACTTCGTCCGCTTC(下划线为HindIII酶切位点) | |
| Spc1 | CGGATCCGTTCGTGAATACAT(下划线为BamHI酶切位点) | |
| Spc2 | CCTGCAG GTTTTCTAAAATCTGA(下划线为PstI酶切位点) | |
| IN1 | GCTCCCTTTGGAAATTCGAT | |
| IN2 | GTCTTATTGGGCGGGAAAAT | |
| OUT1 | GATATTGATCACATGATGGAGG | |
| OUT2 | GTTATAGCGATACCTGGTCAC |
DNA限制性内切核酸酶、Ex-Taq DNA聚合酶、T4DNA连接酶、RNA反转录试剂盒及质粒DNA抽提试剂盒均购自TaKaRa公司;蛋白酶K购自Merck公司;RNA提取试剂盒、胶回收试剂盒购自Promega公司;Todd-Hewitt Broth(THB)培养基购自Difco公司;Ultraspec 2000型紫外分光光度计购自Pharmacia公司;Gene Pulser X Cell TM型电穿孔仪购自Bio-Rad公司。
1.3 实验动物BALB/c雌性小鼠,SPF级,4周龄,购自军事医学科学院实验动物中心。
1.4 方 法 1.4.1 Δ0562的构建与鉴定(1)重组敲除质粒PUC-LSR的构建。以05ZYH33基因组为模板,分别以引物L1/L2、R1/R2进行PCR扩增SSU0562编码基因的上下游片段L及R;同时以pSET2质粒为模板,用引物Spc1/Spc2进行PCR扩增壮观霉素抗性基因Spcr(Spcrcasstte)。利用双酶切及T4 DNA连接酶将它们依次克隆到pUC19载体上,形成一个Spcr基因两侧具有与SSU0562基因上下游同源序列的重组敲除质粒pUC-LSR(图 1)。
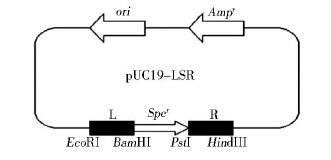
|
| 图 1 SSU0562基因敲除载体示意图 Fig. 1 Construction of plasmid pUC19-LSR |
(2)基因敲除突变株Δ0562的筛选。参照Smith等[14]的方法略作改动制备05ZYH33感受态细菌,设置电转参数2 250V/cm、200Ω和25uF,用构建好的重组质粒pUC19-LSR电转化制备好的05ZYH33感受态细菌,电转化结束后37℃、160r/min振荡孵育2h后,将菌液涂布于THB平板(含有100μg/ml壮观霉素),37℃培养48h,挑取所有的单菌落于THB培养基(含有100μg/ml壮观霉素)中培养,之后用SSU0562基因内引物IN1/IN2进行PCR初步筛选,对疑似阳性菌用引物OUT1/Spc2、Spc1/Spc2、Spc1/OUT2进行组合PCR进一步验证。
(3)RT-PCR鉴定。利用RNA提取试剂盒提取野生株05ZYH33及突变株Δ0562的RNA,将提取的RNA反转录成cDNA,并利用SSU0562基因内部引物IN1/IN2对cDNA进行鉴定。
1.4.2 生物学特性分析(1)形态结构和溶血活性。为比较野生株和突变株之间生长状态的差异,采用了分区划线法,将野生株05ZYH33和突变株Δ0562分别涂布于THB血平板(含5%绵羊血),37℃孵育24h,观察菌落的形态及溶血活性。
(2)生长曲线的绘制。在相同培养条件下,取等量的野生株05ZYH33和突变株Δ0562接种于THB培养基中,37℃振荡培养,每隔1h测OD600值,重复实验3次并绘制生长曲线。
(3)革兰氏染色。根据绘制的生长曲线,将野生株05ZYH33和突变株Δ0562在THB培养基中37℃培养至对数中期,然后分别取样对其进行革兰氏染色,在普通光学显微镜下观察菌落形态。
1.4.3 小鼠毒力实验将20只SPF级BALB/c小鼠随机分成2组,每组10只。从THB平板上挑取野生株和突变株的单菌落,转接于THB液体培养基中过夜培养,次日以1∶50的比例接种于新鲜THB中,当生长至OD600=0.4时,取1ml突变株和野生株腹腔注射小鼠各10只(1×108CFU/只),每日2次观察记录小鼠发病及死亡情况,观察1周。
2 结 果 2.1 SSU0562基因敲除突变株的构建与鉴定 2.1.1 SSU0562基因敲除载体PUC19-LSR的验证构建基因敲除质粒pUC19-LSR,并对其进行不同引物对(L1/L2、Spc1/Spc2、R1/R2、L1/Spc2、Spc1/R2、L1/R2)的PCR扩增,得到的片段大小和理论值一致,结果见图 2(a)。对敲除质粒进行双酶切验证,各组酶切产物大小均与理论预期值吻合,双酶切产物出现6条相应的核酸片段[图 2(b)]。pUC19-LSR测序结果显示L、R和Spcr片段连接次序均正确,证实重组质粒构建成功。
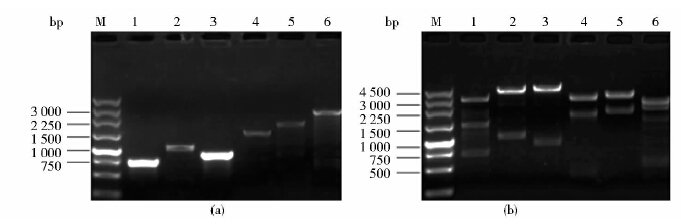
|
| 图 2 PUC19-LSR交叉PCR及双酶切验证 Fig. 2 Multiple-PCR analysis and restriction enzyme digesting of the recombinant plasmid pUC19-LSR (a) Multiple-PCR analysis M: 250bp DNA marker; 1: PCR products with L1/L2; 2: PCR products with Spc1/Spc2; 3: PCR products with R1/R2; 4: PCR products with L1/Spc2; 5: PCR products with Spc1/R2; 6: PCR products with L1/R2 (b) Restriction enzyme digesting M: 250bp DNA marker 1: Digested by EcoRI and BamHI; 2: Digested by BamHI and PstI; 3: Digested by PstI and HindIII; 4: Digested by EcoRI and PstI; 5: Digested by BamHI and HindIII; 6: Digested by EcoRI and HindIII |
基因敲除的筛选和鉴定挑取电转化后的单菌落振荡培养,用引物IN1/IN2进行PCR扩增验证。IN1/IN2位于SSU0562基因内部(产物大小为780bp),如果SSU0562基因被成功敲除将得到阴性结果;反之,则得到阳性结果。通过上述方法初步筛选后,发现两株扩增结果为阴性[图 3(a)],泳道3、7的疑似敲除菌株。然后对PCR初步筛选得到的疑似敲除株进行组合PCR扩增,基于同源重组原理,如果SSU0562基因位点被Spcr基因所取代,则用引物Out1/Spc2、Spc1/Spc2、Spc1/Out2进行PCR扩增,其大小将分别为1 945bp、1 130bp和2 208bp,在野生株05ZYH33中,用以上引物进行PCR,则均为阴性结果;用引物IN1/IN2进行PCR扩增,在野生株中会得到780bp大小的片段,而在SSU0562基因敲除突变株中则得到阴性结果。结果[图 3(b)]与理论值相符合。为了进一步证实SSU0562敲除成功,用引物Out1/Out2扩增得到大小为3 023bp的片段,将PCR产物进行测序,结果比对正确,将该突变株命名为Δ0562。然后提取野生株05ZYH33和突变株Δ0562的总RNA进行反转录,得到的cDNA使用引物IN1/IN2进行PCR扩增,观察SSU0562在转录水平的改变。如图 4所示:05ZYH33扩增结果为阳性,提示SSU0562基因正常转录;Δ0562为阴性,证实SSU0562基因在转录水平的缺失,上述结果再次表明突变株Δ0562构建成功。
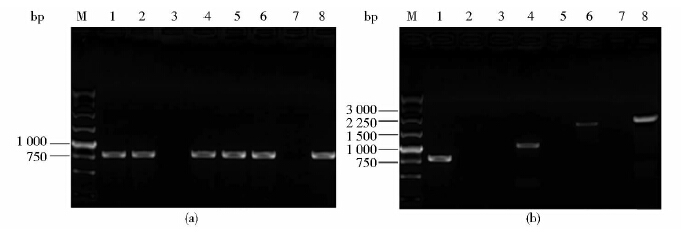
|
| 图 3 Δ0562的PCR初步筛选及组合PCR鉴定结果 Fig. 3 PCR analysisand multiple-PCR analysis of Δ0562 (a) PCR analysis M:250bp DNA marker; 1~8:Mutant strains (b) Multiple-PCR analysis M: 250bp DNA marker; 1: IN1/IN2 PCR amplification using 05ZYH33 genomic DNA as template; 2: IN1/IN2 PCR amplification using Δ0562 genomic DNA as template; 3: SPC1/SPC2 PCR amplification using 05ZYH33 genomic DNA as template; 4: SPC1/SPC2 PCR amplification using Δ0562 genomic DNA as template; 5: OUT1/SPC2 PCR amplification using 05ZYH33 genomic DNA as template; 6: OUT1/SPC2 PCR amplification using Δ0562 genomic DNA as template; 7:SPC1/OUT2 PCR amplification using 05ZYH33 genomic DNA as template; 8: SPC1/OUT2 PCR amplification using Δ0562 genomic DNA as template |
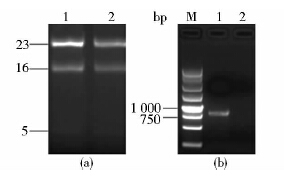
|
| 图 4 Δ0562 RT-PCR分析 Fig. 4 RT-PCR analysis of Δ0562 (a) Total RNA of 05ZYH33 and Δ0562 1: RNA of 05ZYH33; 2: RNA of Δ0562 (b) RT-PCR analysis M: 250bp DNA marker; 1: IN1/IN2 PCR amplification using cDNA of 05ZYH33; 2: IN1/IN2 PCR amplification using cDNA of Δ0562 |
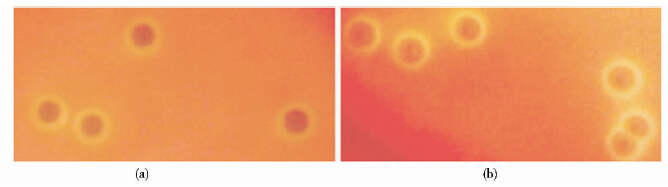
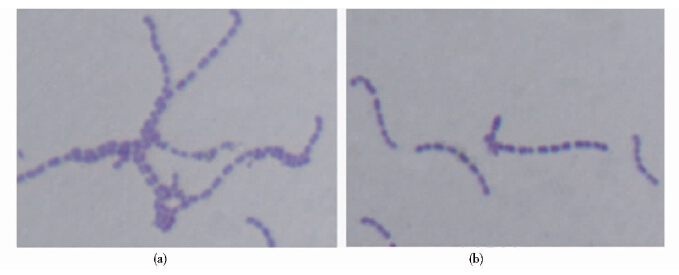
将野生株05ZYH33和突变株Δ0562分别涂布于THB血平板(含5%绵羊血),两者均长出表面光滑、湿润、灰白色、圆形半透明的细小菌落,菌落周围均有明显的溶菌环(图 5)。在溶血活性和菌落形态方面,野生株与突变株并未出现明显差异。如图 6所示,两者的革兰染色均为阳性,菌落形态为圆形或椭圆形,05ZYH33呈链状排列;相比05ZYH33,突变株Δ0562排列更加散在,链的长度明显较野生株的短,提示SSU0562基因敲除后猪链球菌的成链能力减弱。
|
| 图 5 野生型05ZYH33(a)和突变株Δ0562(b)的菌落形态和溶血活性 Fig. 5 Sheep blood THB plates of 05ZYH33(a) and Δ0562(b) |
|
| 图 6 野生株05ZH33(a)和突变株Δ0562(b)的结构形态(×1 000) Fig. 6 Gram stain of the wide type 05ZYH33(a) and mutant Δ0562(b) |
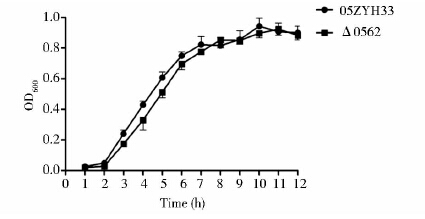
在相同的培养条件下,测定野生株05ZYH33和突变株Δ0562的OD600值,绘制生长曲线。结果如图 7所示。从图中可以看出,突变株Δ0562与野生株05ZYH33均在培养约3h后进入对数生长期,野生株05ZYH33在7h后进入平台期,突变株Δ0562在8h后进入平台期,总体而言两者的生长速率并无明显差异。
|
| 图 7 野生株与突变株的生长速率比较 Fig. 7 Growth rate of the parent strain and mutant Δ0562 |
野生株组小鼠在接种(1×108CFU/ml)野生株05ZYH33后,数小时内均出现精神萎靡、食欲下降等反应,12h内全部死亡;突变株组在攻毒12h内死亡8只,2只萎靡不振,发病较重,24h内死亡。统计学分析显示,与野生株相比突变株的毒力并未显著改变,提示SSU0562基因不改变猪链球菌强毒株05ZYH33的毒力特性。
3 讨 论MocR家族是细菌中重要的转录调控因子家族,对MocR家族的研究主要集中在谷氨酸棒状杆菌(Corynebacterium glutamicum)和芽孢杆菌(Bacillus),其作用机制尚不清楚。目前,MocR家族成员只发现了GabR和PdxR[15, 16, 17]。在枯草芽孢杆菌中,GabR作为gabTD操纵子的转录激活因子,主要通过γ-氨基丁酸和5′-磷酸吡哆醛对gabT的表达进行正向调控,γ-氨基丁酸作为唯一氮源的利用会因为gabR的缺失而受到阻断[15, 22]。γ-氨基丁酸(γ-aminobutyric acid,GABA)由谷氨酸经谷氨酸脱羧酶催化转化而来,通过GABA旁路(GABA shunt)完成代谢[17]。有研究报道GABA在微生物中参与氮、碳源的代谢[12, 18],以及腐胺和精胺等多胺的代谢[19],且能够对多种逆境产生协同应答,具有重要的生理功能[20]。最新研究表明GABA作为真核生物与病原菌相互作用的一种重要信号分子,可通过调控细菌群体感应信号分子OC8-HSL [N-(3-oxooctanoyl)homoserine lactone]的表达水平,影响病原菌对真核生物的致病力[21, 22]。在本课题组前期研究工作的基础上,我们对MocR家族转录调控因子SSU0562基因的功能进行了研究,探索其对2型猪链球菌强毒株05ZYH33的基本生物学性状和毒力的影响。
为探讨MocR家族成员SSU0562基因在2型猪链球菌致病过程中的作用,本研究通过同源重组基因敲除方法构建了猪链球菌强毒株05ZYH33中SSU0562基因敲除的突变株Δ0562。组合PCR和RT-PCR结果证实SSU0562基因无论是在基因水平上还是在转录水平上均被成功敲除。通过生物学功能实验,我们发现突变株Δ0562与野生型05ZYH33相比,在溶血活性与生长速率均无明显差异;但突变株Δ0562的成链能力明显减弱,提示SSU0562基因可能参与调控2型猪链球菌的成链能力。小鼠致病实验结果显示,突变株的毒力较野生株没有明显变化,敲除SSU0562基因并没有明显改变S.suis2的毒力。细菌的基础代谢和毒力调节是由多种因素共同作用的结果,SSU0562作为重要的转录调控因子,其在细菌代谢和毒力调控网络中的作用可能是复杂的,SSU0562调控作用是否与环境压力诱导等外在因素相关仍待进一步探索。
通过本实验的研究,我们发现SSU0562编码基因参与调节了2型猪链球菌的成链能力,但对其溶血活性及生长速率没有明显影响;小鼠致病实验提示,SSU0562可能在感染致病过程中发挥了重要作用,但并非S.suis2的毒力决定因子。MocR家族作为一种重要的转录调控因子家族,在S.suis2中的作用还有待进一步的阐明。
| [1] | Tang J Q, Wang C J, Feng Y J, et al. Streptococcal toxic shock syndrome caused by Streptococcus suis serotype 2. PLoS Med,2006,3(5):668-676. |
| [2] | Okwumabua O, O'Connor M, Shull E, et al. A polymerase chain reaction (PCR) assay specific for Streptococcus suis based on the gene encoding the glutamate dehydrogenase. FEMS Microbiol Lett,2003,218(1):79-84. |
| [3] | Smith H E, Damman M, van der Velde J, et al. Identification and characterization of the cps locus of Streptococcus suis serotype 2:the capsule protects against phagocytosis and is an important virulence factor. Infect Immun,1999,67(4):1750-1756. |
| [4] | Staats J J, Plattner B L, Stewart G, et al. Presence of the Streptococcus suiss uilysin gene and expression of MRP and EF correlates with high virulence in Streptococcus suis type 2 isolates. Vet Microbiol,1999,70 (1-2):201-211. |
| [5] | Lun S, Perez-Casal J, Connor W, et al. Role of suilysin in pathogenesis of Streptococcus suis capsular serotype 2. Microb Pathogenesis,2003,34(1):27-37. |
| [6] | Astrid de G,Herma B, Robin V, et al. Contribution of fibronectin-binding protein to pathogenesis of Streptococnu suis serotype 2. Infect Immun,2002,70(3):1319-1325. |
| [7] | Gottschalk M, Segura M.The pathogenesis of the meningitis caused by Streptococcus suis:the unresolved questions.Vet Microbiol, 2000,76(3): 259-272. |
| [8] | Haydon D J, Guest J R. A new family of bacterial regulatory proteins. FEMS Microbiol Lett,1991,63(2-3):291-295. |
| [9] | Rigali S,Schlicht M, Hoskisson P,et al. Extending the classification of bacterial transcription factors beyond the helix-turn-helix motif as an alternative approach to discover new cis/trans relationships. Nucleic Acids Res,2004, 32(11):3418-3426. |
| [10] | Lee M H, Scherer M, Rigali S, et al. PlmA a new member of the GntR family,has plasmid maintenance functions in Anabaena sp.strain PCC 7120.J Bacteriol, 2003, 185(15):4315-4325. |
| [11] | 王毅. 苜蓿中华根瘤菌(Sinorhizobium meliloti)Rm1021中GntR家族转录因子功能的初步研究. 福州:福建农林大学,生命科学学院,2006. Wang Y. Function of the GntR Family Transcriptional Regulator in Rm1021of Sinorhizobium meliloti.Fuzhou:Fujian Agriculture and Forestry University, College of Life Sciences,2006. |
| [12] | Belitsky B R, Sonenshein A L. GabR,a member of a novel protein family,regulates the utilization of gamma-aminobutyrate in Bacillus subtilis et. Mol Microbiol,2002,45(2):569-583. |
| [13] | Sung M H, Tanizawa K, Tanaka H, et al. Thermostable aspartate aminotrans-ferase from a thermophilic Bacillus species.Gene cloning,sequence determination,and preliminary X-ray characterization. J Biol Chem,1991,266(4): 2567-2572. |
| [14] | Smith H E, Wisselink H J, Vecht U, et al. High-efficiency transformation and gene inactivation in Streptococcus suis type 2. Microbiology, 1995, 1419(1): 181-188. |
| [15] | Belitsky B R. Bacillus subtilis GabR, a protein with DNA-binding and aminotransferase domains,is a PLP-dependent transcriptional regulator. J Mol Biol,2004,340(4):655-664. |
| [16] | Jochmann N, Götker S, Tauch A, et al. Positive transcriptional control of the pyridoxal phosphate biosynthesis genes pdxST by the MocR-type regulator PdxR of Corynebacterium glutamicum ATCC 13032. Microbiology,2011,157(1):77-88. |
| [17] | 朱莉, 宋福平, 张杰, 等. 芽孢杆菌γ-氨基丁酸代谢旁路研究进展. 生物技术通报, 2007,17(2): 72-75. Zhu L, Song F P, Zhang J, et al. Progresson γ -aminobutyric acid shuntin Bacillus. Biotechnology Bulletin, 2007,17(2): 72-75. |
| [18] | Bown A W, Shelp B J. The metabolism and functions of γ-aminobutyricacid acid. Plant Physiol,1997,115(1): 1-5. |
| [19] | Zaboura M, Halpern Y S. Regulation of gamma-aminobutyric acid degradation in Escherichia coli by nitrogen metabolism enzymes.J Bacteriol, 1978,133(2):447-451. |
| [20] | Shaibe E, Metzer E, Halpern Y S, et al. Metabolic pathway or the utilization of l-arginine, l-ornithine,agmatine,and putrescine as nitrogen sources in Escherichia coli K-12. J Bacteriol,1985,163(3):933-937. |
| [21] | Metzner M, Germer J, Hengge R, et al. Multiple stress signal integration in the regulation of the complex sigma S-dependent csiD-ygaF-gabDTP operon in Escherichia coli. Mol Microbiol,2004,51(3):799-811. |
| [22] | Chevrot R, Rosen R, Haudecoeur E, et al. GABA controls the level of quorum- sensing signal in Agrobacterium tumefaciens. PNAS,2006,103(19):7460-7464. |
 2015, Vol. 35
2015, Vol. 35




