文章信息
- 刘雅清,侯孝仑,郭玮婷,常忠义,高红亮,步国健,鲁伟,解秀娟,金明飞
- LIU Ya-qing,HOU Xiao-lun,GUO Wei-ting,CHANG Zhong-yi,GAO Hong-liang,BU Guo-jian,LU Wei,XIE Xiu-juan,JIN Ming-fei
- 甲壳素促进茂源链霉菌发酵产酶
- Enhancement of Transglutaminase Production in Streptoverticillium mobaraensis as Achieved by Treatment with Chitin
- 中国生物工程杂志,2015,35(6): 40-45
- China Biotechnology,2015,35(6): 40-45
- http://dx.doi.org/10.13523/j.cb.20150607
-
文章历史
- 收稿日期:2015-03-04
- 修回日期:2015-03-26
2. 泰兴市东圣食品科技有限公司 泰兴 225411
2. Taixing Dongsheng Food Science and Technology Limited Company,Taixing 225411,China
谷氨酰胺转胺酶(transglutaminase,TGase,EC2.3.2.13)是一种能催化蛋白质分子内、蛋白质分子间或蛋白质与氨基酸之间酰基转移反应的转移酶。这种催化特性可以使蛋白质间产生交联从而改变蛋白产品的质地与口感,因而在食品、纺织、医药等领域应用广泛[1]。TGase是一种胞外酶,其在细胞内首先合成没有活性的酶原pro-MTG(分子量约为43kDa),pro-MTG分泌到胞外后被TAMEP切割形成有活性的成熟酶MTG(分子量约为38kDa)[2]。TGase存在于动物、某些植物及微生物中,但动植物来源的TGase提取量少,价格昂贵[3]。TGase的市场化推广对该酶的产量提出了更高要求。自从Ando等利用微生物发酵法生产TGase以来,国内外学者们对该酶的应用研究主要集中在通过微生物发酵生产的方法提高产酶。自1993年,TGase在日本实现工业化生产后,很多学者致力于通过发酵条件的优化和添加发酵促进剂来实现菌株的高产。1997年Junqua等[4]优化了Streptoverticillium cinnamoneum的发酵培养基;2002年,陈坚等[5]通过在发酵过程中添加表面活性剂,提高菌体通透性来增加TGase的分泌;2005年,张程杰等[6]通过在发酵培养时添加羟胺来诱导菌株产酶;2007年,程力等[7]在链霉菌发酵过程中添加CTAB来提高菌株产酶,随后在2010年,又向发酵培养基中添加胰蛋白酶代替TEAMP,解除了酶原的产物抑制,提高了菌株产酶;2012年,Zhang等[8]在基础发酵培养基中添加NaCl,提高了菌株的产酶。
本文通过在基础发酵培养基中添加甲壳素来提高茂源链霉菌产酶。甲壳素(Chitin)化学名称为β-(1-4)-2-乙酰氨基-2-脱氧-D-葡萄糖,为固体不溶物,广泛存在于低等植物菌类、虾、蟹、昆虫等甲壳动物的外壳以及某些真菌的细胞壁中,价格便宜。[9,10]甲壳素对细菌、真菌、病毒等有着广泛的抑菌谱,[11]革兰氏阳性菌对甲壳素的抑菌作用尤为敏感[12]。茂源链霉菌为革兰氏阳性菌,谷氨酰胺转胺酶为该菌的次级代谢产物,在菌株发酵的基础培养基中添加适量的甲壳素可能使菌株的生长受到一定程度的胁迫,进而刺激菌体产生大量的次级代谢产物,从而提高产酶。另一方面甲壳素固型不溶物的特性可能会作为一种分散剂,使得链霉菌分散生长,形成的菌丝球致密性较弱,促进菌体生长与TGase的分泌进而提高产酶。目前通过添加甲壳素来提高链霉菌产酶还未有报道。本文主要研究了甲壳素对茂源链霉菌发酵产酶的影响,并对其作用机理进行了初步的探讨。
1 材料与方法 1.1 菌 种茂源链霉菌Streptoverticillium mobaraense DSM40587,系实验室从土壤中分离后诱变所得。
1.2 培养基种子培养基(g/L):甘油20;酵母膏5;鱼粉蛋白胨25;MgSO4·7H2O 2;K2HPO4·3H2O 2;pH调至7.4。
发酵培养基(g/L):甘油20;酵母膏6;鱼粉蛋白胨25;MgSO4·7H2O 2;K2HPO4·3H2O 2;pH调至7.4。
高氏一号培养基(g/L):可溶性淀粉20;KNO3 1;MgSO4·7H2O 0.5;K2HPO4·3H2O 0.5;NaCl 0.5;FeSO4·7H2O 0.01,琼脂20; pH 调至7.2~7.4。
上述培养基灭菌温度皆为121℃,时间为20 min。
1.3 试 剂Na-CBZ-Gln-Gly购自上海多肽公司;还原型谷胱甘肽购自山东金城钟化生物药业有限公司;其他药品均为分析纯级,购自国药集团化学试剂有限公司。
1.4 方 法 1.4.1 甲壳素添加实验菌株在高氏一号培养基中培养7d,以108/ml的孢子浓度在30ml种子培养基中转接1ml菌体,在30℃、200r/min摇床培养28h后,以3%的接种量接种到30ml已添加了不同浓度甲壳素的发酵培养基中,在30℃、200r/min摇床培养,分别在0、32、35、38、41、44h时取样。甲壳素在发酵培养基中的添加浓度分别为0.05%、0.1%、0.5%、1%、1.5%、2%。
1.4.2 酶活的检测酶活的检测采用异羟钨酸比色法[13],将TGase在37℃下催化Na-CBZ-Gln-Gly反应1min生成1μmol L-谷氨酸-γ-单羟氧肟酸所需要的酶量定义为一个酶活单位,用U/ml表示。
1.4.3 pH的检测不同发酵时间的样品在3000g,离心10min,取上清测定pH。
1.4.4 蛋白浓度的测定不同发酵时间的样品在3000g,离心10min,取上清,采用考马斯亮蓝结合法测定蛋白浓度。
1.4.5 总氮的测定不同发酵时间的样品在3000g,离心10min,取上清,采用碱性过硫酸钾消解紫外分光光度法,具体操作参考国家标准HJ636-2012测定水质中总氮的方法来进行。
1.4.6 聚丙烯酰胺凝胶电泳将不同时间的样品在3000g,离心10min,取上清,loading buffer处理后煮样5min。采用5%浓缩胶和12%分离胶进行聚丙烯酰胺凝胶电泳。
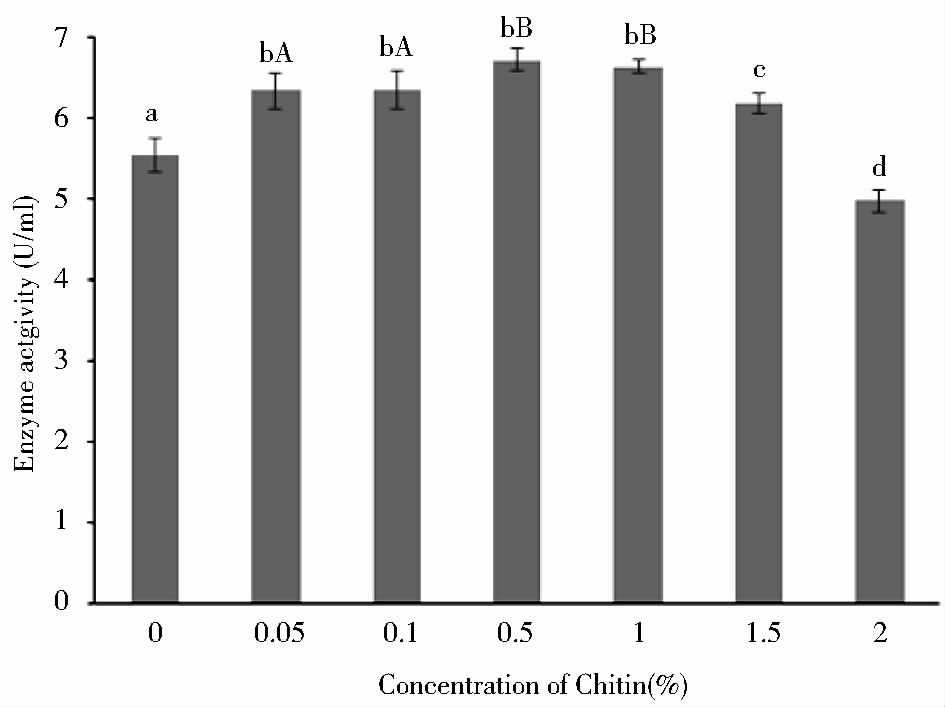
2 结果与分析 2.1 甲壳素对茂源链霉菌产TGase的影响在茂源链霉菌发酵培养基中分别添加质量分数为0.05%、0.1%、0.5%、1%、1.5%、2%的甲壳素,同时以未添加甲壳素的发酵培养基作为对照,发酵41h后测定菌株产酶情况。
如图 1所示,从发酵酶活结果可以看出,0.05%的甲壳素添加量即对茂源链霉菌发酵产酶有极显著的促进效果(P<0.01),酶活较对照组提高了14%;当添加量达到0.5%时,甲壳素对菌株的产酶促进作用最大,酶活较对照组提高了21%,且较之0.05%的甲壳素添加量有着显著的差异(P<0.05);当甲壳素的添加量达到1.5%时,其对菌株产酶的促进作用减弱,酶活较对照组仅提高了11%; 2%甲壳素添加量反而会抑制菌株产酶,酶活较对照组降低了11%。可见,甲壳素对该茂源链霉菌发酵产酶的促进作用不是随添加量呈线性升高的关系,其促进作用有一定的作用范围。接下来选取了对菌株产酶有促进作用且添加量之间有显著差异的甲壳素添加量0.1%和1%,以及对菌株产酶有抑制作用的2%的甲壳素添加量为实验对象,对甲壳素促进茂源链霉菌产酶的机理作进一步的探讨。
|
| 图 1 添加不同质量浓度的甲壳素时发酵产TGase的影响 Fig. 1 Effects of different chitin concentrations in fermentation process on the TGase activity Different lowercase letters represents extremely significant difference(P<0.01);Different capital letters represents significant difference(P<0.05) |
在茂源链霉菌发酵培养基中分别添加质量分数为0.1%、1%、2%的甲壳素,同时以未添加甲壳素的发酵培养基作为对照,于发酵不同时间测定菌株产酶情况、pH变化、发酵液中蛋白含量及总氮含量,同时对菌体生长状态进行显微观察。
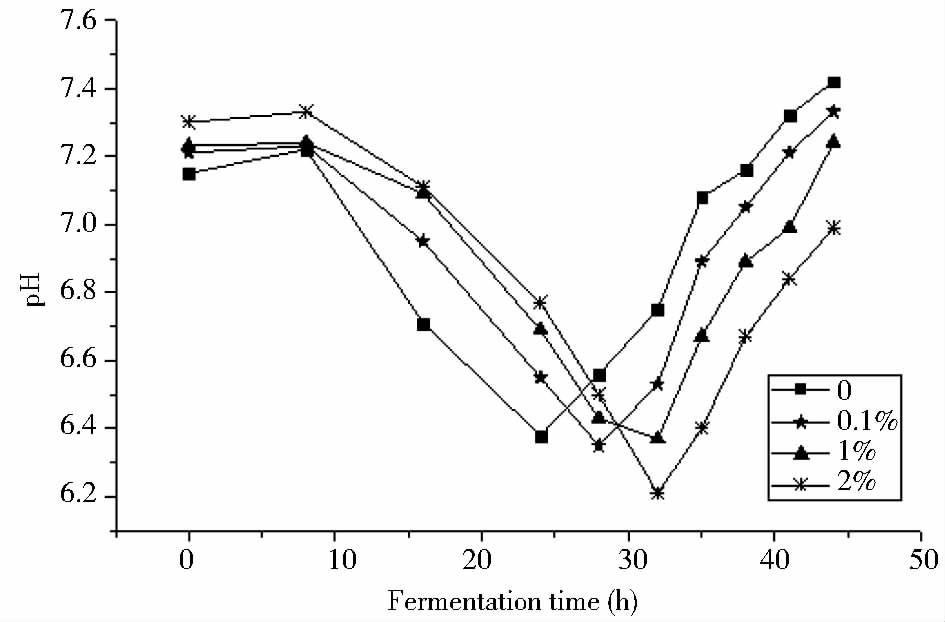
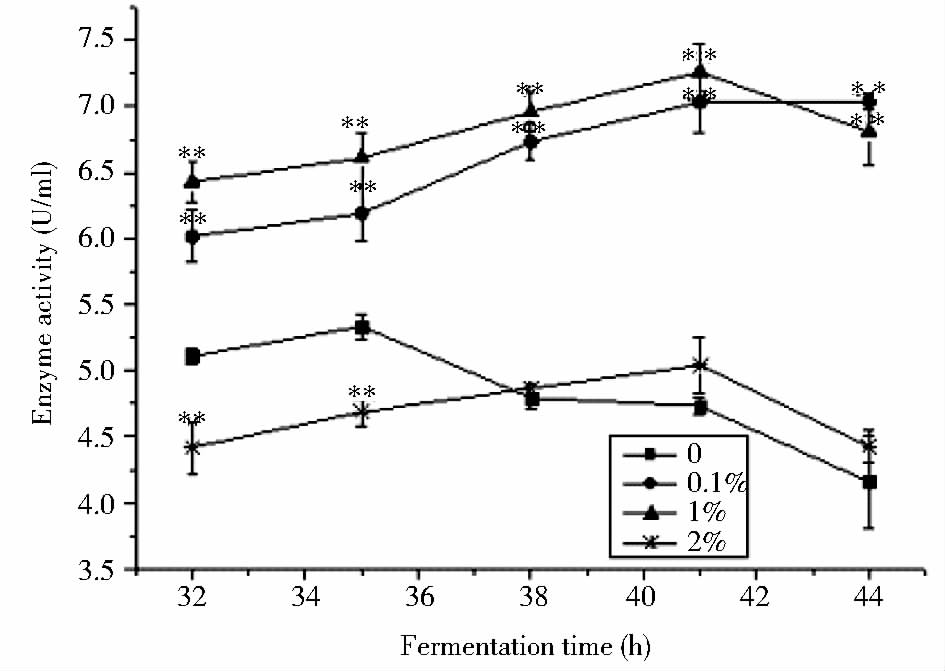
2.2.1 pH值的变化与产酶的关系由图 2可以看到,茂源链霉菌在发酵过程的pH变化遵循先降后升的趋势。在菌体生长稳定期之前,因分解代谢过程中产酸较多,pH值在波动中下降,进入衰亡期后,随着菌体自溶过程的持续,大量碱性物质释放到培养中,导致pH的回升直至稳定。高压灭菌后的常规发酵培养基pH由7.4降至7.14,而添加了甲壳素的发酵培养基pH值下降较少,且随着甲壳素添加量的增加下降值递减。实验组在发酵过程中较对照组pH的下降延缓,同时pH回升也相应延迟,而且随着甲壳素添加量的增加延缓程度增强,可能由于添加了甲壳素后菌体生长受到一定程度抑制,菌体代谢缓慢,达到稳定期的时间延长。根据图 3所示,实验组发酵产酶最高点较对照组延后,进一步说明甲壳素的添加可能抑制了菌体的生长。添加0.1%和1%甲壳素的实验组产酶较对照组明显增加,说明添加适量的甲壳素可能使菌株的生长受到一定程度的胁迫,进而刺激菌体产生大量的次级代谢产物,从而提高产酶。而添加了2%的甲壳素后菌株产酶减少,说明高浓度的甲壳素严重干扰了菌株的生长代谢,进而使产酶能力下降。
|
| 图 2 添加不同质量浓度的甲壳素时发酵过程中pH的变化 Fig. 2 Changes of pH in fermentation process with addition of different chitin concentrations |
|
| 图 3 添加不同质量浓度的甲壳素时发酵过程中产酶的变化 Fig. 3 Changes of the TGase activity in fermentation process with addition of different chitin concentrations ** Represents extremely significant difference (P<0.01) |
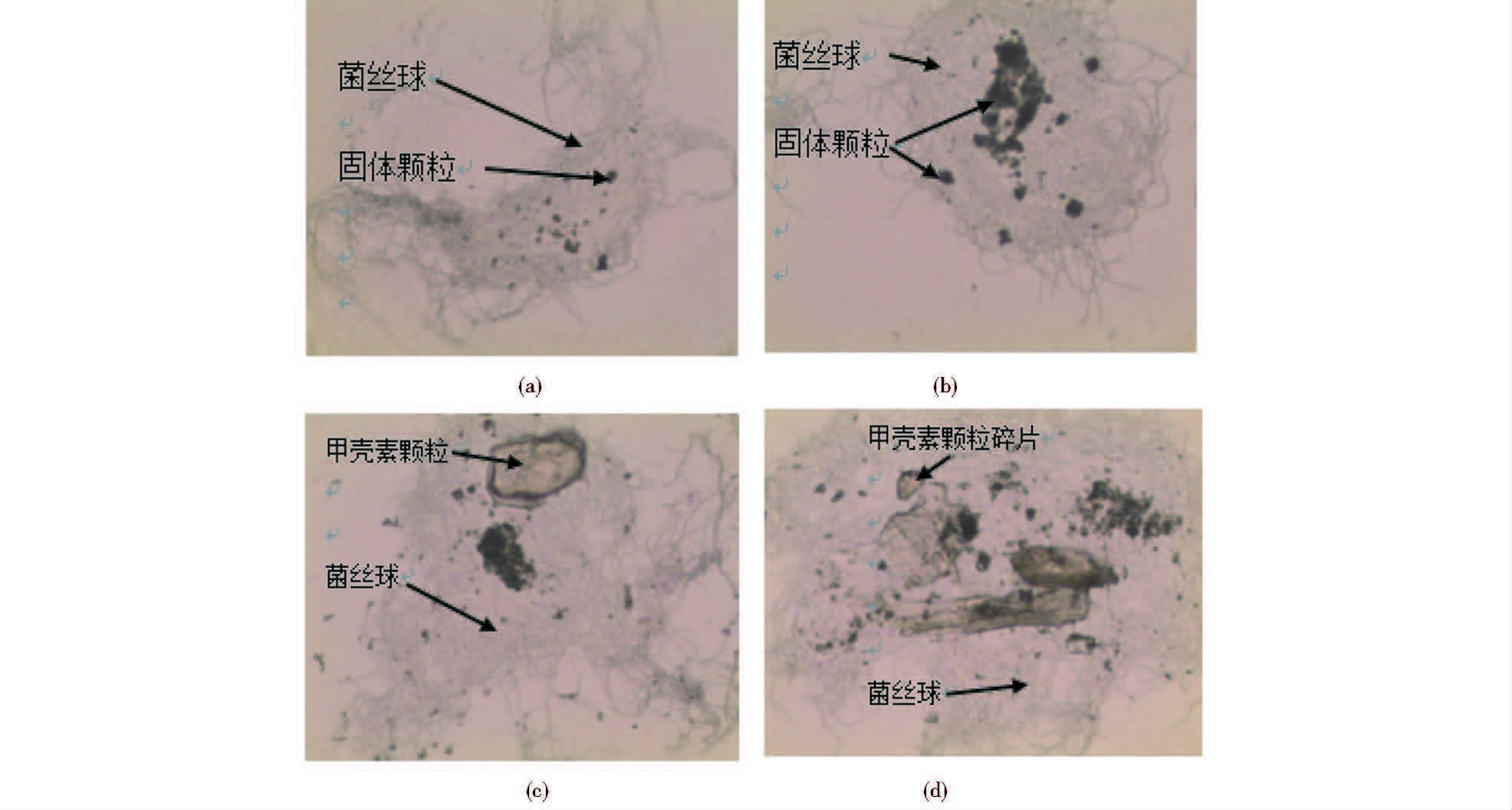
菌株生长指数期,对发酵中的菌体进行显微观察,如图 4所示,随机选取了对照组和实验组各两个单一的菌丝球作为实例进行说明,添加了1%甲壳素的实验组(图 4c、图 4d)菌丝球菌丝分化程度较对照组(图 4a、图 4b)更高,菌丝球致密性较弱,生长更旺盛。如图 4d中标识的甲壳素的小片段可能是甲壳素分解过程中的破碎残体。
|
| 图 4 添加甲壳素后的菌丝球显微照片(10×40) Fig. 4 Microphotograph of mycelium pellets in cultures with chitin (a),(b) Sample without adding chitin (c),(d) Adding 1% chitin |
茂源链霉菌的发酵产酶过程涉及到各种胞外蛋白酶的切割,对发酵0h、32h、35h、38h、41h和44h的样品发酵液上清进行蛋白含量的检测。如表 1所示,添加了0.1%、1%甲壳素的发酵液,其蛋白表达量较对照组有显著提高(P<0.05),而添加了2%甲壳素的发酵液其蛋白表达量则明显低于对照组。发酵后期随着菌体的衰亡,蛋白降解为氨基酸等小分子物质,蛋白含量下降。说明茂源链霉菌产TGase的能力与胞外其他蛋白的产量呈正相关,添加适量的甲壳素能促进菌株产TGase及其它胞外蛋白酶。
| 发酵时间(h) | 蛋白浓度(mg/ml) | |||
| 0%甲壳素添加量 | 0.1%甲壳素添加量 | 1%甲壳素添加量 | 2%甲壳素添加量 | |
| 0 | 0.15 | 0.15 ±0.01 | 0.15 | 0.15 ±0.02 |
| 32 | 1.85 ±0.05 | 2.05 ±0.1* | 1.93 ±0.34 | 1.44 ±0.02* |
| 35 | 1.86 ±0.06 | 2.18 ±0.06** | 1.98 ±0.06* | 1.48 ±0.07* |
| 38 | 1.85 ±0.17 | 2.21 ±0.08* | 2.18 ±0.19* | 1.44 ±0.14* |
| 41 | 1.82 ±0.06 | 2.13 ±0.2* | 2.14 ±0.22* | 1.82 ±0.05 |
| 44 | 1.40 ±0.05 | 1.60 ±0.04* | 1.61 ±0.08* | 1.36 ±0.04 |
| *,** Represent significant difference and extremely signiffcant difference respectively | ||||
表 2所示为发酵液上清中的总氮含量,随着菌体的生长,培养基中的氮源被逐渐利用,总氮含量下降,41h后菌体生长进入衰亡期,蛋白降解为氨基酸等小分子物质,蛋白含量降低(表 1),总氮含量上升(表 2)。添加了0.1%、1%甲壳素的发酵液其发酵液上清的总氮含量显著低于对照组(P<0.05)。
| 发酵时间(h) | 总氮浓度(mg/ml) | |||
| 0%甲壳素添加量 | 0.1%甲壳素添加量 | 1%甲壳素添加量 | 2%甲壳素添加量 | |
| 0 | 4.47 ±0.03 | 4.5 ±0.04 | 4.48 ±0.01 | 4.46 ±0.03 |
| 32 | 2.82 ±0.09 | 2.64 ±0.1* | 2.99 ±0.06* | 2.84 ±0.09 |
| 35 | 2.75 ±0.1 | 2.24 ±0.08** | 2.2 ±0.07** | 2.73 ±0.16 |
| 38 | 2.61 ±0.06 | 2.56 ±0.21 | 2.41 ±0.05** | 2.47 ±0.06* |
| 41 | 3.35 ±0.07 | 2.46 ±0.15** | 2.74 ±0.11* | 3.48 ±0.06* |
| 44 | 3.42 ±0.05 | 3.21 ±0.12* | 3.55 ±0.03 | 3.11 ±0.35 |
| *,** Represent significant difference and extremely signiffcant difference respectively | ||||
以添加0.1%、1%和2%甲壳素的发酵培养基作为实验组,未添加的作为对照组,对发酵0h、41h和44h 的上清样品进行聚丙烯酰胺凝胶电泳。如图 5所示,在发酵产酶最高点41h时,添加1%甲壳素的实验组TGase含量最高,添加0.1%甲壳素的实验组次之,且TGase含量皆显著高于对照组,而添加2%甲壳素的实验组则明显低于对照组。随着发酵的进行,菌株进入衰亡期,如图 5所示,44h时TGase开始降解,TGase含量降低。利用Bandscan软件对各泳道蛋白进行相对含量分析,如表 3所示,发酵开始时,对照组较实验组蛋白成分复杂,可能是由于较高的pH值使得蛋白有微弱的降解和交联,各实验组初始蛋白含量没有差异。发酵41h时,添加1%甲壳素的实验组成熟TGase含量较实验组高了7.3%,较对照组高了15.6%,差异最为明显。添加2%甲壳素的实验组其总蛋白浓度较低(表 1),故成熟TGase的含量略高于对照组。发酵44h后,随着蛋白的降解,添加0.1%和1%甲壳素的实验组成熟TGase的含量降低,同样由于总蛋白含量的不同,添加2%甲壳素的实验组和对照组TGase含量反而升高。
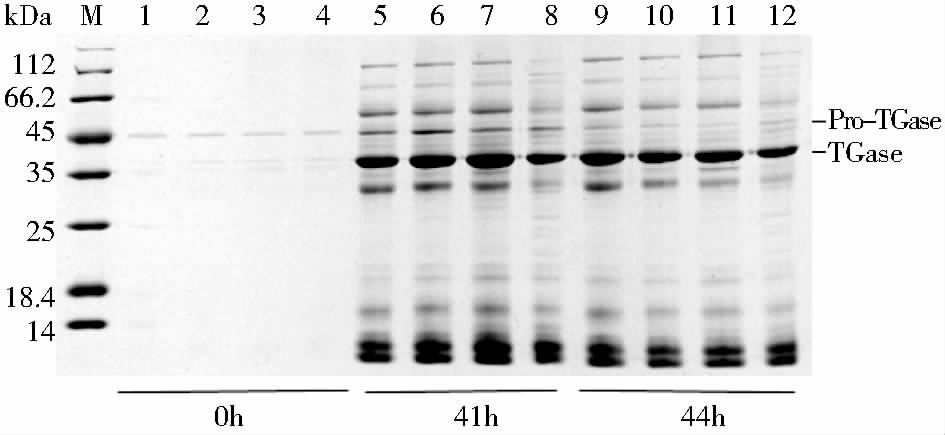
|
| 图 5 聚丙烯酰胺凝胶电泳图谱 Fig. 5 SDS-PAGE result M:Low molecular weight protein marker;1,5,8: Control group; 2,6,9:Samples of adding 0.1% chitin;3,7,10:Samples of adding 0.5% chitin;4,8,11:Samples of adding 2% chitin |
| 指标 | Lane | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Pro-TGase含量(%) | 61.5 | 68.1 | 66.1 | 69.5 | 8.1 | 11 | 3.5 | 5.4 | 2.4 | 1.7 | 1.3 | 1.8 |
| TGase含量(%) | 23.6 | 31.9 | 33.9 | 31.5 | 32 | 40.3 | 47.6 | 38.6 | 40.8 | 35.8 | 36.1 | 58.7 |
| 其他蛋白含量(%) | 14.9 | 0 | 0 | 0 | 59.9 | 48.7 | 48.9 | 56 | 56.8 | 62.5 | 62.6 | 39.5 |
| The content of each lane is the same as the fig.4 | ||||||||||||
本研究通过实验证明了甲壳素是一种可以促进茂源链霉菌产TGase的发酵促进剂。TGase是茂源链霉菌的次级代谢产物,对微生物来讲,次级代谢产物是在微生物的对数生长末期或稳定期开始产生[14]。链霉菌发酵产酶情况以及代谢过程中pH的变化结果显示,添加适量的甲壳素使菌体生长代谢及产酶皆延后,说明菌体的正常生长代谢受到一定程度的抑制,然而产酶总量的增多则说明菌株生长过程可能受甲壳素的胁迫,进而促使次级代谢产物增多。而当甲壳素添加量过高时,则因为严重抑制菌体生长代谢,使得菌体自身生长受抑制,因而影响产酶。发酵过程中蛋白含量及总氮含量的变化趋势进一步说明,添加甲壳素后总蛋白含量较对照组增加,可能参与TGase切割成熟的各种蛋白酶的含量也有所增加,促使成熟的TGase产量增加。SDS-PAGE电泳图谱及各泳道的蛋白组分比例分析则是上述结论的又一佐证。
对菌体发酵过程的显微观察说明,甲壳素也可能作为分散剂使得菌株生长过程中聚集形成的菌丝球致密性较低,通透性增强,有利于菌株的生长和Pro-TGase向胞外的分泌,从而提高菌株产酶[15]。因甲壳素价格便宜,且添加量较少即可显著提高产酶的这一特性,因此在工业生产中可以极大地提高产量,为企业获得可观的经济效益。
| [1] | Yokoyama K, Keiichi U, Hiroe N, et al. Screening for improved activity of a transglutaminase from Streptomyces mobaraensis created by a novel rational mutagenesis and random mutagenesis. Applied Microbiology and Biotechnology,2010, 87(6):2087-2096. |
| [2] | Zotzel J, Keller P, Fuchsbauer H L. Transglutaminase from Streptomyces mobaraensis is activated by an endogenous metalloprotease. European Journal of Biochemistry, 2003,270(15): 3214-3222. |
| [3] | Yokoyama K, Nio N, Kikuchi Y. Properties and applications of microbial transglutaminase. Applied Microbiology and Biotechnology, 2004,64(4):447-454. |
| [4] | Junqua M, Duran R, Gancet C, et al. Optimization of microbial transglutaminase production using experimental designs. Applied Microbiology and Biotechnology, 1997,48(6): 730-734. |
| [5] | 陈坚,李寅.发酵过程优化原理与实践.北京:化学工业出版社,2002. Cheng J, Li Y. Fermentation Process Optimization Theory and Practice. Beijing: Chemical Industry Press, 2002. |
| [6] | 张程杰,堵国成,李寅,等.添加羟胺诱导Streptomyces hygroscopicus产谷氨酰胺转胺酶.过程工程学报, 2005(4):434-437. Zhang C, Du G C, Li Y, et al. Induced microbial transglutaminase accumulation by Streptomyces hygroscopicus due to addition of hydroxylamine. The Chinese Journal of Process Engineering, 2005(4): 434-437. |
| [7] | 程力,张东旭,堵国成,等.添加胰蛋白酶促进Streptomyces hygroscopicus CCTCC M203062产谷氨酰胺转胺酶.中国生物工程杂志,2010 (7): 53-58. Cheng L, Zhang D X, Du G C, et al. Improvement on the activity of microbial transglutaminase with Streptomyces hygroscopicus by the addition of surfactant CTAB. Chin Journal of Biotechnology, 2010,7:53-58. |
| [8] | Zhang L, Han X. Enhancement of transglutaminase production in Streptomyces mobaraensis as achieved by treatment with excessive MgCl2. Applied Microbiology and Biotechnology, 2012,93(6):2335-2343. |
| [9] | Kean T, Thanou M. Biodegradation, biodistribution and toxicity of chitosan. Advanced Drug Delivery Reviews, 2010,62(1):3-11. |
| [10] | Kim S K, Rajapakse N. Enzymatic production and biological activities of chitosan oligosaccharides (COS): a review. Carbohydrate Polymers, 2005,62(4):357-368. |
| [11] | Marin L, Ailincai D, Mares M, et al. Imino-chitosan biopolymeric films. Obtaining, self-assembling, surface and antimicrobial properties. Carbohydrate Polymers, 2015,117:762-770. |
| [12] | Zhong Z, Xing R, Liu S,et al. Synthesis of acylthiourea derivatives of chitosan and their antimicrobial activities in vitro. Carbohydrate Research, 2008,343(3):566-570. |
| [13] | Grossowicz N, Wainfan E, Borek E, et al. The enzymatic formation of hydroxamic acids from glutamine and asparagine. The Journal of Biological Chemistry, 1950,187(1): 111-125. |
| [14] | Martin J, Liras P. Engineering of regulatory cascades and networks controlling antibiotic biosynthesis in Streptomyces. Current Opinion in Microbiology, 2010,13(3):263-273. |
| [15] | Yang F, Yang M, Cheng S H. A novel method to enhance the mycelia production of Ganoderma lucidum in submerged cultures by polymer additives and agitation strategies. Journal of the Taiwan Institute of Chemical Engineers, 2009,40(2):148-154. |
 2015,Vol. 35
2015,Vol. 35




